博莱霉素诱导小鼠肺间质纤维化造模方式的选择
2010-02-06李丽娜张永胜于永利王丽颖孙陆果
李丽娜 王 华 周 蕾 张永胜 于永利 王丽颖 孙陆果
(吉林大学白求恩医学院分子生物学教研室,长春 130021)
博莱霉素诱导小鼠肺间质纤维化造模方式的选择
李丽娜 王 华 周 蕾 张永胜 于永利①王丽颖 孙陆果
(吉林大学白求恩医学院分子生物学教研室,长春 130021)
目的:建立博莱霉素导致肺间质纤维化小鼠动物模型,比较不同给药方式的成模差异。方法:利用8周龄雄性ICR小鼠,①随机分为腹腔给药组(P组)、气管内给药组(I组)、阴性对照组(C组),分别经腹腔注射BLM 40mg/kg 5次、气管内滴入BLM 5mg/kg 1次或气管内滴入生理盐水50μl。分别于14、28、40天处死,②小鼠随机分为4组,分别经腹腔注射BLM 40 mg/kg3、4、5次或经腹腔给予生理盐水200μl。分别于28、40天处死。观察小鼠体重、咳嗽、挠鼻症状、肺系数及肺组织病理改变。结果:给予博莱霉素后①小鼠的体重均下降并出现咳嗽及挠鼻等呼吸障碍症状;处置后第14、28及40天处死小鼠,计算肺系数,P组较I组肺系数高;处死小鼠后,P组和I组小鼠均形成广泛、稳定的间质纤维化病理改变,P组主要分布在胸膜下及血管周围,而I组主要分布在肺门和支气管周围。P组较I组肺纤维化病理评分高。②不同腹腔给药次数模型小鼠体重变化以5次给药对体重影响最大;计算肺系数以给药5次肺系数变化最大。上述模型均成功建立。通过比较生存率、呼吸困难症状、组织病理变化等指标,选出腹腔给药5次相对于给药3次及4次为更好的造模方式。结论:利用BLM腹腔注射和气管内滴入制备了肺间质纤维化动物模型,纤维化形成的部位存在着一定的差异,腹腔给药5次方法制备肺间质纤维化模型的成功率更佳。
ICR小鼠;博莱霉素;肺间质纤维化
肺纤维化一般指在毒物、自发免疫反应、药物副反应、感染、严重的外伤等不同因素刺激下引起肺部炎症反应,肺泡持续性损伤、细胞外基质反复破坏、修复、重建并过度沉积,导致正常肺组织结构改变、功能丧失的一类疾病,是所有间质性肺疾病的终末结局,其发生、发展关系到这一大类疾病的研究进展。目前我国还没有明确的流行病学调查资料,美国的一项调查显示18~34岁人群的特发性肺间质纤维化(Idiothomeol pulmonary fibrosis,IPF),患病率约为7/10万,75岁以上人群的IPF患病率为227.2/10万,年发病率约为1.2~76.4/10万[1]。主要表现逐渐加重的呼吸困难,伴有刺激性干咳,病情一般持续发展,最终因呼吸衰竭而死亡;至今无有效的药物能逆转肺纤维化的自然过程及其终末结局;预后差,确诊后平均生存时间2~3年。
博莱霉素是从链霉菌属中一个产抗生素株中提取出的糖肽类物质。临床上,博莱霉素常用于治疗淋巴瘤、辜丸癌、鳞状细胞癌等。使用博莱霉素早期可出现全身炎症反应及类似肺炎症状,而后期则产生进行严重的肺纤维化[2]。由于其导致动物肺间质纤维化模型与人类肺间质纤维化病理过程相似,所以常被用来制作肺纤维化的动物模型。为建立一种比较适合肺纤维化发病及治疗的造模方式,先后有学者选用了腹腔给药、气管滴入、尾静脉给药及雾化吸入等方法[3-6],但尾静脉给药法成模率较低,雾化吸入法成本较高,因此本研究比较了腹腔、气管给予博莱霉素及经腹腔给予不同剂量的博莱霉素建立肺间质纤维化模型的效果,以选用最为简便及成模率高的方式从而进行下一步研究。
1 材料与方法
1.1 实验材料 雄性SPF级ICR小鼠,8周龄,体重18~22克,由吉林大学白求恩医学院实验动物中心提供。博莱霉素粉剂每支8mg(哈尔滨博莱制药有限公司),戊巴比妥钠由Serva进口分装。
1.2 方法
1.2.1 动物模型建立 小鼠饲养于IVC鼠笼中,室温(24℃~26℃),保持湿度,日照 14小时和黑夜10小时交替进行,垫料、食物和水灭菌处理。实验过程中不限制食水。具体造模方法:气管给药组(I组)实验小鼠用4%水合氯醛(0.01m l/g)150μl腹腔注射麻醉后,取仰卧固定位,常规消毒,行颈正中切口,钝性分离暴露气管,于气管软骨环间隙穿刺缓缓注入BLM(5mg/kg)0.05 ml,。注药后立即将小鼠直立旋转3~5分钟,使药液均匀分布于两侧肺内,然后缝合皮肤,并在缝合处消毒,待清醒后常规饲养。手术前一日及术后三天连续肌肉注射青霉素(0.05 m l/只)。腹腔给药组于实验0、2、4、6、8天于腹膜腔注射BLM(40mg/kg)200μl 3、4或5次,C组注入等体积生理盐水,P 组分别于实验0、2、4、6、8 天于腹膜腔注射BLM(40mg/kg)200μl。
1.2.2 小鼠体重监测 测量每只小鼠每日体重,记录体重变化,并观察小鼠毛色、活动状态等变化。
1.2.3 观察小鼠咳嗽及挠鼻症状 记录每5分钟每只小鼠咳嗽及挠鼻次数。
1.2.4 计算肺系数 各组小鼠分别于给药后第14、28、40天采用摘除眼球造成急性大量失血的方法处死,分离出双肺,分离干净后放入冰冷生理盐水中漂洗除去血液,用滤纸洗净表面的血液后,称肺重,按如下公式计算肺系数:肺系数=肺湿重(mg)/体重(g)。
1.2.5 肺组织病理学观察 取右肺下叶,4%中性福尔马林固定一夜后,按常规病理学方法脱水、包埋、切片、分别进行HE染色及Masson染色。染色后切片参照Szapiel[7]方法确定肺泡炎和肺纤维化程度。具体如下:1)肺泡炎:分为4级①无肺泡炎0分;②轻度肺泡炎l分:单核细胞浸润使肺泡隔增宽,仅限于局部和近胸膜部,面积小于全肺的20%,肺泡结构正常;③中度肺泡炎2分:受累面积占全肺的20%~50%,近胸膜部较重;④重度肺泡炎3分:面积大于50%,偶见肺泡腔内有单核细胞及出血造成的实变。2)肺纤维化:①无肺纤维化0分;②轻度肺纤维化1分:受累面积<20%;③中度肺纤维化2分:受累面积20%~50%;④重度肺纤维化 3分:受累面积>50%,肺泡结构紊乱。
2 结果
2.1 气管给药与腹腔给药两种造模方式比较
2.1.1 小鼠生存率比较 BLM注射处置后,P组小鼠无死亡,生存率为100%;而I组小鼠生存率为50%,死亡主要发生在1~10天。两组间统计学差异显著(P<0.05)。
2.1.2 小鼠体重变化 造模后小鼠体重开始下降,以0~6天明显。P组小鼠体重下降5克,I组小鼠体重下降3克,第6天后模型组小鼠体重变平稳,而I组小鼠体重在14天后逐渐上升。各组小鼠体重标准差比较发现:C组及I组标准差较大,而P组个体间差异较小。以各组小鼠平均体重及标准差作图如下,见图1。
2.1.3 小鼠呼吸系统症状比较 造模后小鼠出现咳嗽及挠鼻等呼吸障碍表现。每日上午同一时间计数每只小鼠5分钟内咳嗽及挠鼻次数。统计后发现:C组小鼠无咳嗽及挠鼻,P组症状较I组重,模型组症状在28天后逐渐减轻,但并未消失。见图2。
2.1.4 各组小鼠肺系数比较 小鼠处死后依照公式计算肺系数,结果显示各时间段腹腔给药方式造模小鼠的肺系数均较气管给药组肺系数高。经统计学分析P组与I组40天处死小鼠肺系数之间比较P<0.05,有明显统计学差异,其他时间点差异不显著。提示腹腔给药方式造模40天时小鼠纤维化程度较气管给药组重。见图3。
2.1.5 肺脏病理变化 腹腔注射法形成的纤维化改变主要分布于胸膜下及血管周围,气管滴入法主要分布在支气管、细支气管周围,尤其以近肺门处更为明显。两组病理评分与比阴性对照组比较有统计学差异(P<0.05),而两组之间比较差异不显著。见图4。
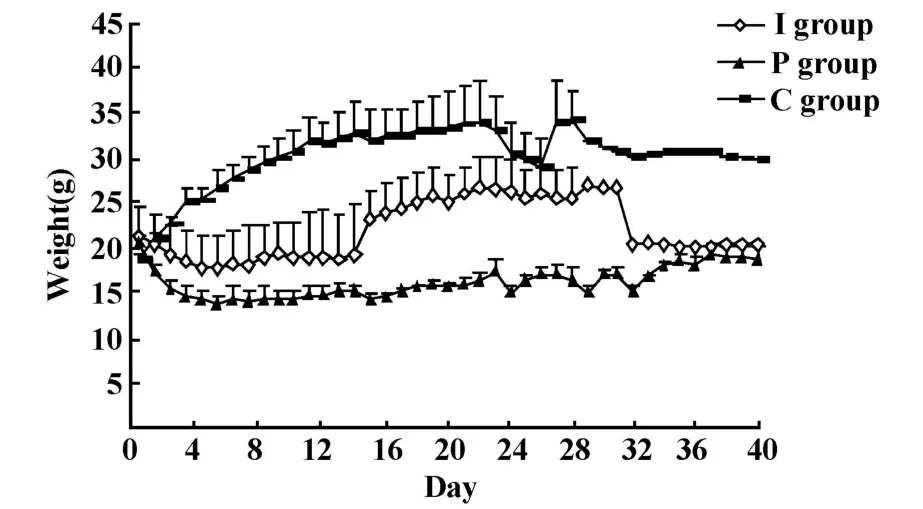
图1 两种给药方式小鼠体重变化Fig.1 Different medicine given way induced the change of m ice'sweight
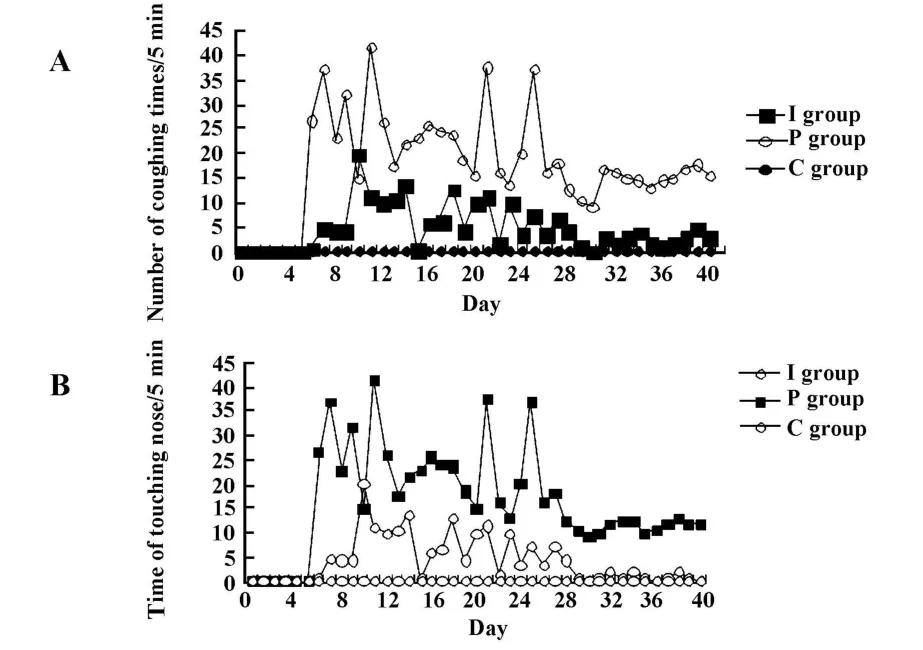
图2 症状比较Fig.2 Symp tom comparison
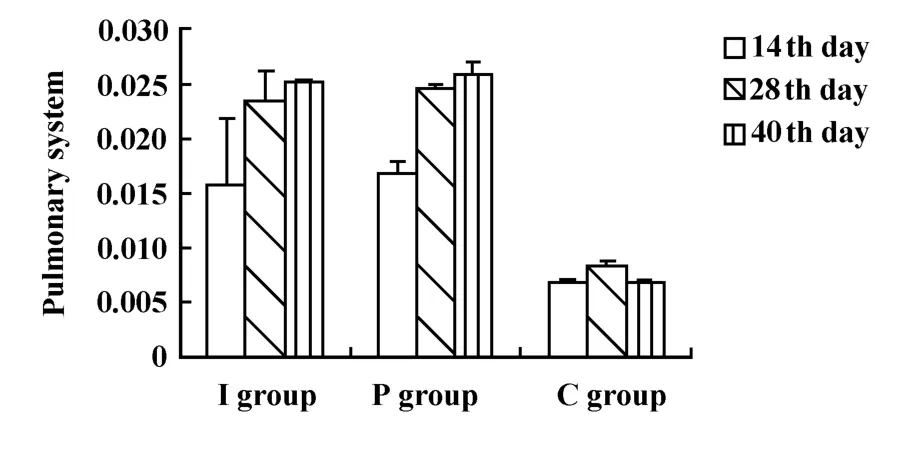
图3 肺系数比较Fig.3 Pulmonary system of different adm ission method
2.2 筛选腹腔给予博莱霉素造模的给药次数 进一步摸索腹腔注射博莱霉素的给药次数,选用了24只雄性SPF级ICR体重18~22克小鼠,随机分为4组 ,于实验 0、2、4、6、8 天于腹膜腔注射 BLM(40mg/kg)200μl3、4或5次,阴性对照组同时给予同体积生理盐水。观察小鼠体重及肺系数变化。
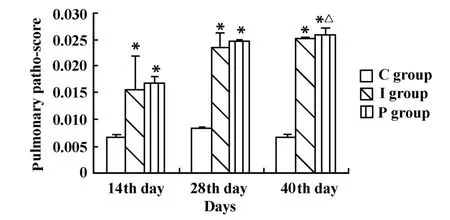
图4 病理评分比较Fig.4 Comparison of patho-score
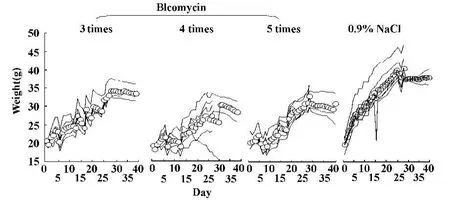
图5 不同给药次数体重变化比较Fig.5 W eight changeby different adm ission times
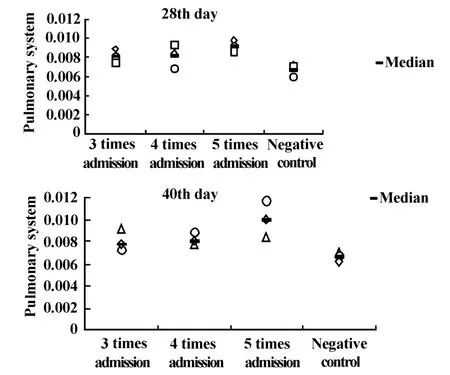
图6 不同给药次数肺系数变化Fig.6 Pu lmonary system change which were induced by different bleomycin adm ission
2.2.1 体重变化比较 给予BLM后均低于阴性对照组,随着给药次数的增加,小鼠体重增加速度明显减慢,最明显为给药5次组。见图5。
2.2.2 肺系数的变化 于实验第28及40天处死小鼠,比较各组肺系数。随给药次数增加,小鼠肺系数逐渐增高,以给药5次最高。见图6。
2.2.3 成模率比较 三种给药次数小鼠分别于开始造模后28天或40天处死,第40天以5次给药组小鼠成模率最高,为100%,而4次及3次给药分别为80%及60%,相比较而言5次给药成模率更高。
3 讨论
BLM是一种细胞毒性抗癌药物,具有致肺纤维化的副作用,因而常被用来制备肺纤维化动物模型。ICR小鼠腹腔注射BLM 40mg/kg,可形成广泛的肺间质纤维化[3]。BLM 5mg/kg气管内注射也是制备这种模型的常用方法。本研究利用ICR小鼠,探讨制备肺间质纤维化模型的异同点并比较不同腹腔给药次数造成小鼠肺间质纤维化病变。结果发现,气管注射法有较高的死亡率(50%),小鼠的死亡发生在6~9天,这与其他研究结果相似[3,6]。而腹腔注射在本实验中未造成小鼠死亡。肺组织病理结果显示,腹腔注射法形成的纤维化改变主要分布于胸膜下及血管周围,与Harrison[6]的实验结果相似。气管滴入法主要分布在支气管、细支气管周围,尤其以近肺门处更为明显,这与Ekimoto[8]报道的结果相似。气管滴入及腹腔注射两种小鼠肺纤维化改变的分布存在着明显的不同,这种表现推测与两种方法注射后,BLM在肺组织局部的分布浓度不同有关。静脉注射BLM后,可能由于肺门处血流速度较快,而肺外周流速明显减慢,所以其在肺周边更容易形成明显的纤维化病理改变,模型形成晚,需要40天,更接近临床。而气管内注射BLM后,药物经支气管上皮吸收后,可能在支气管周围局部形成BLM浓度较高区域,所以在支气管周围特别是临近肺门处而不是周边肺组织形成明显的纤维化改变。比较3种不同腹腔注射博莱霉素次数的小鼠模型,注射5次的小鼠体重及肺系数变化更为明显,为腹腔注射博莱霉素的更好方式。
在本研究中发现气管给药与腹腔给药均能成模。采用腹腔注射BLM制作小鼠肺纤维化动物模型,操作简便、快捷、个体间差异小,可以减轻因手术操作熟练程度的不同造成的纤维化程度不同。在操作过程中注意使小鼠处于头低脚高位,以避免腹腔脏器的副损伤。模型的形成可能与药量有关,腹腔给药3次组,体重已有变化,但不足以造成严重的病理变化,5次给药更容易成模。气管内注射BLM,需麻醉小鼠后手术剖开颈部皮肤,钝性分离肌肉组织充分暴露气管,有一定感染及术中副损伤造成小鼠死亡的危险性,尽量减少操作时间、减少组织损伤,有可能减少死亡的风险。
用BLM复制肺纤维化动物模型被认为是最近似于特发性肺间质纤维化(IPF)病理改变的模型[5]。腹腔注射法形成的病变主要分布于胸膜下,接近人类特发性肺间质纤维化的影像学表现,而气管滴入法主要分布在支气管、细支气管周围,所以腹腔注射法与临床IPF病理分布更为接近。本研究提示,静脉和气管内注射BLM复制肺纤维化动物模型,不仅在肺组织纤维化病理改变的分布上存在差异,而且成模率高,小鼠死亡率低。比较3个不同的腹腔给予博莱霉素的剂量,实验结果显示根据对体重、肺系数及成模率比较及对小鼠药物其他毒性最小,给予BLM 40mg/kg 5次可以更好的复制出小鼠间质性肺疾病的模型,更加适用于科研动物模型的应用。
1 Antoniou KM,AlexandrakisM G.Cytokinenetwork in pathogenesisof idiopathic pulmonary fibrosis[J].Sarcoidosis Vasc Diffuse Lung Dis,2005;22(2):91-95.
2 Wang Q J,Wang Y J,DallasMetal.Effect of antibody againstinte grin onBleomycin induced pulmonary fibrosis in mice[J].Biochem Pharmae,2000;60(12):1949-1958.
3 Clark JG,KostalKM,MarinoBA.Bleomycin-induced pulmonary fibrosis in hamsters.An alveolar macrophage product increases fibroblast prostaglandin E2 and cyc lic adenosinemono-phosphate and suppresses fibroblast proliferation and collagen production[J].JClin Invest,1983;72(6):2082-2091.
4 GharaeeM,UllenbruchM,Phan SH.Animalmodelsofpulmonary fibrosis[J].Methods: MolMed,2005;117:251-259.
5 Felix C,Jack G,Geoffrey J.Pulmonary fibrosis searching formodel answers[J].Am JRespir CellMol Biol,2005;33:9-13.
6 Denis J,Schrier D,Robin Getal.The role of strain variation in murine Bleomycin-induced pulmonary fibrosis[J].Am Rev Respir Dis,1983;127:63-66.
7 SzapielS V,Elson NA,Fulmer JDetal.Bleomycin-induced interstitial pulmonary disease in the nude,athym icmouse[J].Am Rev Respir Dis,1979;120(4):893-899.
8 EkimotoH,TakahashiK,Matsuda Aetal.Experimentally induced bleomycin pulmonary toxicity-comparison of the systemic(intraperitoneal)and local(intratracheal)administration[J].Gan To Kagaku Ryoho,1983;10(12):2550-2557.
[收稿2009-11-01]
(编辑 张晓舟)
Comparison of mouse lung fibrosis induced by intraperitoneal injection and intratracheal instillation of bleomycin
LILi-Na,WANGHua,ZHOULei,ZHANGYong-Sheng,YUYong-Li,WANGLi-Ying,SUNLu-Guo.Departmentof MolecularBiology,NormanBethuneMedicalCollege,JilinUniversity,Changchun130021,China
Objective:To study the differences of bleomycin-induced pu lmonary fibrosis inmice induced by intraperitoneal in jection and intratracheal instillation of bleomycin.Methods:ICRmice(male,8w of age,18 to22 gbodyweight)wereused.①ICRmicewere randomly divided into three groups.In the group P,bleomycin was injected intraperitoneal five times in a dose of 40 mg/kg,and in the group I,bleomycin was instilled intratracheally in a doseof5mg/kg.Themicewere killed at14,28 or40 day.②ICRm icewere randomly divided into fourgroups:bleomycinwas injected intraperitoneal three,fouror five timesin a doseof40mg/kg,and in thegroup control,bleomycinwasinjected intraperitoneal in a dose of 200μl for five times.Themice was killed at28 or 40 day.The pathological changes and symptomswere observed.Results:①Theweightof themice given blemycinewere lostafter injection.Symptomsweremore serious in group P than thoseof group I.The pulmonary coefficient of group Pwasmore than thatofgroup I.At28 day after injection,fibrosiswaswidely and stably formedmainly in around thebronchiaand bronchioles,especially,near the pu lmonary hilararea,in thegroup Imice,however,the same changesweremainly seen under the pleura or perivascular pulmonary tissues in themice of group P.The pathological score of pulmonary fibrosiswas different between those twogroups.②Different dose of bleomycine induced different change of themouse'sweight.Themostof all of the three groupwere five time injection;The lung index of five time injection of bleomycine was themost.The pulmonary fibrosismousemodelwasmade successfully.After comparising all of the data,we found intraperitonealofbleomycine five timeswas themore convenientmethod.Conclusion:The sites of pu lmonary fibrosis in themice are differentbetween themice induced by intraperitoneal injection or intratracheal instillation of bleomycin.Intraperitoneal in jection five times is amore convenientmethod tomake pulmonary fibrosis.
ICRmouse;Bleomycin;Pulmonary fibrosis
R563.1
A
1000-484X(2010)03-0254-04
①吉林大学白求恩医学院免疫学教研室,长春130021
李丽娜(1976年-),女,在读博士,主治医师,讲师,主要从事肺纤维化方面发病机理及治疗方面研究。
·临床免疫学·
