神经生长因子对骨癌痛大鼠疼痛行为学的影响
2010-02-03姚鹏张锦蒋晶晶孟凌新
姚鹏,张锦,蒋晶晶,孟凌新
(中国医科大学 附属盛京医院疼痛科,沈阳 110004)
神经生长因子对骨癌痛大鼠疼痛行为学的影响
姚鹏,张锦,蒋晶晶,孟凌新
(中国医科大学 附属盛京医院疼痛科,沈阳 110004)
目的 观察鞘内注射神经生长因子(NGF)及抗神经生长因子抗体(anti-NGF)对骨癌痛大鼠疼痛行为学的影响,探讨NGF在骨癌痛中可能的作用。方法 建立大鼠胫骨骨癌痛模型,鞘内置管,并分别注入生理盐水(cancer组)、NGF(cancer+NGF组)或anti-NGF(cancer+anti-NGF组),同时设立假手术组(sham组)。在不同时点观察疼痛行为学变化。结果 与sham组比较,cancer各组大鼠体质量减轻;且cancer+anti-NGF组大鼠体质量比cancer组大鼠增加。与sham组比较,cancer组大鼠自发缩足次数增多,缩爪潜伏期(PWL)缩短,缩爪阈值(PWT)降低;与cancer组比较,cancer+anti-NGF组大鼠缩足次数明显减少,PWL延长,PWT增高;而cancer+NGF组大鼠与cancer组比较,缩足次数增多,PWL缩短,PWT降低。结论 NGF可加剧大鼠骨癌痛,而anti-NGF可显著减弱骨癌痛大鼠的痛敏。
骨癌痛;神经生长因子;疼痛行为学;鞘内注射;大鼠
肿瘤发病率呈逐年上升趋势,2010年Thun等[1]统计结果显示,肿瘤已成为危及人类生命的首要原因之一,如何改善肿瘤患者的生存质量成为当前亟需解决的问题。肿瘤骨转移性疼痛多由乳腺癌、前列腺癌及肺癌转移引起,原发性骨肉瘤等也易诱发骨癌痛,严重干扰了患者的日常生活,并导致患者体能状态下降及焦虑或抑郁发生。但是对于这种慢性疼痛的产生和维持机制,我们却知之甚少。
骨癌痛是一种复杂的疼痛综合征。研究发现,骨癌痛的疼痛信号传导与炎症痛和神经病理性痛不同。骨癌痛模型中最具特征的改变是脊髓背角星形胶质细胞标记物胶质原纤维酸性蛋白大量表达[2],脊髓全层尤其是背角浅层胶质细胞大量增生和过度肥大。脊髓的兴奋性明显上调,伤害性感受野扩大,神经元对机械、热、电刺激反应显著增强[3]。但骨癌痛的机制研究远远滞后于其他疼痛类型。因此,需要进一步研究骨癌痛的病理机制以指导临床治疗。本研究建立大鼠胫骨骨癌痛模型,进行疼痛行为学及放射线、病理学观察;鞘内注射神经生长因子(nerve growth factor,NGF)及抗神经生长因子抗体(anti-NGF),观察其对疼痛行为学的影响,探讨NGF在骨癌痛中可能的作用。
1 材料与方法
1.1 实验动物
雌性SD大鼠,初始体质量200~220g,由中国医科大学附属盛京医院动物室提供。饲养于铺垫锯末塑料盒内,每笼 5只,室内温度(22±0.5)℃,湿度40%~60%,自然照明,自由摄食、饮水。实验获得中国医科大学附属盛京医院伦理委员会批准。
1.2 实验分组及给药
60只雌性SD大鼠,随机分成4组:假手术组(sham 组)、骨癌痛模型组(cancer组)、cancer+NGF组和cancer+anti-NGF组,每组15只。sham组大鼠胫骨注入PBS液;cancer各组注入Walker 256细胞。所有动物在模型建立后13d开始进行鞘内置管。置管后3d(注入瘤细胞后16d),sham组及cancer组鞘内注入生理盐水(10μl/只);cancer+NGF组鞘内注入NGF(10μl/只,用生理盐水稀释为0.1μg/μl),cancer+anti-NGF组鞘内注入 anti-NGF(10μl/只,用生理盐水稀释为 1μg/μl),每日 2次,连续5d,置入导管容量10μl,热凝封管。观察大鼠疼痛行为学变化,并通过病理组织切片观察瘤细胞生长情况,数字化摄像观察骨质破坏情况。
1.3 主要仪器和试剂
Walker 256细胞(中国医学科学院肿瘤研究所),von Frey细丝(美国Stoeling公司),BME-410A热辐射刺激仪(中国医学科学院生物工程研究所),银汞混合器(北京四泰新技术开发公司),NGF(ab66458,Abcam 公司),anti-NGF(Santa Cruz公司)。
1.4 瘤细胞提取
Walker 256细胞为来源于大鼠乳腺癌的腹水瘤细胞,保存在中国医科大学附属盛京医院中心实验室液氮罐中,用快融方法复苏并接种。
1.5 大鼠胫骨癌痛模型的建立及鞘内置管
根据Medhurst等[4]的方法建立大鼠胫骨骨癌痛模型。选用体质量为200~220g的雌性SD大鼠,经水合氯醛麻醉后,左侧后肢外侧剪毛,消毒,在胫骨上段将皮肤切开约1cm小口,小心暴露胫骨,先用5ml注射器针头在胫骨钻孔,用弯曲的1ml注射器针头轻柔探测骨髓腔,然后用25μl微量注射器顺针孔进入骨髓腔,缓慢注入10μl含Walker 256的PBS细胞悬液,共含癌细胞1×105个,注射时间为2min,注射完毕后迅速用银汞合剂封住针孔,分别用75%乙醇和无菌生理盐水冲洗切口,皮肤分层缝合。sham组大鼠左侧胫骨上段注入等体积的PBS液,其余操作同各cancer组。鞘内置管参考陈华等[5]的方法置管,注入2%利多卡因20μl,7~20s出现双后肢麻痹后30min左右恢复,证实置管成功,取无感觉和运动障碍的动物作为研究对象。
1.6 行为学观察
1.6.1 一般情况观察:动物术后单笼饲养,以免互相啃噬,注意观察体位、走路姿态、有无自噬行为、后肢持重及体质量等情况。
1.6.2 行走步态及自发缩足次数观察:大鼠置于透明有机玻璃箱内,在其中可以自由行走。观察2min内大鼠行走步态和左后肢的自发缩足次数情况。
1.6.3 热辐射潜伏期测定:测定热辐射刺激引起的缩爪潜伏期(paw withdrawal latency,PWL)。将大鼠置入观察笼内,待其安静后将光辐射焦点对准足趾底中部,打开光源,从照射开始至大鼠缩爪的潜伏期作为热痛阈值,测定3次,时间间隔10min,取其平均值。为防止烫伤,将PWL上限值定为20s。每只大鼠在建立模型前1d测定的PWL作为基础值。
1.6.4 机械性痛阈测定:测定缩爪阈值(paw withdrawal threshold,PWT)。安静室温环境中,机械性痛觉超敏采用von Frey细丝测定,采用Chaplan等[6]的“up and down”方法。
1.7 放射学研究
于造模后第7、13和21天分别进行X线摄片,评估肿瘤诱发的骨破坏程度。放射学评分标准如下:0分,正常的骨结构,无任何骨质破坏的征象;1分,在胫骨近骺端注射部位附近见小的放射性的骨质缺损病灶(≤3个);2分,髓质骨缺损放射性病灶增多(>3个);3分,髓质骨缺失,同时皮质骨受侵;4分,单面的骨皮质完全缺损;5分,双面的骨皮质缺失,移位性骨折。
1.8 组织学研究
大鼠后肢X线摄片结束后进行修剪,留下胫骨及周围少量肌肉组织。先用4%多聚甲醛液固定1周,再在含5%甲酸的多聚甲醛固定液中脱钙4周,6mm厚连续切片,石蜡包埋,HE染色,镜下观察肿瘤生长和骨结构的破坏情况。
1.9 统计学分析
2 结果
2.1 大鼠一般情况
sham组大鼠无死亡;cancer组1例置管后出现肢体瘫痪,1例死亡;cancer+NGF组2例死亡;cancer+anti-NGF组1例死亡,1例置管后出现肢体瘫痪。上述死亡及肢体瘫痪大鼠均排除本研究之外。
2.2 大鼠体质量变化
cancer组大鼠接种Walker 256瘤细胞后毛发缺乏光泽,接种13d后,经常左后足悬空或不敢着地,右后肢负重,基本停止生长,与sham组比较体质量的差异有统计学意义(P<0.05)。cancer+anti-NGF组与cancer组比较,大鼠体质量明显增加(P<0.05),其原因可能与anti-NGF缓解疼痛有关。见表1。
表1 接种Walker 256瘤细胞后各组大鼠体质量变化(±s,g)Tab.1 Changes in rat body weight after inoculation of Walker 256tumor cell in each group(±s,g)
1)P<0.05vs sham group;2) P<0.05vs cancer group.
Group Baseline Post-inoculation day 7 Post-inoculation day 13 Post-inoculation day 16 Post-inoculation day 18 Post-inoculation day 21Sham 219±6.1 225±7.1 235±6.8 237±4.1 239±4.8 243±8.1Cancer 219±8.1 222±6.4 219±8.1 223±8.31) 218±6.91) 219±4.81)Cancer+NGF 220±7.9 223±6.9 220±7.9 221±5.41) 219±7.41) 215±9.21)Cancer+anti-NGF 219±8.3 222±5.8 219±8.3 223±7.51) 226±6.61),2) 228±4.91),2)
2.3 自发缩足次数
cancer组大鼠从接种瘤细胞1周左右开始,自发缩足次数明显高于sham组(P<0.01);接种瘤细胞18d后,cancer+anti-NGF组大鼠缩足次数明显少于cancer组(P<0.01),而cancer+NGF组大鼠缩足次数多于cancer组大鼠。见表2。
表2 接种Walker 256瘤细胞后各组大鼠自发缩足次数变化(±s)Tab.2 Changes in the number of paw withdrawal response after inoculation of Walker 256tumor cell in each group(±s)

表2 接种Walker 256瘤细胞后各组大鼠自发缩足次数变化(±s)Tab.2 Changes in the number of paw withdrawal response after inoculation of Walker 256tumor cell in each group(±s)
1)P<0.01vs sham group;2)P<0.05,3)P<0.01vs cancer group.
Group Baseline Post-inoculation day 7 Post-inoculation day 13 Post-inoculation day 16 Post-inoculation day 18 Post-inoculation day 21Sham 2.3±0.4 2.5±0.5 3.0±0.6 3.1±0.5 2.8±0.4 2.9±0.4Cancer 2.2±0.6 3.6±0.7 12.2±1.81) 18.6±2.11) 22.3±3.11) 24.1±3.61)Cancer+NGF 2.3±0.4 3.5±0.6 12.4±0.91) 17.1±1.41) 25.8±3.91),2) 29.3±5.41),2)Cancer+anti-NGF 2.3±0.5 3.8±0.8 13.1±1.11) 17.2±1.51) 8.9±1.61),3) 6.7±1.21),3)
2.4 PWL和PWT的测定
cancer组大鼠在接种瘤细胞1周左右开始出现PWL及PWT缩短或降低的趋势;接种后13d,cancer组大鼠的PWL缩短,PWT降低,与sham组比较差异有统计学意义(P<0.05或0.01),提示大鼠胫骨接种Walker 256瘤细胞可导致大鼠同时出现机械性痛敏和热痛敏。与cancer组比较,cancer+NGF组大鼠PWL和PWT进一步缩短或降低(P<0.05),提示NGF可加剧cancer大鼠的痛敏;而 cancer+anti-NGF组与 cancer组比较,PWL和PWT均延长或增高(P<0.05),提示机械性痛敏和热痛敏显著减弱。见表3、表4。
表3 接种Walker 256瘤细胞后各组大鼠PWL变化(±s,s)Tab.3 Changes in PWLafter inoculation of Walker 256tumor cell in each group(x ±s,s)
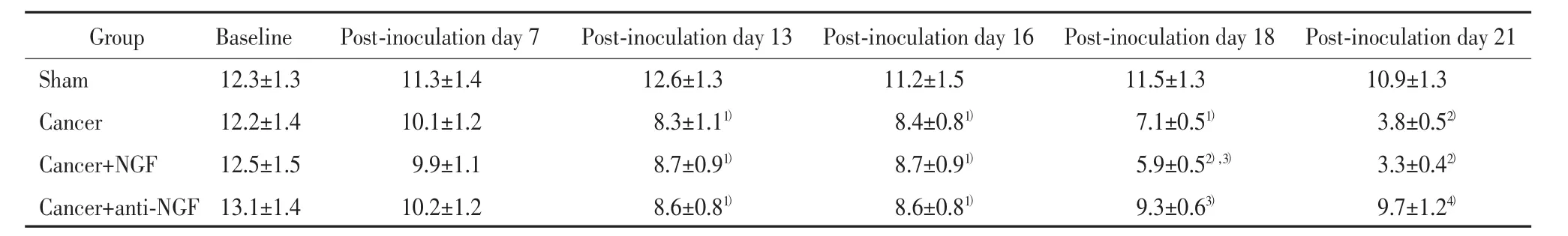
表3 接种Walker 256瘤细胞后各组大鼠PWL变化(±s,s)Tab.3 Changes in PWLafter inoculation of Walker 256tumor cell in each group(x ±s,s)
1)P<0.05,2)P<0.01vs sham group;3)P<0.05,4)P<0.01vs cancer group.
Group Baseline Post-inoculation day 7 Post-inoculation day 13 Post-inoculation day 16 Post-inoculation day 18 Post-inoculation day 21Sham 12.3±1.3 11.3±1.4 12.6±1.3 11.2±1.5 11.5±1.3 10.9±1.3Cancer 12.2±1.4 10.1±1.2 8.3±1.11) 8.4±0.81) 7.1±0.51) 3.8±0.52)Cancer+NGF 12.5±1.5 9.9±1.1 8.7±0.91) 8.7±0.91) 5.9±0.52),3) 3.3±0.42)Cancer+anti-NGF 13.1±1.4 10.2±1.2 8.6±0.81) 8.6±0.81) 9.3±0.63) 9.7±1.24)
表4 接种Walker 256瘤细胞后各组大鼠PWT变化(±s,g)Tab.4 Changes in PWTafter inoculation of Walker 256tumor cell in each group(x ±s,g)

表4 接种Walker 256瘤细胞后各组大鼠PWT变化(±s,g)Tab.4 Changes in PWTafter inoculation of Walker 256tumor cell in each group(x ±s,g)
1)P<0.05,2)P<0.01vs sham group;3)P<0.05,4)P<0.01vs cancer group.
Group Baseline Post-inoculation day 7 Post-inoculation day 13 Post-inoculation day 16 Post-inoculation day 18 Post-inoculation day 21Sham 15.7±2.4 14.9±2.4 13.2±2.3 12.4±2.2 11.7±1.9 12.3±1.3Cancer 16.3±2.5 13.4±2.2 5.6±1.22) 4.3±0.82) 3.7±0.92) 3.2±1.12)Cancer+NGF 15.9±2.3 13.7±2.1 5.9±0.92) 5.1±0.92) 2.1±0.52),3) 1.8±0.32),3)Cancer+anti-NGF 16.3±1.9 14.3±2.0 5.8±1.12) 6.6±0.72),3) 10.9±2.34) 9.7±1.51),4)
2.5 放射线显像结果
sham组大鼠没有发现放射线改变(放射学评分0分)。cancer组大鼠在接种瘤细胞后7d,胫骨近骺端出现骨质破坏;接种后13d,大鼠接种侧胫骨出现明显的髓质骨破坏;接种后21d骨破坏程度进一步加重,大部分骨皮质缺损破坏、个别出现移位性骨折,肿瘤组织突破骨皮质,能观察到明显的异常软组织影。cancer+NGF组及cancer+anti-NGF组大鼠术后21d左胫骨骨皮质均严重缺损破坏,骨不连,瘤细胞突出骨髓腔,cancer组、cancer+NGF组和cancer+anti-NGF组3组大鼠骨质破坏程度无明显差异。见表5。
表5 接种Walker 256瘤细胞后各组大鼠骨破坏程度评分(±s)Tab.5 Changes in the degree of bone destruction after inoculation of Walker 256tumor cell in each group(x ±s)
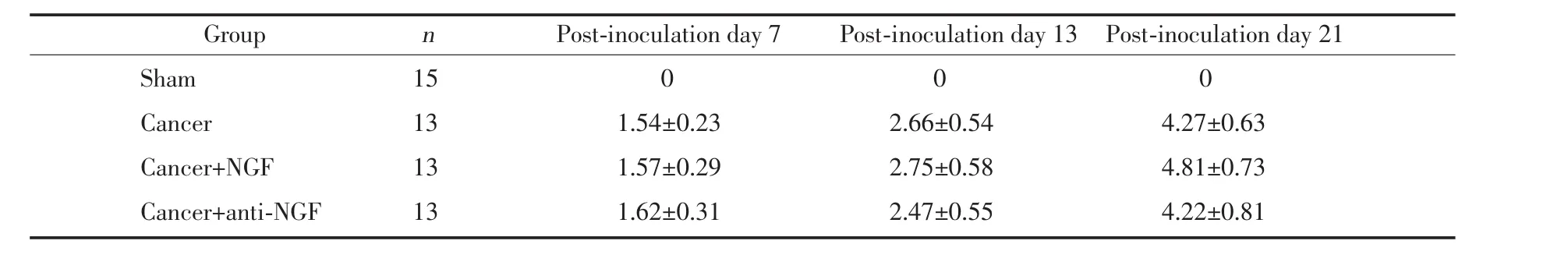
表5 接种Walker 256瘤细胞后各组大鼠骨破坏程度评分(±s)Tab.5 Changes in the degree of bone destruction after inoculation of Walker 256tumor cell in each group(x ±s)
Group n Post-inoculation day 7 Post-inoculation day 13 Post-inoculation day 21Sham 15 0 0 0Cancer 13 1.54±0.23 2.66±0.54 4.27±0.63Cancer+NGF 13 1.57±0.29 2.75±0.58 4.81±0.73Cancer+anti-NGF 13 1.62±0.31 2.47±0.55 4.22±0.81
2.6 病理学改变
光镜下观察显示cancer各组大鼠注射侧胫骨骨髓腔内及骨小梁间被大量肿瘤细胞填充,肿瘤细胞生长活跃,有成熟的、多形核破骨细胞浸润,骨结构破坏。sham组大鼠骨髓腔内见各种正常的骨髓细胞,无异常骨结构的改变。
3 讨论
本研究结果表明,胫骨上段骨髓腔注入Walker 256大鼠乳腺癌细胞后,cancer组大鼠自发缩足次数增多,机械性痛阈降低,热辐射痛刺激PWL缩短,放射显像及病理组织切片均表明胫骨癌痛模型成功建立。目前大鼠及小鼠各种骨癌痛模型已经成功建立,其区别在于肿瘤细胞的接种位点(包括股骨、肱骨、胫骨及跟骨等骨髓腔内)以及肿瘤细胞的组织学来源上存在一定的差异,但其共同的特征[7]在于:(1)行为学:通过自发性的保护或畏缩动作,在预定的观察时间内抬高患肢的时程或频率增加所体现的“进行性痛”或“背景痛”,在空旷区域内自由活动或强迫性运动时患肢使用率降低所体现的“移动诱发痛”;(2)组织学和影像学:肿瘤局部有成熟的、多形核破骨细胞浸润。骨质破坏的程度和疼痛行为学反应、外周及中枢神经系统内神经化学物质、细胞及分子的改变密切相关。
建立骨癌痛模型,不管使用何种肿瘤细胞、接种的位点在何处,模型成功的关键在于确保肿瘤细胞局限于骨髓腔内而不侵及邻近的软组织,否则直接影响骨关节和肌肉的功能,给行为学分析带来困难。本研究按照Medhurst等的方法建立骨癌痛模型,并采用牙科专用银汞合金封堵骨孔,75%乙醇和无菌生理盐水冲洗切口,确保了局部关节、肌肉组织无瘤细胞残留。13d左右无邻近的软组织肿物出现,但随后有15%左右大鼠出现局部肿物生长,考虑与瘤细胞破坏骨组织、侵及邻近组织有关。
本研究发现,骨癌痛大鼠热辐射潜伏期缩短,机械痛阈值降低,出现痛敏。鞘内注射anti-NGF抗体阻断NGF的作用位点后,热辐射潜伏期延长,机械痛阈提高,自发缩足次数减少,而鞘内使用NGF却可加剧骨癌痛大鼠的痛敏反应。这些结果显示NGF在大鼠乳腺癌骨转移痛时发挥重要作用。以往的一些基于骨肿瘤的研究显示,肿瘤细胞在骨髓腔内不断生长,肿瘤细胞本身会释放NGF;肿瘤浸润组织的白细胞增多,有研究认为占整个肿瘤组织的80%,活化的白细胞会合成并释放大量高浓度的生长因子;肿瘤细胞坏死,受侵的正常组织细胞也会释放生长因子。因此在高浓度的生长因子作用下,感觉神经元的表型及反应特性均会发生明显的变化。
Zahn等[8]的研究显示,阻断NGF通路,热痛觉超敏减弱,而机械痛敏无变化。本研究结果显示,鞘内使用anti-NGF后,骨癌痛大鼠热痛敏及机械痛敏反应均减弱,提示阻断NGF通路可产生明显的抗伤害感受作用。与以往研究不一致之处考虑可能与使用anti-NGF的持续时间有关,本研究中连续应用5d,而Zahn等的研究仅是单次用药。
NGF在伤害性感受器的急、慢性敏化过程中发挥重要作用。当发生炎性损伤或使用致炎因子白介素1β和肿瘤坏死因子α后,NGF在局部组织中的浓度会迅速升高,导致部分肽能伤害性感受器发生敏化,出现痛敏。电生理研究发现,伤害性感受器的兴奋性与NGF的含量密切相关。NGF不仅可直接活化感觉神经元,还可调控一些神经递质、受体、通道的活性。有研究提示,NGF可促进前列腺癌细胞在骨髓的迁延、破坏,加剧痛敏发生[9],与本研究结果一致。因此,NGF在肿瘤骨转移疼痛的发生、发展过程中发挥重要作用,阻断NGF的作用位点可能是缓解骨癌痛的一种新的治疗方案。
今后,将继续研究NGF在骨癌痛发生、发展过程中的作用及其与相关受体、通道的关联及机制。
[1]Thun MJ,DeLancey JO,Center MM.The global burden of cancer:priorities for prevention[J].Carcinogenesis,2010,31(1):100-110.
[2]King T,Vardanyan A,Majuta L,et al.Morphine treatment accelerates sarcoma-induced bone pain,bone loss,and spontaneous fracture in a murine model of bone cancer[J].Pain,2007,132(1-2):154-168.
[3]Khasabov SG,Hamamoto DT,Harding-Rose C,et al.Tumor-evoked hyperalgesia and sensitization of nociceptive dorsal horn neurons in a murine model of cancer pain[J].Brain Res,2007,14(1180):7-19.
[4]Medhurst SJ,Walker K,Bowes M,et al.Arat model of bone cancer pain[J].Pain,2002,96(1-2):129-140.
[5]陈华,张锦,崔健君,等.鞘内应用吗啡和氯胺酮对神经痛大鼠脊髓NOS活性和NO产量的影响[J].中华麻醉学杂志,2004,24(3):203-205.
[6]Chaplan SR,Bach FW,Pogrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw [J].JNeurosci Meth,1994,53(1):55-63.
[7]Goblirsch MJ,Zwolak PP,Clohisy DR.Biology of bone cancer pain[J].Clin Cancer Res,2006,12(20Pt 2):6231s-6235s.
[8]Zahn PK,Subieta A,Park SS,et al.Effect of blockade of nerve growth factor and tumor necrosis factor on pain behaviors after plantar incision[J].JPain,2004,5(3):157-163.
[9]Sato S,Futakuchi M,Ogawa K,et al.Transforming growth factor beta derived from bone matrix promotes cell proliferation of prostate cancer and osteoclast activation-associated osteolysis in the bone microenvironment[J].Cancer Science,2008,99(2):316-323.
(编辑 陈 姜,英文编辑 陈 姜)
Effect of Nerve Growth Factor on Pain Behavior in Rat Model of Bone Cancer Pain
YAOPeng,ZHANGJin,JIANGJing-jing,MENGLing-xin
(Department of Pain,Shengjing Hospital,China Medical University,Shenyang 110004,China)
ObjectiveTo observe the effect of nerve growth factor (NGF)and anti-NGFinjected intrathecally on pain behavior in rat model of bone cancer pain.MethodsThe rat model of bone cancer pain was established,and randomly assigned to receive intrathecal injection of normal saline(cancer group),NGF(cancer+NGFgroup),and anti-NGF(cancer+anti-NGFgroup).The changes in mechanical and thermal hyperalgesia were assessed at different time points after inoculation of Walker 256tumor cell.ResultsCompared with shamoperated group,the body weight of rats in other 3groups significantly decreased(P<0.05);and the body weight of rats in cancer+anti-NGFgroup was significantly higher than that in cancer group (P<0.05).Compared with sham-operated group,more paw withdrawal responses,reduced paw withdrawal latency (PWL),and decreased paw withdrawal threshold (PWT)were observed in cancer group.Compared with cancer group,the number of paw withdrawal response decreased,and PWLand PWTincreased in cancer+anti-NGFgroup;but in cancer+NGFgroup the number of paw withdrawal response increased,and PWLand PWTdecreased.ConclusionNGFcould deteriorate cancerinduced bone pain in rats,while anti-NGFcould ameliorate the mechanical and thermal hyperalgesia.
bone cancer pain;nerve growth factor;pain behavior;intrathecal injection;rat
R338
A
0258-4646(2010)12-1009-04
辽宁省自然科学基金资助项目(20082111)
姚鹏(1971-),男,讲师,博士.
张锦,E-mail:yaop@sj-hospital.org
2010-09-26
