99Tcm-DTPA-Gd的制备及其生物学分布
2010-01-26丁志凌黄占文孙媛媛
丁志凌,陈 跃,黄占文,张 伟,孙媛媛,张 莉
泸州医学院附属医院 核医学科,四川 泸州 646000
磁共振影像(magnetic resonance imaging,MRI)是目前重要的影像学检查手段,与CT相比具有显著优势,首先是对软组织的空间高分辨率可以清晰显示脏器及周围组织的对比关系,可以提供精确的脏器解剖信息,其次MRI应用不同的扫描序列和借助增强对比剂可以完成脏器的部分功能检查。Gd-DTPA是MRI中应用最早、最广泛的钆类顺磁增强对比剂。稀土元素钆(Gd)主要通过质子弛豫增强作用缩短周围组织及液体的T1、T2驰豫时间,主要是T1加权成像,广泛应用于肿瘤、神经、心血管等疾患的诊断。早期应用放射性同位素153Gd研究153Gd-DTPA的生物分布,认为Gd-DTPA属于细胞外显像剂,由于分子量小、非脂溶性等因素不能渗透入细胞,静脉注射后迅速从血管内弥散到血管外,分布于细胞外结缔组织间隙中,几乎完全从肾小球滤过而排出体外。本工作拟通过放射性核素99Tcm标记Gd-DTPA,观察标记的可能性,并进一步研究99Tcm-DTPA-Gd的生物学分布。
1 实验部分
1.1 主要试剂和仪器
二乙三胺五乙酸(DTPA)和Gd-DTPA·2H2O均为美国Sigma Aldrich公司产品;氯化亚锡(SnCl2·2H2O),成都科龙化工试剂厂;三氯乙酸(TCA),天津市科密欧化学试剂开发中心。所有试剂均为分析纯。成年健康昆明小鼠60只,体重20~30 g;成年家兔3只,体重1.5~2.0 kg,所有实验动物雌雄不限,均由泸州医学院动物实验中心提供。
Millennium VG5 SPECT仪,美国GE公司;SN-695型自动γ免疫计数仪,中国科学院上海物理研究所日环光电仪器有限公司;MS-1000 自动薄层扫描仪,美国Bioscan公司;99Mo-99Tcm发生器,北京原子高科股份有限公司。
1.2 99Tcm-DTPA-Gd的制备
1.2.1标记方法 参考文献[1]中99Tcm-DTPA的标记条件:设定Gd-DTPA与SnCl2摩尔比为10∶1,称取Gd-DTPA 0.05 mmol(约27 mg)置于淋洗瓶中,用0.4 mL蒸馏水溶解,加入SnCl20.005 mmol(约1.0 mg,用0.1 mol/L HCl溶解)。加入1.0 mL新鲜淋洗的Na99TcmO4溶液(约74~185 MBq),充分混匀后置45 ℃水浴中反应30 min。本实验以99Tcm-DTPA作为实验对照。

1.3 血浆蛋白结合率测定
家兔心脏采血15 mL,肝素500 IU抗凝,3 000 r/min离心5 min,收集血浆约6 mL。取6支一次性塑料试管,每管加入0.8 mL血浆,分设2组,即99Tcm-DTPA-Gd和99Tcm-DTPA组。分别加入0.1 mL(约37 kBq)标记物(99Tcm-DTPA-Gd和99Tcm-DTPA分别用生理盐水稀释至370 kBq/mL)。含标记物的血浆试管置37 ℃水浴箱孵育2 h后,加入25%三氯乙酸4 mL,2 000 r/min离心5 min,弃上清液;再次加入10%三氯乙酸4 mL,2 000 r/min离心5 min,弃上清液,重复2次;每管加入生理盐水0.4 mL再次离心清洗2次。本实验设总管(0.1 mL稀释的标记药物)、非特异性管(不加血浆,加入0.1 mL稀释的标记药物,相同步骤操作)和本底管(未加标记物的试管)。最后用γ计数器测定试管的放射性计数,按以下公式计算血浆蛋白结合率:
血浆蛋白结合率=(沉淀中的放射性计数-非特异性管放射性计数)/(0.1 mL标记药物放射性总计数-非特异性管放射性计数)×100%。
1.4 小鼠体内分布试验
60只昆明成年小鼠,雌雄不限,随机分为2组,即99Tcm-DTPA-Gd组和99Tcm-DTPA组。按注射后不同时间点分为6组,每组5只。99Tcm-DTPA-Gd和99Tcm-DTPA分别用生理盐水稀释至约185 kBq/mL。取0.1 mL(18.5 kBq)标记药物小鼠尾静脉注射,分别于注射药物后1、5、10、15、30、60 min,先摘取眼球眶静脉取血约1 mL,然后断颈处死,解剖取出脑、心、肝、脾、肺、肾、小肠、肌肉等脏器,其中肾脏和脑组织为完整脏器,其余均剪取部分脏器,置预先称重及标记的一次性试管中称重,获得绝对质量(g)。γ计数器分别测量0.1 mL注射总计数(Total,T,n=5)、本底管计数(Background,B,n=5)和每管放射性计数,计算每克组织百分注射剂量率(%ID/g),结果以(均值±标准差)表示。
1.5 家兔显像
两只成年家兔用于显像。SPECT仪配通用平行孔准直器,选择肾动态显像模式,双时相采集(灌注相,帧/2 s,60 s;功能相,帧/30 s,60 min)。用0.1 mol/L NaOH溶液分别调节99Tcm-DTPA-Gd和99Tcm-DTPA的pH值为4.0~6.0。0.1 mL (约18.5~37 MBq)标记药物经家兔耳缘静脉注射,即刻采集,沿双肾边缘勾画感兴趣区(ROI),计算机处理获得部分功能参数,包括分肾摄取百分比(%)、达高峰时间(Tmax)、半排时间(T1/2)。每只家兔均进行99Tcm-DTPA-Gd和99Tcm-DTPA显像对比分析。为了避免前一种药物的干扰,间隔48 h后进行第二种药物显像。
1.6 统计学分析
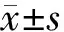
2 结果和讨论
2.1 标记物的标记率、放化纯度和稳定性分析
99Tcm-DTPA-Gd标记溶液外观澄清透明。以生理盐水和丙酮为展开剂时,99Tcm-DTPA-Gd与99Tcm-DTPA具有相同的Rf值,即在生理盐水中Rf=0.9~1.0,在丙酮中Rf=0~0.1。计算99Tcm-DTPA-Gd的标记率为98.7%。室温放置6 h内,标记物放化纯均大于95%,可满足实验要求。
测得最终标记溶液的pH≈2.0;2种标记物用生理盐水稀释至370 kBq/mL时,测pH值均为6.0~6.2;0.8 mL血浆中加入0.1 mL稀释后的标记物(370 kBq/mL),测pH值均为7.2左右。两种标记物分别用0.1 mol/L NaOH溶液调节pH 为4.0~6.0,测定放化纯无明显变化,均大于95%。
2.2 血浆蛋白结合率
99Tcm-DTPA是核医学检查中常用的肾动态显像剂,静脉注射后几乎全部经肾小球滤过,是目前公认的评价肾小球滤过率的最佳方法[2]。一般认为99Tcm-DTPA体内的血浆蛋白结合率在3%~10%,这种差异与药盒组成有关。本实验用三氯乙酸沉淀法测定99Tcm-DTPA-Gd在家兔血浆中的蛋白结合率。实验中测得总管放射性计数约为40 000;沉淀放射性计数约为1 600;非特异性管约为180;本底管约为160(均为均数)。测得99Tcm-DTPA-Gd和99Tcm-DTPA的血浆蛋白结合率分别为(3.80±0.25)%和(3.48±0.26)%。配对t检验,差异无统计学意义(P=0.104)。
Gd-DTPA类顺磁增强对比剂广泛应用于肿瘤、神经、心血管以及肾脏的形态和功能检查[3]。Gd-DTPA静脉注入机体后,主要分布在细胞外液经肾脏排泄,1~3 h约80%排除体外,体内血浆蛋白结合率很低。DTPA是重要的8齿配体,其分子结构中含有3个氮原子和5个羧基,螯合能力强,进入体内几乎全部经肾小球滤过而排除体外。Gd与DTPA络合稳定,在体内外稳定性好而不易解离,DTPA的部分配位原子与Gd(Ⅲ)络合,分子中存在过剩的配位原子,99Tcm在适当的条件下可以与Gd-DTPA形成螯合物。
2.3 标记物在小鼠体内生物分布
表1列出了99Tcm-DTPA-Gd和99Tcm-DTPA在健康昆明小鼠血液及主要脏器的每克组织百分注射剂量率(%ID/g)。 由表1可知,2种标记物具有相似的生物分布,注射后1 min血液摄取均达到最高,分别为(14.79±9.77)%ID/g和(10.65±4.28)%ID/g;99Tcm-DTPA-Gd 在注射后1 min肾脏摄取达最高((26.02±8.50)%ID/g),注射后5 min肾脏排泄大于50%。99Tcm-DTPA在注射后5 min肾脏摄取最高((16.86±5.55)%ID/g),注射后5~10 min肾脏排泄约至50%。各时间点,脑组织分布最少(小于1%ID/g);心脏、肝脏、脾脏和肺脏有部分摄取。注射后60 min两种标记物在各主要脏器内分布很少,其中99Tcm-DTPA-Gd组各脏器摄取率均小于1%ID/g,99Tcm-DTPA在血液、肺脏和肾脏摄取率大于1%ID/g。

表1 99Tcm-DTPA-Gd和99Tcm-DTPA在小鼠体内的生物分布Table 1 Biodistribution of 99Tcm-DTPA-Gd and 99Tcm-DTPA in mice
注(Note):n=5
Gd-DTPA与99Tcm-DTPA具有相同的肾脏滤过和排泄机制,Gd-DTPA通过静脉进入机体后,存在于细胞外的组织液,不进入细胞内,几乎全部经肾脏由肾小球滤过排泄,24 h排泄率大于90%。Weinmann等[4]用153Gd标记DTPA,以大鼠为实验对象,结果表明,静脉注射153Gd-DTPA 后5 min约10%分布于全身血液;血液浓度清除半衰期约20 min;至3 h约80%通过肾脏排泄出体外,肾脏排泄半衰期约20 min;7 d后,有90%回收于尿液,7%来自粪便。Prato等[5]研究表明,尽管153Gd-DTPA与99Tcm-DTPA分布特性比较接近,排泄相似,但99Tcm-DTPA在血液和肺脏的滞留超过153Gd-DTPA,而肾脏的滞留低于153Gd-DTPA,原因是99Tcm-DTPA的部分血浆蛋白结合。李明等[6]的研究显示153Gd-DTPA与99Tcm-DTPA排泄基本相同,153Gd-DTPA血液清除符合2室模型,T1/2(α)为1.5 min,T1/2(β)为29.9 min。本实验中99Tcm-DTPA-Gd和99Tcm-DTPA的血浆蛋白结合率没有显著性差异,两种标记药物在小鼠体内具有相似的生物分布,99Tcm-DTPA-Gd主要经肾脏排泄,由于血脑屏障的完整性,99Tcm-DTPA-Gd不能进入正常脑组织,注射后60 min,大部分排出体外而没有脏器的特异性滞留。
2.4 家兔肾动态显像
正常成年家兔肾动态显像显示注射99Tcm-DTPA-Gd 后1 min双肾影逐渐出现,至5 min时清晰显影。正常家兔注射两种标记药物后6.5~8.0 min的肾动态显像图像分别示于图1、2。由图1、2可知,标记药物主要浓聚于双肾和膀胱,至显像结束,大部分标记药物聚集在膀胱,双肾有少量滞留,血周围本底较低,无其它脏器的特异性摄取和滞留。正常家兔注射两种标记药物后肾动态显像的功能参数列入表2。由表2可知,99Tcm-DTPA-Gd和99Tcm-DTPA的排泄基本相同,肾脏达高峰时间约为5~10 min,半排时间约为10~20 min。
综上,99Tcm-DTPA-Gd和99Tcm-DTPA在生物体内的排泄和分布基本相同,可能与二者具有相同的血浆蛋白有关。药物的血浆蛋白结合是影响药物排泄和分布的一个重要因素。Russell等[7]研究了3种来自不同厂家的肾动态显像剂药盒(99Tcm-DTPA),结果显示各药盒标记物的血浆蛋白结合存在显著性差异,这种差异影响到了肾小球滤过率(GFR)的正确计算。同时,实验结果显示,两种标记药物在动物体内的分布和排泄又不完全相同,其中影响因素较多,包括标记药物的标记率、放化纯度、注射方法、注射剂量、药物的分子量、电荷性以及组织器官的病理生理特性等等。其中Assadi等[8]研究认为不同剂量的99Tcm-DTPA测定GFR会有不同的结果。普遍认为99Tcm-DTPA进入体内后仅存在于细胞外组织间隙而不弥散进入细胞内,除肾脏摄取排泄外不会被其它脏器特异性摄取。但Arheden等[9]在一项大鼠的试验研究中却发现99Tcm-DTPA在缺血后再灌注的受损心肌中有较高的滞留,源于受损的心肌不能有效清除99Tcm-DTPA所致。

图1 正常家兔注射99Tcm-DTPA-Gd后肾动态显像Fig.1 Renal scintigram with 99Tcm-DTPA-Gd in rabbit after injection(a)——6.5 min,(b)——7.0 min,(c)——7.5 min,(d)——8.0 min

图2 正常家兔注射99Tcm-DTPA后肾动态显像Fig.2 Renal scintigram with 99Tcm-DTPA in rabbit after injection (a)——6.5 min,(b)——7.0 min,(c)——7.5 min,(d)——8.0 min

标记物(Labelingcompounds)家兔(Rabbits)放射性摄取(Uptakeratio)/%Tmax/minT1/2/min左肾(Leftkidney)右肾(Rightkidney)左肾(Leftkidney)右肾(Rightkidney)左肾(Leftkidney)右肾(Rightkidney)99Tcm⁃DTPA142957178681020125054953131607599Tcm⁃DTPA⁃Gd13826186888141165250549553438295
医学影像技术的发展逐渐向多模式的图像融合发展,其中多模式显像剂的研究是目前的一个热点[10]。笔者认为,在本实验的基础上可以进一步研究设计一种新型的显像剂,适用于SPECT和MRI显像,通过影像融合技术以提高肿瘤诊断的准确性。
3 结 论
应用放射性核素99Tcm标记磁共振增强对比剂Gd-DTPA方法简单、标记率高、稳定性好。Gd-DTPA与99Tcm连接后,动物体内外实验显示标记后Gd-DTPA生物分布特性基本没有改变。99Tcm-DTPA-Gd与99Tcm-DTPA具有相似的生物分布,应用99Tcm标记顺磁对比剂Gd-DTPA既可进行动物体内药代动力学的研究,也可通过活体动物核素显像直接观察Gd-DTPA的代谢和排泄。本实验显示DTPA作为一个双功能螯合剂可以同时链接99Tcm和Gd,对于一些新型具有脏器特异性的Gd-DTPA类顺磁显像剂,或许可以通过这种标记方法进行药代动力学的研究。
[1] Russell C D, Rowell K, Scott J W. Quality Control of Technetium-99m DTPA: Correlation of Analytic Tests WithinVivoProtein Binding in Man[J]. J Nucl Med, 1986, 27(4): 560-562.
[2] Abou El-Ghar M E, Shokeir A A, Refaie H F, et al. MRI in Patients With Chronic Obstructive Uropathy and Compromised Renal Function: A Sole Method for Morphological and Functional Assessment[J]. Br J Radiol, 2008, 81(968): 624-629.
[3] Choyke P L, Austin H A, Frank J A, et al. Hydrated Clearance of Gadolinium-DTPA as a Measurement of Glomerular Filtration Rate[J]. Kidney Int, 1992, 41(6): 1 595-1 598.
[4] Weinmann H J, Brasch R C, Press W R, et al. Characteristics of Gadolinium-DTPA Complex: A Potential NMR Contrast Agent[J]. Am J Roentgenol, 1984, 142(3): 619-624.
[5] Prato F S, Wisenberg G, Marshall T P, et al. Comparison of the Biodistribution of Gadolinium-153 DTPA and Technetium-99m DTPA in Rats[J]. J Nucl Med, 1988, 29(10): 1 683-1 687.
[6] 李 明,林祥通,陈 伟,等.Gd-DTPA的合成及其在小鼠体内分布的实验研究[J].核技术,1998,18(5):278-281.
[7] Russell C D, Bischoff P G, Rowell K L, et al. Quality Control of Tc-99m DTPA for Measurement of Glomerular Filtration: Concise Communication[J]. J Nucl Med, 1983, 24(8): 722-727.
[8] Assadi M, Eftekhari M, Hozhabrosadati M, et al. Comparison of Methods for Determination of Glomerular Filtration Rate: Low and High-Dose Tc-99m-DTPA Renography, Predicted Creatinine Clearance Method, and Plasma Sample Method[J]. Int Urol Nephrol, 2008, 40(4): 1 059-1 065.
[9] Arheden H, Saeed M, Higgins C B, et al. Measurement of the Distribution Volume of Gadopentetate Dimeglumine at Echo-Planar MR Imaging to Quantify Myocardial Infarction: Comparison With99mTc-DTPA Autoradiography in Rats[J]. Radiology, 1999, 211(3): 698-708.
[10] Lee S, Chen X. Dual-Modality Probes forinVivoMolecular Imaging[J]. Mol Imaging, 2009, 8(2): 87-100.
