树突细胞与新生隐球菌
2010-01-26方伟徐瑞宏廖万清
方伟,徐瑞宏,廖万清
第二军医大学附属长征医院皮肤科,上海200003
新生隐球菌(Cryptococcusneoformans,Cn)是临床上重要的病原真菌,易侵犯免疫功能低下者,偶见于免疫功能正常的人群。研究证明,10%~40%的人类免疫缺陷病毒(human immunodeficiency virus,HIV)相关性死亡由隐球菌性脑膜脑炎导致[1]。近年来,随着器官移植手术的广泛开展,Cn感染率明显上升,并发隐球菌性脑膜脑炎的器官移植患者病死率可高达50%[2]。
树突细胞(dendritic cell,DC)是人体内最重要的抗原呈递细胞,可有效刺激T细胞和B细胞应答,将固有免疫和适应性免疫有机联系起来,是基础与临床研究的热点。尽管DC在启动宿主免疫方面具有重要的功能,但对其与Cn的相互作用及机制还知之甚少,本文分别从DC和Cn 2个角度论述两者之间复杂的作用机制。
1 DC在抗Cn感染中的免疫效应
1.1 概述
宿主抗Cn感染的功能主要由细胞免疫介导,Cn感染后的转归很大程度上取决于Th1/Th2细胞因子的平衡:极化的Th1免疫应答起保护作用,而Th2细胞因子的偏移则使宿主易于感染。这种平衡状态在Cn入侵宿主的早期,受到多种免疫细胞的调节,其中最主要的是DC(图1)。DC不仅具有强大的抗原识别能力,还高表达主要组织相容性复合物(major histocompatibility complex,MHC)Ⅱ类分子和共刺激分子;同时还具有强大的诱导初次免疫应答的独特功能,在体液和细胞免疫应答中发挥独特作用。
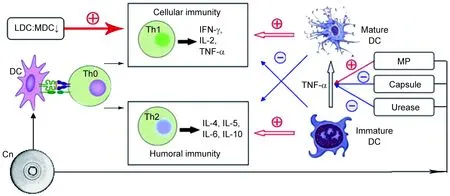
图1DC与Cn的相互作用机制
Fig.1ThemechanismsofinterplaybetweendendriticcellsandC.neoformans
Kelly等[3]研究发现,混合人体血清(pooled human serum,PHS)(含不耐热补体)和(或)抗荚膜单克隆抗体等调理素能有效促进DC对Cn的识别及其抗真菌活性;但在超氧化物歧化酶、过氧化氢酶及甘露醇等存在时,DC的抗Cn效应显著下降。这说明DC在体外通过氧依赖性和非氧依赖性机制发挥抗Cn效应,那么宿主体内感染时是否能产生类似的防御效应呢?
为了研究DC在宿主体内的抗Cn作用,Wozniak等[4]通过小鼠的Cn吸入感染模型证实,宿主体内的肺DC具有吞噬Cn和抗原呈递功能,参与诱导宿主抗隐球菌感染的固有免疫和适应性免疫应答。在此基础上,他们又通过共聚焦显微镜证实Cn在被DC吞噬后被迅速运输至内体(endosome)和溶酶体小室内(该过程并不依赖特定调理素的选择)。DC溶酶体提取物具有显著的杀真菌作用,且呈现剂量依赖性[5]。实验证明,DC既有呈递抗原,又有直接杀灭隐球菌的作用。
1.2 多种Cn抗原识别机制
近年来,病原体相关分子模式在宿主防御感染性疾病中的重要性已经越来越为人们所认识。目前研究的热点主要集中在模式识别受体(pattern recognition receptor,PRR)中的甘露糖受体(mannose receptor,MR)和Toll样受体(Toll-like receptor,TLR)。
MR是一种常见的C型凝集素受体,能识别末端甘露糖化分子。人体DC表面存在多种MR[6-8],其中对巨噬细胞MR(macrophage MR,MMR,CD206)和DC-SIGN(CD209)研究较多。这2种受体均能识别并内化甘露糖蛋白(mannoprotein,MP;存在于Cn胞壁及荚膜中的一种重要抗原),而且识别过程能被其他甘露糖化配体竞争性抑制[9]。
Levitz等[10]通过体外实验,比较了小鼠脾DC、脾B细胞和巨噬细胞这3种抗原呈递细胞在应答Cn MP抗原中的作用,发现只有DC能有效捕获并呈递MP抗原给T细胞,并促进其增殖、活化。应用荧光结合实验对3种细胞进一步分析,发现尽管三者均表达MR,但只有DC表面的MR对MP具有高亲和力,其中MMR和DC-SIGN在识别、吞噬MP抗原过程中发挥至关重要的作用。Dan等[11]通过构建野生小鼠和敲除MR小鼠的Cn吸入感染模型,发现MR敲除的小鼠死亡率更高,生存时间更短,且其肺部Cn负荷量显著增加。但2组小鼠肺部中的未成熟DC对MP抗原的摄取率相似,这可能是宿主DC表面存在其他C型凝集素受体识别抗原的缘故。感染2周后,野生小鼠外周淋巴结中发生显著的MP特异性T细胞增殖反应,而MR敲除小鼠则不明显。由此推测,无论其他凝集素受体是否发挥抗原识别作用,MR在启动MP特异性CD4+T细胞应答中是不可或缺的。
上述研究提示,依赖MR识别的免疫机制确实有利于宿主抵御Cn感染,但是还不足以完全保护宿主免受感染或清除病原体。是否可联合其他靶受体以增强MR的保护效应以提高宿主的免疫应答水平,尚有待进一步研究。
在抗Cn感染中,另一类重要的PRR是TLR。TLR表达于多种免疫细胞中,仅识别表达在病原微生物上高度保守的结构基序。对于TLR在识别Cn抗原中的作用尚无定论。
Yauch等[12]通过构建CD14、TLR2、TLR4和MyD88缺陷小鼠的隐球菌感染模型,研究TLR和CD14在活体宿主内抗Cn的作用,发现TLR2抗Cn感染效应很有限,而MyD88则非常重要。在另一项研究中,Biondo等[13]认为TLR2和MyD88具有抗隐球菌的防御功能,TLR4则无此效应。
Nakamura等[14]通过小鼠实验提出,TLR2和TLR4对宿主抗Cn的细胞免疫作用十分有限(与Biondo等研究结果不尽相同)。而Cn的DNA能以类似于CpG寡聚脱氧核苷酸(CpG oligodeoxynucleo-
tide,CpG-ODN)的方式,通过激发TLR9-MyD88途径,最终活化DC,诱导其释放白细胞介素12(interleukin-12,IL-12)p40,表达CD40,从而产生保护效应[15]。这种Cn的DNA活化效应在TLR9敲除小鼠(TLR9-/-)或MyD88敲除小鼠(MyD88-/-)中则完全消失,说明TLR9可能是宿主免疫系统识别真菌病原体的新机制,为研究、设计新的抗隐球菌免疫治疗方法提供了新的思路。
除MR和TLR外,研究还发现IgG Fc段受体Ⅱ(Fcγ receptor Ⅱ,FcγRⅡ)和补体受体(complement receptor,CR)等表面受体对DC识别并呈递Cn抗原亦发挥重要作用[16,17]。
1.3 不同DC亚群产生的影响
根据细胞来源的不同,DC可分为髓样DC(myeloid DC,MDC)和淋巴样/浆细胞样DC(lymphoid DC/plasmacytoid DC,LDC/PDC),在抗Cn感染中各有不同的功能特点。
Bauman等[16]用保护性免疫原CneF-CFA和非保护性免疫原HKC-CFA的小鼠免疫模型检验不同DC亚群在抗Cn感染中所诱导的不同免疫效应。研究发现,经CneF-CFA作用后,小鼠回流淋巴结总体细胞数显著增加,其中MDC、朗格汉斯细胞(Langerhan’s cell, LC)和CD4+T细胞明显升高,但是LDC∶MDC比例显著低于HKC-CFA组或CneF-CFA+HKC-CFA组;而经HKC-CFA免疫后,总体细胞数、CD4+T细胞无明显增加,LDC却显著增加。这可能是因为MDC和LDC作为刺激T细胞活化的主要抗原呈递细胞,参与抗Cn的保护性细胞免疫应答;而LDC具有负性免疫调节作用,其高水平表达与抗Cn的非保护性免疫应答相关;同时,LDC∶MDC的平衡受抗原调控,从而决定宿主是否能诱导保护性的免疫效应(图1)。
另有学者[18]通过体外实验,进一步证实MDC经Cn刺激后活化,增强IL-12/23 p40(均为IL-12家族成员,能诱导初始T细胞分化为Th1细胞,对抗Cn,具有保护效应)的分泌,并上调MHCⅡ类分子和CD86的表达,从而呈递抗原,刺激T细胞增殖、活化,诱导保护性免疫应答;而LDC无此作用。MDC是否能在活体隐球菌感染过程中也发挥类似保护功能,尚有待进一步研究。
1.4 DC的成熟状态对免疫应答的影响
DC呈递抗原能力随其发育成熟而逐步增强,而摄取抗原能力则逐渐减弱;成熟DC能有效进行抗原呈递并诱导T细胞活化,而未成熟DC可能诱导免疫耐受。
Herring等[19]研究了DC成熟状态对宿主抗Cn感染的影响,发现在给小鼠接种Cn前输入经Cn MP脉冲处理的未成熟DC,小鼠肺部IL-4、IL-5、IL-10以及嗜酸性粒细胞水平明显升高,清除病原菌的能力显著下降〔与经抗肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体处理后的效果相似〕。结果提示,未成熟DC抑制抗Cn的保护性Th1免疫应答,诱导Th2免疫偏移(图1)。
TNF-α能促进未成熟的DC成熟,并从外周组织迁移至回流淋巴结中。TNF-α的拮抗可能通过影响未成熟DC的成熟过程诱导免疫耐受,这很可能是免疫正常宿主发生慢性Cn感染的一种新机制。因为外伤、继发感染、免疫治疗等多种因素可使正常宿主发生早期TNF-α分泌延迟,或导致DC处于未成熟状态,从而发生免疫偏移现象。Osterholzer等[20]在研究Cn尿素酶对宿主清除肺部病原菌能力和免疫应答的差异时,获得类似结论。
2 Cn对DC的影响
2.1 MP
MP是一类包含80%~90%甘露糖的糖结合蛋白,主要表达于真菌表面,在真菌生长期间脱落[21]。MP是Cn细胞壁中含量最高的一类多糖物质,在胞壁外荚膜中亦少量存在[22]。
大量的体内、外实验研究证实,MP对于诱导宿主抗真菌的T细胞免疫应答十分重要,不仅能诱导产生迟发型超敏反应,刺激淋巴细胞增殖,还可诱导人单核细胞早期分泌大量IL-12,对宿主抗Cn感染具有显著的保护效应,已被鉴定为其所产生的主要免疫显性抗原[23-26]。
MP具有广泛的N-甘露糖残基和O-甘露糖残基,是DC表面MR和DC-SIGN的配体。Pietrella等[27]研究发现,经Cn的MP刺激后,DC表面CD40,CD86,CD83和MHCⅠ、Ⅱ类分子等显著表达,而CD14、CD16、CD32则受抑制,且大量TNF-α和IL-12分泌;与同源T细胞共孵育后,T细胞大量增殖、活化,并以CD4+T细胞为主,还产生大量细胞因子,且随时间延长,γ干扰素(interferon-γ,IFN-γ)分泌增加而IL-2、IL-10分泌逐渐减少。说明DC通过表面MR识别Cn的MP,实现最优化的抗原呈递过程,促进宿主的保护性免疫应答(图1),从理论上进一步确立了以MP构建抗真菌疫苗的可行性。
在此基础上,Pietrella等[28]引入1个新的干预因素——TLR9激动剂CpG(一种可诱导Th1分化途径免疫偏移的佐剂)。与单用MP相比,MP+CpG显著增强小鼠MDC和LDC分泌炎症细胞因子和趋化因子的能力(其中很多细胞因子与Th1分化途径的免疫应答有关)以及MP特异性CD4+T细胞IL-2的分泌。除CpG外,其他TLR激动剂亦有类似的免疫效应。很明显,MP与TLR激动剂的协同作用能激发更强烈的Th1保护性免疫应答。结果提示,在研究、设计人用抗Cn疫苗时,MP抗原辅以TLR受体激动剂可能是防治隐球菌病的一个新的思路,目前尚需活体实验进一步研究。
2.2 荚膜多聚糖
多年研究已证实,荚膜是Cn致病的最主要毒力因子,其80%由葡萄糖醛酸木糖甘露聚糖(glucuronoxylomannan,GXM)组成。GXM具有抗宿主吞噬、阻碍白细胞迁移、干扰抗原呈递、抑制抗真菌的迟发型超敏反应、致细胞因子分泌失调和使抗体无应答等多种效应[29-33]。
Vecchiarelli等[34]通过体外实验,比较了Cn荚膜包被株(Cap-Cn)与荚膜缺陷株(Acap-Cn)对DC活化能力的差异。结果显示,Acap-Cn易被未成熟DC吞噬,且DC更易成熟并活化同源T细胞,而Cap-Cn作用相反。Cap-Cn组加入抗GXM单克隆抗体后,表现与Acap-Cn相似。推测GXM能有效干扰宿主DC的活化和成熟,这也是Cn逃避宿主免疫应答的途径之一(图1)。
Lupo等[35]应用微阵列技术分析、研究DC与Cn的相互作用与影响,证实荚膜多聚糖物质的存在使DC基因表达发生显著变化。在与荚膜缺陷株(cap59缺陷株)相作用的DC中,大量与促DC成熟及与抗原加工、呈递功能相关的基因表达上调。相反,经来源于同一遗传背景的Cn荚膜包被株刺激后,DC中不仅上述基因无显著表达,而且大量的趋化因子编码基因表达下调,并诱导IFN-γ和IL-12相关调节基因表达。该研究第1次从分子水平证明Cn荚膜逃避宿主免疫的复杂基因调节网络:抑制DC的活化、成熟,阻碍参与抗Cn感染的细胞因子、趋化因子表达以及炎症反应的发生。
2.3 尿素酶
除了荚膜,尿素酶也是Cn的重要毒力因子。尿素酶能催化水解尿素生成氨和氨基甲酸盐,使局部环境pH升高,利于Cn在吞噬溶酶体中生存。有研究证实尿素酶可促进大脑微血管内血循环量上升,从而利于Cn侵犯中枢神经系统,导致宿主罹患脑膜脑炎,甚至死亡[36]。
Osterholzer等[20]比较尿素酶阳性株与阴性株接种后宿主肺部清除病原体能力和免疫应答的差异,结果发现,与阴性株相比,经尿素酶阳性株感染后,小鼠肺部清除病原体能力明显受损,并启动了非保护性免疫应答——Th2分化途径的免疫,而且在肺部和回流的淋巴结中发现大量未成熟的DC(如前所述,大量未成熟DC促进Th2分化途径的免疫偏移,图1)。
很多研究已经证明,宿主清除Cn以预防其播散性感染的关键在于诱导Th1分化途径的免疫应答,而Th2免疫应答对抵御Cn的肺部感染无保护作用,而且可能与Cn的持续性感染有关[37-40]。另一种产尿素酶的病原体牛分枝杆菌(M.bovis)的相关研究也证实,尿素酶的存在强烈促进了Th2途径的适应性免疫应答[41]。
3 结语
随着HIV在世界范围内的蔓延、免疫抑制剂以及创伤性治疗手段的广泛应用,全球易感人群日益增多,Cn等侵袭性真菌感染的发病率明显上升。DC在宿主抵抗真菌侵袭性感染中具有十分独特且极其重要的免疫作用,免疫学防治策略已成为预防和辅助治疗隐球菌病的新的选择方向。抑制隐球菌毒性因子和促进DC成熟等方法可能会有助于提高侵袭性真菌感染防治疫苗或新的治疗方法的效果。
迄今,对Cn与DC的相互作用关系知之甚少,如果能进一步洞察两者之间的复杂作用机制,对深入理解Cn的致病机制、探索和建立新的控制Cn感染的免疫治疗方法无疑具有非常重要的意义。
[1] Corbett EL, Churchyard GJ, Charalambos S, Samb B, Moloi V, Clayton TC, Grant AD, Murray J, Hayes RJ, De Cock KM. Morbidity and mortality in South African gold miners: impact of untreated disease due to human immunodeficiency virus [J]. Clin Infect Dis, 2002, 34(9): 1251-1258.
[2] Wu G, Vilchez RA, Eidelman B, Fung J, Kormos R, Kusne S. Cryptococcal meningitis: an analysis among 5 521 consecutive organ transplant recipients [J]. Transpl Infect Dis, 2002, 4(4): 183-188.
[3] Kelly RM, Chen J, Yauch LE, Levitz SM. Opsonic requirements for dendritic cell-mediated responses to Cryptococcus neoformans [J]. Infect Immun, 2005, 73(1): 592-598.
[4] Wozniak KL, Vyas JM, Levitz SM. In vivo role of dendritic cells in a murine model of pulmonary cryptococcosis [J]. Infect Immun, 2006, 74(7): 3817-3824.
[5] Wozniak KL, Levitz SM. Cryptococcus neoformans enters the endolysosomal pathway of dendritic cells and is killed by lysosomal components [J]. Infect Immun, 2008, 76(10): 4764-4771.
[6] Stahl PD, Ezekowitz RA. The mannose receptor is a pattern recognition receptor involved in host defense [J]. Curr Opin Immunol, 1998, 10(1): 50-55.
[7] Geijtenbeek TB, Torensma R, van Vliet SJ, van Duijnhoven GC, Adema GJ, van Kooyk Y, Figdor CG. Identification of DC-SIGN, a novel dendritic cell-specific ICAM-3 receptor that supports primary immune responses [J]. Cell, 2000, 100(5): 575-585.
[8] Mansour MK, Latz E, Levitz SM. Cryptococcus neoformans glycoantigens are captured by multiple lectin receptors and presented by dendritic cells [J]. J Immunol, 2006, 176(5): 3053-3061.
[9] East L, Isacke CM. The mannose receptor family [J]. Biochim Biophys Acta, 2002, 1572(2-3): 364-386.
[10] Levitz SM, Specht CA. The molecular basis for the immunogenicity of Cryptococcus neoformans mannoproteins [J]. FEMS Yeast Res, 2006, 6(4): 513-524.
[11] Dan JM, Kelly RM, Lee CK, Levitz SM. Role of the mannose receptor in a murine model of Cryptococcus neoformans infection [J]. Infect Immun, 2008, 76(6): 2362-2367.
[12] Yauch LE, Mansour MK, Shoham S, Rottman JB, Levitz SM. Involvement of CD14, Toll-like receptors 2 and 4, and MyD88 in the host response to the fungal pathogen Cryptococcus neoformans in vivo [J]. Infect Immun, 2004,72(9): 5373-5382.
[13] Biondo C, Midiri A, Messina L, Tomasello F, Garufi G, Catania MR, Bombaci M, Beninati C, Teti G, Mancuso G. MyD88 and TLR2, but not TLR4, are required for host defense against Cryptococcus neoformans [J]. Eur J Immunol, 2005, 35(3): 870-878.
[14] Nakamura K, Miyagi K, Koguchi Y, Kinjo Y, Uezu K, Kinjo T, Akamine M, Fujita J, Kawamura I, Mitsuyama M, Adachi Y, Ohno N, Takeda K, Akira S, Miyazato A, Kaku M, Kawakami K. Limited contribution of Toll-like receptor 2 and 4 to the host response to a fungal infectious pathogen, Cryptococcus neoformans [J]. FEMS Immunol Med Microbiol, 2006, 47(1): 148-154.
[15] Nakamura K, Miyazato A, Xiao G, Hatta M, Inden K, Aoyagi T, Shiratori K, Takeda K, Akira S, Saijo S, Iwakura Y, Adachi Y, Ohno N, Suzuki K, Fujita J, Kaku M, Kawakami K. Deoxynucleic acids from Cryptococcus neoformans activate myeloid dendritic cells via a TLR9-dependent pathway [J]. J Immunol, 2008, 180(6): 4067-4074.
[16] Bauman SK, Nichols KL, Murphy JW. Dendritic cells in the induction of protective and nonprotective anticryptococcal cell-mediated immune responses [J]. J Immunol, 2000, 165(1): 158-167.
[17] Syme RM, Spurrell JC, Amankwah EK, Green FH, Mody CH. Primary dendritic cells phagocytose Cryptococcus neoformans via mannose receptors and Fc gamma receptor Ⅱ for presentation to T lymphocytes [J]. Infect Immun, 2002, 70(11): 5972-5981.
[18] Siegemund S, Alber G. Cryptococcus neoformans activates bone marrow-derived conventional dendritic cells rather than plasmacytoid dendritic cells and down-regulates macrophages [J]. FEMS Immunol Med Microbiol, 2008, 52(3): 417-427.
[19] Herring AC, Falkowski NR, Chen GH, McDonald RA, Toews GB, Huffnagle GB. Transient neutralization of tumor necrosis factor alpha can produce a chronic fungal infection in an immunocompetent host: potential role of immature dendritic cells [J]. Infect Immun, 2005, 73(1): 39-49.
[20] Osterholzer JJ, Surana R, Milam JE, Montano GT, Chen GH, Sonstein J, Curtis JL, Huffnagle GB, Toews GB, Olszewski MA. Cryptococcal urease promotes the accumulation of immature dendritic cells and a non-protective T2 immune response within the lung [J]. Am J Pathol, 2009, 174(3): 932-943.
[21] Nguyen TH, Fleet GH, Rogers PL. Composition of the cell walls of several yeast species [J]. Appl Microbiol Biotechnol, 1998,50(2): 206-212.
[22] Reiss E, White EH, Cherniak R, Dix JE. Ultrastructure of acapsular mutant Cryptococcus neoformans cap 67 and monosaccharide composition of cell extracts [J]. Mycopathologia, 1986, 93(1): 45-54.
[23] Quinti I, Palma C, Guerra EC, Gomez MJ, Mezzaroma I, Aiuti F, Cassone A. Proliferative and cytotoxic responses to mannoproteins of Candida albicans by peripheral blood lymphocytes of HIV-infected subjects [J]. Clin Exp Immunol, 1991, 85(3): 485-492.
[24] Orendi JM, Verheul AF, De Vos NM, Visser MR, Snippe H, Cherniak R, Vaishnav VV, Rijkers GT, Verhoef J. Mannoproteins of Cryptococcus neoformans induce proliferative response in human peripheral blood mononuclear cells (PBMC) and enhance HIV-1 replication [J]. Clin Exp Immunol, 1997, 107(2): 293-299.
[25] Murphy JW. Protective cell-mediated immunity against Cryptococcus neoformans [J]. Res Immunol, 1998, 149(4-5): 373-386.
[26] Mansour MK, Schlesinger LS, Levitz SM. Optimal T cell responses to Cryptococcus neoformans mannoprotein are dependent on recognition of conjugated carbohydrates by mannose receptors [J]. J Immunol, 2002, 168(6): 2872-2879.
[27] Pietrella D, Corbucci C, Perito S, Bistoni G, Vecchiarelli A. Mannoproteins from Cryptococcus neoformans promote dendritic cell maturation and activation [J]. Infect Immun, 2005, 73(2): 820-827.
[28] Pietrella D, Corbucci C, Perito S, Bistoni G, Vecchiarelli A. Cooperative stimulation of dendritic cells by Cryptococcus neoformans mannoproteins and CpG oligodeoxynucleotides [J]. PLoS ONE, 2008, 3(4): e2046.
[29] Retini C, Vecchiarelli A, Monari C, Tascini C, Bistoni F, Kozel TR. Capsular polysaccharide of Cryptococcus neoformans induces proinflammatory cytokine release by human neutrophils [J]. Infect Immun, 1996, 64(8): 2897-2903.
[30] Kozel TR, Pfrommer GS, Guerlain AS, Highison BA, Highison GJ. Role of the capsule in phagocytosis of Cryptococcus neoformans [J]. Rev Infect Dis, 1988, 10(Suppl 2): S436-S439.
[31] Kozel TR, Gulley WF, Cazin J Jr. Immune response to Cryptococcus neoformans soluble polysaccharide: immunological unresponsiveness [J]. Infect Immun, 1977, 18(3): 701-707.
[32] Dong ZM, Murphy JW. Effects of the two varieties of Cryptococcus neoformans cells and culture filtrate antigens on neutrophil locomotion [J]. Infect Immun, 1995, 63(7): 2632-2644.
[33] Collins HL, Bancroft GJ. Encapsulation of Cryptococcus neoformans impairs antigen-specific T-cell responses [J]. Infect Immun, 1991, 59(11): 3883-3888.
[34] Vecchiarelli A, Pietrella D, Lupo P, Bistoni F, McFadden DC, Casadevall A. The polysaccharide capsule of Cryptococcus neoformans interferes with human dendritic cell maturation and activation [J]. J Leukoc Biol, 2003, 74(3): 370-378.
[35] Lupo P, Chang YC, Kelsall BL, Farber JM, Pietrella D, Vecchiarelli A, Leon F, Kwon-Chung KJ. The presence of capsule in Cryptococcus neoformans influences the gene expression profile in dendritic cells during interaction with the fungus [J]. Infect Immun, 2008, 76(4): 1581-1589.
[36] Olszewski MA, Noverr MC, Chen GH, Toews GB, Cox GM, Perfect JR, Huffnagle GB. Urease expression by Cryptococcus neoformans promotes microvascular sequestration, thereby enhancing central nervous system invasion [J]. Am J Pathol, 2004, 164(5): 1761-1771.
[37] Blackstock R, Murphy JW. Role of interleukin-4 in resistance to Cryptococcus neoformans infection [J]. Am J Respir Cell Mol Biol, 2004, 30(1):109-117.
[38] Olszewski MA, Huffnagle GB, McDonald RA, Lindell DM, Moore BB, Cook DN, Toews GB. The role of macrophage inflammatory protein-1 alpha/CCL3 in regulation of T cell-mediated immunity to Cryptococcus neoformans infection [J]. J Immunol, 2000, 165(11): 6429-6436.
[39] Hernandez Y, Arora S, Erb-Downward JR, McDonald RA, Toews GB, Huffnagle GB. Distinct roles for IL-4 and IL-10 in regulating T2 immunity during allergic bronchopulmonary mycosis [J]. J Immunol, 2005, 174(2): 1027-1036.
[40] Traynor TR, Kuziel WA, Toews GB, Huffnagle GB. CCR2 expression determines T1 versus T2 polarization during pulmonary Cryptococcus neoformans infection [J]. J Immunol, 2000, 164(4):2021-2027.
[41] Mukai T, Maeda Y, Tamura T, Miyamoto Y, Makino M. CD4+T-cell activation by antigen-presenting cells infected with urease-deficient recombinant Mycobacterium bovis bacillus Calmette-Guerin [J]. FEMS Immunol Med Microbiol, 2008, 53(1): 96-106.
