D型钠尿肽对豚鼠胃窦环形肌细胞钙敏感钾电流的影响及其作用机制*
2010-01-25张曙影闻庆平曲成龙蔡正旭郭慧淑
张曙影,李 萍,闻庆平,曲成龙,蔡正旭,郭慧淑
(1.大连医科大学 附属第一医院 中心实验室,辽宁 大连 116011; 2.大连大学 附属中山医院 心内科,辽宁 大连116001)
钠尿肽是具有生物活性的多聚肽类家族,它包括ANP、BNP、CNP和DNP。这些肽类分布在全身各处发挥其生理功能,如尿液的排出、血管扩张、调节血压和电解质平衡等[1]。D型钠尿肽(dendroaspis natriuretic peptide,DNP)是最近新发现钠尿肽家族的成员,是从一种美洲蛇的蛇毒中提炼出来的由38个氨基酸组成聚肽类物质。到目前为止,关于DNP的研究仅仅局限在心血管系统、泌尿系统和生殖系统。DNP对胃肠动力方面的研究非常少。Kim JH等[2]首次在大鼠的结肠内发现DNP并发现它通过局部的调质调节结肠动力。作者前期研究发现钠尿肽能调节胃肠动力,而且DNP通过cGMP途径抑制胃动力[3,4],但其深入的离子通道机制还不清楚。NP系统类似与NO系统都是产生cGMP的系统,作者以往的研究中发现SNP可以通过IP3受体介导的钙库钙释放产生cGMP而达到抑制胃肠动力的作用[5]。因此,本研究考虑到DNP调节胃肠动力可能与IP3受体有关。基于以上的背景,本研究深入探讨DNP对胃窦环形肌细胞上钙敏感钾电流[IK(Ca)]的影响,并探讨cGMP途径和细胞内钙库在其中的作用机制。
1 材料和方法
1.1 细胞制备
用25%的氨基甲酸乙酯(50 mg/kg)麻醉动物后,迅速剪取胃窦部放入氧饱和的无钙的PSS缓冲液中漂洗,然后分离环行肌并将其分割成几个肌条(1 mm×4 mm)。将肌条放入4℃的K-B液中保存约15 min,之后将其放入装有36℃消化液的试管中进行孵育。消化液是由0.1%的Ⅱ型胶原酶、0.1%的二硫苏醇糖、0.15%的胰蛋白抑制剂和0.2%的牛血清白蛋白溶入4 mL无钙的PSS缓冲液组成的。孵育结束,将消化好的肌条移入4℃K-B液中保存。
1.2 药品和溶液
台氏液成分(mmol/L):NaCl 147,KCl 4,MgCl2·6H2O 1.05,CaCl2·2H2O 0.42,Na2PO4·2H2O 1.81,Glucose 5.5,以NaOH调pH值至7.35;PSS成分(mmol/L):NaCl 134.8,KCl 4.5,MgCl2·6H2O 1.0,CaCl2·2H2O 2.0,Glucose 5.0,HEPES 10.0,以Tris调pH值至7.40;无钙PSS的成分(mmol/L):NaCl 134.8,KCl 4.5,HEPES 10,MgCl21,Glucose 10,以Tris调pH值至7.40;Kraft-Bruhe液(K-B液)的成分(mmol/L):EGTA 0.5,HEPES 10,MgCl23,KCl 50,Glucose 10,L-Glutamate 50,Taurine 20,KH2PO4 20,以KOH调pH值至7.40;记录IK(ca)电极内液的成分(mmol/L):K-aspartic acid 110,Mg-ATP 5,MgCl2·6H2O 1.0,KCl 20,EGTA 0.1,di-tris-creatine phosphate 2.5,disodium-creatine phosphate 2.5,HEPES 5,以KOH调pH值至7.30;配制完成后,用1 mL的分装瓶分装存放于0℃的冷冻箱中,实验前解冻使用。
非选择钾通道阻断剂(Tetraethylammonium TEA)配成10 mmol/L,DNP配成0.1、1、10、100 nmmol/L不同浓度。乌苷酸环化酶抑制剂(LY83583)和CGMP敏感磷酸酯酶抑制剂(Zaparinast)各配成相应的浓度。实验中用到的所有药品均为美国Sigma公司产品。
1.3 电生理记录
在实验前用管口圆滑的滴管轻轻吹打肌条即可得到分离的单细胞。取1滴细胞悬浮液(0.1 mL)平铺于倒置显微镜(Ⅸ-70 Olympus,Japan)镜台上的灌流槽底部,待10~15 min细胞沉降至槽底后,用等渗溶液进行灌流(2~3 mL/min)。然后用电阻为2~5 MΩ的玻璃电极进行5~10 GΩ的千兆封接。用传统全细胞模式记录膜电流,在电压钳制在-60 mV,阶跃电压刺激从-40 mV开始,以每20 mV的阶跃幅度去极花至+100 mV,持续400 ms记录钙敏感钾电流。用相同电极内液,电压牵制在-200 V连续记录自发瞬间外向钾电流(spontaneous translent outwad ourrents's ToCs)。
1.4 统计学方法
实验数据用均数±标准误来表示。用同体对照的t检验,P<0.05为差异具有显著性意义。
2 结 果
2.1 豚鼠胃窦环形肌上钙敏感钾电流和自发瞬间外向钾电流的记录
SToCs与IK(ca)同样是钙敏感钾电流,前者是睡间外向钾电流[6],可以连续记录。用非选择性钾通道阻断剂TEA和特异性钙敏感钾通道阻断剂CHTX检测Stocs从而确定记录到的是否是IK(Ca),见图1。
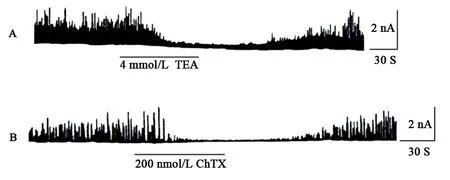
图1非选择性钾通道阻断剂TEA和特异性钙敏感钾通道阻断剂CHTX对豚鼠胃窦环形肌上钙敏感钾电流的影响
2.2 DNP对豚鼠胃窦环形肌细胞IK(ca)的影响
DNP明显增加IK(Ca),并具有剂量依赖关系,0.1、1、10和100 nmol/L的DNP增加IK(Ca)的幅度分别为(16.7±1.12)%、(26.5±2.3)%、(46.2±3.3)%和(58.3±3.7)%。10 nmol/L的DNP明显增加STOCs的幅度和频率,见图2。
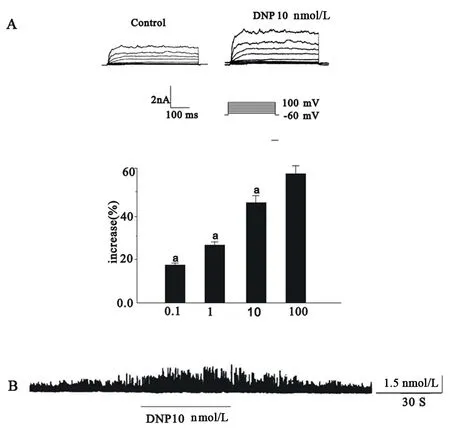
图2不同浓度的DNP增加豚鼠胃窦环形肌上钙敏感钾电流的剂量依赖关系,与上一个浓度组相比,a:P<0.01
2.3 细胞外钙对DNP增加IK(Ca) 的影响
IK(Ca)的激活与细胞外钙的内流有密切关系。为探讨细胞外钙是否参与DNP增加IK(Ca)过程,将细胞外液换成无钙液后观察10 nmol/L的DNP对IK(Ca)作用,结果发现DNP仍然增加IK(Ca),其增加幅度为(47.1±2.7)%(图3)。由于L型钙通道是细胞外钙离子内流的主要通道,因此,作者用L型钙通道阻断剂尼卡地平后发现尼卡地平明显抑制IK(Ca),但不影响DNP对IK(Ca)的增加作用。见图4。
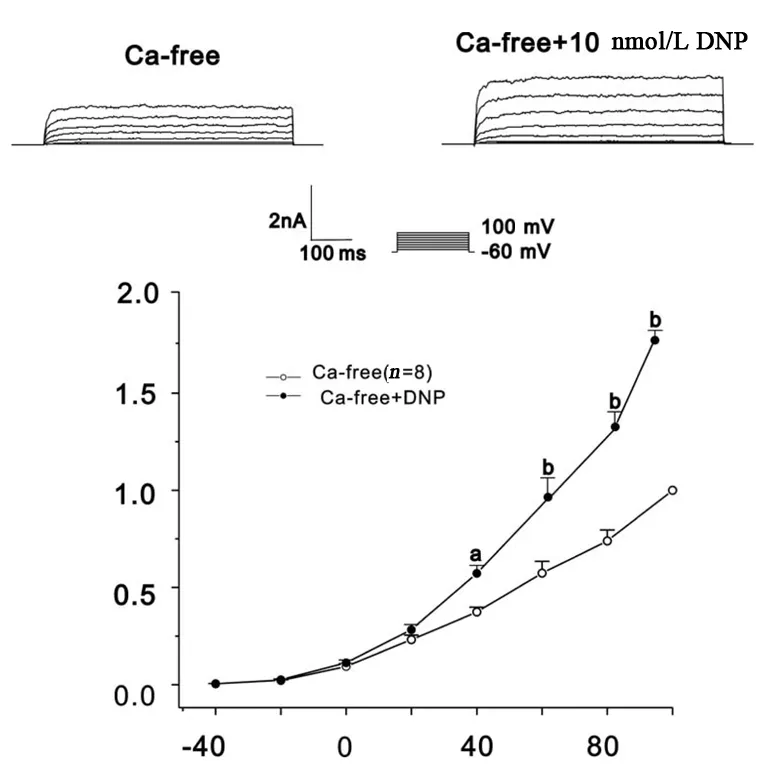
图3细胞外钙无钙对DNP增加豚鼠胃窦环形肌上钙敏感钾电流的影响,与对照组相比,a:P<0.05,b:P<0.01

图4 L型钙通道阻断剂对DNP增加豚鼠胃窦环形肌上钙敏感钾电流的影响,与PSS组或nicardipine组比较,
a:P<0.01
2.4 细胞内钙库钙释放与DNP增加IK(Ca)之间的关系
钙敏感钾通道能被细胞内IP3受体介导的钙库和Rydonine受体介导的钙库释放的钙所激活。因此,本文观察了细胞内这两大钙库是否参与DNP增加IK(Ca)和STOCs的过程。结果发现,IP3受体阻断剂肝素明显抑制DNP增加IK(Ca)和STOCs(图5),而Rynodine是Rynodine受体介导钙库的钙的耗竭剂,用Rynodine后STOCs先短暂增加,这是Rynodine受体介导钙库钙耗竭过程,耗竭完毕后给予其钙库的激动剂Cafeine后发现STOCs不再增加。此时再给予DNP,发现DNP仍然可以增加STOCs,见图6。
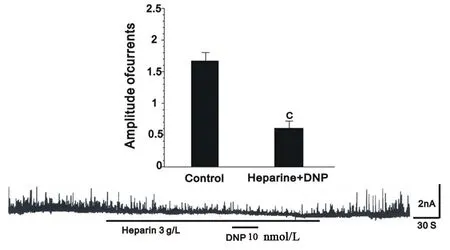
图5 IP3受体阻断剂肝素对DNP增加STOCs的影响。与对照组,c:P<0.01
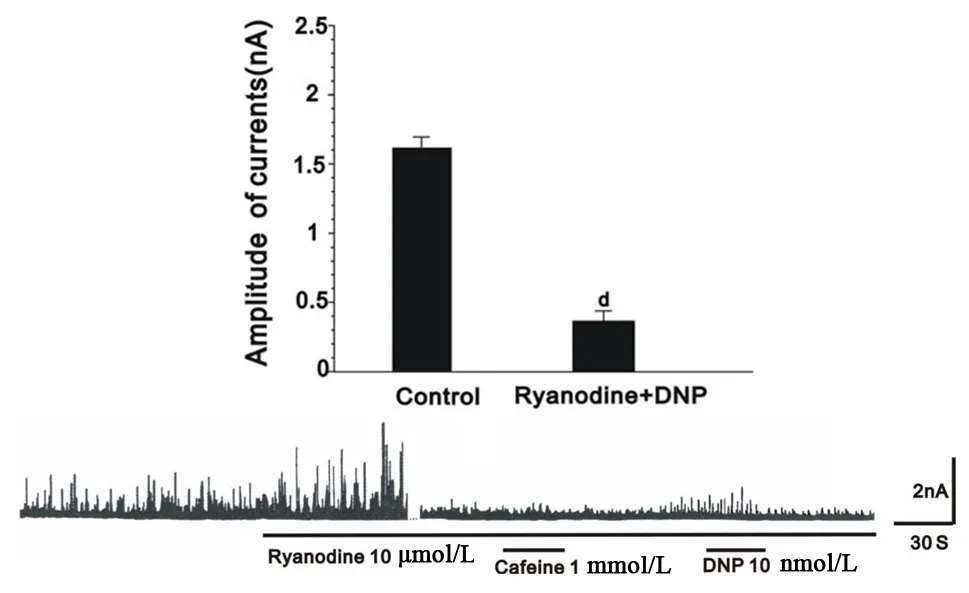
图6 Rynodine受体介导的钙库与DNP增加STOCs之间关系,与对照组相比,d:P<0.01
2.5 cGMP对DNP引起STOCs 的作用
为了进一步探讨cGMP在DNP增加STOCs过程中的作用,从cGMP生成减少和降解减少两方面证实了cGMP确实参与DNP对豚鼠胃窦环行肌STOCs的增加过程。鸟苷酸环化酶抑制剂LY83583明显抑制DNP对STOCs的增加作用(图7),而cGMP敏感的磷酸酯酶抑制剂却增强其作用(图8)。
3 讨 论
本实验发现在豚鼠胃窦环形肌上DNP增加IK(Ca)和STOCs,细胞外换成无钙液或尼卡地平均不能抑制DNP引起的IK(Ca)的增加。肝素明显抑制DNP引起的STOCs的增加而Rynodine无此效应。另外,鸟苷酸环化酶抑制剂LY83583抑制DNP引起的STOCs的增加而cGMP敏感磷酸酯酶抑制剂Zaparinast却增强DNP引起的STOCs的增加。
在平滑肌上主要有三种钙敏感钾通道:大电导和中等电导的钾通道可以被2 mmol/L的TEA和200 nmol/L的CHTX阻断而小电导的钾通道不能被5 mmol/L的TEA阻断而对apamin敏感。本研究发现钙敏感钾通道可被4 mmol/L TEA和200 mmol/L CHTX阻断,因此是大电导钾通道。给予去极化刺激时平滑肌上可记录到三种钾通道:钙敏感钾通道[IK(Ca)]、延迟整流型钾通道[IK(V)]和瞬间外向钾通道I(TO)[7]。以往研究表明在豚鼠胃窦环形肌上只能记录到两种钾通道即IK(Ca)和IK(V)[8]。为了去掉IK(V)成分,采用了3种方法:①电极内液中中加入0.1 mmol/L的EGTA;②细胞外液中加入10 mmol/L的4-AP;③TEA和CHTX明显阻断STOCs(图1A、B)。钙敏感钾通道与平滑肌的收缩有密切关系。以往的研究表明,NP能通过激活IK(Ca)舒张平滑肌。ANP可以通过激活IK(Ca)舒张人呼吸道平滑肌,在此过程中cGMP系统参与此过程。CNP通过激活大电导的IK(Ca)引起犬类股静脉血管平滑肌的舒张,cGMP系统参与此过程。BNP通过激活IK(Ca)和启动NO产生而实现动脉血管平滑肌的舒张。但到目前为止,没有关于IK(Ca)与胃肠动力之间关系的报道。以往作者的研究中发现DNP抑制豚鼠胃窦环形肌自发性收缩活动而在本研究中又发现DNP明显增加IK(Ca)和STOCs并呈现剂量依赖关系(图2)。

图7鸟苷酸环化酶抑制剂LY83583对DNP增加STOCs的影响,与对照组相比,e:P<0.05;与DNP组相比,f:P<0.01
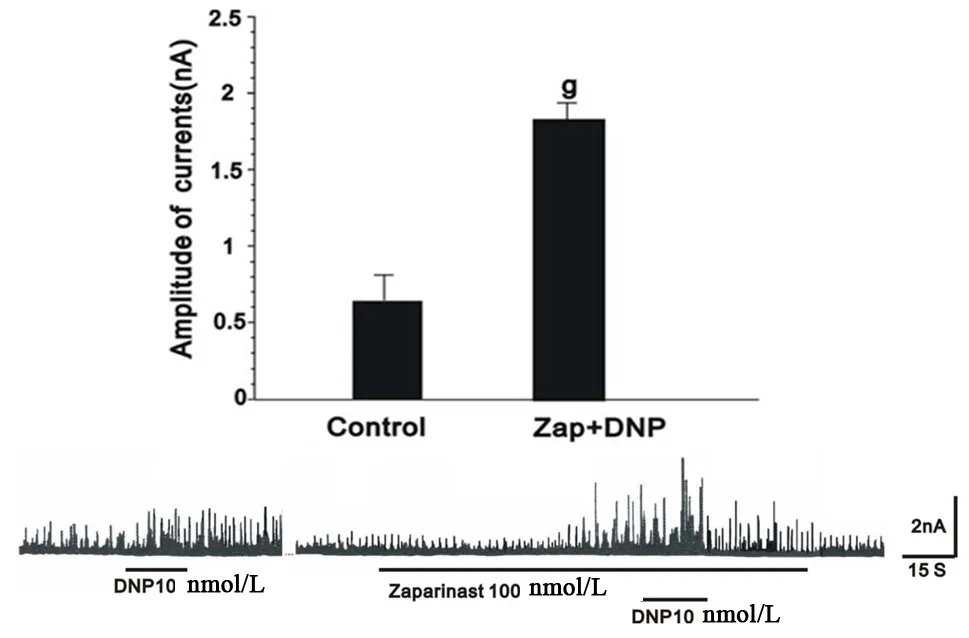
图8 cGMP敏感磷酸酯酶抑制剂Zaparinast对DNP增加STOCs的影响。与对照组相比,g:P<0.01
IK(Ca)受到细胞内外钙离子的调节。为证明这些钙动员与DNP增加IK(Ca)之间的关系,本研究发现,在细胞外缺乏钙离子的情况下观察DNP的作用(图3、4)。结果显示DNP在细胞外缺乏钙离子时仍然增加IK(Ca)。另外,L型钙通道阻断剂尼卡地平能抑制钙电流但不能抑制DNP引起的IK(Ca)的增加。这表明细胞外的钙离子不参与DNP增加IK(Ca)的过程。
平滑肌细胞内钙库主要有两种:IP3受体介导的钙库和Rynodine受体介导的钙库。研究表明,SNP可通过启动IP3受体介导的钙库的钙释放增加IK(Ca)引起动脉血管平滑肌的舒张[9]。研究表明,在心血管系统牵张刺激引起的BNP基因的表达需ynodine受体介导的钙库钙释放,从而使神经钙蛋白和神经钙蛋白依赖的激酶激活而实现。这些研究都表明平滑肌舒张和细胞内钙库释放钙之间有密切的关系。与本研究结果一致:DNP通过激活细胞内IP3受体介导的钙库的钙释放激活IK(Ca)(图5、6)。
DNP实现很多生理功能是通过激活cGMP途径。研究报道DNP通过启动cGMP系统舒张人动脉和静脉平滑肌。DNP也可通过cGMP产生引起H9C2细胞凋亡。本研究中发现鸟苷酸环化酶抑制剂LY83583抑制cGMP产生削弱DNP引起的STOCs的增加(图7),而cGMP敏感的磷酸酯酶抑制剂使cGMP降解减弱而使细胞内cGMP浓度增加从而使DNP增加IK(Ca)的程度加强(图8)。这些数据显示,DNP通过激活IP3受体介导的钙释放和增加cGMP产生引起IK(Ca)增加,从而引起豚鼠胃窦环形肌舒张。
DNP通过细胞内cGMP的产生和IP3受体介导钙库的钙释放,使豚鼠胃窦环形肌细胞上钙敏感钾电流增加,进而使细胞超极化使平滑肌舒张。
[1] Tingberg E,Roijer A,Thilen U,et al.Neurohumoral changes in patients with left ventricular dysfunction following acute myocardial infarction and the effect of nitrate therapy: a randomized,double-blind,placebo-controlled long-term study[J].J Cardiovasc Pharmacol,2006,48:166-172.
[2] Kim JH,Yang SH,Yu MY,et al.Dendroaspis natriuretic peptide system and its paracrine function in rat colon[J].Regul Pept,2004,120:93-98.
[3] Guo HS,Cui X,Cui YG,et al.Inhibitory effect of C-type natriuretic peptide on spontaneous contraction in gastric antral circular smooth muscle of rat[J].Acta Pharmacol Sin,2003,24:1021-1026.
[4] Guo H-S,Cai Z-X,Xu J,et al.Inhibitory effect of dendroaspis natriuretic peptide on spontaneous contraction in gastric antral circular smooth muscle of guinea-pig[J].Acta Pharmacol Sin,2007,28 (11): 1797-1802.
[5] Yu YC,Guo HS,Li Y,et al.Role of calcium mobilization in sodium nitroprusside-induced increase of calcium-activated potassium currents in gastric antral circular myocytes of guinea pig[J].Acta Pharmacol Sin,2003,24:819-825.
[6] Lin PIAO,Ying Li,Lin Li,et al.The involvement of calcium mobilization in the calcium-activated potassium currents activated by hyposmotic swelling in gastric antral circular myocytes of the guinea-pig[J].Jpn J Physiol,2001,51:223-230.
[7] Kang TM,So IS,Uhm DY,et al.Two types of voltage-dependent outward potassium currents in smooth muscle cells of rabbit basilar artery[J].Kor J Physiol Pharmacol,1997,1:169-183.
[8] Piao L,Li Y,Li L,et al.Increment of calcium-activated and delayed rectifier potassium current by hyposotic swelling in gastric antral circular myocytes of guinea pig[J].Acta Pharmacol Sin,2001,22:566-572.
[9] Kudoh S,Akazawa H,Takano H,et al.Stretch-modulation of second messengers: effects on cardiomyocyte ion transport[J].Prog Biophys Mol Biol,2003,82:57-66.
