缓释骨形态发生蛋白-2听泡内植入对豚鼠内耳功能的影响*
2010-01-25李雪盛孙建军姜伟刘肖
李雪盛 孙建军 姜伟 刘肖
近年来,随着原位组织工程技术研究的深入,应用这项技术进行异位成骨的研究进展很快[1],其基本方法为应用三维立体的生物支架材料,复合骨形态发生蛋白(bone morphogenetic protein, BMP)植入体内骨缺损部位,原位诱导新骨形成。有研究[2]表明,缓释BMP-2可在中耳空腔内诱导形成新生骨组织,有可能用于听骨缺损的修复重建。本实验旨在观察缓释BMP-2植入中耳腔后的成骨诱导情况及对内耳听功能的影响,为这种材料应用于听骨缺损重建提供理论依据。
1 材料与方法
1.1脱细胞松质骨的制备与观察 取新鲜成年猪(性别不限)椎体部松质骨块,切成5 mm×2 mm×2 mm柱状,蒸馏水浸泡24 h,15%过氧化氢溶液浸泡48 h,70%乙醚脱脂24 h,蒸馏水浸泡24~48 h,冷冻干燥后环境扫描电镜(Quanta 200 FEG,FEI,荷兰)观察其超微结构。另取脱细胞骨以10%乙二胺四乙酸脱钙,石蜡包埋,切片后HE染色,显微镜下进行组织学检查。
1.2BMP-2复合 BMP-2(军事医学科学院提供)为粉末状结晶,不溶于水,搅拌后呈混悬状,将此混悬液滴入脱细胞松质骨后(每块约含BMP 0.5 mg,为该院提供的经验剂量)迅速渗入骨孔内,-20℃过夜后低温冷冻干燥,环氧乙烷消毒后备用。
1.3手术植入 20只(40耳)健康成年白色豚鼠(雌雄不拘,北京兴隆实验动物养殖厂提供)作为实验对象,左耳作为实验组(20耳),右耳作为对照组(20耳)。氯胺酮及速眠新Ⅱ等比混合液肌肉注射(0.5 ml/kg)麻醉,麻醉成功后取左耳后切口,分离找到听泡后外侧气房,仔细清理表面软组织,尖针穿刺进入听泡,扩大骨孔,植入含缓释BMP-2的脱细胞松质骨,植入体形状根据听泡大小及手术需要进行修剪,以含抗生素(0.5%红霉素软膏)的明胶海绵固定。右耳植入不含BMP-2的脱细胞松质骨作为对照,骨孔以小块肌肉组织封闭。缝合切口,术后3日内每日肌注青霉素2万单位预防感染。
1.4ABR测试 术前及术后即刻、术后3个月所有动物行ABR检查(TDT-3,USA)。于隔声屏蔽室完成测试,动物常规麻醉后,记录电极置颅顶正中,参考电极置受试耳耳后皮下,接地电极置鼻尖。刺激声为宽频带短声(click),脉冲宽度为0.1 ms,扫描时程10 ms,叠加1 024次。以波Ⅲ消失时的声刺激强度作为该耳的ABR反应阈值。
1.5大体观察及病理学检查 术后观察动物行为特点及对声反应,术后3个月处死动物,取出听泡观察植入物形态变化及黏膜覆盖情况后,中性福尔马林固定1周,10%乙二胺四乙酸脱钙,每3天换液1次,2周后每天换液1次,以尖针刺入确定脱钙效果满意后,石蜡包埋,切片,HE染色,显微镜下观察。
1.6耳蜗毛细胞硝酸银染色观察 术后3个月,于ABR阈值测试后将动物处死,取出耳蜗,打开蜗尖、前庭窗和蜗窗,以临时配制的0.5%硝酸银溶液自蜗尖行耳蜗灌注染色3次,蒸馏水冲洗,10%福尔马林灌注固定4次,蒸馏水洗后于日光下曝晒约2小时至蜗壳呈黄褐色为止,最后再置10%福尔马林中还原固定。在体视显微镜下分离出耳蜗基底膜,制作铺片,甘油封片,于光学显微镜下观察毛细胞形态。
2 结果
2.1支架材料制备情况 新鲜松质骨呈红色,经脱细胞脱脂处理后,颜色纯白,亲水性好,呈海绵状多孔结构,大体形态无明显变化,人工挤压粗测仍可保持一定的机械强度,与文献报道一致[3]。环境扫描电镜观察,可见互相连通的孔隙,表面附有少量残余软组织,孔径大小不一,多在200~600 μm左右(图1)。HE染色光镜下观察,见松质骨形成均匀网状孔隙,骨小梁清晰完整,胶原纤维排列有序,无细胞成分,骨陷窝空虚(图2)。冻干处理后的材料表面观察无明显变化。
2.2术后观察动物状况 全部手术动物于麻醉后约1.5 h苏醒,无行走不稳、原地打转等不良反应,对声反应良好。术后2周,手术切口愈合良好,耳内镜观察鼓膜完整,无充血及穿孔。
2.3ABR测试结果 术后即刻ABR反应阈升高,术后3个月基本恢复正常,各时间点对照组与实验组ABR反应阈差异无统计学意义(表1)。

表1 实验耳及对照耳植入前后ABR阈值比较
注:*与同组植入前及植入后3个月比较,P<0.05
2.4大体观察及光学显微镜下观察 术后3个月,实验组听泡内无渗液及脓性分泌物,植入的缓释BMP-2小柱被再生黏膜完整包裹,无血管增生,无肉芽及瘢痕组织形成。光镜下检查发现实验组听泡及耳蜗大体形态良好,无异常骨质增生(图3),镫骨底板关节无骨质增生或固定(图4),与对照组相比无明显差异。实验组植入的含缓释BMP-2的脱细胞松质骨孔隙中,有新生骨组织形成(图5),对照组植入的脱细胞松质骨孔隙中无新生骨形成,孔隙内被纤维结缔组织充填(图6)。
2.5耳蜗铺片硝酸银染色观察 植入3个月后,实验组耳蜗基底膜及各回结构均完整,界限清楚,内、外毛细胞静纤毛排列整齐无缺失,与对照组相比无明显差异(图7、8)。
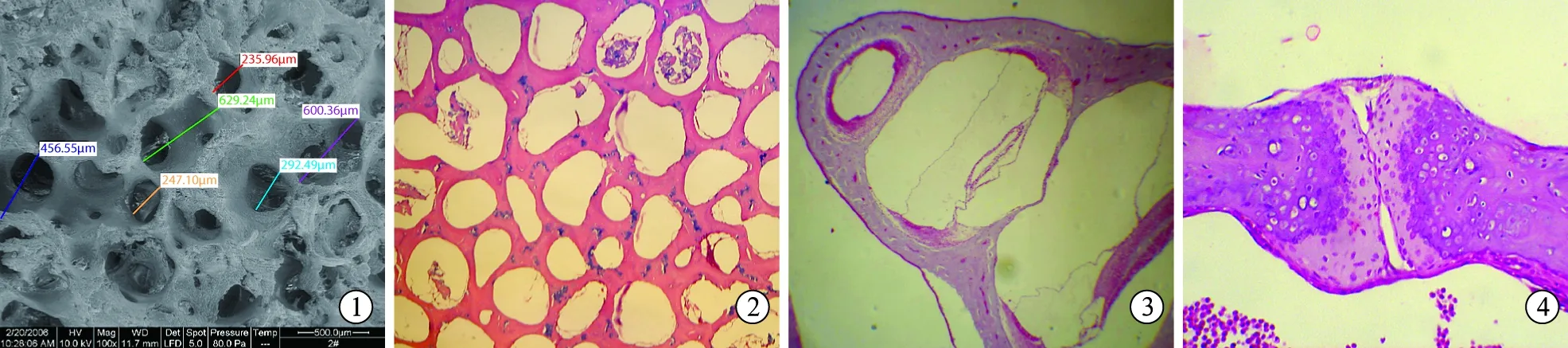
图1猪脱细胞松质骨材料环镜扫描电镜观察可见互相连通的孔隙,表面附有少量残余软组织,孔径大小不一,多在200~600 μm左右(环镜扫描电镜 ×100)
图2猪脱细胞松质骨光镜下观察松质骨形成均匀网状孔隙,骨小梁清晰完整,胶原纤维排列有序,无细胞成分,骨陷窝空虚(HE染色 ×100)
图3耳蜗形态正常,骨壁无异常骨质增生(×100)
图4镫骨底板关节无异常骨质增生或固定(×200)

图5复合BMP-2猪脱细胞松质骨植入术后3个月光镜观察(HE染色 ×200)A:脱细胞松质骨支架;B:新生骨
图6单纯猪脱细胞松质骨植入术后3个月光镜观察(HE染色 ×200)A:脱细胞松质骨支架;B:纤维结缔组织
图7植入3个月后实验耳的耳蜗基底膜各回结构均完整,界线清楚,内、外毛细胞静纤毛排列整齐无缺失。IHC:内毛细胞;OHC:外毛细胞(×200)
图8对照组耳蜗基底膜
3 讨论
BMP是一种广泛存在于骨基质中的低分子糖蛋白多肽,具有诱导骨形成的生物学特性,可以作用于间充质细胞表面受体,诱导血管周围的未分化间充质细胞和骨髓基质细胞转化为软骨和骨细胞,其中BMP-2 的成骨能力最强,也是最常用的成骨活性因子,其高效诱导成骨活性已经被许多实验和临床研究证实[4]。在骨组织形成过程中,BMP-2 可使未分化的间充质细胞定向分化为成骨细胞并具有形成骨组织的能力,形成的新骨细胞表达血管内皮生长因子(VEGF),为骨组织周围的血管再生提供有利条件[5]。
由于BMP-2在体内很快会弥散或降解消失,因此在诱导成骨过程中,需要选择合适的载体,使其缓慢释放。脱细胞松质骨是一种常用的成骨基质材料,研究表明,经脱细胞脱脂处理后,其免疫活性很低,但同时可保持良好的机械特性[6~8]。本实验中所用BMP为人反转录BMP-2,不溶于水,局部分解缓慢,完全降解时间约在1月以上,加入脱细胞松质骨互相连通的微小孔隙内,可进一步延迟BMP-2的释放。
BMP-2是否会影响听觉功能,是决定其能否应用于听骨缺损修复的关键。从本实验结果看,实验组中耳腔植入缓释BMP-2后,听泡内无异常骨质增生,耳蜗形态正常,内、外毛细胞及支持细胞均着色良好, 各组织形态结构清晰可见, 毛细胞排列整齐规律;两组耳蜗毛细胞未见明显听毛倒伏、融合、变性和缺失等形态改变;植入术后即刻,两组的ABR反应阈明显升高,但实验组与对照组相比无明显差异,说明听力下降可能与植入手术操作有关。术后三个月,两组的ABR反应阈与术前无明显差异,说明听泡内植入缓释BMP-2对动物听功能无明显影响。因此,中耳内植入含缓释BMP-2听骨赝复物对中耳及内耳功能无明显影响。
传统的听骨链重建手术所用的听骨假体材料种类繁多,包括异种材料、异体材料、自体材料等。由于听骨赝复物将被永久植入人体,理想的听骨赝复物应具有以下特点:①在人体内无毒;②有非常好的组织相容性及化学稳定性,能与周围骨质紧密相连;③易于塑形,操作简单;④在植入局部长期保持稳定,具有良好传音性,并且不脱出,不被吸收,且无其它不良反应发生。目前尚缺乏完全满足以上特点的听骨赝复材料,因此,有必要寻找新的更好的材料与方法[9]。应用缓释BMP-2异位诱导成骨方法进行听骨重建,由于释放的BMP-2容易被降解破坏或弥散吸收,因此只在缓释材料局部才有新生骨组织形成,且是形成自身活骨组织修复缺损,理论上可避免免疫反应、吸收、脱出等目前所用各种吸骨赝复物的缺点,具有一定的优越性,是一种值得研究的方法。本实验结果表明,缓释BMP-2可于中耳腔内有效诱导新生骨形成,并在此剂量下对内耳功能不产生明显影响,有可能用于听骨缺损修复重建,但尚需进一步深入研究。
4 参考文献
1 李雪盛,孙建军.原位组织工程技术的发展与应用前景[J].中华医学杂志,2007,87:430.
2 Takeda Y, Tsujigiwa H, Nagatsuka H, et al. Regeneration of rat auditory ossicles using recombinant human BMP-2/collagen composites[J]. J Biomed Mater Res A,2005, 73:133.
3 张旗涛,姚猛,于友,等.同种异体脱细胞骨的生物力学性质及其临床应用[J].中华小儿外科杂志,2004,25:172.
4 Thomson RC, Cook AD, Rohrer MD, et al. rhBMP-2 significantly enhances guided bone regeneration[J]. Clin Oral Implants Res,2004,15:194.
5 Deckers MM, van Bezooijen RL, van der Horst G, et al. Bone morphogenetic proteins stimulate angiogenesis through osteoblast-derived vascular endothelial growth factor A[J]. Endocrinology,2002,143:1 545.
6 Czitrom AA, Axelrod T, Fernandes B. Antigen presenting cells and bone allotransplantation[J]. Clin Orthop, 1985, 197: 27.
7 孙新君,王正国,朱佩芳,等.脱细胞异种骨基质植入后受体外周血T淋巴细胞亚型的变化[J].中国修复重建外科杂志,2005,19:322.
8 Urist MR, Mikulski A, Boyd SD. A chemosterilized antigen-extracted autodigested alloimplant for bone banks[J]. Arch Surg,1975,110:416.
9 龚树生.听骨赝复体[J].中国医学文摘耳鼻咽喉科学,2008,23:39.
