结核分枝杆菌VII型分泌系统的研究进展*
2010-01-24霍如松焦新安
孙 林,霍如松,焦新安
结核分枝杆菌VII型分泌系统的研究进展*
孙 林,霍如松,焦新安
细菌的致病性依赖于分泌毒力因子的能力,这些毒力因子可以表达在细胞表面,也可以通过分泌的方式到达细胞外基质或者是直接进入宿主细胞。对蛋白分泌机制的研究主要集中在革兰氏阴性菌,并由此鉴定出了不同的分泌系统,分别命名为I-V I型分泌系统。革兰氏阴性菌的蛋白分泌特别复杂,因为这些细菌都有两层膜包裹,也就是说分泌的蛋白必须通过内膜和外膜这两层膜才能进入胞外基质或者宿主细胞。相对而言,革兰氏阳性菌结构比革兰氏阴性菌简单,因此其分泌的蛋白只需穿过质膜和肽聚糖层就可以到达细胞外环境。
在结核分枝杆菌(M ycobacterium.tubercu losis)中,有些蛋白(如 T细胞抗原Ag85)含有典型的信号肽序列,这些蛋白的分泌通过Sec途径进行,还有一些蛋白则通过Sec2旁路途径或者 Tat途径进行分泌。然而在结核分枝杆菌的培养滤液中含有很多小分子量、高免疫原性的蛋白,它们都缺少典型的信号肽序列,其中ESA T-6(6 kDa early secreted antigenic target,6 kDa早期分泌抗原靶位)就是这些蛋白的代表。结核分枝杆菌具有十分复杂的细胞壁结构(图1),分枝菌酸和细胞壁基质共价结合,形成了高度疏水、几乎不通透的分枝菌酸膜(mycomembrane,MM),蛋白质必须穿过分枝菌酸膜才能分泌到胞外环境,这就提示在结核分枝杆菌中可能存在着一种特殊的分泌系统。
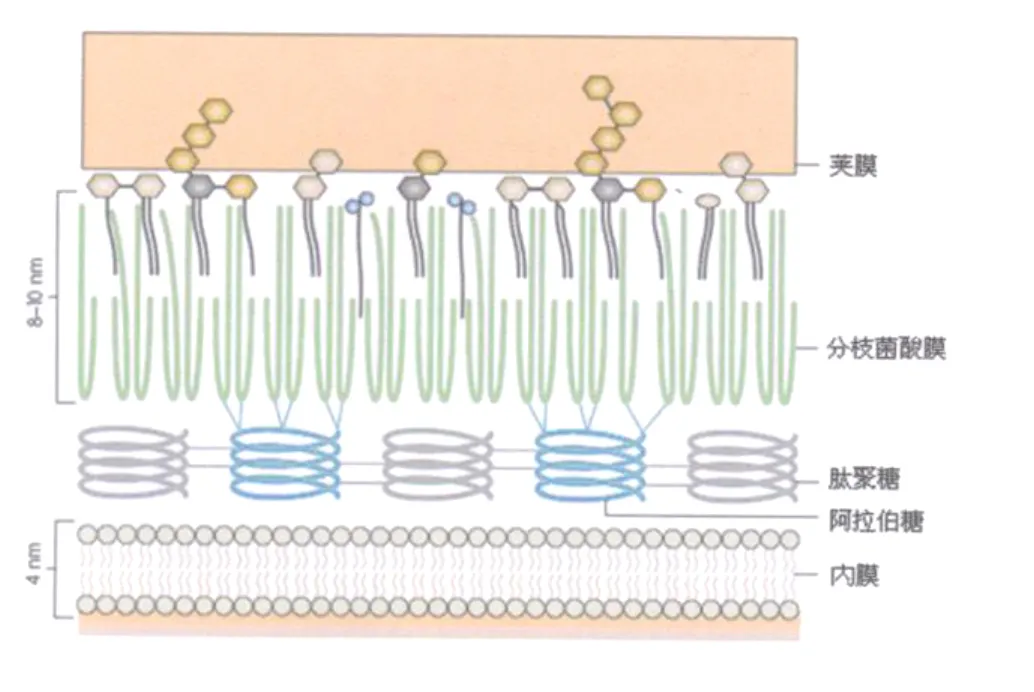
图1 结核分枝杆菌细胞膜结构示意图〔1〕Fig.1 Schematic representation of the cell envelope of M.tuberculosis
1 ESX-1分泌系统
在ESX-1分泌系统被发现之前,通过基于 ESA T-6、CFP-10以及两侧的膜相关蛋白和假定A TP酶的基因芯片分析已经预测到了这个分泌系统的存在。有关这个分泌系统的第一个实验证据是〔2〕,只有将完整的RD1区插入BCG疫苗株后,ESA T-6才得以分泌,RD1区单个基因的破坏(特别是Rv3870,Rv3871和 Rv3877)都将妨碍 ESA T-6和CFP-10的分泌。这个系统现在被称为 ESA T-6分泌系统或者 ESX-1分泌系统,亦被称为V II型分泌系统 (type V II secretion system,T7S system)〔1〕。接着,在鱼致病性分枝杆菌海洋分枝杆菌(M.m arinum)和非致病性分枝杆菌耻垢分枝杆菌(M.smegmatis)中也发现了ESX-1分泌系统。
2 ESX-1系统的组成及分泌机制
ESX-1系统所包含基因的数量还存在着争议,可能在不同种类的分枝杆菌之间存在差异。目前,已经鉴定出一些确切参与 ESX-1的蛋白质组分,普遍认为 EspA、EspB、EAST-6、CFP-10、M ycP1、PE35、 Rv3614c、 Rv3615c、 Rv3868、 Rv3869、Rv3870、Rv3871、Rv3877、Rv3879c和 Rv3882c等蛋白参与了ESX-1分泌系统的形成。Rv3868是具有AAA+A TP酶位点的假定细胞质伴侣蛋白,Rv3883c(M ycP1)是一种枯草杆菌样丝氨酸蛋白酶,Rv3870和Rv3871可能共同形成FtsK/SpoⅢE类A TP酶。其他参与 ESX-1分泌系统的蛋白质,如 Rv3869、Rv3877、Rv3881c 以及 Rv3882,它们与已知功能的蛋白之间没有同源性,但预测其存在于细胞质膜上。例如,Rv3877是一种多重跨膜蛋白,能够在细胞质膜上形成蛋白质转位孔。Rv3881c(M h3881c)在分泌时C端会被切除,而其C端对协同分泌具有重要的作用,对 ESA T-6的分泌水平有影响。研究还发现,基因序列 Rv3614c~Rv3616c也参与了ESX-1分泌系统的组成,如果这些基因缺失,即使存在完整的 RD1区,同样导致 ESA T-6和 CFP-10不能分泌〔3-4〕(图2)。
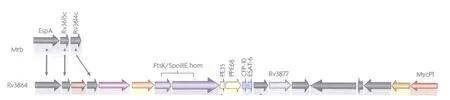
图2 ESX-1分泌系统中的基因〔1〕Fig.2 Genes involved in the ESX-1 secretion sy?stem
ESX-1分泌系统中的相关蛋白是如何相互作用进而定位和转移出细胞膜和细胞壁的?尽管缺乏结构数据的支撑,ESX-1分泌系统组分很有可能形成一个类似于细菌 I型—IV型分泌系统的多重跨膜结构。有关ESX-1分泌系统相关蛋白相互作用的研究为了解 ESX-1分泌系统的分子机制提供了理论依据。
分泌的ESA T-6和CFP-10在稳定性上互相依赖,并且形成紧密的1∶1的二聚体结构。酵母双杂交试验揭示,Rv3870可能与 Rv3871相互结合,而Rv3871又是与CFP-10结合的,因此推断胞浆蛋白Rv3871首先识别 ESA T-6/CFP-10复合物,并与CFP-10的C端结合,接下来 Rv3871与 Rv3870在细胞内膜上相互作用并形成具有活性的A TP酶(图 3)。分子伴侣 Rv3868可能和 Rv3870和Rv3871相互作用进而促进 ESA T-6和CFP-10蛋白的分泌。Rv3871/Rv3870复合物类似于 I型和IV型分泌系统中的A TP酶,形成一个具有中央空洞的六环结构,这种结构有助于分泌的底物通过分泌通道。Rv3877预测含有11个跨膜结构域,很有可能形成了位于内膜(inner membrane,IM)上的转位通道。但是目前还不清楚是什么蛋白或者哪些蛋白形成了分枝菌酸膜上的通道。
当发现 ESX-1分泌系统的第 2个基因簇(Rv3614c~Rv3616c)后,ESX-1的分泌机制变得更加复杂。Rv3616c(EspA)和 ESA T-6、CFP-10是协同分泌的,共同参与 ESX-1分泌系统。Rv3614c~Rv3616c与 RD1区域的 Rv3864~Rv3867同源,EspA可能与 Rv3614c和 Rv3615c共同形成操纵子。胞质蛋白Rv3614c和胞膜蛋白 Rv3882c相互作用进而促进相关 ESX-1分泌蛋白的分泌(图3)。Rv3815c是一种分泌蛋白,其C端同CFP-10一样是分泌系统 ESX-1所必需的。在缺少 EspA或Rv3815c时,能有效形成 ESA T-6/CFP-10复合物,但是只能停留在细胞内而不能被分泌,这就意味着ESX-1的所有底物(EspA,Rv3815c,ESA T-6和CFP-10)在分泌时是互相依赖的〔3-4〕。
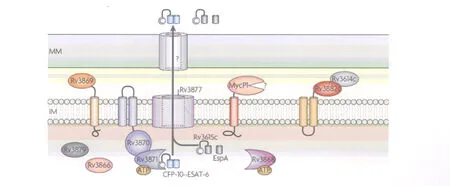
图3 ESX-1分泌机制模式图〔1〕Fig.3 Workingmodel for the ESX-1 secretion system
有关ESX-1的分泌机制还有很多问题无法解决,例如在 ESX-1分泌系统中 M ycP1的作用是什么?虽然 M ycP1对于 ESX-1系统是必需的,但是目前还没有鉴定出由M ycP1作用的分泌底物。另一个重要的问题是,ESX-1底物是如何穿过分枝菌酸膜的?分枝菌酸膜非常厚,达9-10nm,然而目前经预测ESX-1系统中没有组分位于分枝菌酸膜上。
3 ESX-1分泌系统的作用
ESX-1位于RD1区域,是结核分枝杆菌重要的毒力因素,这个区域在BCG疫苗株中是缺失的〔5〕。如果结核分枝杆菌缺失功能性的 ESX-1分泌系统将会导致其毒力的降低〔6〕,同样如果将完整的 ESX-1互补进BCG将会使BCG恢复部分的毒力〔7-8〕。麻风分枝杆菌(M.leprae)也含有 ESX-1分泌系统,麻风患者的 T细胞能够对麻风分枝杆菌的 ESA T-6发生强烈的反应〔9〕。但是功能性的 ESX-1分泌系统并不仅仅存在于致病菌中,并且有少数分枝杆菌,如溃疡分枝杆菌(M.ulcerans)、田鼠分枝杆菌(M.m icroti)和禽分枝杆菌(M.avium),它们缺少ESX-1的部分区域,ESA T-6不能被分泌,但依然是致病性的。为什么仅仅在某些种属的细菌中ESX-1与毒力相关?或许与非致病菌相比,致病性分枝杆菌中的 ESA T-6/CFP-10具有额外的功能,也有可能是因为致病性分枝杆菌通过 ESX-1系统分泌了其他的蛋白〔1〕。究竟哪些分泌蛋白对于细菌的毒力是至关重要的,这些蛋白又是怎样和宿主发生相互作用的?目前的认识还无法清晰地回答这些问题,这将寄希望于对 ESX-1分泌系统的进一步认识。
4 分枝杆菌中其他的ESX分泌系统
由于结核分枝杆菌细胞壁结构的特殊性,人们推测结核分枝杆菌具有独特的分泌系统,但出人意料的是,结核分枝杆菌含有5个这样的分泌系统。结核分枝杆菌基因组含有11-12个由 ESA T-6家族成对基因串联而成的基因簇,其中有4个基因簇是大基因座,并且与 ESX-1具有更高的同源性,分别被命名为 ESX-2(Rv3884c~Rv3895c)、ESX-3(Rv0282~Rv0292)、ESX-4(Rv3444c~Rv3450c)和ESX-5(Rv1782~Rv1798)。将不同的分泌系统进行比较发现有6个基因出现在不同的基因簇中,它们可能是结核分枝杆菌 T7S系统的核心组分〔10〕,其中两个组分属于 ESA T-6家族,一个组分属于FtsK/Spo IIIE家族,一个枯草杆菌样丝氨酸蛋白酶,一个具有10-11个跨膜结构域的整合蛋白以及另外的一个膜蛋白。除此之外还发现,有些基因出现在绝大多数的基因簇中,如编码 PE、PPE蛋白的基因,而有些基因仅仅出现在特定的分泌系统中。
由于ESX-1和致病性分枝杆菌的毒力相关,因此 ESX-1成为了近年来的研究热点,然而对于其他ESX系统的研究较少。系统发生学和比较基因组学研究揭示,分枝杆菌中5种不同的ESX系统是通过基因复制的形式进化而产生的,其顺序为ESX-4,ESX-1,ESX-3,ESX-2 以及 ESX-5〔10〕,因此 ESX-4在分枝杆菌中是最古老的 T7S系统。与其他的ESX基因座相比,ESX-4最小,在结核分枝杆菌中仅为9 870bp,而其他的 ESX基因座一般为14-22kb。同时 ESX-4含有的基因数目最少,在结核分枝杆菌中仅含有7个基因,而其他的ESX基因座含有11-18个基因。目前关于ESX-4的生物功能仍然不清楚,同样,对于ESX-2的功能也是一无所知。在结核分枝杆菌中,ESX-2位于ESX-1基因座的下游,尽管 ESX-2片段较大,但是在海洋分枝杆菌中是缺失的。有关 ESX-3的信息比较多,通过基因芯片微阵列分析表明,ESX-3在结核分枝杆菌的Fe/Zn平衡方面有重要作用〔11〕。然而,ESX-3系统究竟是如何工作的还不清楚。目前对于 ESX-5系统的功能有了一定的认识,相关数据都是通过对海洋分枝杆菌以及斑马鱼幼体感染模型的研究获得的。Wilbert小组首次证实 ESX-5系统与 PPE蛋白的分泌相关〔12〕。后来该小组还发现,与野生型海洋分枝杆菌相比,ESX-5缺失株感染人Mφ-1后引起了IL-12p40、IL-6和 TNF-α分泌水平的上调和 IL-1β分泌水平的下调,因此认为 ESX-5在调控细胞因子分泌方面有着重要的作用〔13〕。
不同的ESX分泌系统之间是相互独立的,彼此之间不能互补。ESX-1被删除后,另外的4种 ESX系统并没有使结核分枝杆菌的毒力得到恢复。ESX-5和ESX-1一样,都参与了结核分枝杆菌从巨噬细胞的逃逸以及细胞间的传播〔12,14〕,这就意味着这两种分泌系统在细胞的感染过程中可能扮演独立的角色。ESX分泌系统的相互独立,可能是由于它们不同的进化水平以及基因调控引起的。
5 其他革兰氏阳性菌的VII型分泌系统
T7S系统似乎和蛋白质的穿膜运输相关,包括穿过分枝菌酸膜,因此在其他的分枝杆菌属,如棒状杆菌和诺卡氏菌中也发现了类似的分泌系统。但是,令人惊讶的是,一些高 G+C含量的革兰氏阳性菌,如链霉菌,并没有分枝菌酸膜结构,但是也含有类似的T7S系统。最近在金黄色葡萄球菌和枯草芽胞杆菌中也发现了 T7S系统。在非致病菌中也存在T7S系统的事实表明,或许 T7S系统最初并不是用于毒力因子的分泌而存在的,可能在进化的过程中获得了分泌毒力因子的功能,比如产单核细胞增生李斯特菌中的 T7S系统与毒力之间没有关系〔15〕。令人费解的是,没有分枝菌酸层的革兰氏阳性菌为什么也需要特定的分泌系统?或许这些细菌中的 T7S系统与特定的表面结构或附属结构的生物合成相关。
6 总结与展望
结核分枝杆菌V II型分泌系统是近年来发现的一种新型分泌系统,由一些独特的蛋白组分构成,分泌的主要蛋白都属于 ESA T-6家族,所有的分泌蛋白在分泌时彼此依赖,并且通过特定的途径得以分泌。目前人们对这个系统的认识已经取得了很大的进展,但是还有许多问题有待进一步阐明。对结核分枝杆菌ESX分泌机制的深入研究,将为结核病的预防、诊断和治疗提供理论依据。
〔1〕Abdallah AM,Gey van Pittius NC,Champion PA,et al.Type V IIsecretion-mycobacteria show the way〔J〕.Nat Rev Microbiol,2007,5(11):883-891.
〔2〕Pym AS,Brodin P,Majlessi L,et al.Recombinant BCG exporting ESA T-6 confers enhanced protection against tuberculosis〔J〕.Nat Med,2003,9:533-539.
〔3〕Fo rtune SM,Jaeger A,Sarracino DA,et al.M utually dependent secretion of proteins required for mycobacterial virulence〔J〕.Proc Natl Acad Sci U S A,2005,102(30):10676-10681.
〔4〕MacGurn JA,Raghavan S,Stanley SA,et al.A non-RD1 gene cluster is required for Snmsecretion in Mycobacterium tuberculosis〔J〕.Mol Microbiol,2005,57(6):1653-1663.
〔5〕M ahairas GG,Sabo PJ,Hickey MJ,et al.Molecular analysis of genetic differences between M ycobacterium bovis BCG and virulent M.bovis〔J〕.J Bacteriol,1996,178(5):1274-1282.
〔6〕Lew is KN,Liao R,Guinn KM,et al.Deletion of RD1 from Mycobacterium tuberculosis mimics bacille Calmette-Guerin attenuation〔J〕.J Infect Dis,2003,187(1):117-123.
〔7〕Majlessi L,Brodin P,Brosch R,et al.Influence of ESA T-6 secretion system 1(RD1)of Mycobacterium tuberculosis on the interaction between mycobacteria and the host immune system〔J〕.J Immunol,2005,174:3570-3579.
〔8〕Pym AS,Brodin P,Brosch R,et al.Lossof RD1 contributed to the attenuation of the live tuberculosis vaccines M ycobacterium bovis BCGand M ycobacterium microti〔J〕.Mol Microbiol,2002,46(3):709-717.
〔9〕Geluk A,van Meijgaarden KE,Franken KL,et al.Identification and characterization of the ESA T-6 homologue of M ycobacterium leprae and T-cell cross-reactivity with M ycobacterium tuberculosis〔J〕.Infect Immun,2002,70(5):2544-2548.
〔10〕Gey Van Pittius NC,Gamieldien J,Hide W,et al.The ESA T-6 gene cluster of Mycobacterium tuberculosis and other high G+C Gram-positive bacteria〔J〕.Genome Biol,2001,2(10):RESEARCH0044.
〔11〕Maciag A,Dainese E,Rodriguez GM,et al.Global analysis of the Mycobacterium tuberculosis Zur(FurB)regulon〔J〕.J Bacteriol,2007,189(3):730-740.
〔12〕Abdallah AM,Verboom T,Hannes F,et al.A specific secretion system mediates PPE41 transport in pathogenic mycobacteria〔J〕.Mol Microbiol,2006,62(3):667-679.
〔13〕Abdallah AM,Savage ND,van Zon M,et al.The ESX-5 secretion system of Mycobacterium marinum modulates the macrophage response〔J〕.J Immunol,2008,181(10):7166-7175.
〔14〕Gao LY,Guo S,McLaughlin B,et al.Amycobacterial virulence gene cluster extending RD1 is required for cytolysis,bacterial sp reading and ESA T-6 secretion〔J〕.Mol Microbiol,2004,53(6):1677-1693.
〔15〕Way SS,Wilson CB.The M ycobacterium tuberculosis ESA T-6 homologue in Listeria monocyto genes is dispensable for grow th in vitro and in vivo〔J〕.Infect Immun,2005,73(9):6151-6153.
1002-2694(2010)08-0772-04
R378.9
A
*973项目(2006CB504404)、国家科技重大专项(2008ZX10003-010)和公益性行业(农业)科研专项(200903027)联合资助
焦新安,Email:xajiao@yahoo.com
扬州大学 江苏省人兽共患病学重点实验室,扬州225009
2010-05-23;
2010-06-18
