细粒棘球蚴(中国大陆株)抗原zw-5基因的表达、纯化及免疫学特性初步分析
2010-11-20于晶晶王娅娜于辛酉师志云赵巍
于晶晶,王娅娜,于辛酉,师志云,卜 阳,赵巍
2.宁夏医科大学附属医院,银川 750004
细粒棘球蚴病又称包虫病,是全球性的人兽共患寄生虫病。在我国甘肃、宁夏、青海、新疆等西部地区及相邻地区流行〔1〕。根据几个重点流行省区的不完全统计,估计我国受细粒棘球蚴病威胁的人口约在5 000万人以上,棘球蚴病患者人数约50-60万人〔2〕。由于包虫病发病缓慢,易于传播,并且至今没有一种有效的预防措施,因而严重威胁当地人民的健康和畜牧业的发展。随着分子生物学技术的不断发展和广泛应用,极大的推动了基因工程疫苗在预防各种传染病和寄生虫病的应用研究。本研究在已克隆 Eg.zw-5基因的基础之上〔3〕,构建表达质粒,获取重组蛋白,并对重组蛋白的免疫学特性进行初步分析。以期为筛选新包虫病疫苗打下基础。
1 材料与方法
1.1 质粒和菌种 zw-5/p GEM-T/JM109〔3〕为本室构建。表达载体pET28a购自Novagen公司。大肠埃希菌(Escherichia coli)BL21(DE3)p LysS由Saskatchewan大学肖伟博士馈赠。
1.2 主要试剂仪器 限制性内切酶Bam HⅠ、NotⅠ和T4连接酶、IPTG购自 PROMEGA公司;酵母提取物、蛋白胨为OXOID公司产品;质粒提取试剂盒购自上海华舜公司;DNA回收试剂盒购自北京赛百盛基因技术有限公司;200bp DNA Marker、Lambda DNA/Hin d IIIMarker、低分子质量Marker、预染Marker、HRP标记的羊抗鼠IgG购于北京华美生物工程公司;重组蛋白纯化试剂盒购自Novagen公司;弗氏完全和不完全佐剂购自Sigma公司;其余试剂均为国产分析纯。紫外分光光度仪(DMS200型)美国Varian公司产品;凝胶成像仪和分析软件、蛋白质电泳及转印装置、酶联免疫检测仪、洗板机均为BIO-RAD公司产品。
1.3 实验动物 6w龄雌性ICR小鼠,体重(18±2)g,共48只,购自宁夏医科大学实验动物中心。
1.4 重组表达质粒Eg.zw-5/p ET28a/BL21(DE3)的构建及鉴定 用Bam HⅠ、NotⅠ同时对已构建的Eg.zw-5/pGEM-T/JM109重组质粒和p ET28a进行双酶切,将目的片段与表达载体p ET28a在T4连接酶的作用下,4。C连接过夜。连接产物转化入感受态细菌E.coli BL 21(DE3),并在含有卡那霉素(终浓度为50μg/mL)的YT培养基中,37。C培养过夜。筛选阳性菌落提取质粒,用Bam HⅠ和Not I酶切鉴定。将含有重组质粒的菌株送大连宝生物有限公司进行目的基因测序、鉴定。
1.5 重组蛋白的表达 将重组菌接种于含卡那霉素(终浓度为 50μg/mL)的 3mL YT培养基中,37。C,220r/min振荡培养数 h,按1∶50接种于50mL培养基中,37。C,220r/min,培养至OD600=0.6时,加入IPTG至终浓度为0.4mmol/L,分别25。C、28。C、30。C、37。C振荡培养过夜,优化诱导表达条件。4 000r/min离心10min,弃上清,收集细菌沉淀和诱导表达前的菌液,进行SDS-PAGE鉴定。
1.6 重组zw-5包涵体的鉴定 将37。C诱导表达收集的菌体,用1×PBS洗三遍后,加入无变性剂的1×Binding buffer充分重悬。在超声裂解强度40%的条件下裂菌30min。7 500r/min,4。C离心15min,分别收集上清和沉淀制样,12%SDS-PAGE鉴定。将超声裂菌收集的细菌沉淀按1mL细菌中加2mL含6mol/L尿素的1×Binding buffer的比例重悬。冰上1h后,12 000r/min,4。C离心30min。收集上清,用0.45μm滤膜过滤。
1.7 表达产物的纯化 由于Eg.zw-5/his是含6个his的融合蛋白,可以用Novagen购买的含Ni2+的His-bind树脂亲合层析柱进行蛋白的纯化。将诱导后的菌液裂解,并收集上清(含尿素)。用树脂悬液、1×Charge buffer和 1×Binding buffer含6mol/L尿素处理平衡柱床。将菌液上清加入柱床中,并依次用 1×Binding buffer含 6mol/L尿素、1×Wash buffer含 6mol/L尿素、1×Elut buffer含6mol/L尿素洗脱树脂上结合的蛋白,得到包涵体蛋白。将包涵体蛋白放入透析袋中以去除尿素。SDS-PAGE鉴定纯化蛋白,用标准分子量 Marker根据Bio-Rad公司的Gel Doc1000凝胶分析系统对蛋白进行定量。
1.8 特异性抗血清的制备及重组蛋白的免疫原性鉴定
1.8.1 特异性抗血清的制备(1)小鼠免疫将ICR小鼠随机分为4组每组12只。A组:10μg Eg.zw-5/His+佐剂+PBS组;B组:佐剂+PBS对照组;C组:空白对照组;(2)免疫方法A、B两组小鼠在0、2、4w各免疫1次,一共 3次。第1次基础免疫用弗氏完全佐剂,以后2次为加强免疫均用弗氏不完全佐剂。采用背部皮下多点注射免疫,每次注射量为100μL/只。分别于0、2、4、6、8w 从鼠尾静脉各采血1次,一共5次。(3)制备抗血清 将血液4 000r/min离心10min,吸取血清,-85。C保存。
1.8.2 蛋白质免疫印迹(Western-blot) 特异性血清的免疫识别粗制Eg.zw-5/His重组抗原、BL21(DE3)p LysS的表达产物及原头蚴、囊液、通过180V电压SDS-PAGE电泳1h,按常规方法(电流300mA)印迹转移1h。然后将硝酸纤维膜浸入5%的脱脂奶粉溶液中,37。C封闭2h,以1×PBS-T(含0.5‰Tween-20)洗3次,每次5min。将硝酸纤维膜剪开分别浸泡于1∶100稀释的蛋白免疫的特异性小鼠抗血清及对照组鼠血清中,4。C过夜;洗涤后将膜与1∶100稀释的羊抗鼠IgG-辣根过氧化物酶(HRP)在 37。C摇床上 60r/min反应 2h,再以 1×PBS-T溶液洗4次,每次10min,加入新配制的显色液(6mg 4-氯-1-奈酚,2mL冷甲醇,10mL 1×TBS,12μLH2O2)显色 5min,最后用蒸馏水冲洗终止反应。
1.8.3 酶联免疫吸附试验(ELISA) 用终浓度为10μg/mL的Eg.zw-5/His重组蛋白包被96孔酶标板,每孔100μL,4。C过夜,洗板 4次后,5%脱脂奶粉37。C封闭2h;加入1∶100稀释的相应 A、B、C组鼠血清,100μL/孔,37。C孵育 2h,洗板 4次;加入 1∶800稀释的羊抗鼠IgG-HRP 100μL/孔,37。C孵育2h,洗板4次;加入新配的显色液(70mL基质液,700μL 6mg TMB/1mL DMSO,252μLH 2 O2)显色20min,用2mol/L H2SO4每孔 50μL终止反应。将酶标板放入BIO-RAD公司 550型酶标仪上测定450 nm波长处吸光值(OD值),用SPSS统计软件分析数据。
2 结 果
2.1 Eg.zw-5/p ET28a重组表达质粒的酶切鉴定结果 将构建的重组表达质粒Eg.zw-5/p ET28a用限制性内切酶Bam H I和Not I双酶切后,经1%琼脂糖凝胶电泳检测到插入片段大小约624bp,与目的基因片段大小相符(图1)。
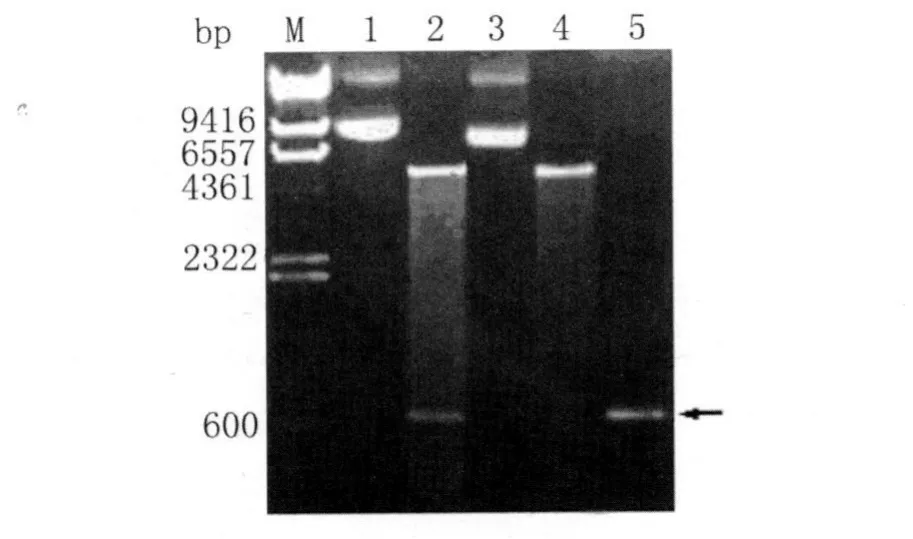
图1 Eg.zw-5/p ET28a重组表达质粒的酶切鉴定Fig.1 Identification of recombinant zw-5/p ET 28a vetcor

图2 Eg.zw-5在上清和沉淀的表达量Fig.2 Eg.zw-5 expression amount in supernatant and sediment
2.2 Eg.zw-5包涵体的鉴定 将菌体裂解液的上清和沉淀分别作SDS-PAGE,考马斯亮兰染色后在沉淀中大约28kD位置有一浓染的蛋白条带,而上清中约28k D处条带色浅灰。结果表明:Eg.zw-5在大肠埃希菌中是以包涵体存在的。
2.3 Eg.zw-5/His的纯化 经IPTG诱导,Eg.zw-5/p ET28a基因能在大肠杆菌BL21(DE3)plysS中表达,形成Eg.zw-5/His重组蛋白,并通过Ni2+的His-bind树脂亲合层析柱进行蛋白的纯化,根据标准分子量蛋白的位置可知纯化的重组蛋白的分子量约28k D(图 3)。

图3 SDS-PAGE鉴定纯化重组蛋白Fig.3 Identification of purified reconmbinant protein by SDS-PAGE
2.4 Western-blot实验结果 用抗原免疫的小鼠血清识别重组蛋白和天然抗原原头蚴(不能识别天然抗原囊液),可见在约28k D处有明显识别条带,表明该重组蛋白具有很强的抗原活性,但以上条带均不被对照组鼠血清识别(图4)。
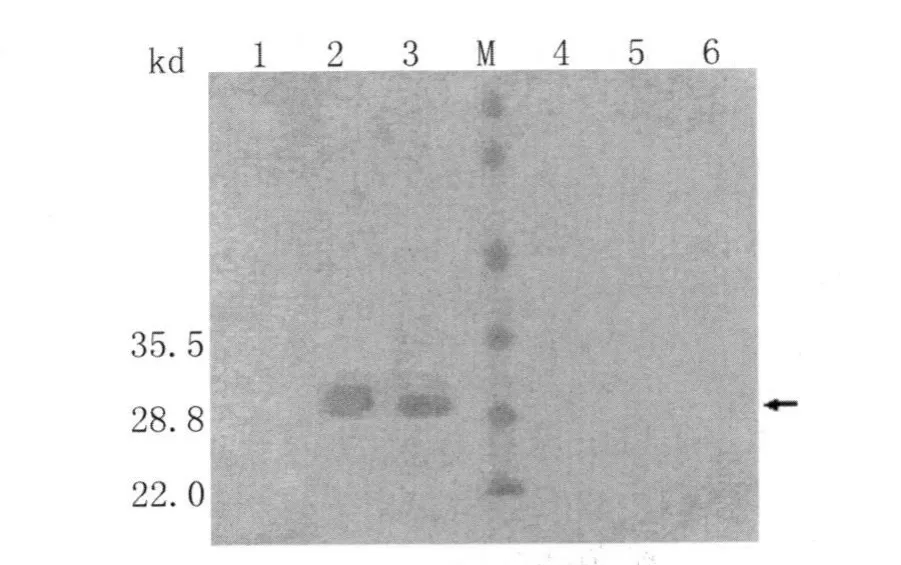
图4 重组蛋白免疫鼠血清免疫印迹分析Fig.4 Western-blot analysis with experimental antiserum
2.5 免疫鼠血清抗体水平 分别用蛋白含量为5mg/mL的Eg.zw-5/His,蛋白含量为10mg/mL的囊液和原头蚴匀浆液包板,用不同组的小鼠血清分别与之结合反应,终止反应后在酶标分析仪上测定450nm波长处光吸收值(OD值),用ELISA方法测定 A、B、C三组 Eg.zw-5免疫鼠血清抗体,经SPSS统计软件分析,结果见表1、表2。结果显示:免疫前各组间无统计学意义(P>0.05);免疫2w周、4w、6w、8w,A、B组与C组间比较有统计学意义(P<0.05)。前3次免疫抗体滴度逐渐升高,至第6w抗体滴度达到最高值,此后逐渐下降。免疫后6w小鼠血清特异性识别原头蚴、囊液。原头蚴包板A组、B组分别与 C组比较有统计学意义(P<0.05)。囊液包板A组、B组分别与C组比较没有统计学意义(P>0.05)。
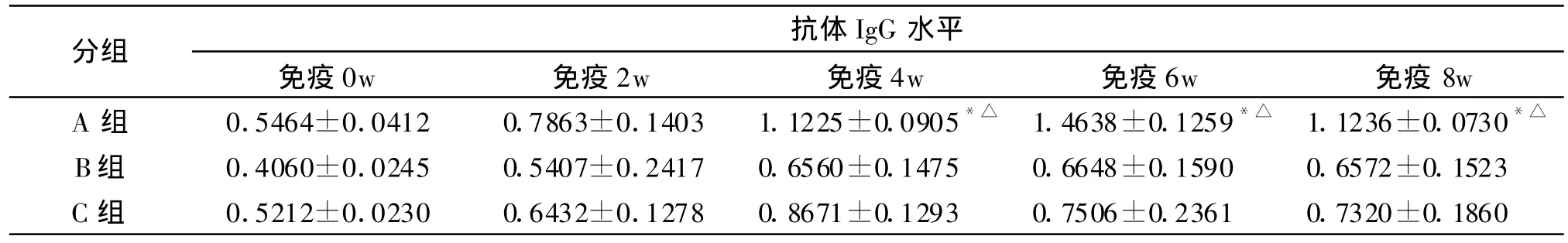
表1 用重组蛋白包被的ELISA测定结果(OD值)Tab.1 ELISA outcome of recombinant antigen

表2 用天然蛋白包被的ELISA测定结果(免疫6w血清检测)Tab.2 ELISE outcomeof natural antigen tested with six antiserum
3 讨 论
近年来,利用基因工程技术发展包虫疫苗已经成为包虫病防治研究的热点〔4〕,并确定了一些较有希望的候选疫苗分子.现在已经筛选出重组Eg.95疫苗并证实其具有高度、有效的保护力〔5〕,但由于缺乏更多的疫苗候选分子对于成虫感染后的免疫机制方面的研究,包虫病的控制仍然在我国是一个重大的医学问题。由于包虫生活史复杂,有多个发育阶段,抗原成分多,因此广泛筛选新的候选抗原分子,并用基因重组技术制备重组抗原(基因工程疫苗),采用多种抗原伍用、针对多个发育阶段的多价复合疫苗联合免疫以增强其免疫效果,是今后包虫疫苗的发展方向〔7-10〕。本课题组在已研究细粒棘球蚴P29、HSP70、14-3-3 、铁蛋白〔11-15〕等的基础上进一步筛选出新的候选抗原分子zw-5,并对其在细粒棘球蚴感染的小鼠中做了初步的免疫学机制的研究。
经DNAman软件对本室扩增的细粒棘球蚴zw-5基因序列分析发现,该基因的序列长度为624bp。在NCBI/BLAST公共数据库中对 Gen-Bank中检索的原序列(乌拉圭株)和克隆的中国大陆株zw-5序列进行比较发现:核苷酸序列的同源性达 99%〔3〕。Thompson R C A〔6〕研究认为细粒棘球绦虫在不同地域和不同中间宿主中可发育成不同的虫株,从而导致其流行病学特征和致病性不同,同时由于外在环境及条件的不同使得寄生虫在长期的演化过程中遗传基因可发生改变,据此我们考虑该基因的变化可能因地域差异所造成,是我国细粒棘球蚴虫虫株所特有的,因此它作为预防当地包虫病疫苗可能具有更好的特异性和针对性,同时可能在虫株的鉴别诊断方面也有着一定的应用价值。
鉴于本序列为中国虫株的特有序列与乌拉圭株的zw-5序列具有差异性,我们已将该基因序列在GenBank数据库进行注册,并获得GenBank登陆号为:EU266756。
本次研究在已成功克隆Eg.zw-5基因的基础上,高效表达且利用纯化的重组蛋白Eg.zw-5/his免疫小鼠获得抗血清。Western-blot结果显示纯化的重组蛋白免疫小鼠得到的抗血清,不仅能特异性识别重组蛋白,也能识别原头蚴中相应抗原,而对照组鼠血清均未见反应条带,表明重组蛋白与天然虫体抗原具有共同的抗原表位。用三种不同来源的蛋白(重组蛋白、天然抗原原头蚴和囊液)作为抗原包板的ELISA数据统计分析结果显示,重组蛋白组血清的抗体IgG含量分别与佐剂+PBS对照组、空白对照组血清的抗体IgG含量差异有统计学意义(P<0.05)。免疫后6w小鼠血清特异性识别原头蚴、囊液。原头蚴包板A组、B组分别与C组比较有统计学意义(P<0.05)。囊液包板A组、B组分别与C组比较没有统计学意义(P>0.05)。
两种实验结果说明,重组抗原具有较好的抗原性和免疫原性,有望成为包虫疫苗的侯选抗原。但重组抗原是否抑制棘球蚴虫的生长或能否起到杀虫减囊作用,还需进一步的动物攻击感染保护性试验证实。
〔1〕章家新,傅玉才.包虫病的疫苗研究进展〔J〕,汕头大学医学院学报,2002,15(2):118-120.
〔2〕叶尔江,苏里唐,江莉.我国棘球蚴病防治研究进展〔J〕.中国寄生虫学与寄生虫病杂志,2000,18(3):179-181.
〔3〕赵嘉庆,王健,王娅娜,等.细粒棘球蚴中国大陆株ZW-5基因的生物信息学分析〔J〕.宁夏医学院学报,2005,27(2):85-87.
〔4〕Lightowlers MW,Gauci CG.Vaccines against cysticercosis and hydatidosis〔J〕.Vet Parasitol,2001,101(3-4):337-352.
〔5〕Thompson RCA,Lymbery AJ.Echinococcus and hydatid disease〔M〕.Oxon:CAB International,1995,1-50.
〔6〕Lightowlers MW,Jensen O,Fernandez E,et al.Vaccination trials in Australia and Argentina confirm the effectiveness of the EG95 hydatid vaccine in sheep〔 J〕.Int J Parasitol,1999,29(4):531-534.
〔7〕Yang Y,Sun T,Li Z,et al.Community survey s and risk factor analysis of human alveolar and cystic echinococcosis in Ningxia Hui Autonomous Region,China〔J〕.Bull World Health Organ,2006,84(9):714-721.
〔8〕Craig PS,Larrieu E.Control of cystic echinococcosis/hydatidosis:1863-2002〔J〕.Adv Parasitol,2006,61:443-508.
〔9〕Craig PS,McManus DP,Lightowlers MW,et al.Prevention and control of cystic echinococcosis〔J〕.Lancet Infect Dis,2007,7(6):385-394.
〔10〕师志云,李昭宇,等.细粒棘球绦虫(中国大陆株)诊断抗原P229基因的表达、纯化及免疫原性初步分析〔J〕.中国人兽共患病学报,2009,25(11):1065-1067.
〔11〕黄瑾,李宗吉,张静,等.细粒棘球蚴重组14-3-3基因的表达、纯化及免疫学鉴定〔J〕.中国病原生物学杂志,2006,1(4):253-256.
〔12〕李宗吉,黄瑾,张静,等.细粒棘球蚴谷胱甘肽s-转移酶重组抗原的高效融合表达、纯化及免疫特性的研究〔J〕.中国人兽共患病学报,2007,23(1):76-79.
〔13〕张静,王洁,王淑静,等.细粒棘球蚴(中国大陆株)线粒体苹果酸脱氢酶重组蛋白的表达、纯化及免疫特性分析〔J〕.中国病原生物学杂志,2006,1(4):249-252.
〔14〕王娅娜,丁淑琴,王洁,等.细粒棘球蚴铁蛋白基因的克隆重组、高效表达及免疫学初步研究〔J〕.中国人兽共患病学报,2006,22(5):399-406.
〔15〕丁淑琴,王洁,王淑静,等.细粒棘球蚴2HSP70重组质粒的构建、原核表达、纯化和初步鉴定〔J〕.中国人兽共患病学报,2006,22(8):764-766.
