MHCⅡ类转激活因子基因的重组腺病毒载体的构建
2009-11-27张敏敏杨骅金晶吴红玉李兆申
张敏敏 杨骅 金晶 吴红玉 李兆申
·论著·
MHCⅡ类转激活因子基因的重组腺病毒载体的构建
张敏敏 杨骅 金晶 吴红玉 李兆申
目的构建含有主要组织相容性复合物(major histocompatibility complex, MHC)Ⅱ类分子激活物(CⅡTA)基因的重组腺病毒载体。方法回收CⅡTA的PCR产物插入pUC57中,用EcoRⅠ和XhoⅠ双酶切,U-Gene凝胶回收纯化3300bp目的基因片段。用EcoRⅠ和SalⅠ双酶切质粒载体pShuttle-GFP-CMV,用T4DNA连接酶将上述目的基因片段与pShuttle-GFP-CMV片段连接,得到穿梭质粒pShuttle-GFP-CMV-CⅡTA,并经KpnⅠ单酶切及测序鉴定。Ⅰ-CeuⅠ/Ⅰ-SceⅠ双酶切处理,回收目的片段,将pAdxsi载体片段和插入片段进行酶连接,得到腺病毒质粒pAdxsi-GFP-CⅡTA,经Xho I酶切鉴定后转染HEK293细胞并培养出毒。扩增、纯化重组腺病毒AdCⅡTA,并测定病毒滴度。结果重组穿梭质粒pShuttle-GFP-CMV-CⅡTA经Kpn I单酶切及测序分析,证实与GeneBank中公布的小鼠CⅡTA(NM_007575)序列完全相符。重组腺病毒pAdxsi-GFP-CⅡTA构建成功后在HEK293细胞中包装产生的重组腺病毒AdCⅡTA对HEK293细胞有致病作用。经多次重复感染并纯化后,病毒滴度达2.0×1011PFU/ml。结论含小鼠CⅡTA基因的重组腺病毒已成功构建。
胰腺肿瘤; 基因,MHCⅡ类; 基因疗法
表达明显减少或缺失,致使T细胞对肿瘤细胞抗原不能识别,肿瘤细胞得以逃避宿主的免疫攻击[1-2]。MHCⅡ类转激活子(MHC class Ⅱ transactivator, CⅡTA)是MHCⅡ类基因表达的“分子开关”,对MHCⅡ类基因的组成和诱导表达起关键作用。高度转移性的肿瘤细胞MHCⅡ类分子的表达下降,其与CⅡTA的表达降低密切相关[3-4]。外源性的CⅡTA能够促进MHCⅡ基因转录的激活[5],改变MHC分子的表达,促进肿瘤抗原的提呈,从而达到阻断肿瘤细胞免疫逃逸的目的[3]。为此,我们构建了CⅡTA基因重组腺病毒的表达载体,为进一步的实验研究奠定基础。
材料和方法
一、pShuttle-GFP-CMV-CⅡTA的构建及鉴定
参照文献[6]的方法。先设计扩增CⅡTA全基因引物。上游引物5′-AATAGAGAGCCACCA-GGGGT-3′,下游引物5′-GTGCTTCTGAGTGCTGCCT-3′,产物片段3300 bp。PCR扩增程序:94℃ 4 min,94℃ 30 s、58℃ 30 s、72℃ 90 s,30个循环,最后72℃延伸5 min。PCR产物电泳后,用U-Gene凝胶回收试剂盒回收、纯化。应用EcoRⅠ和XhoⅠ双酶切,将PCR产物插入pUC57质粒,制备目的基因片段。用EcoRⅠ和SalⅠ双酶切质粒载体pShuttle-GFP-CMV,用T4DNA连接酶将上述目的基因片段与pShuttle-GFP-CMV片段连接,转化DH5a。挑取平板中单个菌落,接种含100 μg/ml Amp的5 ml LB培养液内,震荡培养过夜。酶切法鉴定阳性菌液。并送上海Sangon公司测序鉴定。
二、pAdxsi-GFP-CⅡTA的构建与鉴定
用Ⅰ-CeuⅠ/Ⅰ-SceⅠ双酶切腺病毒载体pAdxsi,同时双酶切穿梭质粒载体pShuttle-GFP-CMV-CⅡTA,回收目的片段,连接病毒载体片段和目的片段,转化大肠杆菌,涂布到氨苄抗性固体培养基平皿,挑取若干单克隆菌落,接种到氨苄抗性液体培养基中培养过夜,将对数生长期的菌液加入LB培养基中,摇菌过夜,大量提取重组腺病毒,行XhoⅠ酶切鉴定。
三、腺病毒的重组及鉴定
将HEK293细胞(购自加拿大Microbix Biosystems lnc.)接种于6孔板中,每孔5×105细胞,常规培养过夜。换新鲜的含10%胎牛血清的DMEM培养基继续培养。待细胞生长至底面积的80%~90%时,取重组腺病毒pAdxsi-GFP-CⅡTA,采用Lipofectamine2000脂质体(GIBCO BRL产品)进行转染。转染后第2天,将长满的细胞传代于含5%胎牛血清的DMEM培养基的25 cm2细胞培养瓶中继续培养。待细胞长满瓶底时再转入75 cm2细胞培养瓶中,每天观察细胞出毒迹象。出毒现象为细胞变大变圆,呈葡萄状,并开始出现明显噬斑。第8天出现细胞出毒现象;第11天大部分细胞病变并从底部脱落,将培养瓶置-70℃冰箱和37℃水浴锅中反复冻融3次,3000 r/min离心5 min,收集含重组腺病毒(AdCⅡTA)的上清液,为第一代毒种(P1)。
取第一代毒种50 ml接种于25 cm2细胞瓶中培养的HEK293细胞,按前述方法培养、冻融、离心收集病毒上清液,此为第二代毒种(P2)。取200 μl P2上清液,加入20 μl蛋白酶K、200 μl Buffer AL,置56℃水浴10 min,加入200 μl无水乙醇,震荡混匀。将混合物放入2 ml收集柱内,8000 r/min离心1 min,弃柱下收集管,换新管。向柱内加入500 μl Buffer AW1,8000 r/min离心1 min,换柱下收集管。再向柱内加入500 μl Buffer AW2,13 000 r/min离心3 min,柱下换新EP管。向柱内加入100 μl Buffer AE,室温放置1 min,8000 r/min离心1 min,重复1次。收集2次流出液,取5 μl作为模板,进行PCR鉴定。CⅡTA上游引物5′-CTATGTCCCCTG-TCATTGCTT-3′,下游引物5′-GTCTTGGTTCCC-CGCTGT-3′,产物430 bp。PCR反应参数:94℃ 5 min,94℃ 30 s、58℃ 40 s、72℃ 50 s,30个循环,最后72℃延伸5 min。扩增产物行凝胶电泳分离,观察。
四、AdCⅡTA的扩增、纯化和滴度测定
在5个75 cm2培养瓶中分别接种4×106个HEK293细胞,待细胞生长至90%时,加入2 ml P2液,待细胞完全病变后,冻融3次,离心取病毒上清。然后在4个转瓶同法染毒70 h后收获病变细胞混悬液。3000 r/min离心10 min, Tris缓冲液重悬细胞沉淀,反复冻融3次,6000 r/min离心取上清,用DNase消化、0.45 μm滤膜过滤、SOURSE 15Q和分子筛纯化。纯化后的病毒保存于腺病毒保存液中,经除盐处理后用0.22 μm一次性滤器除菌,分装保存于-80℃冰箱。用10×的病毒裂解液裂解纯化病毒样品,测定A260和A280。每ml制品中的病毒颗粒数(VP/ml)=A260×1.1×1012。
结 果
一、重组穿梭质粒pShuttle-GFP-CMV-CⅡTA鉴定
pShuttle-GFP-CMV-CⅡTA经Kpn I单酶切后得到2300 bp及6100 bp两个片段(图1),符合目的片段长度。阳性质粒经测序分析,与GeneBank公布的小鼠CⅡTA(NM_007575)序列完全相符。
二、重组腺病毒质粒pAdxsi-GFP-CⅡTA鉴定
pAdxsi-GFP-CⅡTA经Xho I酶切后得到7个片段(图2),与预期结果一致。
三、重组腺病毒AdCⅡTA的鉴定及滴度
pAdxsi-GFP-CⅡTA在HEK293细胞中包装产生重组腺病毒AdCⅡ TA。对HEK293细胞有致病作用。转染后第2天开始出现明显噬斑,荧光显微镜下观察到绿色荧光(图3)。
分离收集的病毒,经PCR扩增,可以扩增出430 bp的特异性片段(图4)。
用收集的病毒感染HEK293细胞扩增重组腺病毒,44 h后完全出毒。多次重复感染并纯化后,病毒滴度达2.0×1011PFU/ml。

图1 经Kpn I酶切的pShuttle-GFP-CMV-CⅡTA产物电泳图
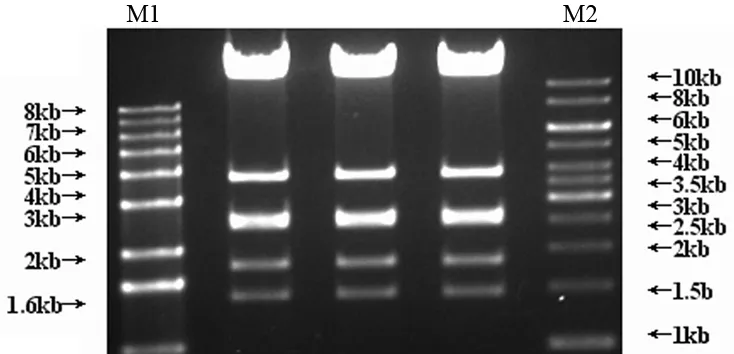
图2 Xho I酶切的pAdxsi-GFP-CⅡTA的产物电泳图
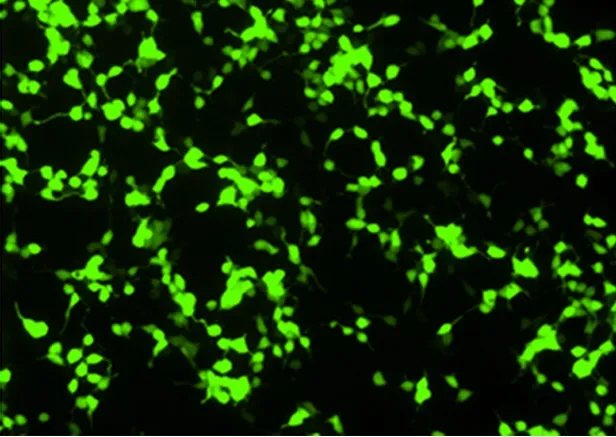
图3 AdCⅡTA感染的HEK293细胞出现绿色荧光

M: marker;1:阳性对照;2:AdCⅡTA病毒;3:阴性对照
讨 论
促进机体免疫系统对肿瘤抗原的提呈,制备安全、高效的肿瘤疫苗以提高肿瘤免疫原性,已成为目前肿瘤免疫治疗中最受青睐的研究热点之一。MHCⅡ类分子主要表达于活化的T细胞、B细胞、巨噬细胞以及APC表面,是T、B细胞活化的必要信号。1993年,瑞士科学家Mach发现了一种能使裸淋巴细胞综合征患者重新表达MHCⅡ类分子的新基因CⅡTA[6]。CⅡTA可以定量控制MHCⅡ类分子表达,与MHCⅠ类分子及各种抗原递呈相关基因如Ii、DM等的表达也有关[7-8]。
腺病毒是基因疫苗、基因治疗、组织工程等研究中应用最广泛的载体之一[9]。本研究选用的Adxsi腺病毒,缺失E1/E3,可允许摄入大的片段,并具有I-Ceu I和I-Sce I酶切位点,能识别较长的非回文序列,2种酶一起使用还可提高连接效率。此外,我们选用的pShuttle-GFP-CMV质粒携带绿色荧光蛋白基因(GFP),能直接在荧光倒置显微镜下观察目的基因表达。本实验结果显示,我们成功构建了含小鼠CⅡTA基因的重组腺病毒,病毒滴度达2.0×1011PFU/ml,为下一步进行CⅡTA基因对肿瘤,特别是胰腺癌的治疗等研究奠定基础。
[1] Yazawa T,Kamma H,Fujiwara M,et al.Complicated mechanisms of class Ⅱ transactivator transcription deficiency in small cell lung cancer and neuroblastoma.Am J Pathol,2002,161:291-300.
[2] Xi H, Blanck G.Interferon regulatory factor-2 point mutations in human pancreatic tumors.Int J Cancer,2000,87:803-808.
[3] Shi B,Vinyals A,Alia P,et al.Differential expression of MHC class Ⅱ molecules in highly metastatic breast cancer cells is mediated by the regulation of the CIITA transcription Implication of CIITA in tumor and metastasis development. Int J Biochem Cell Biol,2006,38:544-562.
[4] Satoh A,Ikeda H,Toyota M,et al.Epigenetic inactivation of class Ⅱ transactivator (CIITA) is associated with the absence of interferon-gamma-induced HLA-DR expression in colorectal and gastric cancer cells.Oncogene,2004,23:8876-8886.
[5] Tzortzakaki E,Zika E,Spilianakis C,et al.Steroid receptor coactivator 1 links the steroid and interferon gamma response pathways.Mol Endocrinol,2003,17:2509-2518.
[6] Steimle V,Zufferey M,Otten LA,et al.Complementation cloning of an MHC class Ⅱ transactivator mutated in hereditary MHC class Ⅱ deficiency (or bare lymphocyte syndrome).Cell,1993,75:135-146.
[7] Nagarajan UM,Boss JM,Bushey A.Modulation of gene expression by the MHC class Ⅱ transactivator.J Immunol,2002,169:5078-5088.
[8] Girdlestone J.Synergisticinduction of HLA class Ⅰ expression by RelA and CIITA.Blood,2000,15:3804-3808.
[9] Rouard H,Klonjkowski B,Marquet J,et al.Adenoviral transduction of human ‘clinical grade’ immature dendritic cells enhances costimulatory molecule expression and T-cell stimulatory capacity.J Immunol Methods,2000,241:69-81.
2009-10-10)
(本文编辑:屠振兴)
ConstructionofMHCclassⅡtransactivatorrecombinantadenovirusvector
ZHANGMin-min,YANGHua,JINJing,WUHong-yu,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
ZHANGMin-min,Email:minminzhang2002@126.com
ObjectiveTo construct a recombinant adenovirus vector containing the gene of major histocompatibility complex (MHC) class Ⅱ transactivator (CⅡTA).MethodsThe restriction fragment of CIITA was inserted into pUC57 vector with EcoRⅠ and XhoⅠ. Then, recombinant plasmid pShuttle-GFP-CMV CⅡTA was constructed with EcoRⅠ and SalⅠ, and was confirmed by restriction enzyme digestion and sequencing. After the treatment with Ⅰ-Ceu Ⅰ and Ⅰ-Sce Ⅰ, the fragment CⅡTA from recombinant plasmid pShuttle-GFP-CMV-CⅡTA was inserted into vector pAdxsi. And the pAdxsi-GFP-CⅡTA was packed into liposome, and was transfected to 293 cells.ResultsRecombinant plasmid pShuttle-GFP-CMV-CⅡTA was constructed successfully. After packed into vector pAdxsi, and transfected to 293 cells, significant virus plaques were observed, which showed the successful homologous recombination. The titer of the purified AdCⅡTA was 2.0×1011PFU/ml.ConclusionsRecombinant adenovirus AdCⅡTA containing gene of MHC class Ⅱ transactivator was established successfully.
Pancreatic neoplasms; Genes, MHC classⅡ; Gene therapy
在多数肿瘤,包括胰腺癌,主要组织相容性复合物(major histocompatibility complex, MHC)Ⅱ类分子
10.3760/cma.j.issn.1674-1935.2009.06.012
国家自然科学基金(30600752)
200433 上海,第二军医大学长海医院消化内科
张敏敏,Email: minminzhang2002@126.com
