IL-6和MMP-9在大鼠急性坏死性胰腺炎发病过程中的作用
2009-11-27赵蕊陈少夫
赵蕊 陈少夫
IL-6和MMP-9在大鼠急性坏死性胰腺炎发病过程中的作用
赵蕊 陈少夫
近年来,有关细胞因子及基质金属蛋白酶类在重症急性胰腺炎(SAP)发病中的作用已受到重视。目前认为,单核巨
噬细胞系统异常激活并产生过多的细胞因子是SAP时局部和全身并发症的主要机制。本文观察白介素-6(IL-6)和基质金属蛋白酶-9(MMP-9)在急性坏死性胰腺炎(ANP)发病机制中的作用及两者的相关性,为SAP发病机制的研究提供更为可靠的理论依据。
一、材料与方法
1.模型制备及标本采集:雄性Wistar大鼠60只,体重170~190 g,由中国医科大学实验动物中心提供。随机分为对照组和制模后1、2、3、4、5 d组,每组10只。术前12 h禁食,不禁水。采用逆行胆胰管注入4.5%牛磺胆酸钠1 ml/kg体重方法制备ANP模型。对照组注射等量生理盐水。制模后1、2、3、4、5 d分别断头处死大鼠,切取胰腺,10%中性福尔马林溶液固定,石蜡包埋、切片,HE染色,行常规病理检查。
2.IL-6和MMP-9免疫组化染色:胰腺包埋组织连续切片后进行免疫组化染色。IL-6免疫组化试剂盒购于武汉博士德公司,MMP-9免疫组化试剂盒购于北京中山公司。具体步骤按试剂盒说明书操作。40倍镜下,每张切片选取四周及中央5个区域内阳性反应最多的视野,测阳性反应面积比(阳性面积/胰腺组织面积×100%),取均值。
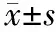
二、结果
1.胰腺组织病理改变:对照组胰腺结构正常,无出血和坏死。ANP组胰腺组织间质肿胀,弥漫性出血及片状坏死,腺泡细胞和脂肪坏死,且可见大量炎症细胞浸润。
2.IL-6和MMP-9蛋白表达变化:细胞质棕黄染色或伴有细胞核棕黄色颗粒为阳性。对照组IL-6无表达,制模后IL-6主要表达于胰腺腺泡胞质内及细胞外基质,制模后第3天达最高峰。对照组MMP-9为低表达,制模后MMP-9主要表达于胰腺腺泡胞质内及细胞外基质,制模后第4天达最高峰(Plt;0.05,表1,图1)。
3.IL-6与MMP-9表达的相关性:IL-6与MMP-9的相关系数r=0.317,P=0.025,两者呈正相关。
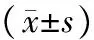
表1 各组IL-6和MMP-9蛋白表达
注:与对照组比较,aPlt;0.05;与其他各组比较,bPlt;0.05
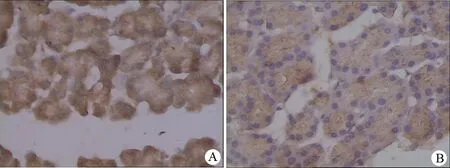
图1制模后第3天IL-6(A)与MMP-9(B)表达(免疫组化 ×400)
讨论研究证明,炎症等疾病的发生及其病变过程与IL-6的异常表达有着密切相关[1]。IL-6可作用于多种靶细胞,能激化炎性细胞对炎性介质的效应[2]。IL-6在AP发病及发展过程中发挥重要作用。SAP患者中IL-6水平明显增高[3]。本结果显示,制模后IL-6表达升高,第3天达最高峰,以后有所下降,这与Mckay等[2]、Chen等[4]报道的结果相一致,说明IL-6在SAP发展中起重要作用。以IL-6为主的大量炎性细胞因子可致SAP向多器官功能衰竭(MSOF)发展[5],甚至可作为AP患者并发呼吸衰竭的指标[6],预测SAP的严重程度[7]。
MMP-9是金属蛋白酶家族中分子质量最大的酶,以酶原形式存在,又称为明胶酶B。MMP-9由中性粒细胞、单核细胞、血管内皮细胞等多种细胞分泌。活化的MMP-9具有基质金属蛋白酶的一些共同特点[8]:(1)能裂解一种或多种细胞外基质;(2)可被金属蛋白酶组织抑制剂(TiMPs)及耦合剂所抑制。正常情况下,MMP-9的活性被控制在较低水平,主要参与机体生理活动的需要。但在炎症、组织重塑等各种病理生理过程中高度表达,陈平等[9]认为,MMP-9在SAP中与病情的严重程度有明显相关性。Lohr等[10]报道,SAP病程中伴有细胞间基质的分解,并与病情的严重性相关,间接证明MMP-9在SAP疾病的发生发展中起重要作用。本结果显示,MMP-9在制模后平稳升高,第4天达最高峰,与上述结果基本一致。
本结果还显示,IL-6与MMP-9存在正相关性。这与IL-6延迟中性粒细胞(PMN)凋亡,保持大量PMN的存活,而PMN在前炎症因子的刺激下,大量释放MMP-9有关。因此在SAP发病过程中检测IL-6与MMP-9,有利于判断疾病的严重程度。
[1] Klei B.Cytokine,cytokine receptors,transdaction signals,and oncogenes in human multiple myeloma.Semin Hematol,1995,32:4-19.
[2] Mackay CJ,Gallagher G,Brooks B, et al.Increased monocyte cytokine production in association with systemic complications in acute pancreatitis.Br J Surg,1996,83:919-923.
[3] Denham W,Norman J.The potential role of therapeutic cytokine manipulation in acute pancreatitis.Surg Clin North Am,1999,79:769-781.
[4] Chen X,Ji B,Han B,et al.NF-KappaB activation in pancreas induces pancreatic and systemic inflammatory response.Gastroenterology, 2002,122:448-457.
[5] Yoshinaga K,Washizuka M,Seqawa Y.Fasting exacerbates acute pancreatitis by occlusion of the common bile duct in rats.Jpn J Pharmacol,2000,84:455-461.
[6] Mayer J,Rau B,Gansauge F,et al.Inflammatory mediators in human acute pancreatitis: clinical and pathophysiological implications.Gut,2000,47:546-552.
[7] Norman J.The role of cytokines in the pathogenesis of acute pancreatitis.Am J surg,1998,175:76-83.
[8] Woessner JF Jr.Matrix metalloproteinases and their inhibitors in connective tissue remodeling.FASEB J,1991,5:2145-2154.
[9] 陈平,詹乐恒,晏波.血清基质金属蛋白酶9在急性胰腺炎严重性预测中的研究.中国急救医学,2003,23:388-389.
[10] Lohr M,Hummel F,Martus P,et al.Serum level of extracellular matrix in acute pancreatitis.Hepatogastroenterology,1999,46:3263-3270.
2009-02-13)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2009.06.021
110006 沈阳,沈阳市第六人民医院(赵蕊);中国医科大学附属盛京医院消化内科(陈少夫)
陈少夫,Email:csf196211@yahoo.com.cn
