口虾蛄乙酸乙酯提取物分离及体外抗肿瘤活性研究
2009-04-25,,,,*
,,,,*
(1.广东药学院,广东 广州 519020;2.广东省天然药物开发研究重点实验室,广东 湛江 524023;3.广东医学院 病理生理学教研室,广东 湛江 524023)
海洋是地球上资源最丰富的领域,而海洋生物物种的生态环境复杂,比陆生生物恶劣,产生并积累了大量特殊化学结构、具有生物活性的物质[1]。口虾蛄(Squilla oratoria)又称濑尿虾,属于节肢动物门,在湛江海域广泛分布。近年来,本研究室对口虾蛄提取物进行抗鼻咽癌和抗EB病毒筛选,发现了其乙醇及乙酸乙酯提取物对鼻咽癌细胞生长抑制作用最为显著[2-4]。在此基础上,笔者对乙醇提取物作进一步的分离工作,并对其乙酸乙酯分离物的抗肿瘤活性进行追踪研究。
1 实验材料
1.1 药物 口虾蛄乙酸乙酯提取物(由广东药学院实验室自行制备)
1.2 细胞培养 人卵巢癌低分化细胞株HO-8910PM(为广东医学院生物化学教研室液氮保存),实验前复苏培养(含10%新生牛血清,双抗,RPMI1640培养液中),置于5%CO2培养箱内,恒温37℃,CO2浓度控制在5%。取对数生长期、生长良好的细胞(台盼蓝染色计数,活细胞率≥95%)用于试验。
1.3 仪器及试剂 RE52CS-2旋转蒸发器,SHB-Ⅲ循环水式多用真空泵,倒置显微镜,METTLER AE240电子分析天平,96孔塑料培养板,ELx 800全自动酶标仪,无菌操作台,所用的试剂均为国产分析纯试剂。
2 实验方法
2.1 药物分离提取及纯化 口虾蛄脱水后,乙醇浸渍5 d,重复3次。所得提取液旋转蒸发得到乙醇粗提取物。乙醇粗提取物与硅藻土混合,石油醚II、乙酸乙酯系统溶剂法分离,分别得到石油醚提取物、乙酸乙酯提取物。对乙酸乙酯提取物经硅胶柱层析分离得到A,B,C,D,E 5种组分,展开剂为氯仿∶乙酸乙酯∶甲醇∶水(10∶8∶2∶0.5)。抗肿瘤生物活性跟踪的方法,E组分经展开剂正丁醇∶冰醋酸∶水(4∶1∶5),硅胶柱层析洗脱后得到两个组分。
2.2 药物抗肿瘤活性组分的筛选
2.2.1 MTT法筛选抗肿瘤活性组分 以5×104细胞浓度接种于96孔培养板。贴壁后吸去培养液,加入不同浓度的药物,空白对照组加入等量的培养液、阳性对照组加入40 μg/ml的5-Fu。置培养箱5% CO2,37℃培养24 h后,加20 μl MTT,37℃继续培养4 h后弃去培养液,每孔加150 μL DMSO,振荡器振荡后,酶标仪上实验波长570 nm,参比波长630 nm测定各孔吸光度OD值,计算生长抑制率。生长抑制率IR(%)=(1-试验组OD值/空白对照组OD值)×100%[5]。
2.2.2 集落形成实验 以200个细胞浓度接种于75 mL培养板。贴壁后吸去培养液,药物组加入不同浓度药物,空白对照组加入等量的培养液、阳性对照组加入40 mg/mL的5-Fu,培养7 d。甲醇固定,弃固定液,Giemsa染色。显微镜计算细胞集落数(每个集落的细胞总数≥50个),计算集落形成抑制率:集落形成抑制率=(1-实验组集落数/对照组集落数)×100%。
2.2.3 生长曲线实验 8×103细胞浓度接种于24孔培养板。12 h细胞贴壁后,吸去培养液,实验组加入不同浓度药物培养液,空白对照组加入等量的培养液、阳性对照组加入40 μg/mL的5-Fu。0,12,24,36,48 h各取3孔细胞消化后计数,绘制生长曲线。
3 结果
3.1 分离、纯化
3.1.1 乙酸乙酯提取物分离 经氯仿∶乙酸乙酯∶甲醇∶水(10∶8∶2∶0.5)梯度洗脱,相同斑点合并,得到A,B,C,D,E 5种组分。并将5种组分点于同一硅胶G薄层板,上行展开至距板上端2 cm处,取出,晾干,置碘缸内熏蒸至出现清晰斑点,并于254 nm紫外灯下检测(管1~4合并为A组分,管5~6合并为B组分,管7~9合并为C组分,管10~13管合并为D组分,管14~20合并为E组分)。结果见图1。
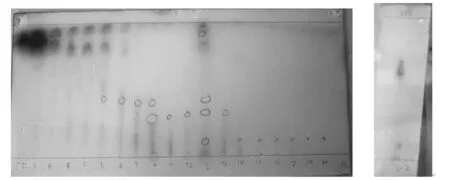
图1 图2
3.1.2 E组分的分离 乙酸乙酯提取物E组分经点样于硅胶G板上,经展开剂正丁醇∶冰醋酸∶水(4∶1∶5)上行展开10 cm,碘蒸气显色,出现两个清晰斑点,其Rf值分别是0.12,0.65,于254 nm紫外灯下检测,Rf值为0.65的斑点有荧光吸收。结果见图2。
3.2 抗肿瘤活性组分的筛选
3.2.1 MMT检测结果 见表1,表2。

表1 乙酸乙酯提取物5个组分对HO-8910PM细胞生长抑制率的比较
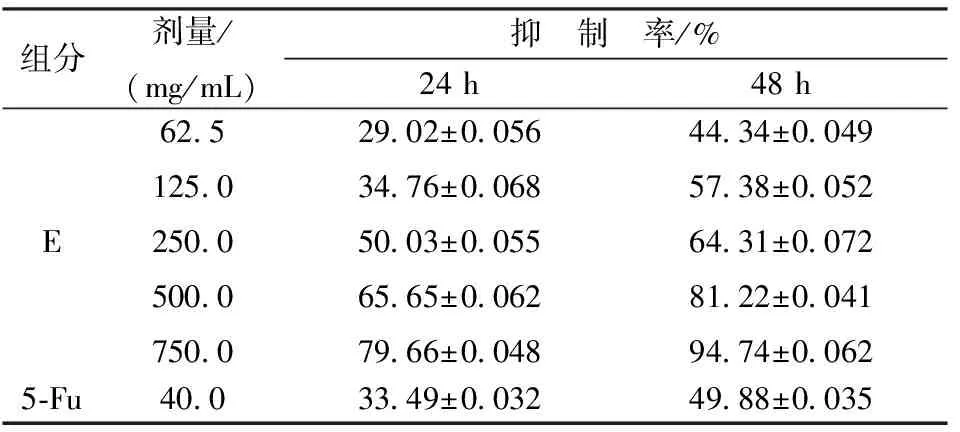
表2 不同浓度乙酸乙酯E提取物对HO-8910PM细胞生长抑制率的比较
3.2.2 生长曲线实验 12~48 h的每一个时间点,活细胞数随药物浓度的增加而减少。空白对照组的活细胞数呈指数增加,在48 h达到最高峰。低浓度药物组,活细胞增幅比空白对照组明显降低,中、高浓度药物组则持续减少(见表3)。
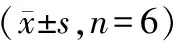
表3 乙酸乙酯E提取物不同时间对HO-8910PM细胞生长的影响
3.2.3 集落形成实验 见表4。
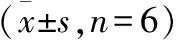
表4 不同浓度的E组分提取物对HO-8910PM细胞集落形成的影响
4 讨论
癌症是严重威胁人类健康的一类疾病,目前治疗癌症的方法主要有手术、放疗、化疗、免疫治疗、中医中药治疗等多种。近年海洋药物在治疗肿瘤放、化疗的作用方面倍受重视[6]。本研究是对口虾蛄这种海洋生物采用系统有机溶剂法、硅胶柱层析法分离得到乙酸乙酯提取物分离产物E组分。以体外抗肿瘤活性为指标,人的HO-8910PM肿瘤细胞系为筛选模型进行体外抗肿瘤活性的检测。体外检测细胞增殖代谢活力主要采用MTT法、台盼蓝染色细胞计数法以及同位素法等[7]。通过MTT法、集落形成实验及生长曲线等实验验证了其乙酸乙酯提取物分离产物E组分在体外对HO-8910PM细胞的生长有明显抑制作用。结果表明乙酸乙酯提取物部分可能在口虾蛄提取物的抗肿瘤作用中起主导因素,因此有必要对该提取物作进一步的分离、纯化工作。
[1]Sherly A P.The bioprocess-technological potential of the sea[J].Biotechnology,1999,70:5-13.
[2]李明勇,黄培春,孔 霞.MTT法测定口虾蛄提取物的体外抗肿瘤活性[J].现代肿瘤医学杂志,2005,13(3):336-337.
[3]顾帝水,黄培春,孔 霞,等.口虾蛄提取物对人鼻咽癌裸鼠移植瘤生长的影响[J].现代中西医结合杂志,2005,14(14):1825-1828.
[4]李明勇,黄培春.口虾蛄提取物对人鼻咽癌CNE-2Z细胞的抑制作用[J].实用癌症杂志2006,11(3):241-243.
[5]彭海燕,章永红,韩 英.槲寄生碱对乳腺癌细胞抑制作用的实验研究[J].吉林中医药,2003,23(9):50-51.
[6]陈平平,申贵隽,天然抗癌药物活性成分研究进展[J].吉林中医药,2005,25(3):61-62.
[7]粟 栗.玉屏风散中补气与解表药对小鼠细胞免疫功能的影响[J].吉林中医药,2008,28(5):380.
