基于超声纹理特征与基于超声造影的预测模型鉴别最大径≤2 cm乳腺良恶性结节的对比研究
2025-02-13刘博雅方靖琴姚晓静杜鹏黄鑫李陶

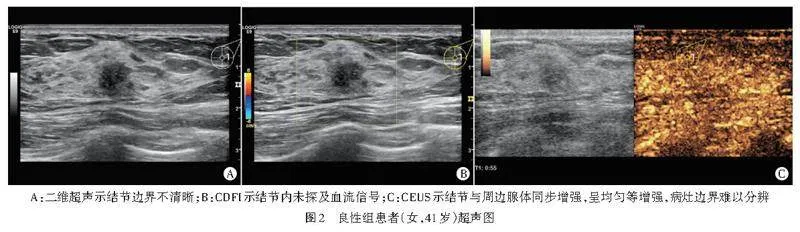
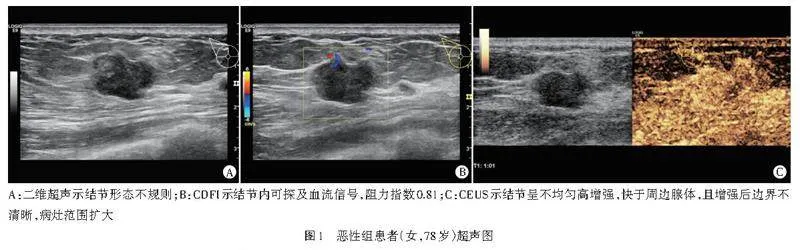
摘" " 要" " 目的" " 比较基于二维超声纹理特征(2D-Ultrasomics)的预测模型与基于超声造影(CEUS)的预测模型鉴别最大径≤2 cm乳腺良恶性结节的诊断价值。方法" " 选取我院经病理确诊的乳腺结节患者109例(共112个结节),依据病理结果分为良性组58个和恶性组54个,均行二维超声及彩色多普勒(2D-CDUS)、CEUS检查,比较两组超声检查结果的差异;基于二维超声图像提取2D-Ultrasomics,使用最小绝对收缩和选择算子(LASSO)进行特征筛选。采用多因素Logistic回归分别构建2D-CDUS模型、2D-CDUS结合CEUS(2D-CD+CEUS)模型、2D-CDUS结合2D-Ultrasomics(2D-CDUS+Ultrasomics)模型,绘制受试者工作特征(ROC)曲线评估各模型鉴别最大径≤2 cm乳腺良恶性结节的诊断效能;采用Hosmer-Lemeshow拟合优度检验评估模型的拟合度;绘制临床决策曲线评估模型的临床适用性。结果" " 两组结节2D-CDUS图像特征(内部回声、边界、血流、短径)和CEUS图像特征(增强方式、增强时相、造影边界、增强均匀性、增强病灶范围)比较差异均有统计学意义(均Plt;0.05)。共提取818个2D-Ultrasomics,经过LASSO筛选后保留6个关键特征。根据多因素Logistic回归分析结果,纳入边界、短径构建2D-CDUS模型,纳入边界、短径、造影边界构建2D-CD+CEUS模型,纳入短径、灰度游程长度矩阵、灰度依赖矩阵、灰度大小区矩阵构建2D-CDUS+Ultrasomics模型。ROC曲线分析显示,2D-CDUS+Ultrasomics模型鉴别最大径≤2 cm乳腺良恶性结节的曲线下面积(AUC)为0.917,高于2D-CD+CEUS模型、2D-CDUS模型的AUC(0.892、0.823),且2D-CD+CEUS模型的AUC高于2D-CDUS模型的AUC,差异均有统计学意义(均Plt;0.001)。Hosmer-Lemeshow拟合优度检验显示,2D-CDUS模型、2D-CD+CEUS模型和2D-CDUS+Ultrasomics模型均具有良好的拟合度(P=0.818、0.103、0.281)。临床决策曲线分析显示,2D-CDUS+Ultrasomics模型在0.20~0.39、0.43~0.78及0.88~0.91概率阈值范围内具有较高的临床获益。结论" " 基于2D-Ultrasomics的预测模型较基于CEUS的预测模型能更准确地鉴别最大径≤2 cm乳腺良恶性结节,有助于临床早期准确诊断乳腺小结节和制定治疗决策。
关键词" " 超声检查,多普勒,彩色;造影剂;纹理特征;乳腺结节,良恶性
[中图法分类号]R445.1;R737.9" " " [文献标识码]A
Predictive models based on ultrasound texture features and contrast-enhanced ultrasound for distinguishing benign and malignant breast nodules with diameter≤2 cm:a comparative study
LIU Boya1,FANG Jingqin1,YAO Xiaojing1,DU Peng1,HUANG Xin2,LI Tao1
1.Department of Ultrasound Diagnosis,Daping Hospital,Army Military Medical University,Chongqing 400042,China.
2.Department of Ultrasound,Chongqing University Three Gorges Hospital,Chongqing 404100,China
ABSTRACT" " Objective" " To compare the diagnostic value of predictive models based on two-dimensional ultrasound texture features(2D-Ultrasomics) and contrast-enhanced ultrasound(CEUS) for distinguishing benign and malignant breast nodules with diameter≤2 cm.Methods" " A total of 109 patients(112 nodules)" with breast nodules confirmed by pathology in our hospital were selected.According to the pathological results,the patients were divided into benign group(58 nodules) and malignant group(54 nodules).Two-dimensional ultrasound and color Doppler(2D-CDUS),CEUS examination were performed,the differences of ultrasound examination results between the two groups were compared.2D-Ultrasomics features were extracted based on two-dimensional ultrasound images,followed by feature selection by the least absolute shrinkage and selection operator(LASSO).Multivariable Logistic regression analysis was used to construct three models:2D-CDUS,2D-CDUS combined with CEUS(2D-CD+CEUS),and 2D-CDUS combined with 2D-ultrasomics(2D-CDUS+Ultrasomics).Receiver operating characteristic(ROC) curve was drawn to assess the diagnostic efficacy of each model for distinguishing benign and malignant breast nodules with diameter≤2 cm.The Hosmer-Lemeshow test was used to evaluate model fit,and clinical decision curve was drawn to assess the clinical applicability of the models.Results" " There were significant differences in 2D-CDUS(internal echogenicity,boundary,blood flow,width) and CEUS(enhancement pattern,phase,boundary,uniformity,and lesion range) image features between the two groups(all Plt;0.05).A total of 818 2D-Ultrasomics features were extracted,with 6 retained after LASSO selection.According to the results of multivariate Logistic regression analysis,three models were constructed:the 2D-CDUS model(based on boundary and width),the 2D-CD+CEUS model(based on boundary,width,contrast boundary),and the 2D-CDUS+Ultrasomics model(based on width,gray-level run length matrix,gray-level dependence matrix,gray-level size zone matrix).ROC curve analysis showed that the area under the curve(AUC) of 2D-CDUS+Ultrasomics model for distinguishing benign and malignant breast nodules with diameter≤2 cm was 0.917,which was significantly higher than that of 2D-CD+CEUS model and 2D-CDUS model (0.892,0.823),and the AUC of 2D-CD+CEUS model was higher than that of 2D-CDUS model,the difference were statistically significant (all Plt;0.001).The Hosmer-Lemeshow test showed a good model fit for all three models(P=0.818,0.103,0.281).Clinical decision curve analysis showed the 2D-CDUS+Ultrasomics model provided the highest clinical benefit in the thresholds of 0.20~0.39,0.43~0.78,and 0.88~0.91.Conclusion" " The" predictive model based on 2D-Ultrasomics can more accurately distinguish benign and malignant breast nodules with diameter≤2 cm compared to the predictive model based on CEUS,which is helpful in the early and accurate diagnosis of small breast nodules and facilitating treatment decision-making.
KEY WORDS" " Ultrasonography,Doppler,color;Contrast agent;Texture features;Breast nodules,benign and malignant
乳腺癌是女性最常见的恶性肿瘤,发病率呈逐年上升趋势。肿瘤大小在评估患者预后和治疗效果中具有重要的意义[1]。根据美国癌症联合委员会对肿瘤-淋巴结-转移分期系统显示,最大径≤2 cm且无淋巴结转移的乳腺癌为T1期,患者5年生存率可达95%以上,而肿瘤增大或伴有淋巴结转移时生存率显著下降[2-3]。乳腺癌筛查可提高早期发现率并降低死亡率[4-5]。尽管超声BI-RADS分类可以评估乳腺结节的恶性风险[6],但最大径≤2 cm的乳腺结节常因缺乏典型的恶性征象,二维超声及彩色多普勒(two-dimensional ultrasound and color Doppler ,2D-CDUS) 的诊断准确率较低[7-8]。超声造影(contrast-enhanced ultrasound,CEUS)通过注入微泡造影剂增强超声影像[9],可提高乳腺小结节的诊断准确率[10-12],但存在造影剂过敏风险及依赖操作者经验水平等局限。二维超声纹理特征(two-dimensional ultrasound texture features,2D-Ultrasomics)通过定量分析结节内部结构的细微差异,减少了主观因素干扰,诊断依据更为客观[13]。本研究通过比较基于2D-Ultrasomics与基于CEUS的预测模型鉴别最大径≤2 cm乳腺良恶性结节的诊断效能,旨在为T1期乳腺癌的早期诊断提供参考。
资料与方法
一、研究对象
选取2019年1月至2024年5月我院经病理确诊的乳腺结节患者109例,均为女性,年龄24~78岁,中位数47(41,53)岁。共112个结节,其中2例为双侧乳腺恶性结节,1例为双侧乳腺良性结节;结节位于外象限79个,内象限33个。其中良性组58个,包括纤维腺瘤37个、囊肿病11个、硬化性腺病和导管内乳头状瘤各5个;恶性组54个,包括浸润性癌44个、原位癌9个和腺样囊性癌1个。纳入标准:①术前2D-CDUS及CEUS检查资料完整;②最大径≤2 cm的乳腺结节(单侧多发结节者,仅选择最可疑结节);③有明确病理结果,均无淋巴结转移。排除标准:①妊娠期或哺乳期;②二维图像无法提取2D-Ultrasomics;③正在接受化疗或免疫治疗。本研究经我院医学伦理委员会批准[2023(202)],所有患者行CEUS检查前均签署知情同意书。
二、仪器与方法
1.2D-CDUS和CEUS检查:使用GE Logiq E9或Philips EPIQ7彩色多普勒超声诊断仪,2D-CDUS检查使用ML6-15、L12-5线阵探头,频率分别为6~15 MHz、5~12 MHz;CEUS检查使用L9-3、eL18-4线阵探头,频率分别为3~9 MHz、4~18 MHz;造影剂使用SonoVue(意大利Bracco公司),使用前严格按照说明书配制成混悬液备用。患者取仰卧位,双手上举,充分暴露乳房,应用2D-CDUS检查并记录结节大小、位置、形态、边界、回声、平行生长、钙化、血流等,将二维超声图像以DICOM格式存储在医学影像存档与通信系统。然后进行CEUS检查,选择避开钙化的切面,进入造影模式,机械指数设置为0.07,焦点置于灰阶图像显示结节处,调整增益确保图像清晰,然后经肘正中静脉快速团注造影剂混悬液5.0 ml,随后推注5.0 ml生理盐水冲管。于CEUS模式下观察结节的动态灌注过程3 min。以上操作由1名具有3年以上乳腺检查经验的超声医师及1名护士配合完成。
2.图像分析:由2名具有5年以上乳腺检查经验的超声医师在不知晓病理结果的情况下对2D-CDUS和CEUS图像进行分析,意见不一致时则由1名具有10年以上乳腺检查经验的超声医师判定。2D-CDUS图像特征根据BI-RADS分类[6]的影像术语进行描述,具体包括:位置(外象限、内象限)、内部回声(极低回声、低回声或等/稍高回声)、形态[规则(圆形或椭圆形)、不规则(分叶)]、边界[清晰、不清晰(毛刺、微小分叶、“蟹足”状突起)]、大小(长径及该切面下垂直的短径)、平行生长、钙化、后方回声(衰减、无变化或增强)、血流。其中血流参照Adler半定量分级标准[14]分为4级,0~Ⅰ级判为不丰富,Ⅱ~Ⅲ级判为较丰富。CEUS图像特征包括增强方式(低/等增强、高增强)、增强时相(慢/同步增强、快增强)、造影边界(清晰、不清晰)、增强均匀性、增强病灶范围(不变或难以分辨、扩大)及有无灌注缺损。
3.2D-Ultrasomics提取及筛选:选择结节最大径切面的二维超声图像,由1名具有5年以上乳腺检查经验的超声医师采用ITK-SNAP软件(http://www.itksnap.org)沿结节边界手动勾画感兴趣区,使其包括整个结节但不含周边组织。由另1名具有7年以上乳腺检查经验的超声医师在2周后重复上述操作,采用组内相关系数(ICC)评估2D-Ultrasomics提取的可重复性,保留ICCgt;0.75的特征用于后续分析。2D-Ultrasomics通过PyRadiomics软件包提取,主要包括:①一阶特征;②基于形状的特征;③高阶特征,包括灰度共生矩阵、灰度依赖矩阵(GLDM)、灰度游程长度矩阵(GLRLM)、灰度区域大小矩阵(GLSZM)和邻域灰度差矩阵等。为平衡数据集中良性与恶性样本的比例,本研究通过重复随机采样增加样本数量。随后对特征矩阵进行归一化并计算特征间的相似性,若某对特征的相关系数gt;0.990,则删除其中1个以简化特征空间并确保特征独立。采用方差分析选择与乳腺良恶性结节显著相关的特征,并通过F值排序进行初步筛选。最后采用最小绝对收缩和选择算子(LASSO)进一步筛选特征,通过L1正则化压缩不重要的特征系数,实现特征稀疏化,保留最关键的特征。
三、统计学处理
应用Python 3.11.8和R 4.4.0软件,符合正态分布的计量资料以x±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Wilcoxon秩和检验。计数资料以频数或率表示,组间比较采用χ2检验。采用单因素分析筛选与最大径≤2 cm乳腺良恶性结节相关的2D-CDUS和CEUS图像特征,然后将其分别纳入Logistic回归分析,筛选独立预测因子。由此分别构建2D-CDUS模型、2D-CDUS结合CEUS(2D-CD+CEUS)模型、2D-CDUS结合2D-Ultrasomics(2D-CDUS+Ultrasomics)模型。绘制受试者工作特征(ROC)曲线评估各模型鉴别最大径≤2 cm乳腺良恶性结节的诊断效能,曲线下面积(AUC)比较采用Delong检验;采用Hosmer-Lemeshow拟合优度检验评估模型的拟合度;绘制临床决策曲线评估模型的临床适用性;绘制列线图分析2D-CDUS+Ultrasomics模型的预测效能并进行验证。Plt;0.05为差异有统计学意义。
结" 果
一、2D-CDUS模型构建
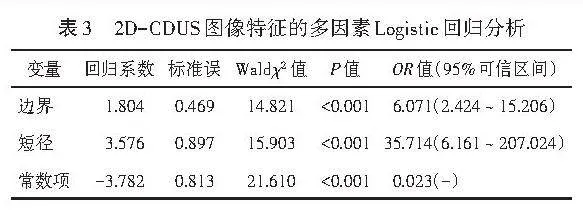
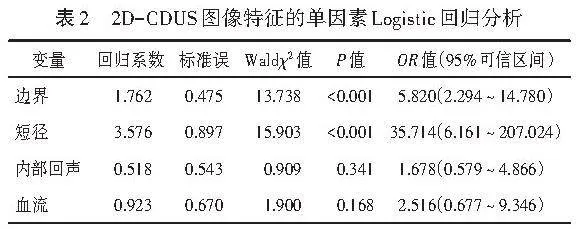
两组患者年龄和结节内部回声、边界、血流、短径比较差异均有统计学意义(均Plt;0.05);两组结节位置、形态、平行生长、后方回声、钙化、长径比较差异均无统计学意义。见表1和图1,2。本研究Logistic回归分析时剔除年龄因素,仅研究超声变量,结果显示,边界、短径均为鉴别最大径≤2 cm乳腺良恶性结节的独立预测因子(均Plt;0.001)。见表2,3。由此构建2D-CDUS模型,方程式为:Logit(P)=-3.782+1.804×边界+3.576×短径。
二、2D-CD+CEUS模型构建
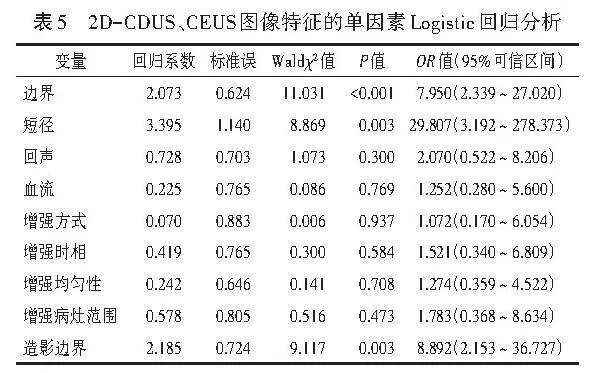
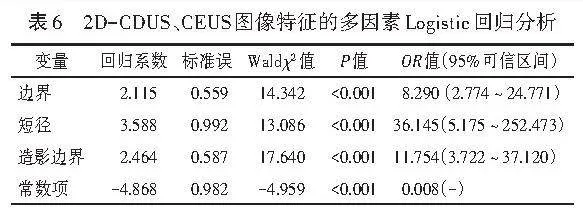
两组增强方式、增强时相、造影边界、增强均匀性、增强病灶范围比较差异均有统计学意义(均Plt;0.05);两组灌注缺损比较差异无统计学意义。见表4。进一步将2D-CDUS、CEUS图像特征的单因素分析中差异有统计学意义的变量纳入Logistic回归分析,结果显示,边界、短径、造影边界均为鉴别最大径≤2 cm乳腺良恶性结节的独立预测因子(均Plt;0.05)。见表5,6。由此构建2D-CD+CEUS模型,方程式为:Logit(P)= -4.868+2.115×边界+3.588×短径+2.464×造影边界。
三、2D-Ultrasomics筛选和模型构建
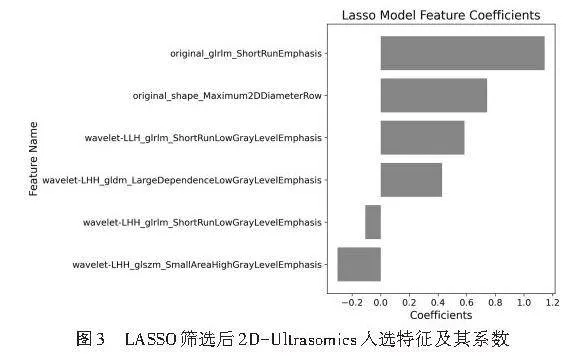
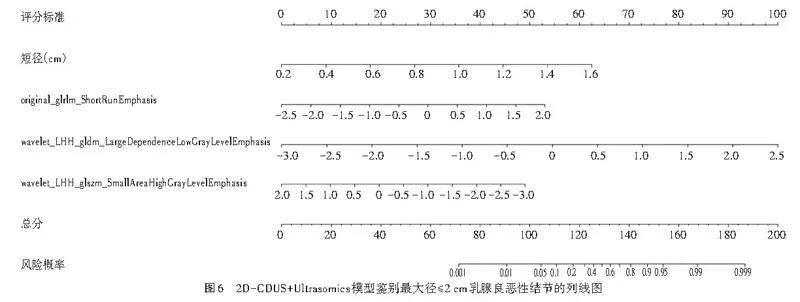
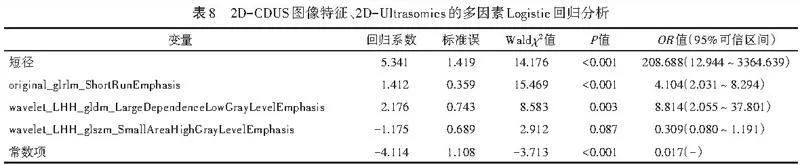
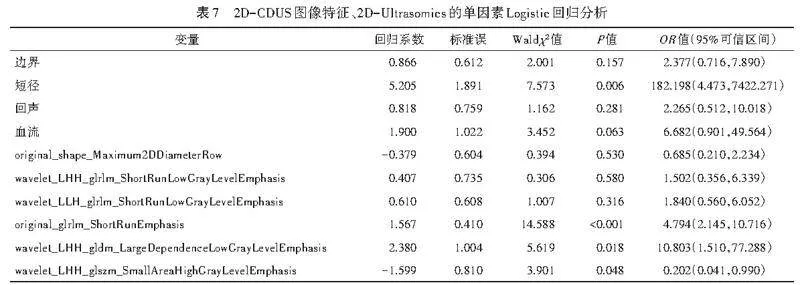
从二维超声图像中共提取818个纹理特征,采用方差分析初步筛选出9个显著特征,随后通过LASSO保留6个关键特征(图3)。将2D-CDUS图像特征的单因素分析中差异有统计学意义的变量纳入Logistic回归分析,结果显示,短径、基于GLRLM中短游程显著性的特征(original_glrlm_ShortRunEmphasis)、基于GLDM描述的特征(wavelet_LHH_gldm_LargeDependenceLow GrayLevelEmphasis)、基于GLSZM中高灰度小面积区域突出性的特征(wavelet_LHH_glszm_SmallArea HighGrayLevelEmphasis)均为鉴别最大径≤2 cm乳腺良恶性结节的独立预测因子(均Plt;0.05)。见表7,8。由此构建2D-CDUS+Ultrasomics模型,方程式为:Logit(P)=-4.114+5.341×短径+1.412×original_glrlm_Short RunEmphasis+2.176×wavelet_LHH_gldm_LargeDependence LowGrayLevelEmphasis-1.175×wavelet_LHH_glszm_ SmallAreaHighGrayLevelEmphasis。
四、模型的效能及验证
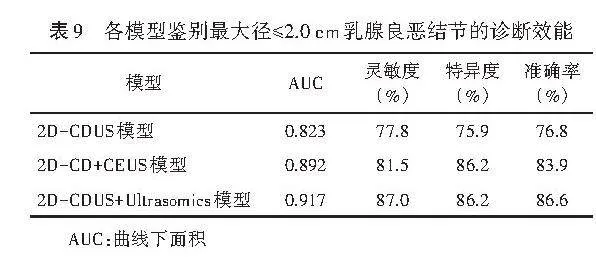
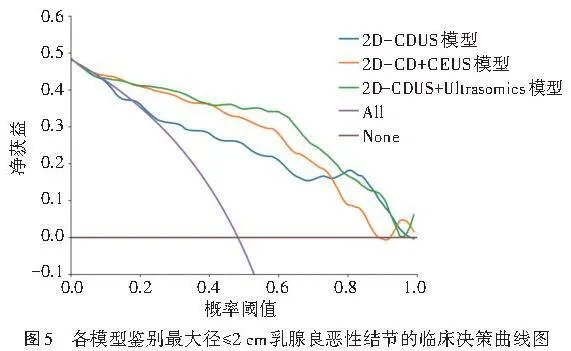
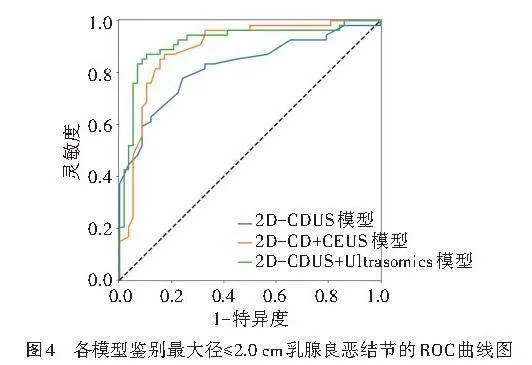
1.2D-CDUS+Ultrasomics模型鉴别最大径≤2 cm乳腺良恶性结节的AUC为0.917,显著高于2D-CD+CEUS模型及2D-CDUS模型的AUC(0.892、0.823),2D-CD+CEUS模型的AUC高于2D-CDUS模型的AUC,差异均有统计学意义(均Plt;0.001)。见表9和图4。Hosmer-Lemeshow拟合优度检验显示,2D-CDUS模型、2D-CD+CEUS模型和2D-CDUS+Ultrasomics模型均具有良好的拟合度(P=0.818、0.103、0.281)。临床决策曲线分析显示,2D-CDUS+Ultrasomics模型在0.20~0.39、0.43~0.78及0.88~0.91概率阈值范围内具有较高的临床获益(图5)。
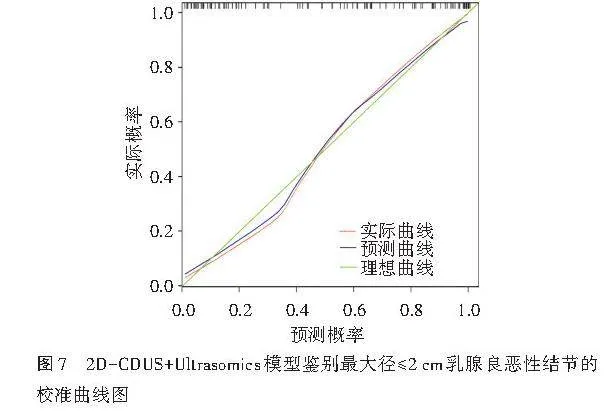
2.基于2D-CDUS+Ultrasomics模型绘制了列线图和校准曲线用以评估其预测效能,结果显示该模型具有较高的预测效能和校准度。见图6,7。
讨" 论
临床上早期准确鉴别乳腺良恶性结节对改善患者预后至关重要。近年来,2D-Ultrasomics和CEUS作为新兴的影像学技术,逐渐被应用于乳腺结节的风险分层。CEUS通过增强血流动力学特征显示,有助于区分结节的良恶性[15];2D-Ultrasomics通过提取二维超声图像的纹理特征,提高了对结节的诊断精度[16]。目前尚无研究比较2D-Ultrasomics与CEUS对最大径≤2 cm乳腺良恶性结节的鉴别诊断价值。基于此,本研究对比了基于2D-Ultrasomics与基于CEUS的预测模型鉴别最大径≤2 cm乳腺良恶性结节的诊断效能,结果显示2D-Ultrasomics显著提高了2D-CDUS对乳腺小结节的识别能力,为最大径≤2 cm乳腺良恶性结节的早期诊断提供了新的思路。
目前超声对最大径≤2 cm且具有恶性倾向的乳腺结节定性诊断较为困难[6]。由于此类结节体积小且生物学特征复杂,超声表现常不典型,增加了定性诊断的难度。本研究结果显示,两组2D-CDUS图像特征(内部回声、边界、血流、短径)比较差异均有统计学意义(均Plt;0.05),与既往研究[10,17]结果部分一致,表明超声图像特征与恶性结节内部异质性相关。然而,不同的分类标准可能导致结果有所差异,今后研究需进一步探讨超声图像特征与结节内部异质性的关系,并标准化超声图像特征提取,以提高诊断的一致性。既往研究[18]表明,恶性结节内部常含大量纤维化或坏死组织,超声表现为内部回声减低,但本研究结果显示,良性组结节内部极低回声占比高于恶性组,差异有统计学意义(Plt;0.05)。随访其病理结果发现,部分二维超声表现为极低回声的结节病理提示为囊肿。对于此类结节,2D-CDUS鉴别较为困难,但由于恶性结节通常缺乏囊膜,毛细血管网络紊乱,CEUS表现为微循环增加,此时应用CEUS有助于鉴别诊断。本研究恶性组结节血流较丰富者占比高于良性组(Plt;0.05),分析其原因,恶性结节常伴随不规则结构的新生血管形成,且毛细血管的通透性增加[19],导致结节在彩色多普勒下表现为较丰富的血流信号。进一步Logistic回归分析显示,短径、边界均为鉴别最大径≤2 cm乳腺良恶性结节的独立预测因子(均Plt;0.05)。短径与恶性结节生长模式密切相关,恶性结节常向周边呈侵袭性生长,故其多呈圆形或球形,而良性结节则多为椭圆形[6]。此外,恶性结节边界不清晰亦体现其浸润性生长特点。
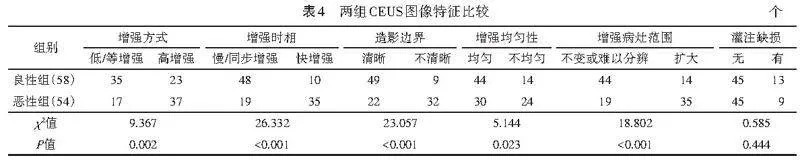
本研究两组结节增强方式、增强时相、造影边界、增强均匀性、增强病灶范围比较差异均有统计学意义(均Plt;0.05),提示CEUS的动态观察能进一步反映恶性结节的微血管灌注特点,与既往研究[20]结果一致。但本研究中两组结节灌注缺损比较差异无统计学意义,与既往研究[17]结果不同,分析原因可能为乳腺恶性小结节通常血供充足,较少发生坏死,故在CEUS过程中较少发生灌注缺损。Logistic回归分析显示,造影边界为鉴别最大径≤2 cm乳腺良恶性结节的独立预测因子(Plt;0.05),分析原因为恶性结节的微循环更丰富,CEUS时造影剂迅速扩散至周围血管,导致造影边界亦不清晰[10]。既往研究[11-12]表明,CEUS可作为2D-CDUS的有效补充,能够提高鉴别最大径≤2cm乳腺良恶性结节的诊断效能,本研究结果亦验证了这一结果。
2D-Ultrasomics分析能够深入评估结节内部结构的复杂性,揭示2D-CDUS肉眼难以观察的细微纹理特征[16]。本研究从二维超声图像中共提取了818个纹理特征,采用方差分析初步筛选出9个显著特征,随后通过LASSO保留6个关键特征。Logistic回归分析显示,基于GLRLM、GLDM、GLSZM的纹理特征均为鉴别最大径≤2 cm乳腺良恶性结节的独立预测因子(均Plt;0.05)。其中基于GLRLM的纹理特征反映图像中短游程的显著性,恶性结节通常具有更复杂的结构和更小的区域游程,表现出更显著的短游程特征;基于GLDM的纹理特征评估了低灰度区域的大面积依赖性;基于GLSZM的纹理特征则衡量了图像中高灰度小面积区域的突出性。本研究结果显示,恶性结节更多见于较大面积低灰度的区域,而良性结节更多见小面积高灰度区域,分析可能与乳腺良恶性结节的组织结构特点相关,恶性结节由于其生长和肿瘤细胞增殖速度较快,容易导致回声不均匀性及区域性血流变化,从而在纹理分析中表现出较大的灰度非均匀性;而良性结节通常有明确清晰的边界,可由结缔组织、增生的腺体细胞和脂肪组织混合形成假包膜[21],导致其在超声图像上呈现更多的小面积高灰度区域。既往研究[22]也指出,纹理分析能客观量化组织异质性,恶性结节通常表现出较大的灰度非均匀性,反映组织内坏死或纤维化等病理特征。然而,纹理特征与病理特征间的具体关系仍需后续研究进一步验证。
本研究ROC曲线分析显示,基于2D-CDUS和CEUS图像特征构建的2D-CD+CEUS模型鉴别最大径≤2 cm乳腺良恶性结节的AUC为0.892,高于基于单独2D-CDUS图像特征构建的2D-CDUS模型(0.823),差异有统计学意义(Plt;0.001),诊断效能有所提高,但通过比较发现,2D-CDUS+Ultrasomics模型在鉴别最大径≤2 cm乳腺良恶性结节方面具有更高的AUC(0.917)。分析其原因可能为:2D-Ultrasomics能揭示大量二维超声图像中的非肉眼识别特征,减少了诊断中的主观性和设备依赖性[23]。研究[16,22]表明二维超声联合2D-Ultrasomics的Logistic回归模型鉴别乳腺良恶性结节的诊断效能优于单独基于2D-CDUS和2D-CDUS联合CEUS的预测模型[16,22]。但Mannina等[24]研究发现2D-Ultrasomics对乳腺良恶性结节预测效能的提高有限,尤其联合弹性成像时,分析原因可能为其组织硬度信息与灰度特征重复。本研究结果显示,2D-Ultrasomics联合2D-CDUS图像特征有助于提高诊断精度,减少不必要的活检操作。与2D-CDUS+CEUS模型比较,2D-CDUS+Ultrasomics模型在乳腺恶性结节诊断中展现了更高的灵敏度,为临床提供了更精准的判断依据,降低了误诊风险。
列线图展示了模型中各变量对预测结果的贡献,便于临床医师在实际操作中根据患者的具体情况进行个性化风险评估;校准曲线则用于评估模型预测概率与实际观察结果之间的吻合度,本研究基于2D-CDUS+Ultrasomics模型绘制了列线图和校准曲线用以评估该模型鉴别最大径≤2 cm乳腺结节良恶性的预测效能,结果显示该模型在临床应用中具有较高的预测准确性,表明其能够较为精确地预测乳腺良恶性结节,为临床决策提供有力支持。
本研究的局限性:①样本量偏小,可能影响模型的普适性;②为单中心研究,数据来源单一,缺乏多中心验证;③不同仪器和参数对结果的影响未充分考虑。有待今后扩大样本量,开展多中心验证,并统一仪器和参数或采用计算机校正灰度,以减少外部变量对模型诊断效能的影响,从而进一步提升模型的普适性和准确性。
综上所述,基于2D-Ultrasomics的预测模型较基于CEUS的预测模型能更准确地鉴别最大径≤2 cm乳腺良恶性结节,显著提高了对恶性结节的识别能力,为乳腺小结节的诊断提供了新的标准化手段。
参考文献
[1] Siegel RL,Miller KD,Fuchs HE,et al.Cancer statistics,2022[J].CA Cancer J Clin,2022,72(1):7-33.
[2] Desantis CE,Ma J,Goding SA,et al.Breast cancer statistics,2017,racial disparity in mortality by state[J].CA Cancer J Clin,2017,67(6):439-448.
[3] Teichgraeber DC,Guirguis MS,Whitman GJ.Breast cancer staging:updates in the AJCC cancer staging manual,8th edition,and current challenges for radiologists,from the AJR special series on cancer staging[J].Am J Roentgenol,2021,217(2):278-290.
[4] Benitez Fuentes JD,Morgan E,De Luna Aguilar A,et al.Global stage distribution of breast cancer at diagnosis:a systematic review and Meta-analysis[J].JAMA Oncol,2024,10(1):71-78.
[5] Wang Y,Li Y,Song Y,et al.Comparison of ultrasound and mammography for early diagnosis of breast cancer among Chinese women with suspected breast lesions:a prospective trial[J].Thorac Cancer,2022,13(22):3145-3151.
[6] Mercado CL.BI-RADS Update[J].Radiol Clin North Am,2014,52(3):481-487.
[7] Pistolese CA,Tosti D,Citraro D,et al.Probably benign breast nodular lesions(BI-RADS 3):correlation between ultrasound features and histologic findings[J].Ultrasound Med Biol,2019,45(1):78-84.
[8] Xiao X,Jiang Q,Wu H,et al.Diagnosis of sub-centimetre breast lesions:combining BI-RADS-US with strain elastography and contrast-enhanced ultrasound——a preliminary study in China[J].Eur Radiol,2017,27(6):2443-2450.
[9] Boca Bene I,Dudea SM,Ciurea AI.Contrast-enhanced ultrasonography in the diagnosis and treatment modulation of breast cancer[J].J Pers Med,2021,11(2):81.
[10] 钟兆明,唐丽娜,王瑶琴,等.常规超声联合超声造影对乳腺BI-RADS 4类小结节的诊断价值[J].中华超声影像学杂志,2021,30(11):955-960.
[11] Li Q,Hu M,Chen Z,et al.Meta-analysis:contrast-enhanced ultrasound versus conventional ultrasound for differentiation of benign and malignant breast lesions[J].Ultrasound Med Biol,2018,44(5):919-929.
[12] Niu Q,Zhao L,Wang R,et al.Predictive value of contrast-enhanced ultrasonography and ultrasound elastography for management of BI-RADS category 4 nonpalpable breast masses[J].Eur J Radiol,2024,173:111391.
[13] Zhang J,Wu J,Zhou XS,et al.Recent advancements in artificial intelligence for breast cancer:image augmentation,segmentation,diagnosis,and prognosis approaches[J].Semin Cancer Biol,2023,96:11-25.
[14] Adler DD,Carson PL,Rubin JM,et al.Doppler ultrasound color flow imaging in the study of breast cancer:preliminary findings[J].Ultrasound Med Biol,1990,16(6):553-559.
[15] 贾超,杜联芳,史秋生,等.超声造影对不同大小BI-RADS 4类乳腺结节的良恶性定性诊断研究[J].中华超声影像学杂志,2020,29(4):343-348.
[16] Basara Akin I,Ozgul H,Simsek K,et al.Texture analysis of ultrasound images to differentiate simple fibroadenomas from complex fibroadenomas and benign phyllodes tumors[J].J Ultrasound Med,2020,39(10):1993-2003.
[17] Wang B,Yang D,Zhang X,et al.The diagnostic value of contrast-enhanced ultrasonography in breast ductal abnormalities[J].Cancer Imaging,2023,23(1):25.
[18] Wojcinski S,Stefanidou N,Hillemanns P,et al.The biology of malignant breast tumors has an impact on the presentation in ultrasound:an analysis of 315 cases[J].BMC Womens Health,2013,13:47.
[19] Byeon SE,Yi YS,Lee J,et al.Hydroquinone exhibits in vitro and in vivo anti-cancer activity in cancer cells and mice[J].Int J Mol Sci,2018,19(3):903.
[20] Wang M,Feng HL,Liu YQ,et al.Angiogenesis research in mouse mammary cancer based on contrast-enhanced ultrasonography:exploratory study[J].Acad Radiol,2018,25(7):889-897.
[21] Lebeau A.Updated WHO classification of tumors of the breast[J].Pathologe,2021,42(Suppl 2):155-159.
[22] Luo WQ,Huang QX,Huang XW,et al.Predicting breast cancer in breast imaging reporting and data system(BI-RADS) ultrasound category 4 or 5 lesions:a nomogram combining radiomics and BI-RADS[J].Sci Rep,2019,9(1):11921.
[23] Lambin P,Rios-Velazquez E,Leijenaar R,et al.Radiomics:extracting more information from medical images using advanced feature analysis[J].Eur J Cancer,2012,48(4):441-446.
[24] Mannina D,Kulkarni A,Van Der Pol CB,et al.Utilization of texture analysis in differentiating benign and malignant breast masses:comparison of grayscale ultrasound,shear wave elastography,and radiomic features[J].J Breast Imaging,2024,6(5):513-519.
(收稿日期:2024-10-14)
基金项目:陆军特色医学中心人才创新能力培养计划(ZXZYTSLC07);重庆市技术创新与应用示范社会民生类一般项目(cstc2018jscx-msybX0018);重庆市自然科学基金面上项目(cstc2021jcyj-msxmX0230)
作者单位:1.陆军军医大学大坪医院超声诊断科,重庆 400042;2.重庆大学附属三峡医院超声科,重庆 404100
通讯作者:李陶,Email:taoli39@tmmu.edu.cn
