不同物种MPG蛋白介导水稻A-to-K碱基编辑
2025-02-10吴雪梅任斌李欣格旷永洁张大伟周焕斌

关键词: N-甲基嘌呤DNA 糖基化酶; 植物腺嘌呤碱基颠换编辑器; 基因组编辑; 水稻
1 引言
单核苷酸多态性(Single nucleotide polymorphisms,SNPs)在植物界中普遍存在,也是作物农艺性状遗传变异和改良的基础. 利用碱基编辑技术对已知的关键SNPs 进行碱基替换,或者人工创制能够用以提高作物产量、品质和抗性的新型SNPs,这样的精准调控模式可极大促进作物的遗传改良和种质创新[1, 2]. 目前在植物中CRISPR/Cas9 介导的胞嘧啶碱基编辑器(Cytosine base editors,CBEs)、腺嘌呤碱基编辑器(Adenine base editors,ABEs)和双碱基编辑系统相继被报道,顺利实现了碱基的转换编辑(A-to-G/C-to-T)
胞嘧啶碱基颠换编辑技术的开发得益于一类DNA 糖基化酶的作用. 在前期CBE 编辑过程中检测到少量的胞嘧啶碱基颠换编辑C-to-A/G 和inde(l insertion and deletion),这是由于 CBE 结构中的尿嘧啶DNA 糖基化酶抑制剂(uracil DNA glycosylaseinhibitor,UGI)并不能完全抑制尿嘧啶DNA 糖基化酶(Uracil-DNA N-glycosylase,UNG或称Uracil DNA glycosylase,UDG)的天然活性.而UNG 可糖基化胞嘧啶C 脱氨产生的尿嘧啶U并激发碱基切除修复机制(Base excision repair,BER),实现靶点处U 的切除并形成无嘌呤无嘧啶(Apurinic/Apyrimidinic,AP)位点[3],进一步引发随机修复,便会产生C-to-A/G 和indel. 在此基础上将UGI 替换为人源尿嘧啶DNA 糖基化酶hUNG 或者水稻内源尿嘧啶DNA 糖基化酶Os‑UNG,在植物中实现了有效的C-to-G/A 的编辑,特别是OsUNG 融合脱氨酶Anc689(R33A)的碱基编辑工具将水稻中的C-to-G 编辑效率提升至21. 3%[4-6].
与UNG 一样,自然界中也存在一类N-甲基嘌呤DNA 糖基化酶(N-methylpurine DNA glycosylase,MPG 或称Alkyladenine DNA glycosylase,AAG),可结合多种作用底物并实现底物的脱氨反应,这些底物中就包含次黄嘌呤Ⅰ. 但由于该类糖基化酶活性远不及UNG 且底物众多,在碱基编辑过程中很难实现对I 的糖基化,因此ABE 的编辑产物中几乎没有A-to-T/C 和indel 类型,这也导致植物中的腺嘌呤碱基颠换编辑(A-to-Y,即A-to-T/C)实现困难. 此前在水稻中也尝试在ABE 的C 端分别融合人源hMPG 和核酸内切酶EndoV 来实现腺嘌呤碱基颠换编辑,但结果分析表明只出现了小片段的缺失,未发生A-to-Y 编辑[5]. Tong 等[7]对hMPG 进行突变得到对Ⅰ具高活性的糖基化酶突变体hMPGv3 并顺利实现了人类细胞中A-to-Y 的编辑. 随后利用hMPGv3 融合高活性腺嘌呤碱基编辑器在水稻、番茄和玉米中也得以实现A-to-K即A-to-G/T 编辑和极少量的A-to-C 编辑[8-11],极大丰富了碱基编辑的类型. 但目前在植物中腺嘌呤碱基颠换编辑器仍存在糖基化酶种类单一、碱基颠换效率较低的问题,制约了通过腺嘌呤碱基颠换编辑对作物进行遗传改良与种质创新的进程.
在哺乳动物细胞中hMPG 和mAAG 均表现出良好的A-to-T/C 编辑能力[7,12],而目前在植物中主要使用的是人源hMPGv3 的密码子优化版本[8-11]. 基于此,本研究测试了鼠源mAAG 三种突变体、人源hMPGv3-EF 变体和水稻内源OsMPG在植物中的A-to-G/T/C 编辑能力. 三种来源的MPG 均成功实现腺嘌呤碱基颠换编辑且主要是A变为T,为进一步优化腺嘌呤碱基颠换编辑器和提高编辑效率奠定一定基础.
2 材料方法
2. 1 实验材料
早熟水稻粳稻品种Kitaake(Oryza sativa ssp.geng)、sgRNA 载体pENTR4:sgRNA4、hMPGv3基因片段、腺嘌呤碱基编辑器pUbi:rBE49b 来源于实验室保存,其余载体由本次实验构建,胰蛋白胨、酵母提取物、琼脂粉、MS 培养基、NAA、6-BA购于北京索莱宝科技有限公司,NaCl、蔗糖、山梨醇购于国药集团,Hygromycin B(60225ES03)、Timentin(60230ES07)购于翌圣生物科技(上海)股份有限公司,各类限制性内切酶、T4 DNA Ligase(EL0021)、T4 DNA Ligase Buffer(B69)、T4 polynucleotidekinase(EK0031)、ATP(R0441)购于Thermo Scientific,Gateway® LR ClonaseTM Ⅱ EnzymeMix(11791100)购于Invitrogen,TRAN Easy‑Pure® HiPure Plasmid MaxiPrep Kit 试剂盒(EM123-01)购于北京全式金生物技术有限公司,PCR 扩增高保真酶Phanta Super-Fidelity DNAPolymerase(P501-d1)、ClonExpress Ⅱ One StepCloning Kit(C112-01)、Vazyme FastPure GelDNA Extraction Mini Kit 试剂盒(DC301-01)、2×Rapid Taq Master Mix(P222-01)购于南京诺唯赞生物科技股份有限公司.
2. 2 实验方法
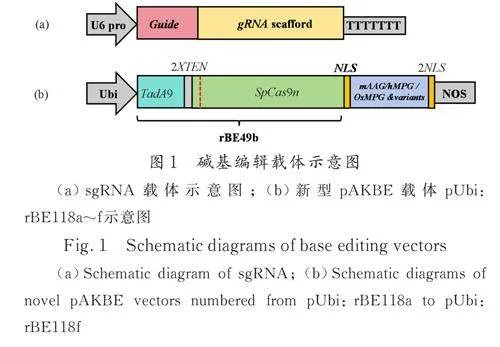
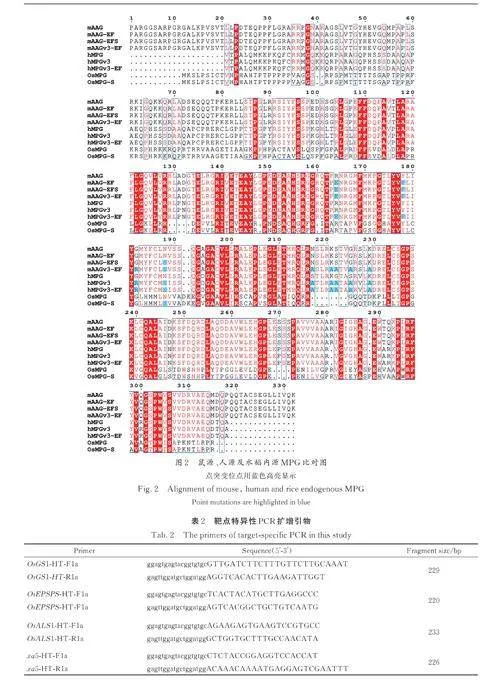
2. 2. 1 sgRNA 设计和载体构建 本研究用到的水稻内源基因靶点见表1. sgRNA 序列由CRISPR-GE(http://skl. scau. edu. cn/targetdesign/)设计,交由公司合成后构建到Bsa Ⅰ或BtgZ Ⅰ酶切后的pENTR4:sgRNA4 载体中(图1a).
2. 2. 2 碱基编辑载体构建 首先按照三种来源氨基酸序列比对结果确定突变位点( 图2),mAAG、OsMPG 基因按照水稻密码子偏好性进行密码子优化后委托公司合成或者以已合成基因为模板进行定点突变PCR 获得,hMPGv3-EF 在hMPGv3 基础上定点突变而来. 使用DNA 无缝克隆试剂与SpCas9-Fg2 组装,使用BamH Ⅰ和Bcu Ⅰ酶切pUbi:rBE49b 载体得到双元表达载体骨架,通过三片段连接将以上片段分别与TadA9-Sp⁃Cas9n-Fg1 片段和双元表达载体骨架融合构建pUbi:rBE118a~(f 图1b).
2. 2. 3 水稻碱基编辑器的构建与农杆菌转化将构建成功的碱基编辑载体与pENTR4:sgRNA通过Gateway LR 反应完成体外重组获得靶向各个基因位点的碱基编辑载体,再利用冻融法将各编辑载体分别转入农杆菌EHA105 中.
2. 2. 4 农杆菌介导的水稻遗传转化 将水稻幼胚进行表面消毒后转入MSD 培养基生长10 d 诱导愈伤组织,去除种皮和胚后继续培养4 d. 提前2 d 活化农杆菌菌株并将新鲜菌落接种TY 培养基过夜培养至OD600 达1. 0~2. 0,将愈伤组织放入OD600 处于0. 15 左右的农杆菌悬浮侵染液中浸泡30 min 后进行暗培养,3~5 d 后转移至筛选培养基上生长1~2 mo,筛选获得的转基因抗性愈伤进一步在再生培养基上可获得转基因植株. 详细步骤参照Wang 等[13]的方法.
2. 2. 5 碱基编辑效率检测 获取转基因材料之后采用CTAB 法提取水稻全基因组DNA,使用特异性引物扩增靶序列(见表2),并在每个样品PCR产物两端添加独立的barcode 后完成NGS 高通量测序以获得各靶点处的编辑类型和编辑效率,测序原理参照Liu 等[14]的方法.
3 结果与分析
3. 1 鼠源N- 甲基嘌呤DNA 糖基化酶融合rBE49b 实现水稻A-to-K 碱基编辑
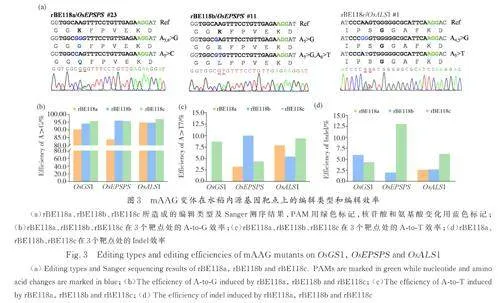
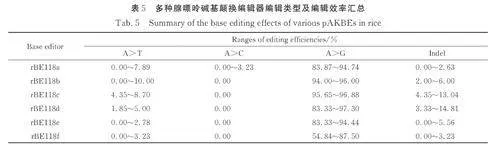
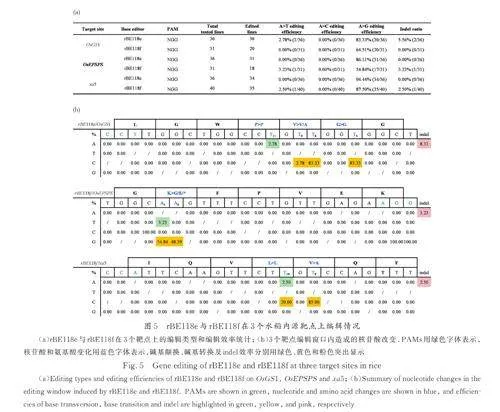
Chen 等[12]提出大鼠来源的N-甲基嘌呤DNA糖基化酶mAAG 变体能够在人类细胞中实现较高效率的腺嘌呤碱基颠换编辑,其多位点组合突变结果表明AXBE-R165E·Y179F 突变体的A-to-Y编辑效率是A-to-G 的3. 8 倍,而目前为止暂未有mAAG 变体在水稻中发挥作用的报道. 在hMPG研究中对N169 位点进行突变并检测切除各类脱氧核苷酸的速率得出N169S 对次黄嘌呤有更快的切除速率[15],经过人工进化筛选发现融合了G163R、N169S、S198A、K202A、G203A、S206A 和K210A 共7 个位点的突变体hMPGv3 在人类细胞中A-to-Y 编辑效率增长为原来的4. 78 倍[7]. 为了检验携带不同突变位点的mAAG 在植物中实现AKBE 的能力,进行了如下探索. 通过人工理性设计并以片段合成和PCR 反应分别获得mAAG-EF(R165E·Y179F)、mAAG-EFS(R165E·Y179F·N189S)、mAAGv3-EF(R165E·Y179F·G183R·N189S·N218A·K222A·S223A·G226A·K230A)3种mAAG 变体,将其进行融合于rBE49b(TadA9-SpCas9n)的C 端并依次获得新的碱基编辑工具rBE118a( TadA9-SpCas9n-mAAG-EF)、rBE118b(TadA9-SpCas9n-mAAG-EFS)和rBE118(c TadA9-Sp Cas9n-mAAGv3-EF),以验证其对于糖基化活性的调节特性乃至在A-to-G/T/C 编辑效率上的影响. 选择OsGS1、OsEPSPS 和OsALS1 作为内源性验证靶点,结果表明rBE118a、rBE118b 和rBE118c 均展现出A-to-K 编辑能力,而在所有突变类型中只发现rBE118a 在OsEPSPS 位点实现了A-to-C 的编辑,编辑效率为3. 23%(图3a),综合碱基编辑和indel 数据( 图3b~3d)可初步得出mAAGv3-EF 在3 个位点有较稳定的pAKBE 编辑活性,同时其indel 的比例也有所增加. 上述结果表明基于鼠源mAAG 突变体的pAKBE 工具在水稻中能够有效地实现A-to-T/C 编辑,同时人源hMPGv3 中的7 个位点变异(G163R、N169S、S198A、K202A、G203A、S206A 和K210A)能有效提升mAGG-EF 的编辑活性.
3. 2 人源N-甲基嘌呤DNA 糖基化酶hMPGv3-EF 融合rBE49b 实现水稻A-to-K 碱基编辑
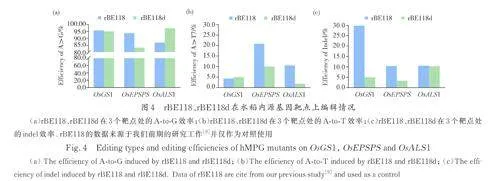
7 个氨基酸变异可以提升鼠源mAGG-EF 的A-to-T/C 编辑活性,我们继续探究将鼠源mAAG中的R165E 和Y179F 突变引入到人源hMPGv3,是否可以进一步提高hMPGv3 的A-to-T/C 编辑活性. 对hMPGv3 进行新一轮突变,融入对应的R145E 和Y159F 突变得到hMPGv3-EF,设计并构建pUbi: rBE118d (TadA9-SpCas9n-hMPGv3-EF),同样靶向OsGS1、OsEPSPS 和OsALS1,测试其编辑活性. NGS 高通量测序结果显示,rBE118d 在3 个靶点处均实现了较高效率的A-to-K,未检测到A-to-C 编辑. 其中,A-to-T 的效率分别为5. 00%、10. 00% 和1. 85%(图4a~4c),但与pUbi:rBE118(TadA9-SpCas9n-hMPv3)相较没有明显的提升[9]. 上述结果证实了该突变体能够实现水稻A-to-Y 编辑,但其编辑能力相较于rBE118 并未得到进一步强化.
3. 3 水稻内源N- 甲基嘌呤DNA 糖基化酶融合rBE49b 实现水稻A-to-K 碱基编辑
将hMPG 和mAAG 在水稻基因组数据库中进行氨基酸序列比对,仅获得一个候选的N-甲基嘌呤DNA 糖基化酶,对应转录本为Os02t0774500-01,编码蛋白为287 个氨基酸,与mAGG(333 aa)的序列相似度为26. 57%,与hMPG(298 aa)的相似度为27. 36%(图2),将其命名为OsMPG. 对水稻内源OsMPG 进行密码子优化和人工合成,将其融合于rBE49b 的C 端得到rBE118e 以探究其pAKBE 编辑活性. 在已知位点OsGS1 处,rBE118e 检测出3. 23% 的A-to-T 编辑,证实了OsMPG 的碱基编辑活性(图5a). 为了进一步改良编辑活性引入新的突变,用OsMPG-R169S 替换OsMPG 得到rBE118f 在OsGS1、OsEPSPS 和xa5处完成打靶实验. 结果显示相比较rBE118e,rBE118f 在3 个位点的A-to-G 编辑效率均有明显下降趋势;另外,rBE118f 在OsEPSPS 和xa5 两个位点处均实现了A-to-T 的编辑( 效率分别为3. 23% 和2. 50%)(图5b).
3. 4 rBE118a~f 造成不同类型的靶基因上插入缺失
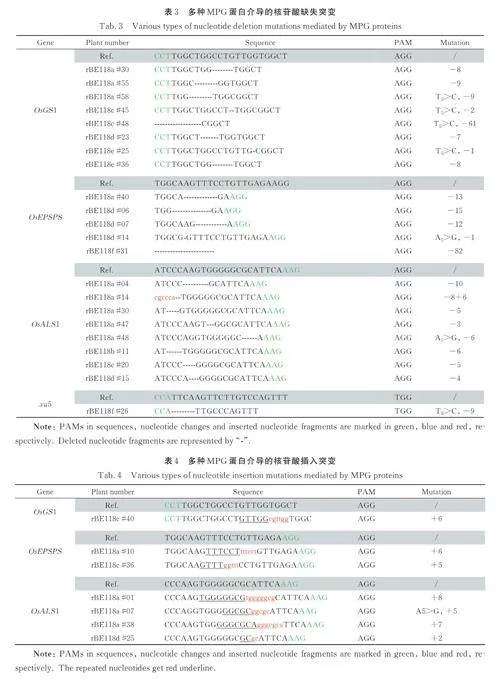
通过对受试编辑工具在四个靶基因处产生的indel 类型进行分析发现,如表3 所示,在OsGS1、OsEPSPS、OsALS1 上均发现了不同类型的缺失,片段大小在2~15 bp 不等,且主要集中于rBE118a~f 的碱基编辑窗口内及SpCas9n 切口酶的活性位点之间. 此外,在前3 个靶基因上还出现了82bp、61 bp 和50 bp 这样的大片段删除. 而在OsGS1、OsEPSPS、OsALS1 和xa5 上产生的碱基插入在2~8 bp 不等且插入序列为相邻序列的重复片段,如rBE118a 在OsALS1 位点产生了tgggggcg(8 bp)的重复插入,与TGGGGGCG 完全相同(表4).
4 讨论与结论
随着新型碱基编辑技术的逐步发展,植物中已经顺利实现了A-to-G/T/C 的碱基编辑类型,而目前为止报道的腺嘌呤碱基颠换均是由hMPGv3融合ABE 碱基编辑器来完成的.
TadA9 是在TadA8e 基础上引入V82S·Q154R 得到的腺嘌呤脱氨酶变体,与SpCas9 融合形成rBE49b(TadA9-XTEN-SpCas9n)在多个位点均展现出稳定的、编辑窗口更宽的A-to-G 替换能力且副产物极少[16]. 将人源N-甲基嘌呤DNA 糖基化酶变体hMPGv3 融合在rBE49b 的C 端在水稻中成功实现了A-to-G/T/C 且主要为A-to-G/T 的编辑,证实了ABE 系统与DNA 糖基化酶融合实现稳定的pAKBE 的可行性[9],但仍需提升编辑效率和挖掘更多可用的糖基化酶. 本研究对鼠源mAAG 突变体蛋白、人源hMPGv3 衍生突变体以及水稻内源OsMPG 在水稻A-to-T/C 编辑中的能力进行了详细评估,这将有助于进一步开发新类型pAKBE,为提升植物pAKBE 的编辑效率、扩展编辑类型奠定基础. 本文成功证实了上述3 类MPG 蛋白及其突变体蛋白在水稻中的A-to-G/T编辑活性. 鼠源mAAG 进行多位点突变所得到的碱基编辑器均能实现A-to-G/T 的编辑,其中mAAGv3-EF 的编辑能力最稳定. 但与动物细胞中的编辑类型不同,这些编辑器并未得到A-to-C类型的阳性植株,这可能与动植物细胞自身的DNA 修复机理差异有关. 在hMPGv3 变体基础上加入R145E 和Y159F 突变并进行实验验证的结果表明加入新突变位点的hMPG 也可实现A-to-G/T/C 的编辑且A-to-T/C 颠换编辑的能力优于mAAG,但未对A-to-T/C 的编辑效率起到明显提升作用. 这可能是因为两种来源的蛋白具有不同的构象,而R145 与Y159 不处于hMPG 的糖基化酶活性位点所导致的.
hUNG 和OsUNG 均可用于植物C-to-G 碱基编辑,并且C-to-G 编辑效率得到提升[4-6],在水稻pAKBE 建立过程中,对多个靶点的突变类型分析可以得出人源和鼠源MPG 变体(在人类细胞中均展现出较高的A-to-T/C 编辑效率)介导的腺嘌呤碱基颠换编辑并未成为主要编辑事件,可能是由于在水稻中人源和鼠源MPG 突变体糖基化酶活性不足,抑制了AP 位点的形成和BER 修复途径.通过序列比对、密码子优化得到的OsMPG 及进一步突变得到的OsMPG-S 成功在水稻中显示A-to-T/C 编辑活性,证明了通过优化OsMPG 蛋白来提升编辑能力的可行性. 此外,Li 等[17]研究发现水稻OsMPG 及其突变体OsMPG-G162R/N168S 架构的pAKBE 也能实现水稻中的A-to-T/C 编辑活性. 因此,对OsMPG 蛋白结构域进行深度学习预测或者饱和进化筛选,可能成为未来改造和提升水稻内源OsMPG 编辑活性的研究方向. 同时,深入优化hMPG 和mAAG 在植物中的糖基化酶活性,以及BER 通路相关基因的加入,也有助于开发提升植物中碱基颠换效率的pAKBE,提升碱基编辑介导的植物遗传改良进程.
与CGBE 在哺乳动物B 细胞中产生的副产物类似,本实验中也检测到了indel. 其中缺失突变主要发生在碱基突变位点和Cas9 切割位点或者两者之间,而插入突变大多为临近碱基重复序列的插入,据分析这可能与AP 位点形成后Polλ 和Polθ 在DNA 修复过程中所发挥的作用有关[18]. 未来可尝试将AP 位点保护蛋白HMCES 优化突变体与碱基编辑器融合来减少副产物,促进植物腺嘌呤碱基颠换编辑.
综上所述,本研究开发了一系列水稻腺嘌呤碱基颠换编辑工具(表5),揭示了鼠源mAAG 突变体和水稻内源OsMPG 及其突变体架构的水稻腺嘌呤碱基颠换编辑器可有效实现A-to-T/C 编辑,为植物腺嘌呤碱基颠换编辑技术的优化提供了更多底盘糖基化酶.
