根肿菌效应蛋白PBRA_000499功能研究
2025-02-10付钰吴明婷徐姊玥王茂林


关键词: 芸薹属根肿菌; 效应蛋白; 植物免疫
1 引言
芸薹属根肿菌(Plasmodiophora brassicae)引发的根肿病(clubroot disease)是一种对十字花科作物极具破坏性的土传性疾病[1],严重影响十字花科经济作物的产量和质量. 在极端年份,平均产量损失为20%~30%,田间损失甚至超过60%[2]. 随着现代农业活动的扩大,油菜及十字花科蔬菜根肿病的发病面积正迅速增加,在四川、湖北、云南、安徽等省份尤为严重[3]. 根肿菌的休眠孢子可在土壤中存留20 年仍然具有侵染能力[4],且根肿菌具有复杂的生理小种分化[5],现有的防治措施或效果欠佳,或成本过高,寻找新的、更有效的抗病基因并培育广谱抗性品种是现阶段根肿病防治的重要任务[6],因此更需深入了解根肿菌致病机理及其与宿主植物互作的关系[7].
在植物与病原菌长期的“ 军备竞赛”中,病原菌会在侵染期间分泌多种不同类型的效应分子,包括效应蛋白、小RNA、植物激素及其衍生物等进入宿主细胞的不同亚细胞区室以干扰各种生物学过程. 如大豆疫霉菌和大丽轮枝菌分泌的效应蛋白PsIsc1 和VdIsc1 可以水解水杨酸前体异支分酸,抑制宿主体内水杨酸介导的先天免疫反应[8].番茄叶霉菌分泌的效应蛋白Avr4 可以与真菌细胞壁中的几丁质结合,保护病原菌的细胞壁不被植物几丁质酶的水解,从而增强了病原菌的致病能力[9, 10]. 黄单胞菌的效应蛋白XopJ 靶向宿主细胞高尔基体并抑制胼胝质沉积[11]. 小麦条锈菌分泌的效应蛋白PgtSR1 改变了参与寄主防御过程的sRNA 丰度,促进对多种病原体的易感性,并抑制了部分抗性基因介导的多种防御反应[12]. 黑粉病菌侵染玉米时,通过分泌Rsp3 效应蛋白与菌丝细胞壁结合,保护菌丝不被玉米抗真菌蛋白AFP1 和AFP2 破坏,进而抵消植物的防御反应[13]. 因此,探究根肿菌分泌蛋白与宿主互作的分子机制是了解根肿菌的一个重要层面,同时也为挖掘根肿病抗病基因和培育广谱抗性品种夯实理论基础[14]. 目前关于根肿菌效应蛋白的鉴定仅有少量报道,PbBSMT 是目前研究较为深入的根肿菌效应蛋白. PbBSMT 是一种甲基转移酶,可以将宿主体内的SA 转化为更易挥发的MeSA,从而降低宿主防御能力,帮助根肿菌入侵和定殖[15]. 另一方面,PbBSMT 也可能消除几丁质诱导的植物防御反应[16]. 除此之外,SSPbP53 [17, 18]、PbZF1[19]、Pb‑ChiB4 和PbChiB2[20]等效应蛋白也被证实对根肿菌发挥致病能力至关重要.
PBRA_000499 是前期鉴定的一种具有分泌功能的根肿菌蛋白,有研究发现PBRA_000499 包含RING 型结构域,具有E3 泛素连接酶活性[21, 22]. 为了进一步探究PBRA_000499 的功能,本研究采用烟草瞬时表达系统验证其在植物免疫系统中的作用,并将PBRA_000499 在拟南芥中稳定表达,探究其在根肿菌侵染过程中发挥的作用. 以期在根肿菌与寄主的互作关系中提供新的见解,为根肿菌的致病机理研究和十字花科病害防治提供一定的理论依据.
2 材料与方法
2. 1 实验材料
根肿菌:采集于四川省广汉市西高镇,根据SCD(Sinitic clubroot differential)分类系统鉴定为Pb3[23],于-20 ℃保存备用.
植物材料:拟南芥哥伦比亚型(Arabidopsisthaliana,Col-0)和烟草(Nicotiana benthamiana)由本实验室提供.
2. 2 实验方法
2. 2. 1 RNA 提取及重组载体构建 取保存的感病植株的肿根,用无菌水清洗后置于液氮中研磨成粉,用KK 超快植物总RNA 提取试剂盒(庄盟生物)按照说明书提取RNA. 使用TransScript® One-Step gDNA Removal and cDNA Synthesis Super‑Mix 试剂盒(全式金)按照说明书进行反转录合成cDNA,所得产物于-20 ℃保存备用.
以根肿菌cDNA 为模板,扩增得到PBRA-000499 和PBRA_000499△ sp 基因片段,根据不同载体的酶切位点设计引物(表1),分别构建pGR107-PBRA_000499△ sp、PBI221-PBRA_000499-eGFP、pFGC5941-PBRA_000499-FLAG 重组载体;挑取阳性克隆提取质粒送测序,于-20 ℃保存测序正确的质粒备用.
2. 2. 2 PBRA_000499 烟草瞬时表达 将重组质粒pGR107-PBRA_000499△ sp 转化到农杆菌感受态GV3101 中,经培养后挑取阳性克隆,继续扩大培养. 8000 r/min 离心5 min 收集菌体,用提前配制好的细胞重悬液(10 mmol/L MgCl2,10 mmol/LMES,0. 15 mmol/L AS)重悬至OD600 为0. 8~1. 0,室温下黑暗处理2 h;使用1 mL 的注射器吸取菌液,用针头轻轻地在烟草叶片背面点一个小口,去掉针头后,从叶片伤口处将菌液注射到叶片中;将注射后的烟草移入黑暗环境中培养12 h,然后在正常光周期下培养2. 5~4 d;使用1 cm 的打孔器截取注射位置的烟草,浸泡在5 mL 的ddH2O 中,室温静置3 h ,测量电导率记为E1;100 ℃ 加热25 min,冷却至室温后再次测定电导率,记为E2;计算电解质渗漏率.
2. 2. 3 亚细胞定位 选取厚实且叶脉较少的叶片,蘸取少量金刚砂轻轻地揉搓烟草下表皮绒毛,将叶片切成1 mm 左右细条,均匀置于酶解液(1. 5% Cellulose R10,0. 4% Macerozyme R10,0. 4 mol/L Mannitol,20 mmol/L MES pH=5. 7,20 mmol/L KCl ,10 mmol/L CaCl2,0. 1% BSA)当中;黑暗条件下,30 ℃培养2 h 左右;挑出培养皿中的叶片残渣及杂质,缓慢轻柔地加入1 倍体积的预冷W5 溶液(10 mmol/L MES,125 mmol/LCaCl2,5 mmol/L KCl,154 mmol/L NaCl),使用200 目过滤网过滤溶液,并将滤液转移至50 mL 圆底EP 管中;200 r/min 离心3 min,缓慢吸取上清,加入等体积预冷的W5 溶液;冰浴1 h;200 r/min 离心2 min,吸去上清,沿管壁缓慢加入2 mL MMG溶液(0. 4 mmol/L MES,400 mmol/L Mannitol,15 mmol/L MgCl2)后轻轻混匀;吸取30 μL 质粒PBI221-PBRA_000499-eGFP、PBI221-eGFP( 阳性对照),加至2 mL 无菌EP 管中,分别向其中加入200 μL 原生质体和230 μL 40% PEG4000 溶液,迅速轻柔混匀,室温条件下转化20 min;加入920 μL 已预冷的W5 溶液;200 r/min 离心2 min,吸去上清,沿管壁加入1 mL预冷的W(I 500 mmol/LMannitol,20 mmol/L KCl,0. 4 mmol/L MES)溶液,重悬原生质体;将EP 管水平放置,25 ℃黑暗培养16~18 h;200 r/min 离心2 min,缓慢吸去上清,用预冷的W5 溶液清洗2 次,留存100 μL 原生质体;吸取10 μL 原生质体制作临时玻片,在正置荧光显微镜下观察原生质体.
2. 2. 4 拟南芥的培养及遗传转化 将重组质粒pFGC5941-PBRA_000499-FLAG 转化到农杆菌GV3101 感受态细胞中,挑取阳性克隆进行PCR 鉴定,将正确的单克隆接种至含有Kan 和Rif 的LB液体培养基中扩大培养,至OD600 为0. 6;4500 g 离心5 min 收集菌体后,用1/2 MS 液体培养基重悬菌体沉淀后再次离心弃上清;用拟南芥花序浸染液(1/2 MS 培养基,5% 蔗糖,0. 03% Silwet L-77)稀释菌体,至OD600 为0. 8~1,黑暗处理0. 5~2 h;选取长势优良的植株,剪去角果,将花序浸没在浸染液中,30~50 s,覆膜保湿,黑暗培养24 h;每隔5~7 d 侵染1 次,重复3 次;收集成熟种子,即获得T0代种子;将T0代种子春化3 d 后撒播在土壤基质中,至长出2 片真叶后,早晚各喷洒1 次0. 05%Basta 溶液. 5~7 d 后可观察到非阳性株枯萎死亡,将阳性植株转移至新的土壤基质中继续培养.2~3 w 后取适量叶片组织提取RNA 后反转录得到cDNA,以其为模板进行PCR、RT-qPCR 检测,相关引物见表2. 使用2-△△Ct 法计算基因相对表达量,选取转录水平较高的3 个株系单株收取种子后扩繁,直至T3 代获得纯合稳定转化的株系.
2. 2. 5 拟南芥的根肿菌侵染 采集感病植株的根部组织,搅碎成匀浆状后过滤,3000 r/min 离心10 min 后弃去上清液;用50%(w/v)蔗糖溶液重悬菌体沉淀,3000 r/min 离心10 min 后弃去上清液;清洗沉淀3~5 次;用2% 的氯胺-T 溶液重悬沉淀,室温静置20 min 后加入抗生素(头孢噻肟钠、盐酸万古霉素和硫酸粘杆菌素,终浓度均为0. 1%),25 ℃静置过夜;3000 r/min 离心10 min,弃上清;洗涤菌体3~5 遍,加入少量无菌水,即得到休眠孢子悬浮液,利用血球计数板对稀释后的悬浮液测定浓度;种子春化3 d 萌发后,挑选大小相近的幼苗,单株移栽. 每株拟南芥根部注射1 mL 浓度为1×107 个/mL 的根肿菌休眠孢子悬浮液,同时设置对照组为根部注射1 mL ddH2O.
分别记录不同拟南芥材料接种根肿菌后7 d、14 d、21 d、28 d 的表型,同时记录接种后21 d 和28 d 的根部情况. 为了确保实验的准确性和可信度,每种拟南芥材料至少种植30 株,进行3 次重复试验;将不同材料置于同一个育苗托盘中培养,以减少由于培养条件不同造成的误差. 计算病情指数DI.
DI=100× Σ(发病等级数×各等级对应拟南芥株数)/(拟南芥总调查株数×最高发病等级数).
3 结果与分析
3. 1 PBRA_000499 影响植物细胞免疫响应
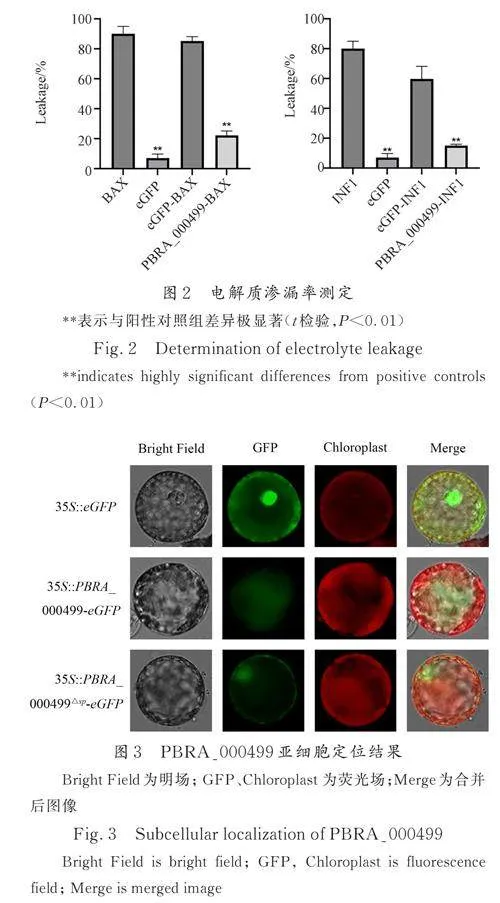
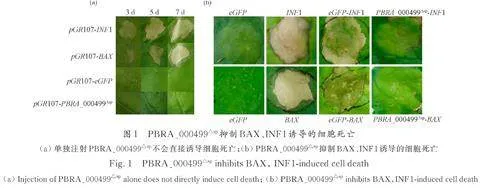
小鼠促凋亡因子BAX[24]、卵菌中的激发子INF1[25]诱导的细胞程序性死亡与植物防御相关的HR 相似. 因此,检测BAX、INF1 诱导的细胞死亡的抑制作用是评估病原菌效应物在抑制植物免疫方面的毒力功能的有效策略. 将构建好的pGR107-PBRA_000499△sp 融合表达载体转化农杆菌,注射本氏烟草进行瞬时表达,结果如图1a 所示. 注射PBRA_000499△sp 后并没有出现细胞死亡现象,即PBRA_000499 不会直接诱导细胞死亡.为了验证PBRA_000499 是否会抑制植物的免疫反应,在注射PBRA_000499△sp 12 h 后,在相同位置分别注射BAX 和INF1,并将单独注射eGFP、单独注射BAX 或INF1、注射eGFP 12 h 后相同位置再注射BAX 或INF1 作为对照,7 d 后观察并记录叶片注射点状态. 结果如图1b 所示,单独注射eGFP 后烟草叶片生长状态良好,而分别单独注射INF1、BAX、eGFP-INF1 或eGFP-BAX 的烟草叶片出现了明显的细胞坏死,而注射PBRA_000499△sp-BAX 和PBRA_000499△sp-INF1 的烟草叶片均未出现明显的细胞死亡现象. 在注射第7 d时对烟草叶片进行电解质渗漏率测定. 结果表明(图2),阴性对照和阳性对照存在极显著差异,注射PBRA_000499△sp-BAX 和PBRA_000499△sp-INF1 与eGFP-BAX 和eGFP-INF1 之间也存在极显著差异,这与烟草叶片上所呈现的表型一致.
3. 2 PBRA_000499 亚细胞定位
为了明确效应蛋白PBRA_000499 发挥功能的具体位置,对PBRA_000499 进行亚细胞定位分析. 将表达载体(pBI221-PBRA_000499-eGFP、pBI221-eGFP 载体)转化至当天制备的高质量烟草原生质体中,黑暗培养后通过正置荧光显微镜观察拍照,结果如图3 所示. 实验结果发现,PBRA_000499 在细胞质当中出现明显的荧光;结果表明PBRA_000499 是一个可以靶向植物细胞内发挥功能的效应蛋白.
3. 3 PBRA_000499 拟南芥稳定转化植株的获得
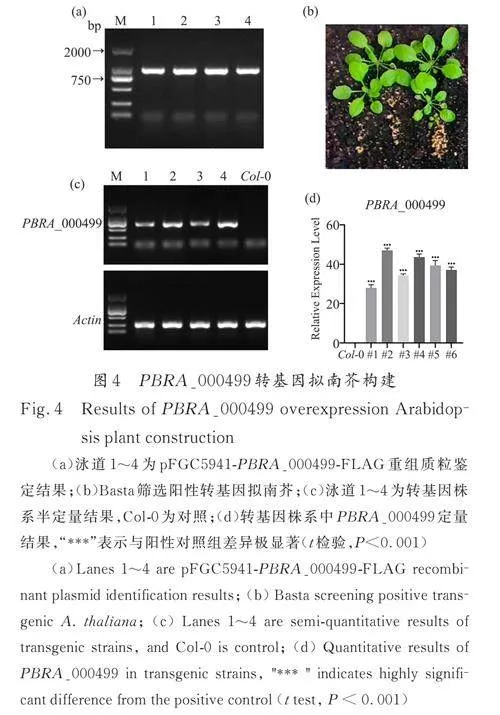
以根肿菌总RNA 反转录得到的cDNA 作为模板,扩增得到PBRA_000499 基因片段,利用双酶切技术,将目的基因导入pFGC5941 载体中. 使用35S 和ocs-R 引物鉴定重组质粒,凝胶电泳显示,在1077 bp 处有特异条带,与预测大小一致(图4a)
将测序结果正确的重组质粒转入农杆菌中,采用花序浸染的方式转入野生型拟南芥中. 收取种子后使用Basta 筛选阳性株系,即T0 代(图4b);通过半定量结果可以看出,相较于Col-0,PBRA_000499 过表达株系可以扩增得到PBRA_000499基因片段(图4c),说明成功构建PBRA_000499 转基因拟南芥株系;qPCR 检测了各稳定转化株系中PBRA_000499 基因的转录水平(图4d),选取表达量最高的3 个株系,扩繁至T3代并保存种子以便后续实验.
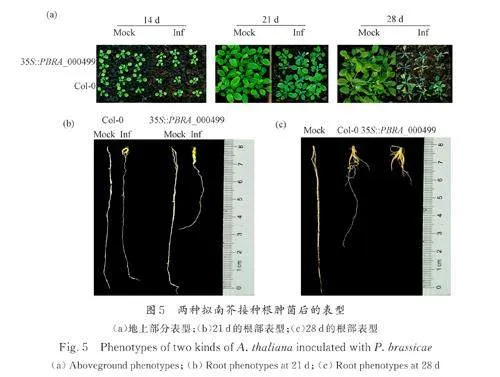
3. 4 PBRA_000499 基因加重拟南芥植株根肿病病情
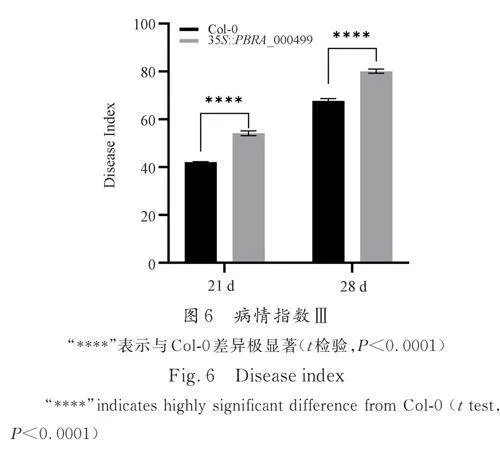
接种前14 d,PBRA_000499 转基因株系及Col-0 两种材料都能正常生长,且相互之间没有明显差异;接种21 d 时,Col-0 植株普遍矮小,呈现受胁迫表型,叶片发紫,且叶片边缘变黄,根部出现肿块. 35S ∷ PBRA_000499 相较于Col-0,植株更小且受胁迫程度更深,部分侧根腐烂,主根肿大.接种28 d 后,35S∷PBRA_000499 和Col-0 材料大多已经萎蔫,根部肿块变大;但35S ∷ PBRA-000499 情况更甚,地上部分基本枯萎死亡,地下根部侧根腐烂仅保留了肿大的主根,仅有少数植株保留一定量的侧根(图5a、5b). 根据表型记录计算21 d 和28 d 不同材料的病情指数,在两个时期与Col-0 相比,35S∷PBRA_000499 的病情指数较高(图6). 综合表型统计和病情指数结果来看,35S∷PBRA_000499 拟南芥对根肿病抗性较弱,更易感.
4 讨论
效应分子在病原菌与寄主互作的过程中发挥了重要功能. 生物营养型病原菌,如玉米黑粉菌、小麦条形柄锈菌等,分泌效应物抑制寄主免疫力,同时最大程度地减少对宿主细胞的损伤,以便病原菌可以在活细胞中繁殖[26, 27]. 死体营养型病原菌在大多数情况下分泌效应物诱导宿主细胞坏死,便于它们在死亡组织上增殖,例如灰霉菌和小麦叶斑病菌[26, 28]. 而像稻瘟病菌和禾谷镰孢菌这样的半生物营养型病原菌则采取多种功能效应子组合的方式,在生物营养阶段抑制寄主先天免疫,在坏死期引发非特异性细胞死亡[27, 28]. 关于病原菌效应物与寄主体内蛋白互作的研究越来越多,已经成为探究各类病原菌致病机制的一个重要方向. 因此,研究鉴定根肿菌的效应蛋白功能具有重要的科学意义. 本研究通过农杆菌介导的烟草瞬时表达系统发现PBRA_000499 可以抑制BAX、INF1 诱导的烟草细胞程序性死亡,表明PBRA_000499 可以抑制烟草的免疫反应,推测PBRA_000499 可能帮助BAX、INF1 逃避了植物的免疫监控,没有被植物的免疫系统识别,因此烟草叶片上并没有表现出细胞死亡症状.
病原菌效应子按其发挥功能所在的空间位置,分为质外体效应分子和胞内效应分子;细胞内效应物还通过与质膜上的不同细胞成分相互作用靶向植物免疫系统和代谢途径,细胞核,细胞质和细胞器,包括叶绿体和线粒体[29-31],干扰受体介导的防御信号传导和植物激素信号传导,改变基因转录和蛋白质稳定性,甚至调节RNA 干扰、降解和选择性剪接[32]. 大麦白粉病分泌蛋白CSEP0105作为一种胞质效应蛋白靶向胞质溶胶中的小热休克蛋白并抑制其伴侣活性以促进毒力[33]. 为了确定效应蛋白PBRA_000499 分泌进入宿主细胞后的作用位置进行了亚细胞定位分析,结果显示PBRA_000499 在细胞质中,所以PBRA_000499 可能是根肿菌分泌的一种胞质效应蛋白.
一部分效应蛋白可以发挥自身毒性功能,以不同的方式抑制寄主免疫反应,降低寄主的抗病性. 研究发现条锈菌分泌的PgtSR1 改变了参与寄主防御过程的sRNA 丰度,促进对多种病原体的易感性,并抑制了部分抗性基因介导的多种防御反应[12]. 条锈菌分泌的PstGSRE1 与ROS 相关转录因子TaLOL2 相互作用并干扰TaLOL2 的核定位,从而抑制了ROS 爆发和寄主的抗病能力[34].大豆疫霉菌分泌的Avr1b 可以抑制BAX 诱导的程序性细胞死亡,异源表达该效应子后寄主的抗病能力降低[35]. 此外,还有一类效应蛋白可以被寄主识别并激活免疫反应,这类效应蛋白也被称为无毒效应子,如曲霉中的酶活性RNase 效应子Zt6 诱导细胞死亡[36];大豆疫霉菌分泌的XEG1 触发寄主细胞死亡等防御反应[37],稻瘟病菌候选效应蛋白MoCDIE2 能诱导非寄主植物细胞死亡[38]. 我们构建了PBRA_000499 转基因拟南芥,观察根肿菌侵染后的表型,病情调查结果分析发现,35S ∷PBRA_000499 转基因拟南芥相比Col-0,感病程度更高. 根肿菌效应蛋白PBRA_000499 可能抑制了寄主的免疫反应,降低寄主的抗病能力.
综上所述,本研究认为PBRA_000499 可以作为根肿菌分泌的胞质效应蛋白,通过调节寄主免疫反应进而调控根肿病的发生. 但具体的调控机制还有待进一步研究,之后将利用酵母文库、双分子荧光互补、GST-pull down 等方法进筛选寄主植物中与PBRA_000499 互作蛋白,探究PBRA_000499 在根肿菌侵染和定殖过程中发挥的作用,进一步解析根肿菌的致病机制.
