FOXC1和SOX10预测三阴性乳腺癌术后复发转移的价值
2025-02-07翁四明熊建华孙晓伟

【摘要】 目的:探讨叉头框蛋白C1(forkhead box C1,FOXC1)和性别决定区盒基因10(SRY-related HMG-box gene 10,SOX10)对三阴性乳腺癌(triple-negative breast cancer,TNBC)术后复发转移的预测价值。方法:收集2019年1月—2020年12月在抚州市第一人民医院诊治的100例TNBC患者的石蜡组织标本,采用免疫组化法检测FOXC1和SOX10的表达。术后随访3年,记录复发转移情况。基于复发转移情况将患者划分为复发转移组31例和未复发转移组69例。对比两组患者的临床资料、FOXC1和SOX10的表达,并构建ROC曲线分析FOXC1和SOX10对TNBC患者术后复发转移的预测价值。结果:两组年龄、绝经状态、乳腺癌家族史和病理类型比较,差异均无统计学意义(Pgt;0.05),而两组临床分期、腋窝淋巴结转移及Ki-67水平比较,差异均有统计学意义(Plt;0.05)。复发转移组FOXC1和SOX10的阳性率均明显高于未复发转移组(Plt;0.05)。FOXC1和SOX10联合预测TNBC患者术后复发转移的AUC为0.816,敏感度为93.5%,特异度为69.6%。结论:FOXC1和SOX10的表达水平在TNBC术后复发转移患者中较高,且二者联合使用具有高度的预测效能,可以作为预测TNBC术后复发转移的有效生物标志物。
【关键词】 乳腺肿瘤 三阴型乳腺癌 叉头框蛋白 C1 性别决定区盒基因 10
The Value of FOXC1 and SOX10 in Predicting Postoperative Recurrence and Metastasis of Triple-Negative Breast Cancer/WENG Siming, XIONG Jianhua, SUN Xiaowei. //Medical Innovation of China, 2025, 22(01): 139-143
[Abstract] Objective: To explore the predictive value of forkhead box C1 (FOXC1) and SRY-related HMG-box gene 10 (SOX10) for postoperative recurrence and metastasis in patients with triple-negative breast cancer (TNBC). Method: Paraffin-embedded tissue samples from 100 TNBC patients treated in the First People's Hospital of Fuzhou from January 2019 to December 2020 were collected, and the expressions of FOXC1 and SOX10 were detected by immunohistochemistry. The patients were followed up for 3 years and the recurrence and metastasis were recorded. Based on recurrence and metastasis, the patients were divided into recurrence and metastasis group (31 cases) and non-recurrence and metastasis group (69 cases). Clinical data, FOXC1 and SOX10 expression were compared between the two groups, and ROC curve was constructed to analyze the predictive value of FOXC1 and SOX10 for postoperative recurrence and metastasis in patients with TNBC. Result: There were no significant differences between the two groups in terms of age, menopausal status, family history of breast cancer, and pathological type (Pgt;0.05), but there were significant differences in clinical stage, axillary lymph node metastasis and Ki-67 level between the two groups (Plt;0.05). The positive rates of FOXC1 and SOX10 were significantly higher than those in non-recurrence and metastasis group (Plt;0.05). The combined prediction of FOXC1 and SOX10 for postoperative recurrence and metastasis in TNBC patients showed an AUC of 0.816, with a sensitivity of 93.5% and specificity of 69.6%. Conclusion: The expression levels of FOXC1 and SOX10 were higher in patients with recurrence and metastasis after TNBC, and their combined use exhibits a high predictive efficiency, making them effective biomarkers for predicting postoperative recurrence and metastasis in TNBC.
[Key words] Breast tumor Triple-negative breast cancer Forkhead box C1 SRY-related HMG-box gene 10
First-author's address: Department of Thoracic Surgery, the First People's Hospital of Fuzhou, Fuzhou 344000, China
doi:10.3969/j.issn.1674-4985.2025.01.032
三阴性乳腺癌(TNBC)是乳腺癌的一种亚型,约占所有乳腺癌患者的15%,由于缺乏特异性的药物靶点,其治疗方案相对有限,且预后相对较差[1-2]。TNBC的复发和转移率高,一旦发生复发或转移,患者的生存率显著降低。因此,探索和发现能够有效预测TNBC复发和转移的生物标志物,对于改善TNBC患者的预后和指导临床治疗具有重要意义。在众多研究TNBC的分子标志物中,叉头框蛋白C1(forkhead box C1,FOXC1)和性别决定区盒基因10(SRY-related HMG-box gene 10,SOX10)引起了研究者的广泛关注。FOXC1是一种转录因子,参与调控细胞的生长、分化和迁移,近年来的研究表明,FOXC1在多种肿瘤中的表达与肿瘤的侵袭性、转移性和患者的预后密切相关[3]。SOX10作为一种高度保守的转录因子,主要参与神经嵴细胞的发育,同时在某些肿瘤的发生发展中也扮演着重要角色[4]。近期研究发现,SOX10在TNBC中的表达与患者的预后有关,提示其可能作为一种新的治疗靶点或预后指标[5-6]。尽管FOXC1和SOX10在其他肿瘤类型中的研究已有一定进展,但是它们在TNBC中的作用及其机制仍然不是完全清楚。此外,FOXC1和SOX10是否可以作为联合预测标志物,提高TNBC患者术后复发和转移的预测准确性,也是目前研究中尚未充分探讨的问题。本研究旨在通过分析FOXC1和SOX10在TNBC患者组织样本中的表达水平及其与疾病复发转移的关系,探讨这两种分子标志物作为预测TNBC术后复发和转移的潜在价值。
1 资料与方法
1.1 一般资料
收集2019年1月—2020年12月在抚州市第一人民医院诊治的100例TNBC患者的石蜡组织标本。纳入标准:(1)经手术病理组织学或穿刺活检确诊为TNBC。(2)未接受过任何形式的乳腺癌治疗,包括手术、放疗、化疗或内分泌治疗。(3)具备完整的临床数据和随访资料,包括但不限于病理报告、治疗记录和随访结果。排除标准:(1)同时患有其他类型的恶性肿瘤或过去5年内有其他恶性肿瘤的治疗史。(2)有严重的心脏病、肝病、肾病或其他重大器官功能不全,不适宜参与本研究。(3)孕妇或哺乳期妇女。(4)精神疾病或认知功能障碍。(5)参与了其他临床试验,或在研究开始前3个月内接受过任何实验性药物治疗。术后随访3年,基于复发转移情况将患者划分为复发转移组31例和未复发转移组69例。本研究已获本院医学伦理委员会的审查和批准。
1.2 方法
1.2.1 免疫组化 本研究采用的FOXC1和SOX10抗体分别是:Anti-FOXC1抗体(EPR20685),购自福州迈新生物科技有限公司;SOX10抗体(ZA-0642UM),购自北京中杉金桥生物技术有限公司。
实验步骤如下:(1)将石蜡包埋的TNBC组织切片进行脱蜡水化处理,以便于抗体的渗透。(2)进行抗原修复,通常采用高压或微波加热的方法,以恢复抗原的活性,提高抗体的结合能力。(3)将上述提到的Anti-FOXC1抗体按照1︰500稀释,SOX10抗体按照1︰200稀释。使用稀释后的抗体分别与组织切片孵育,通常在4 ℃下过夜孵育,以确保抗体与目标蛋白充分结合。(4)使用二次抗体进行孵育,通常选用带有荧光标记或者HRP(辣根过氧化物酶)标记的二次抗体,以便于信号的检测。(5)通过DAB(二氨基苯胺)染色或其他适合的染色方法,对结合于目标蛋白的抗体进行可视化。(6)使用核染料(如苏木精-伊红)对细胞核进行染色,以便于在显微镜下观察。(7)最后,通过显微镜分析肿瘤组织中的FOXC1和SOX10蛋白表达情况,均设阴阳性对照。根据本研究设定的标准,肿瘤细胞核染色强度≥1%的切片被认定为阳性表达。
1.2.2 随访 本研究的随访期为3年。随访计划详细如下:随访频次:术后第1年,患者每3个月进行一次随访;从第2年开始,随访频次调整为每6个月一次。随访内容包括但不限于临床检查、影像学检查(如乳腺X光、超声、CT扫描或MRI),以及血液检测(包括肿瘤标志物)。
复发转移的评估方法包括:(1)临床检查,通过触诊等方法检查原发部位及邻近淋巴结区域,寻找复发的迹象。(2)影像学检查,利用MRI、CT或PET-CT等影像学手段,检测体内是否存在复发或转移性病灶。(3)血液检测,定期检测血液中的肿瘤标志物水平,如CA15-3,以及其他相关生物标志物,作为复发或转移的间接证据。
术后复发转移的认定标准:(1)局部复发,在原乳腺癌切除部位或术后放疗区域内发现新的肿瘤生长。(2)远处转移,通过影像学检查或组织病理学证实,肿瘤细胞扩散到乳腺以外的其他器官,如骨骼、肝脏、肺部或脑部。
1.3 统计学处理
用SPSS 23.0分析数据,计量资料用(x±s)表示,比较用t检验;计数资料用例、率(%)表示,用字2检验。ROC曲线用SPSS 26.0软件作图。Plt;0.05表示差异有统计学意义。
2 结果
2.1 两组临床资料比较
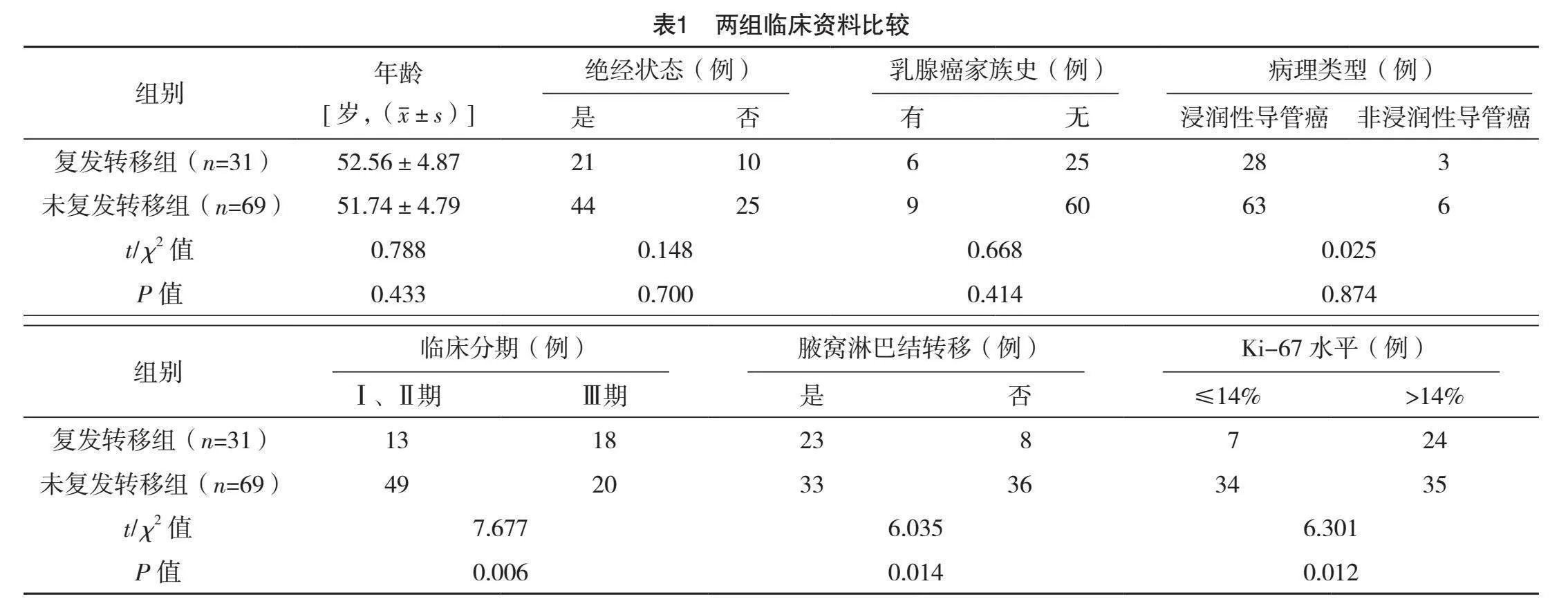
两组年龄、绝经状态、乳腺癌家族史和病理类型比较,差异均无统计学意义(Pgt;0.05),而临床分期、腋窝淋巴结转移及Ki-67水平比较,差异均有统计学意义(Plt;0.05),见表1。
2.2 两组FOXC1和SOX10的表达比较
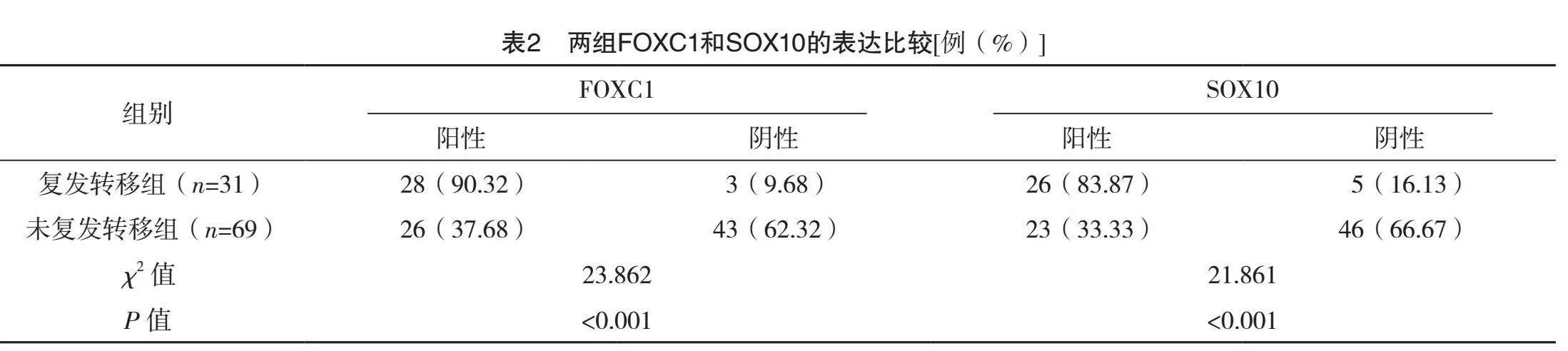
复发转移组FOXC1和SOX10的阳性率均明显高于未复发转移组(Plt;0.05),见表2。
2.3 FOXC1和SOX10的表达预测TNBC患者术后复发转移的ROC曲线
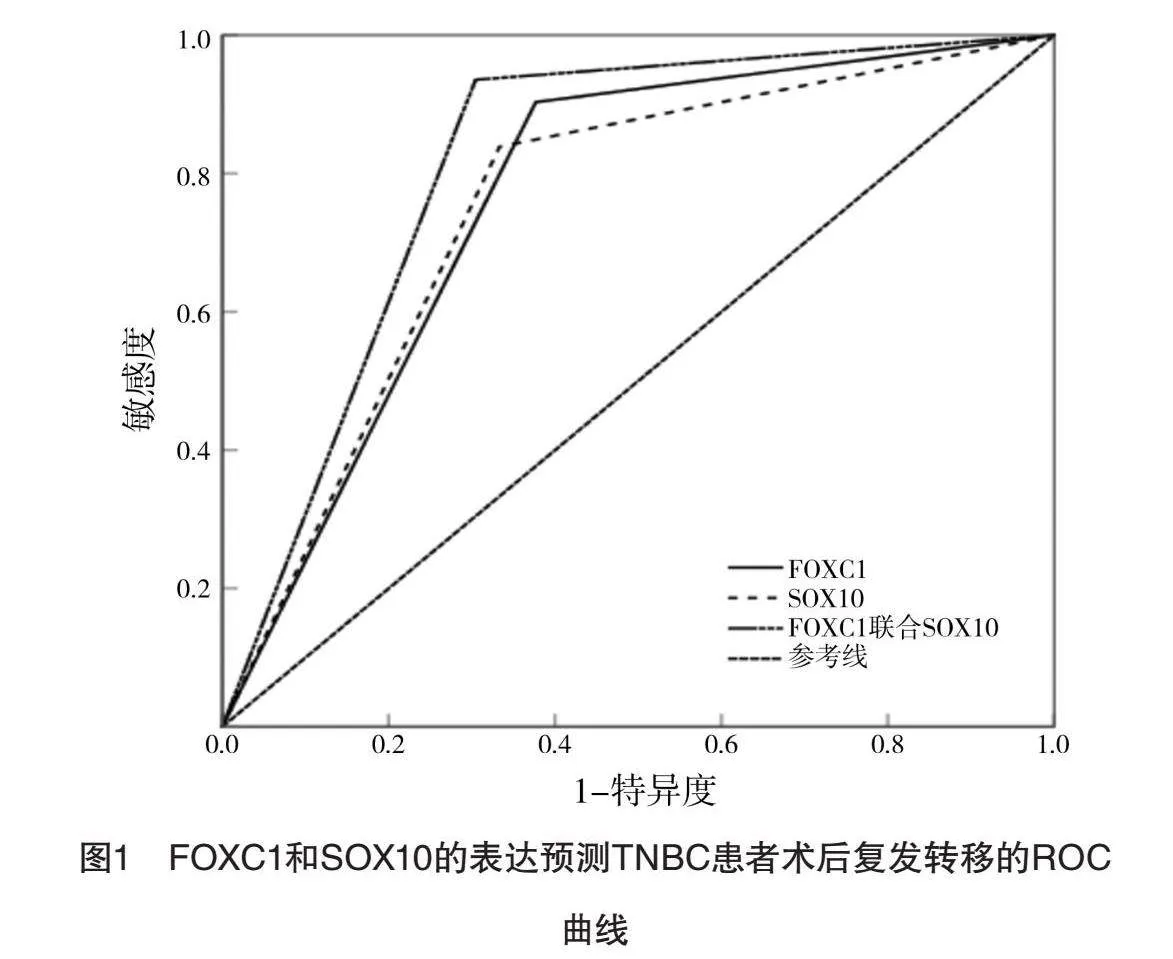
FOXC1和SOX10联合预测TNBC患者术后复发转移的AUC为0.816,敏感度为93.5%,特异度为69.6%,见表3和图1。
3 讨论
TNBC是一种特殊类型的乳腺癌,其特点是雌激素受体、孕激素受体和人表皮生长因子受体2的表达均为阴性。TNBC因其侵袭性高、预后差及治疗选择有限而受到广泛关注[7-9]。由于缺乏有效的靶向治疗方法,TNBC患者的治疗主要依赖于化疗,这在一定程度上限制了治疗效果的提升[10-12]。因此,寻找能够有效预测TNBC患者术后复发转移的生物标志物,对于指导临床治疗和改善患者预后具有重要意义。
FOXC1和SOX10是近年来在多种肿瘤中研究的热点。FOXC1是一种转录因子,参与调控细胞增殖、分化和迁移等多种生物学过程,已被发现在多种肿瘤中表达异常,与肿瘤的侵袭性、转移性和患者预后紧密相关[13-14]。SOX10作为一种神经嵴细胞发育的关键转录因子,在黑色素瘤、神经胶质瘤等肿瘤的发生发展中也扮演着重要角色[15-16]。在TNBC中,FOXC1和SOX10的表达与患者的预后密切相关[17-19],但其具体机制和作用尚需进一步研究。国内外关于FOXC1和SOX10在TNBC中作用的研究日益增多,但目前对其在TNBC术后复发转移中的预测价值的研究还相对有限。现有研究多集中在这两种蛋白的表达水平与TNBC患者临床特征及预后之间的关系,而对其如何影响TNBC患者复发转移的分子机制探讨不足。
本研究发现,复发转移组与未复发转移组在年龄、绝经状态、乳腺癌家族史及病理类型方面的差异无统计学意义,这表明这些基线特征在本研究中对于复发转移的预测不具有显著影响。然而,两组临床分期、腋窝淋巴结转移及Ki-67水平比较差异均有统计学意义,该结果表明临床分期、腋窝淋巴结转移及Ki-67水平与TNBC的复发转移密切相关。因此,较高的临床分期、腋窝淋巴结转移及Ki-67水平可能与TNBC患者较高的复发转移风险相关联。这一发现与以往研究结果相似[20],进一步强调了这些临床参数在TNBC预后评估中的重要性。更值得注意的是,复发转移组中FOXC1和SOX10的阳性率均高于未复发转移组。这一结果表明,FOXC1和SOX10在TNBC复发转移过程中可能起到促进作用。此外,FOXC1和SOX10联合预测TNBC患者术后复发转移的AUC为0.816,敏感度达到93.5%,特异度为69.6%,显示出较高的预测效能。这一发现意味着,通过评估FOXC1和SOX10的表达水平,可以较为准确地预测TNBC患者术后复发转移的风险,从而为临床提供有力的指导。本研究首次展示了FOXC1和SOX10联合使用在预测TNBC患者术后复发转移中的高敏感度和特异度,提供了一种新的、有效的预测工具。这对于临床上精准识别高风险TNBC患者、制定个体化治疗方案、从而提高患者生存率和生活质量具有重要意义。
综上所述,本研究基于FOXC1和SOX10的表达情况,为TNBC患者术后复发转移的预测提供了新的生物学依据,为TNBC的治疗和预后评估提供了新的思路和方法。未来的研究应进一步探讨FOXC1和SOX10在TNBC中的作用机制,以及如何将这些发现转化为临床应用,以期为TNBC患者提供更有效的治疗策略和改善其预后。
参考文献
[1]王婷婷,赵一涵.CCR8+Tregs:三阴性乳腺癌潜在治疗靶点[J].河北医科大学学报,2022,43(10):1220-1223.
[2]张冬梅,翟翠静,冯向东,等.GATA3、SOX10及p16联合应用在三阴性乳腺癌诊断中的价值[J].中华医学杂志,2022,102(10):735-740.
[3]陈然,肖彬,管鑫,等.甲基化酶DNMT3B、叉头框蛋白C1与宫颈癌超声特征的相关性分析[J].河北医科大学学报,2023,44(9):1093-1098.
[4]蹇婕,杨峤,李旭梅,等.SOX10在三阴性基底样型乳腺癌诊断中的临床价值[J].西部医学,2023,35(2):167-171.
[5] SEJBEN A,VÖRÖS A,GOLAN A,et al.The added value of SOX10 immunohistochemistry to other breast markers in identifying cytokeratin 5-positive triple negative breast cancers as of mammary origin[J].Pathobiology,2021,88(3):228-233.
[6] RAMMAL R,GOEL K,ELISHAEV E,et al.The utility of SOX10 immunohistochemical staining in breast pathology:staining of myoepithelial cells,distinction of atypical ductal hyperplasia from usual ductal hyperplasia,and confirming breast origin in triple-negative breast cancer[J].American Journal of Clinical Pathology,2022,158(5):616-625.
[7] LIU Q,SUN H,LIU Y,et al.HTR1A inhibits the progression of triple-negative breast cancer via TGF-β canonical and noncanonical pathways[J].Advanced Science,2022,9(12):2105672.
[8] YIN L,DUAN J J,BIAN X W,et al.Triple-negative breast cancer molecular subtyping and treatment progress[J].Breast Cancer Research,2020,22(1):1-13.
[9] GECK R C,FOLEY J R,STEWART T M,et al.Inhibition of the polyamine synthesis enzyme ornithine decarboxylase sensitizes triple-negative breast cancer cells to cytotoxic chemotherapy[J].Journal of Biological Chemistry,2020,295(19):6263-6277.
[10] GIANNI L,HUANG C S,EGLE D,et al.Pathologic complete response (pCR) to neoadjuvant treatment with or without Atezolizumab in triple-negative,early high-risk and locally advanced breast cancer:NeoTRIP Michelangelo randomized study[J].Annals of Oncology,2022,33(5):534-543.
[11] VAGIA E,MAHALINGAM D,CRISTOFANILLI M.The landscape of targeted therapies in TNBC[J].Cancers,2020,12(4):916.
[12] CHAUDHARY L N.Early stage triple negative breast cancer:management and future directions[J].Semin Oncol,2020,47(4):201-208.
[13] JIANG J,LI J F,YAO W W,et al.FOXC1 negatively regulates DKK1 expression to promote gastric cancer cell proliferation through activation of Wnt signaling pathway[J].Frontiers in Cell and Developmental Biology,2021,9:662624.
[14] SUN Y A,LIN C,DING Q H,et al.Overexpression of FOXC1 promotes tumor metastasis by activating the Wnt/β-catenin signaling pathway in gastric cancer[J].Digestive Diseases and Sciences,2022,67(8):3742-3752.
[15] WU Y H,FLETCHER M,GU Z G,et al.Glioblastoma epigenome profiling identifies SOX10 as a master regulator of molecular tumour subtype[J].Nature Communications,2020,11(1):6434.
[16] AMIRI R,TAFVIZI F,GHANADAN A.Comparison of SOX10 gene expression in melanoma and melanocytic nevus samples using real-time PCR and immunohistochemistry[J].Gene Reports,2020,21:100848.
[17] TANG L,JIN J,XU K,et al.SOX9 interacts with FOXC1 to activate MYC and regulate CDK7 inhibitor sensitivity in triple-negative breast cancer[J].Oncogenesis,2020,9(5):47.
[18] JIN L F,QIN C L,QI X W,et al.Clinicopathological significance of Sox10 expression in triple-negative breast carcinoma[J].Translational Cancer Research,2020,9(9):5603-5613.
[19] ZHENG X J,LI W,YI J,et al.EZH2 regulates expression of FOXC1 by mediating H3K27me3 in breast cancers[J].Acta Pharmacologica Sinica,2021,42(7):1171-1179.
[20] ÇAKIR M,YILDIRIM D,AKTÜRK O M,et al.Impact of status of ER,PR,HER2 and Ki-67 index on axillary lymph node metastasis of breast cancer[J].Archives of Clinical and Experimental Medicine,2020,5(2):48-51.
(收稿日期:2024-04-23) (本文编辑:田婧)
