一株小菇属天麻萌发菌原生质体的制备、再生和应用
2025-01-25李宏敬李锡琴粟忠祥仇全雷雷云霆








摘 要:小菇属真菌(Mycena spp.)遗传转化体系是研究其促进天麻种子萌发机制的重要基础,而其原生质体的制备和再生是该体系构建的必要条件.以小菇菌株MY004为实验材料,通过单因素分析和正交试验策略,探究其原生质体制备和再生的影响因素,构建小菇原生质体制备和再生体系.结果表明,在含10 mM MES和0.7 M甘露醇的酶解缓冲液(pH=6)中,小菇MY004菌丝被10 mg/mL真菌溶壁酶在24 ℃条件下酶解3 h,其原生质体的释放率较高;经液体再生培养基(pH=5)培养3天,其原生质体再生效率可达2%.利用该体系,高效地完成了含报告基因eGFP转基因小菇的菌株纯化.小菇原生质体制备和再生体系可用于小菇遗传转化体系的快速构建,也将为小菇与天麻互作分子机制的研究提供基础平台.
关键词:小菇; 原生质体制备; 原生质体再生; 转基因菌株纯化
中图分类号:S567.23+9; TS201.3
文献标志码: A
Protoplast preparation, regeneration, and their application of a Mycenastrain" for promoting the seed germination of Gastrodia elata
LI Hong-jing1,2, LI Xi-qin3, SU Zhong-xiang2, QIU Quan-lei4, LEI Yun-ting2*
(1.College of Forestry, Southwest Forestry University, Kunming 650224, China; 2.Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China; 3.Xishan Forest Farm, Kunming Forestry and Grass Bureau, Kunming 650199, China; 4.Tibet Bomi Plateau Tibetan Gastrodia Industry Development Co., Ltd., Linzhi 860318, China)
Abstract:The genetic transformation system of Mycena species is crucial for investigating the molecular mechanism for studying the molecular mechanism behind the fungi′s promotion of seed germination in Gastrodia elata.To establish this system in Mycena spp.,it is essential to prepare and regenerate protoplasts.Single-factor analysis and multifactor orthogonal test were employed to investigate the effects of protoplast preparation and regeneration on developing an optimal protoplast preparation and regeneration system in the Mycena strain MY004.The results exhibited that treating MY004 mycelia with 10 mg/mL lywallzyme in an enzymatic buffer (pH=6) containing 10 mM MES and 0.7 M mannitol at 24 ℃ for 3 hours resulted in a higher rate of protoplast release.The protoplasts were then cultured in liquid regeneration medium at a pH of 5 for three days,resulting in a remarkable regeneration efficiency of up to 2%.Furthermore,this system was utilized to efficiently purify a transgenic strain containing the reporter gene eGFP (enhanced green fluorescent protein) in the Mycena strain MY004.The protoplast preparation and regeneration system can be used to rapidly establish the genetic transformation system in the Mycena strain MY004,and it provides a basic platform for studying the molecular mechanism of the interaction between Mycena and G.elata.
Key words:Mycena;" protoplast preparation; protoplast regeneration; purification of transgenic" strain
0 引言
天麻(Gastrodia elata)是兰科(Orchidaceae)天麻属(Gastrodia)植物,入药史已逾2000余年,主治头痛眩晕、半身不遂、小儿惊风等病症,近代药理实验也证明其具有止眩晕、抗惊厥、镇静等功效[1].天麻的种子仅由胚及种皮构成,无胚乳及其他营养储备,所含营养物质较少,难以满足种子萌发的需求[2].早期的观点认为,蜜环菌可以促进天麻种子的萌发,但后期的研究结果证明蜜环菌抑制天麻种子的萌发[3].研究人员相继从天麻中分离出一些小菇属真菌(Mycena spp.),如紫萁小菇(Mycena osmundicola)[4]、石斛小菇(Mycena deindrobii)[5]及兰小菇(Mycena orchidicola)[6]等,并通过种子萌发实验证明这些小菇属真菌能促进天麻种子的萌发.一些研究利用转录组[7]和蛋白组学[8]技术对小菇属真菌与天麻的互作机制进行了初步探讨,但其促进天麻种子萌发的分子机制仍然不清晰.小菇属真菌遗传转化体系的构建是真菌促进天麻种子萌发机制研究的重要前提和基础平台.目前,原生质体和根癌农杆菌介导法是真菌遗传转化的主要策略[9].因此,对于促进天麻种子萌发的小菇属真菌而言,其原生质体的制备和再生是小菇属真菌进行遗传转化的重要前提.
原生质体具有完成的质膜和基因组,是一个具有生理功能的单位[10],可摄取外源大分子,具有极强的再生能力,是真菌遗传转化、体细胞杂交、基因功能等研究的重要工具[11].目前,主要通过酶解法制备真菌原生质体,但其制备、再生及转化的效率仍然受诸多因素的影响[12],包括真菌的物种、菌龄、细胞壁结构、菌丝活力、代谢水平及细胞壁裂解酶种类等.因此,在制备不同真菌原生质体时,其制备条件需要进行优化.
在本研究中,从天麻种子中分离了一株天麻伴生真菌菌株MY004,通过ITS(Internal Transcribed Space)片段的PCR扩增和测序,鉴定为小菇属真菌,并通过种子萌发实验验证其能促进天麻种子的萌发.参照一些担子菌原生质体的制备方法,本研究对小菇MY004的原生质体制备和再生条件进行摸索和优化,并利用原生质法对农杆菌介导的转基因小菇进行了菌株纯化.
1 材料与方法
1.1 实验材料
实验所用真菌菌株分离自中国云南昭通彝良县小草坝的野生天麻,菌株编号为MY004.真菌溶壁酶(lywallzyme,广东省微生物研究所)是一种裂解真菌细胞壁的复合型水解酶,来源于长梗木霉(Trichoderma longibrachiatum).
硫酸镁(MgSO4)、甘露醇(mannitol)、吗啉乙磺酸(2-morpholinoethanesulfonic acid,MES)、蔗糖(sucrose)、山梨醇(sorbitol)、磷酸二氢钾(KH2PO4)、氢氧化钾(KOH)、琼脂粉(agar)、葡萄糖(glucose)、蛋白胨(peptone)、酵母提取物(yeast extract)、色氨酸(tryptophan)、TTC(2,3,5-氯化三苯基四氮唑)等试剂均为国产分析纯.
1.2 实验方法
1.2.1 培养基的配制
(1)mPDA固体培养基:由PDA(potato dextrose agar)培养基修改而来,包含马铃薯汁60 mL (将马铃薯去皮,切块后取200 g煮汁,纱布过滤,收集滤液300 mL)、麸皮汁20 mL (称取麸皮100 g煮汁,纱布过滤,收集滤液500 mL)、木屑汁50 mL (称取木屑100 g煮汁,纱布过滤,收集滤液500 mL)、葡萄糖4 g、琼脂粉2 g、KH2PO4 0.4 g、 MgSO4 0.2 g,最后补水至200 mL.
(2)发酵培养基:葡萄糖1%、蔗糖2%、蛋白胨1%、KH2PO4 0.3%、MgSO4 0.15%.
(3)1号液体再生培养基(RM1):葡萄糖1%,蔗糖2%,蛋白胨1%,硫酸镁0.15%,磷酸二氢钾0.3%,甘露醇0.7 M.
(4)2号液体再生培养基(RM2):麦芽糖1%,葡萄糖0.4%,酵母提取物0.4%,甘露醇0.7 M.
(5)3号液体再生培养基(RM3):酵母提取物0.35%,色氨酸0.5%,蔗糖2%,甘露醇0.7 M.
(6)4号液体再生培养基(RM4):土豆汁65 mL,磷酸二氢钾0.2%,硫酸镁0.1%,葡萄糖1%,蛋白胨1%,甘露醇0.7 M.
以上培养基经过121 ℃灭菌20 min,备用.
1.2.2 缓冲液和酶解液的配制
(1)MES缓冲液:称量0.426 5 g的MES粉末,加入15 mL ddH2O进行溶解,然后用KOH(5 M)调节pH到6,定容至20 mL,制成100 mM的MES溶液,备用.
(2)甘露醇缓冲液:称量2.914 g甘露醇粉末,加入2 mL的MES溶液(100 mM),定容到20 mL,制成含浓度为0.8 M甘露醇的缓冲液,121 ℃灭菌20 min,备用.
(3)酶解液:称取7.5 mg真菌溶壁酶于2 mL离心管,加1 mL甘露醇缓冲液,溶解后,使用0.22 μm滤膜进行过滤除菌,终浓度为15 mg/mL,现配现用.
1.2.3 真菌菌株的鉴定和促天麻种子萌发实验
从昭通野生天麻中分离了一株伴生真菌菌株,菌株编号为MY004.在mPDA培养基上培养2周后,取小菇MY004菌丝并使用CTAB法[13]提取DNA.使用小菇属真菌ITS通用引物[14]进行PCR克隆,然后送样测序(生工生物工程股份有限公司).
对于采收的乌天麻种子,采用TTC染色法[15]检测其活性.在仅含琼脂的培养基上分别铺上无菌青冈叶(不接种小菇MY004,对照组)和青冈菌叶(接种小菇MY004,实验组),然后将活性较好的天麻种子分别铺撒到实验组和对照组青冈叶表面,23 ℃条件下避光培养.培养3周后,在显微镜下观测对照组和实验组中天麻种子的萌发情况.
1.2.4 单因素对小菇原生质体制备的影响
从mPDA固体培养基上收集生长旺盛的小菇MY004菌丝,转入组织破碎管,加入无菌钢珠(5 mm),使用组织破碎仪破碎(35 Hz),并向管内加入发酵培养基.培养一段时间后,离心(12 000 rpm)收集菌丝,用甘露醇缓冲液重悬菌丝,离心(12 000 rpm)收集菌丝,最终菌丝的鲜重为2.5 mg.加入500 μL真菌溶壁酶的酶解液,在合适的温度下酶解小菇MY004菌丝,每半时轻混一次,并利用血球计数板观察原生质体的释放情况.菌丝基本裂解完成后,使用25 μm滤膜过滤除去破碎的菌丝,常温离心(4 000 rpm)滤液收集原生质体,加入500 μL酶解液进行原生质体重悬,使用计数板进行显微计数,计算小菇MY004菌丝原生质体的得率.
参考其他担子菌原生质体的制备方法[16-19],主要选择了小菇MY004菌丝的菌龄、酶解缓冲剂类型和浓度、渗透压稳定剂的类型和浓度、真菌溶壁酶酶量、酶解温度和时间等因素来分析其对小菇原生质体制备的影响.
1.2.5 小菇原生质体制备条件的正交试验
选择影响小菇MY004原生质体制备的主要因素,包括甘露醇浓度、真菌溶壁酶酶量、酶解时间和酶解温度.利用SPSS软件设计了4因素3水平L9(34)的正交试验表,每个处理进行3次重复.
1.2.6 小菇原生质体再生条件的优化
将酶解获得的小菇MY004原生质体稀释到浓度为1×105 cells/mL的悬浮液,然后取200 μL原生质体悬浮液,常温离心(4 000 rpm)收集原生质体,分别加入液体再生培养基RM1-RM4,生长3天后,涂布在mPDA固体培养基上,在23 ℃条件下暗培养10天后,统计原生质体再生的单菌落数量.在此基础上,对影响原生质体再生的酶解时间和再生培养基pH值进行优化.
1.2.7 小菇原生质体的DAPI染色和显微观察
吸取8 μL原生质体溶液,滴加到载玻片,加入2 μL DAPI(4′,6-diamidino-2-phenylindole)溶液,盖上盖玻片.染色10 min后,在荧光显微镜(Leica DM5500 B)下进行原生质体的显微观察.
1.2.8 原生质体法纯化小菇转基因菌株
选择含潮霉素抗性基因HPT的小菇MY004转基因菌株pYT-eGFP(实验组,含报告基因eGFP)和pYT-EV(对照组),利用优化后的体系对该转基因菌株进行原生质体的制备和再生,并进行筛选培养(含50 μg/mL潮霉素)、PCR验证(pieGFP-F:GAGGTAAACGGCCACAAGTT;pieGFP-R:GGGTGTTCTGCTGGTAGTGG)和荧光显微观察.
1.2.9 统计分析
使用SPSS软件分析实验数据,采用在Plt;0.05水平上对原生质体产率和再生率的平均值进行单因素方差分析(One-Way ANOVA,Tukey′s多重比较检验),确认数据的差异显著性.
2 结果与讨论
2.1 小菇属真菌促进天麻种子的萌发
目前,促进天麻种子萌发的菌株主要属于小菇属真菌,如紫萁小菇(M.osmundieola)、兰小菇(M.orchidicola)、石斛小菇(M.dendrobii)、开唇兰小菇(M.anoectochili)[20].实验室从昭通野生天麻中分离了一株伴生真菌菌株,通过ITS序列的测序结果显示,其与小菇属真菌(Mycena spp.)相似度高达99%以上.因此,初步鉴定该菌株属于小菇属真菌,菌株编号为MY004.在23 ℃条件下,避光培养1周后,小菇MY004菌株可以在mPDA培养基上旺盛地生长(如图1(a)所示).
TTC染色后,大部分的乌天麻种子呈红色,表明这些天麻种子的活性较强(如图1(b)所示).在仅含琼脂培养基的平板上分别铺上无菌青冈树叶(对照组)和青冈菌叶(接种MY004菌株,实验组),然后将活性较好的乌天麻种子分别铺撒到是实验组和对照组青冈叶表面,23 ℃条件下避光培养3周.对照组天麻种子未萌发(如图1(c)所示);实验组天麻种子萌发为原球茎(如图1(d)所示),继续培养6周后,部分天麻种子已开始伸长和分枝,发育为营养繁殖茎(如图1(e)所示).天麻种子的萌发实验结果表明,小菇MY004可以促进天麻种子的萌发,其萌发率为63.45%.
2.2 真菌溶壁酶酶解小菇菌丝释放原生质体
细胞壁的裂解是真菌原生质体制备的关键步骤,但细胞壁的结构和成分在真菌不同种属间可能会存在差异[21],导致真菌原生质体制备条件也存在一定的差异.借鉴其他担子菌原生质体的制备条件,使用维素酶(cellulase RS)[22]、蜗牛酶(snailase)[23]、溶壁酶(lywallzyme)[24]等细胞壁的裂解酶来释放小菇MY004菌丝的原生质体,但效果并不理想.在紫褐小菇(M.alcalina)中,细胞壁裂解混合酶液(含driselase和lywallzyme)可以较好地裂解其菌丝[16].因此,本研究使用真菌溶壁酶(lywallzyme)裂解小菇MY004的菌丝.小菇MY004菌丝在真菌溶壁酶的作用下裂解,从菌丝中释放大小不一的原生质体细胞(如图2(a)所示).小菇MY004原生质体是直径小于20 μm的单核细胞(如图2(b)、(c)所示),该特性有利于提高菌丝的遗传转化效率.小菇MY004菌丝可以在真菌溶壁酶作用下释放原生质体,但其原生质体的产率较低,其原生质体制备条件尚需进一步优化.
2.3 小菇菌丝原生质体释放影响因素的分析
当pH值为6时,MY004原生质体在MES作为缓冲剂的酶解液中释放数量较多(如图3(a)所示).当MES缓冲液的浓度为10 mM时,MY004原生质体的释放数量较高,最高可达到1×107 cells/mL,但当MES缓冲液浓度超过10 mM时,反而抑制了小菇菌丝的原生质体释放(如图3(b)所示).
由于缺乏细胞壁保护,渗透压稳定剂对于维持原生质体的细胞形态至关重要[25].因此,本研究选择甘露醇(mannitol)、氯化钠(NaCl)、硫酸镁(MgSO4)、蔗糖(sucrose)和山梨醇(sorbitol)作为渗透压稳定剂进行了试验.在相同的条件下,相比于其他四种渗透压稳定剂,甘露醇能更好地维持小菇MY004原生质体的稳定,获得更多数量的原生质体细胞(如图3(c)所示).当渗透压稳定剂甘露醇的浓度为0.8 M时,MY004原生质体的产率最高,其细胞数量可达到5×106 cells/mL(如图3(d)所示);当甘露醇浓度高于0.8 M时,小菇MY004原生质体的产率呈下降趋势.
真菌菌丝的生理状态影响原生质体的制备,培养时间过长,其细胞壁较厚,导致酶解困难,难以形成均匀分散的原生质体细胞.而培养时间过短,则可有效利用菌丝量不足[19].但本研究发现小菇MY004的菌丝菌龄对原生质体产率的影响并不明显(如图4(a)所示).原因可能是实验所用MY004菌丝是挑选新生菌丝,转接到发酵培养基培养,在发酵培养基中菌丝能够保持较高的活力.
除渗透压稳定剂的浓度和真菌菌丝的生理状态之外,真菌溶壁酶的酶浓度、酶解温度以及酶解时间等因素也能影响原生质体的制备效率.当真菌溶壁酶的酶浓度为15 mg/mL时,小菇MY004菌丝释放的原生质体数量最多;当酶浓度继续增加,小菇MY004原生质体的产率呈下降趋势(如图4(b)所示).原因可能是酶浓度增加,酶解液渗透压增高,从而导致原生质体大量破裂.在酶解温度为24 ℃~26 ℃范围时,小菇MY004菌丝的原生质体产率较高,细胞数量可达到1.2×107 cells/mL;而超过28 ℃后,原生质体的产率呈下降趋势(如图4(c)所示),原因可能是温度影响酶的活性,温度升高,酶活性降低,原生质体的产率下降.原生质体的产率随着酶解时间的增加而增加,在酶解4 h后,小菇MY004菌丝释放的原生质体数量可达1×107 cells/mL(如图4(d)所示).
综上,酶解缓冲液的pH和浓度、渗透压稳定剂的类型和浓度、真菌溶壁酶浓度以及酶解温度和时间都可以影响小菇MY004菌丝的裂解效果及其原生质体的释放效率.
2.4 小菇原生质体制备条件的优化
根据单因素实验结果,在MES缓冲液浓度为10 mM、pH值为6时的条件下,甘露醇浓度、真菌溶壁酶浓度、酶解温度及酶解时间可以影响小菇MY004原生质体的产率.然而,这些因素可能存在相互促进或抑制的作用,影响原生质体的制备效率.因此,本研究选择了影响小菇MY004原生质体产率的4个主要影响因素及其相应的3个水平,采用正交试验法对小菇MY004原生质体的制备条件进行优化(如表1所示).
如表2所示,真菌溶壁酶酶量(R=5.728)和甘露醇浓度(R=4.722)是影响原生质体释放最重要的两个影响因素;在含0.7 M甘露醇和10 mg/mL真菌溶壁酶的酶解液中,24 ℃条件下酶解3 h,小菇MY004菌丝的原生质体产量可达到1.47×107 cells/mL.以NaCl和MgSO4为缓冲剂,1%的蜗牛酶于30 ℃酶解小菇属菌株MFJ-F1菌丝7 h后,其原生质体产率较高(11.17×106 cells/mL)[23];相似地,1.5%崩溃酶和2%真菌溶壁酶在28 ℃条件下酶解紫褐小菇菌丝4 h后,获得较多的原生质体(9.1×105 cells/mL)[16].相比之下,在更低的温度、更短的时间条件下,小菇MY004原生质体产率更高.
综上,通过分析小菇MY004原生质体制备的影响因素,并利用正交试验确定了原生质体制备的最优条件,原生质体产率较高,最高产量可达到107 cells/mL,足够用于原生质体的再生条件和小菇遗传转化体系的构建条件.
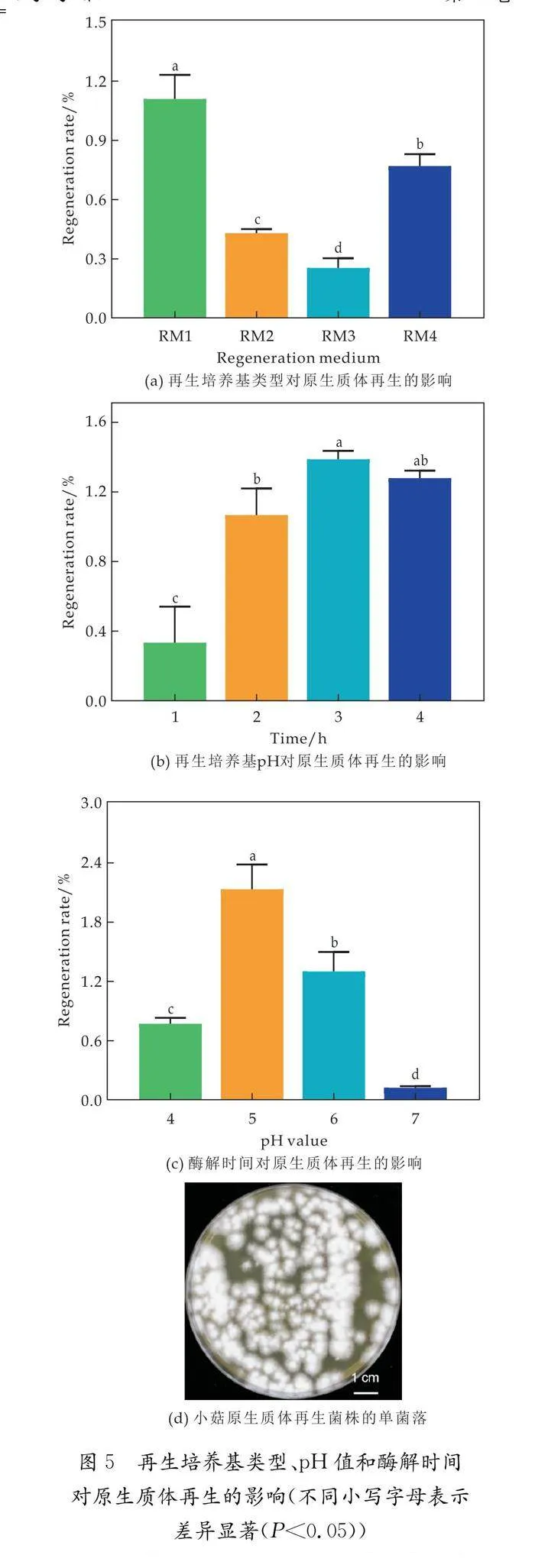
2.5 培养基类型、酶解时间和pH值影响小菇原生质体的再生
研究表明,培养基类型是影响真菌原生质体再生的主要因素[26].依据 Ning等[26]的研究,本研究选择了4种液体再生培养基比较其对小菇MY004原生质体再生的影响.取200 μL稀释后的小菇MY004原生质体(1×105 cells/mL),分别在4种液体再生培养基(RM1-RM4)中培养3天后,将其分别涂布在mPDA固体培养基上继续10天.在RM1中再生培养后,再生的小菇MY004单菌落数量较多(如图5(a)所示).由于缺乏细胞壁的保护,原生质体需要一定的渗透压来维持其细胞形态[27].在本研究中,液体再生培养基RM1中含有与酶解液相同的甘露醇浓度(0.7 M),能够更好地维持小菇原生质体的形态和活性.此外,在液体RM1中再生培养3天后,小菇原生质体大量复壁并出芽(菌丝),液体再生培养基可能更有利于其原生质体的再生.
研究表明,酶解时间会影响真菌原生质体的再生能力[28].虽然酶解4 h的小菇菌丝释放的原生质体数量最多(如图4(d)所示),但在酶解3 h后,小菇原生质体的再生率最高(如图5(b)所示),原因可能是长时间的酶解会降低原生质体再生率[17].
此外,再生培养基pH值也能影响真菌原生质体再生效率[24].将再生培养基RM1的pH值调整到5时,小菇MY004菌丝的原生质体再生率较高,最高可达2%左右(如图5(c)所示).相较于在pH值为6的草菇再生培养基中紫褐小菇原生质体的再生率为0.105%[16],本体系的再生率有所提高.在酶解3 h后,获得小菇MY004菌丝释放的原生质体细胞,并在pH为5的RM1培养基中进行再生,原生质体细胞数量为1×104 cells/板时,已获得较多的小菇再生菌株(如图5(d)所示).
综上,在小菇MY004菌丝酶解3 h后,通过再生培养基类型的筛选和液体再生培养基pH值的优化,提高了小菇MY004原生质体的再生率.
2.6 小菇原生质体制备和再生体系的应用
丝状真菌转基因菌株的纯化,一般策略是使用抗性培养基进行多代筛选[29].然而,转基因真菌中抗性蛋白能够跨细胞隔膜移动,一旦转基因菌株脱离筛选压,非转基因菌丝可能大量繁殖.
同样地,在小菇与天麻互作机制的研究中,转基因小菇菌株是在非筛选压的环境下进行生长,大量增殖的非转基因菌丝可能影响实验的结果.在早期研究中,本研究使用农杆菌介导法转化的小菇MY004菌株,在获得的转基因阳性菌株中,也存在大量的非转基因菌丝,但通过抗性筛选方法难以进一步纯化菌株.但是,小菇MY004菌株的菌丝和原生质体为单细胞核,该特性为原生质体法纯化小菇转基因菌株提供了较高的可行性基础.因此,本研究将转基因菌株进行原生质体的制备和再生,并进行检测和筛选.结果表明,对照组转基因菌株(pYT-EV)的所有菌丝和原生质体都未检测绿色荧光(如图6(a)所示).相反,实验组转基因菌株(pYT-eGFP)的部分菌丝和原生质体细胞能在488 nm激发光下检测到绿色荧光(如图 6(b)所示).
将对上述制备的原生质体在RM1中再生培养3天后,将其涂布到含50 μg/mL 潮霉素的筛选培养基上继续培养.在23 ℃条件下暗培养7天后,原生质体再生的单菌落菌株在筛选培养基上旺盛生长(如图7(a)所示).在这些原生质体再生获得的单菌落菌株中,可以扩增出报告基因eGFP的片段(如图7(b)所示),表明这些原生质体再生菌株至少是转基因阳性菌株.挑取再生菌株单菌落的菌丝在荧光显微镜下观测,对照组转基因菌株菌丝未检测绿色荧光(如图7(c)所示),而原生质体再生菌株中绝大多数菌丝呈绿色荧光(如图7(d)所示).实验结果表明,利用原生质体法能够纯化含报告基因eGFP的小菇转基因菌株,可以快速地获得其纯合的转基因菌株.
综上,将含报告基因eGFP的小菇转基因菌株制备成原生质体,并进行原生质体的再生、潮霉素筛选、PCR鉴定和显微观测,快速地获得小菇转基因的纯合菌株.因此,利用原生质体法可以纯化小菇的转基因菌株.
3 结论
本研究从天麻中分离出一株伴生真菌菌株MY004,鉴定为小菇属真菌.种子萌发实验证明,小菇MY004能够促进天麻种子的萌发.单因素分析结果显示,渗透压稳定剂的类型和浓度、真菌溶壁酶浓度、酶解时间以及酶解温度等因素影响小菇MY004菌丝原生质体的释放.正交试验结果表明,在影响小菇MY004原生质体释放的因素中,透稳定剂甘露醇浓度和溶壁酶酶量大于酶解时间和温度的作用.
通过实验优化,小菇MY004原生质体的最佳制备条件为:甘露醇0.7 M、真菌溶壁酶10 mg/mL、酶解时间3 h、酶解温度24 ℃.小菇MY004菌丝酶解时间3 h后,获得的原生质体继续在pH值为5的液体再生培养基RM1中再生培养3天,其原生质体再生的效率较高.此外,将含报告基因eGFP的小菇转基因菌株制备成原生质体,并进行原生质体的再生、潮霉素筛选、PCR鉴定和显微观测,快速地获得小菇转基因的纯合菌株.因此,利用小菇MY004的原生质体制备和再生体系,既可以用于原生质体介导的遗传转化体系构建,也可用于农杆菌介导转基因菌株的纯化,这将为天麻和小菇互作的分子机制研究提供技术平台.
参考文献
[1] Wu Y N,Wen S H,Zhang W,et al.Gastrodia elata BI.:A comprehensive review of its traditional use,botany,phytochemistry,pharmacology,and pharmacokinetics[J].Evid Based Complement Alternat Med,2023(5 606 021):1-30.
[2] 徐锦堂,冉砚珠,郭顺星.天麻种子发芽营养来源的研究[J].中国医学科学院学报,1990,12(6):431-434.
[3] 徐锦堂,冉砚珠,牟 春,等.天麻种子发芽营养来源的研究(简报)[J].中药通报,1981,11(3):125-128.
[4] 徐锦堂,郭顺星.供给天麻种子萌发营养的真菌——紫萁小菇[J].真菌学报,1989,8(3):221-226.
[5] 范 黎,郭顺星,徐锦堂.天麻种子萌发过程中与其共生真菌石斛小菇间的相互作用[J].菌物系统,1999,18(2):219-225.
[6] 范 黎,郭顺星,徐锦堂.天麻种子与兰小菇共生萌发过程中超微结构变化研究[J].菌物系统,1999,18(4):431-435.
[7] Zeng X,Li Y Y,Ling H,et al.Transcriptomic analyses reveal clathrin-mediated endocytosis involved in symbiotic seed germination of Gastrodia elata[J].Botanical Studies,2017,58(31):1-11.
[8] Zeng X,Li Y,Ling H,et al.Revealing proteins associated with symbiotic germination of Gastrodia elata by proteomic analysis[J].Botanical Studies,2018,59(8):1-7.
[9] 白 璐,卢 萍.丝状真菌遗传转化体系的研究进展[J].生命的化学,2023,43(6):797-808.
[10] 刘祖同.食用蕈菌生物技术及应用[M].北京:清华大学出版社,2002.
[11] 陆 欢,王春晖,姜性坚,等.花脸香蘑原生质体的制备及再生条件[J].菌物学报,2018,37(6):737-745.
[12] Li D,Tang Y,Lin J,et al.Methods for genetic transformation of filamentous fungi[J].Microb Cell Fact,2017,16(168):1-13.
[13] 张颖慧,魏东盛,邢来君,等.一种改进的丝状真菌DNA提取方法[J].微生物学通报,2008,35(3):466-469.
[14] Harder C B,Lssoe T,Froslev T G,et al.A three-gene phylogeny of the reveals 11 phylogenetic species and shows ITS to be unreliable for species identification[J].Fungal Biol-Uk,2013,117(12):764-775.
[15] 冉孝琴,桂 阳,张丽娜,等.天麻种子自然萌发和生长特性[J].湖北农业科学,2014,53(10):2 325-2 329.
[16] 袁青松,安久春,王 绘,等.天麻伴生菌——紫褐小菇原生质体遗传转化体系的构建[J].中国中药杂志,2022,47(9):2 304-2 308.
[17] 邹优花,连玲丹,钟武杰,等.杏鲍菇原生质体制备、再生及其遗传转化体系的建立[J].食品研究与开发,2023,44(21):138-144.
[18] 廖汉泉,邱景芸,吴月嫦.香菇菌丝原生质体分离与再生条件的研究[J].遗传,1990,12(6):8-11.
[19] 关艳丽,赵新海,张庆华,等.平菇P16原生质体制备条件研究[J].食用菌,2017,39(6):30-31.
[20] 徐锦堂,郭顺星,范 黎,等.天麻种子与小菇属真菌共生萌发的研究[J].菌物系统,2001,20(1):137-141.
[21] 吴绍熙,郭宁如.真菌的分子生物学[J].中国真菌学杂志,2007,2(4):231-239.
[22] 刘 彬,刁文涛,周伏忠,等.六妹羊肚菌原生质体再生菌株交配型的分离鉴定[J].中国酿造,2023,42(1):121-125.
[23] 赵明阳,徐玲玲,邓百万,等.一株小菇属天麻萌发菌原生质体制备的研究[J].辽宁农业科学,2019(6):27-30.
[24] 韩业君,曹 晖,陈明杰,等.草菇原生质体制备与再生及诱变效应研究[J].食用菌学报,2004,11(2):1-6.
[25] 陈 鹏,郭成金.金针菇原生质体制备和再生探究[J].江苏农业科学,2014,42(9):200-204.
[26] Ning Y,Hu B,Yu H,et al.Optimization of protoplast preparation and establishment of genetic transformation system of an arctic-derived fungus Eutypella sp[J].Front Microbiol,2022,13(769 008):1-11.
[27] 沈慧敏,李 超,高 利,等.原生质体法介导真菌遗传转化的研究进展[J].植物保护,2017,43(2):25-28.
[28] 许 梅,胡顺珍,贾 乐.大球盖菇原生质体制备与再生条件研究[J].生物技术,2006,16(6):57-60.
[29] Yoon J,Kim Y,Kim S,et al.Agrobacterium tumefaciens-mediated transformation of the aquatic fungus Phialemonium inflatum FBCC-F1546[J].J Fungi,2023,9(12):1 158.
【责任编辑:陈 佳】
