冰片对岩黄连总碱在抑郁症模型大鼠中药效学和药动学的影响
2025-01-15叶峪戴国梁杭华茜于美双王一然邵雪居文政



关键词 岩黄连总碱;冰片;药物相互作用;药效学;药动学;抑郁
抑郁症作为一种常见的精神障碍,严重影响人们的身心健康。据世界卫生组织统计,全球约10 亿人正遭受精神障碍的困扰。联合用药是临床常采用的抑郁症治疗方式,而中医药在治疗抑郁症等精神类疾病方面历史悠久、经验丰富,其用药强调身心合一的整体观,作用更加持久、缓和、稳定,适用于抑郁症的长期药物调节[1―3]。
岩黄连为罂粟科植物石生黄堇Corydalis saxicolaBunting 的全草,性凉、味苦,清热解毒、散瘀消肿[4]。岩黄连总碱为岩黄连药材经75% 乙醇提取并经酸提碱沉法纯化后所得的干燥粉末,总生物碱的含量不低于50%[4]。本课题组前期研究发现,岩黄连总碱的主要成分有脱氢卡维丁、延胡索乙素、黄连碱、巴马汀、药根碱、小檗碱、小檗红碱、表小檗碱[5],且可在一定程度上降低抑郁症小鼠体内的炎症水平[6]。传统中医药理论认为,中药冰片“引药上行,独行则势弱,佐使则有功”[7]。现代药理研究证实,冰片能够抑制P-糖蛋白(P-glycoprotein,P-gp)的活性[8―9],可促进其他药物透过血脑屏障及多种生物黏膜屏障,从而提高药物生物利用度[10―11],达到增强疗效的目的。基于此,本实验通过研究岩黄连总碱联合冰片前后对脂多糖(lipopolysaccharides,LPS)诱导的大鼠抑郁样行为的影响;建立同时检测岩黄连总碱中脱氢卡维丁、延胡索乙素、黄连碱、巴马汀、药根碱、小檗碱、小檗红碱及表小檗碱共8 种成分血药浓度的超高效液相色谱-三重四极杆串联质谱法,比较各成分在岩黄连总碱单用及与冰片联用后在LPS 诱导的抑郁症大鼠模型体内的药动学参数,以期为岩黄连总碱联用冰片在临床试验中的给药方案设计和临床合理用药提供依据。
1 材料
1.1 主要仪器
XR-XQ202 型强迫游泳实验箱、XR-XQ202 型SuperFst高通量强迫游泳实验软件、XR-XZ301 型旷场实验箱(长、宽、高均为1 m)、XR-Xmaze+-SuperMaze+型高通量动物行为实验分析软件均购自上海欣软信息科技有限公司;ExionLC AC 型高效液相色谱仪、Triple QuadTM5500+型三重四极杆质谱仪(配备Analyst 1.7.3 色谱工作站)购自美国SCIEX 公司;CPA225D型十万分之一电子分析天平购自德国Sartorius 公司;D1524R 型高速冷冻离心机购自大龙兴创实验仪器(北京)股份公司;X0-800DT 型超声波清洗机购自南京先欧仪器制造有限公司;MDF-U382VHE 型-80 ℃ 低温冰箱购自美国Thermo Fisher Scientific 公司;BCD-272WD型-20 ℃低温冰箱购自中国海尔集团;Nikon Ti 型荧光显微镜购自日本Nikon公司。
1.2 主要药品与试剂
对照品脱氢卡维丁(批号111667-200401,纯度97.5%)、延胡索乙素(批号110726-201617,纯度99.80%)、氢溴酸右美沙芬(批号100201-201204,纯度94.80%)均购自中国食品药品检定研究院;对照品黄连碱(批号MUST-20051111,纯度99.58%)、巴马汀(批号MUST-20022610,纯度98.75%)、药根碱(批号MUST-20062609,纯度98.62%)、小檗碱(批号20073011,纯度98.96%)、小檗红碱(批号MUST-20060701,纯度98.71%)、表小檗碱(批号MUST-20082412,纯度98.92%)均购自成都曼斯特生物科技有限公司;岩黄连总碱(批号2102,总生物碱含量不少于50%)购自南京弘景医药科技有限公司,冰片(批号220501)购自江苏省医药有限公司;氟西汀(批号D1823052)购自上海阿拉丁生化科技股份有限公司;LPS(批号L2880)购自美国Sigma 公司;大鼠血清白细胞介素1β(interleukin-1β,IL-1β)、IL-6、肿瘤坏死因子α(tumor necrosis factor- α,TNF- α)酶联免疫吸附测定(ELISA)试剂盒( 货号分别为EK301BHS/2-AW1、EK306HS-AW1、EK382HS-AW1)均购自上海酶联生物科技有限公司;苏木素、伊红试剂(批号分别为DH0006、DH0051)均购自北京雷根生物技术有限公司。甲醇、乙腈均为色谱纯,均购自德国Merck 公司。水为超纯水,其余试剂均为分析纯。
1.3 实验动物
SPF 级SD 雄性大鼠,30 只,体重(200±20) g,购自浙江维通利华实验动物技术有限公司,生产许可证号为SCXK(浙)2019-0001。本研究经南京中医药大学附属医院实验动物伦理委员会批准,批号为2023DW-048-01。所有大鼠均适应性饲养7 d,保持12 h昼夜节律。
2 方法
2.1 药效学实验
2.1.1 造模、分组与给药
将雄性SD大鼠30 只按照随机数字表法分为空白对照组、阴性对照组、阳性对照组、单药组、联合给药组,每组6 只。其中,阳性对照组大鼠灌胃氟西汀10 mg/kg,单药组大鼠灌胃岩黄连总碱210 mg/kg,联合给药组大鼠灌胃岩黄连总碱210 mg/kg+冰片50 mg/kg(各给药组剂量依据前期预实验得出)。实验前大鼠正常供给饲料及饮水,并进行1% 蔗糖水训练。适应7 d 后,采用LPS 诱导构建抑郁症大鼠模型,即除空白对照组大鼠腹腔注射等体积生理盐水外,其余各组大鼠每天腹腔注射1 次LPS(0.5 mg/kg),持续7 d,进行行为学实验。确认造模成功后[12],各给药组大鼠按10 mL/kg 灌胃相应药液,其间空白对照组及阴性对照组大鼠灌胃等体积溶解药物的溶剂,连续15 d;给药期间仍需每天腹腔注射1 次LPS造模。由于阳性对照药的作用机制已比较清楚,后文仅用于大鼠抑郁样行为学检测。
2.1.2 大鼠抑郁样行为学检测
(1)体重:实验开始前,记录大鼠体重;实验过程中,每2 d 称重并记录一次大鼠体重,用以分析造模和给药期间大鼠的体重变化。(2)糖水偏好实验:造模前,对大鼠先进行3 d 的糖水偏好适应性训练。糖水测试前禁水不禁食12 h,进行行为学测试时,所有大鼠置于单笼,每笼笼盖上放一瓶1%(m/V)蔗糖水溶液和纯水,测试时间为4 h,中间每2 h 时交换水瓶位置。测试结束前后分别称量水瓶质量,计算糖水偏好率[糖水偏好率(%)=糖水消耗量/(糖水消耗量+纯水消耗量)×100%]。(3)旷场实验:各组大鼠在给药2 周时进行旷场实验。开始之前,将大鼠挪至行为学房间,关灯适应1 h。测试时,将大鼠背对实验者轻轻置于长、宽、高均为1 m的实验箱中央自由探索5 min,使用摄像机记录各大鼠在箱内的运动轨迹,用动物行为学软件分析大鼠旷场运动总路程。(4)强迫游泳实验:将大鼠放入透明的有机玻璃圆筒(直径20cm,高50 cm)中,设置水深40 cm,水温20~25 ℃。使用动物行为学软件记录6 min 内的后4 min 大鼠的游泳不动时间(大鼠在水中停止挣扎,一动不动呈漂浮状态,或只有细小的肢体运动以保持头部浮在水面上,认为其是静止不动的[13])。
2.1.3 大鼠血清炎症因子水平检测
末次给药后,于各组大鼠腹主动脉取血,静置30min,以4 000 r/min 离心10 min,分离上层血清,根据ELISA 试剂盒说明书操作,以酶标仪检测IL-1β、IL-6、TNF-α水平。
2.1.4 大鼠海马组织病理形态学变化观察
末次给药后,每组随机取2 只大鼠麻醉后用生理盐水灌注,再用多聚甲醛灌注至头部及四肢,待肌肉僵硬后,迅速断头取脑,将脑组织置于4% 多聚甲醛固定液中保存,待用。取上述脑组织,进行常规石蜡包埋、切片,苏木素-伊红(HE)染色后,使用中性树胶封片,于显微镜下观察其海马区病理形态学变化并拍照。
2.2 药动学实验
2.2.1 色谱条件
色谱柱为Agilent ZORBAX SB-C18(100 mm×3.0 mm,3.5 μm);流动相为0.3% 甲酸溶液(含1 mmol/L甲酸铵)-乙腈(60∶40,V/V);柱温为40 ℃;流速为0.5mL/min;进样量为5 μL。
2.2.2 质谱条件
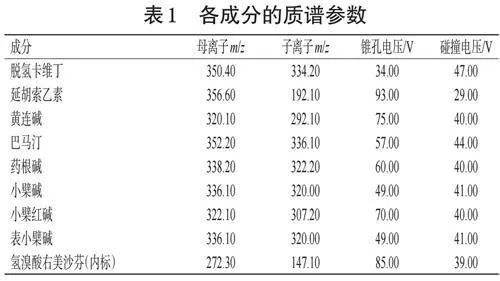
采用电喷雾离子源、多反应监测模式进行正离子扫描;离子源温度为550 ℃;电喷雾电压为5 500 V。各成分的质谱参数见表1。
2.2.3 对照品溶液
精密称取脱氢卡维丁、延胡索乙素、黄连碱、巴马汀、药根碱、小檗碱、小檗红碱、表小檗碱对照品适量,加甲醇溶解,定容,配制成质量浓度分别为4.00、2.00、0.80、0.80、0.80、1.00、1.00、0.80 mg/mL 的对照品储备液。分别精密吸取对照品储备液适量,加50% 甲醇逐级稀释制成8 个不同质量浓度的混合对照品标准曲线工作液。精密吸取各储备液适量,用50% 甲醇稀释成低、中、高质量浓度(脱氢卡维丁0.060、1.260、7.200 ng/mL,延胡索乙素0.045、1.680、9.600 ng/mL,黄连碱0.006、0.210、1.200 ng/mL,巴马汀0.030、0.210、1.200 ng/mL,药根碱0.030、0.210、1.200 ng/mL,小檗碱0.024、0.280、1.600ng/mL,小檗红碱0.009、0.210、1.200 ng/mL,表小檗碱0.030、0.210、1.200 ng/mL)的质控工作液。上述溶液均于4 ℃下保存,备用。
2.2.4 内标溶液
精密称取适量氢溴酸右美沙芬对照品,加甲醇溶解并定容,配制成质量浓度为2.11 mg/mL 的内标储备液。精密吸取上述储备液适量,加50% 甲醇稀释,得质量浓度为15.0 ng/mL的内标工作液,于4 ℃下保存,备用。
2.2.5 血浆样品处理
精密吸取血浆样品50 μL,依次加入内标工作液5 μL、乙腈110 μL,涡旋3 min,于4 ℃下以12 000 r/min 离心10 min,吸取上清液60 μL,再次于4 ℃下以12 000 r/min离心10 min,取5 μL上清液进样[14]。
2.2.6 方法学考察
(1)专属性考察:分别取大鼠空白血浆、空白血浆+对照品+内标、大鼠给药后45 min 的血浆+内标,按照“2.2.5”项下方法处理,并按“2.2.1”“2.2.2”项下条件进样分析,记录色谱图。
(2)标准曲线与线性范围考察:精密吸取空白血浆50 μL,加入系列浓度的混合对照品溶液5 μL,按“2.2.5”项下方法处理,并按“2.2.1”“2.2.2”项下条件进样分析,记录峰面积。以血浆中各成分质量浓度为横坐标(X)、相应成分峰面积与内标峰面积的比值为纵坐标(Y),采用加权最小二乘法(权重系数为1/X2)进行线性回归。
(3)准确度与精密度考察:精密吸取空白血浆50 μL,加入定量下限、低、中、高质量浓度的质控工作液5 μL,得到待测成分定量下限、低、中、高质量浓度的质控血浆样品,每个浓度平行制备6 份,3 d 内连续制备3 批,每批随行一条标准曲线。按“2.2.5”项下方法处理,并按“2.2.1”“2.2.2”项下条件进样分析,记录色谱图。以各质控样品的实测浓度相对其理论浓度的准确度(RE)和各质控样品实测浓度的相对标准偏差(RSD)来表示日内、日间准确度及精密度水平。
(4)基质效应考察:精密吸取空白血浆50 μL(不加内标),按“2.2.5”项下方法处理,离心后取上清,即为空白基质。分别精密吸取低、高2 个质量浓度的质控工作液及内标各5 μL,再加入空白基质50 μL、50% 甲醇110μL,涡旋3 min,吸取30 μL 于进样小瓶中,按“2.2.1”“2.2.2”项下条件进样分析,记录待测物峰面积A和内标峰面积C(每个浓度平行3 个样品)。分别精密吸取低、高2 个质量浓度的质控工作液及内标各5 μL,再加入50% 甲醇160 μL,涡旋3 min,吸取30 μL 于进样小瓶中,按“2.2.1”“2.2.2”项下条件进样分析,记录同一浓度样品各待测物峰面积的均值A1(n=3)及低、高2 个浓度样品内标峰面积的均值C1(n=6)。待测物基质效应因子(MEs)=A/A1×100%,内标基质效应因子(MEi)=C/C1×100%,内标归一化的基质效应因子(ME)=MEs/MEi×100%,计算ME的RSD。
(5)提取回收率考察:精密吸取空白血浆50 μL,按“2.2.5”项下方法处理,制备成低、中、高3 个质量浓度的质控样品,并按“2.2.1”“2.2.2”项下条件分析,每个浓度平行6 个样品。记录待测物峰面积A3。另取空白血浆50 μL,按“2.2.5”项下方法处理空白血浆(不加内标),离心后上清为空白血浆溶液。分别加入低、中、高3 个质量浓度的质控工作液及内标工作液5 μL,再加入空白血浆溶液50 μL、50% 甲醇110 μL,涡旋3 min,吸取30 μL于进样小瓶中,按“2.2.1”“2.2.2”项下条件分析,每个浓度平行6 个样品。记录待测物峰面积A4 以及同一浓度样品各待测物峰面积的均值A5(n=6)。各成分的提取回收率=A3/A5×100%。
(6)稳定性考察:精密吸取空白血浆50 μL,加入低、高2 个质量浓度的质控工作液,每个浓度平行制备3 份,分别考察室温下放置6 h、在自动进样器放置24 h、-20 ℃放置72 h、反复冻融3 次、-80 ℃放置30 d后的稳定性。
2.2.7 药动学分析
单药组与联合给药组大鼠于于第15 天给药后0、0.083、0.25、0.5、0.75、1、1.5、2、4、6、8、10、12、24 h 眼眶采血约0.3 mL于含肝素钠抗凝剂的离心管中,以3 500 r/min离心10 min,取上层血浆,置于-80 ℃冰箱保存,备用。取上述血浆样品,按“2.2.5”项下方法处理后,按“2.2.1”“2.2.2”项下条件进样分析,记录峰面积,以内标法计算大鼠血浆样品中各成分的血药浓度。以时间为横坐标(X)、大鼠血药浓度为纵坐标(Y)作图,得各成分的平均血药浓度-时间曲线,通过DAS 3.2.2 软件处理,采用非房室模型计算各成分的药动学参数,其中血药浓度-时间下面积(area under the curve,AUC;包括AUC0-t 和AUC0-∞)采用梯形面积法计算,半衰期(t1/2)利用血药浓度-时间曲线计算,药峰浓度(cmax)和达峰时间(tmax)为实测值。
2.3 统计学分析
采用SPSS 23.0 软件进行统计分析,采用GraphpadPrism 9.0 软件绘图。数据满足正态分布以x±s 表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q 检验。不满足正态分布以M(P25,P75)表示,组间比较采用非参数秩和检验。检验水准α=0.05。
3 结果
3.1 药效学实验结果
3.1.1 各组大鼠抑郁样行为参数比较
给药2 周后,与空白对照组比较,阴性对照组大鼠体重、糖水偏好率、旷场运动总路程均显著降低或缩短,游泳不动时间显著延长(P<0.05);与阴性对照组比较,阳性对照组、单药组和联合给药组大鼠体重、糖水偏好率、旷场运动总路程均显著升高或延长,游泳不动时间显著缩短(P<0.05);与单药组比较,联合给药组大鼠抑郁样行为参数变化差异无统计学意义(P>0.05)。结果见表2。
3.1.2 各组大鼠血清炎症因子水平比较
与空白对照组比较,阴性对照组大鼠血清IL-1β、IL-6、TNF-α水平均显著升高(P<0.05);与阴性对照组比较,单药组、联合给药组大鼠血清IL-1β、IL-6、TNF-α水平均显著降低(P<0.05);与单药组比较,联合给药组大鼠血清炎症因子水平差异无统计学意义(P>0.05)。结果见表3。
3.1.3 各组大鼠海马组织病理形态学比较
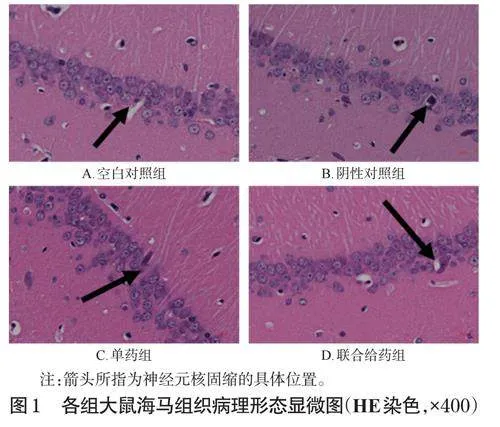
空白对照组大鼠海马组织整体结构基本正常,神经元排列整齐紧密,神经元数量未见明显减少。阴性对照组大鼠海马组织整体结构异常,神经元排列整齐紧密,少量神经元核固缩。单药组大鼠海马组织整体结构轻度异常,神经元排列整齐紧密,个别神经元核固缩。联合给药组大鼠海马组织整体结构轻度异常,神经元排列整齐紧密,极个别神经元核固缩。结果见图1。
3.2 药动学实验结果
3.2.1 方法学考察结果
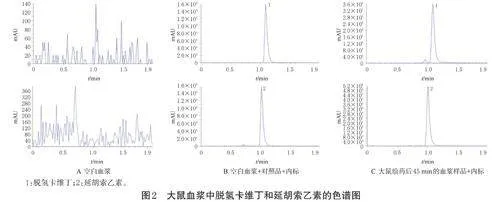
(1)专属性:内标(氢溴酸右美沙芬)、脱氢卡维丁、延胡索乙素、黄连碱、巴马汀、药根碱、小檗碱、小檗红碱、表小檗碱保留时间分别为1.14、1.91、1.01、1.05、1.19、1.01、1.24、1.04、1.01 min,各待测成分和内标未受到血浆中杂质及内源性物质的干扰,色谱峰良好,表明所建立的方法专属性良好。结果见图2(只展示了脱氢卡维丁和延胡索乙素,其余略)。
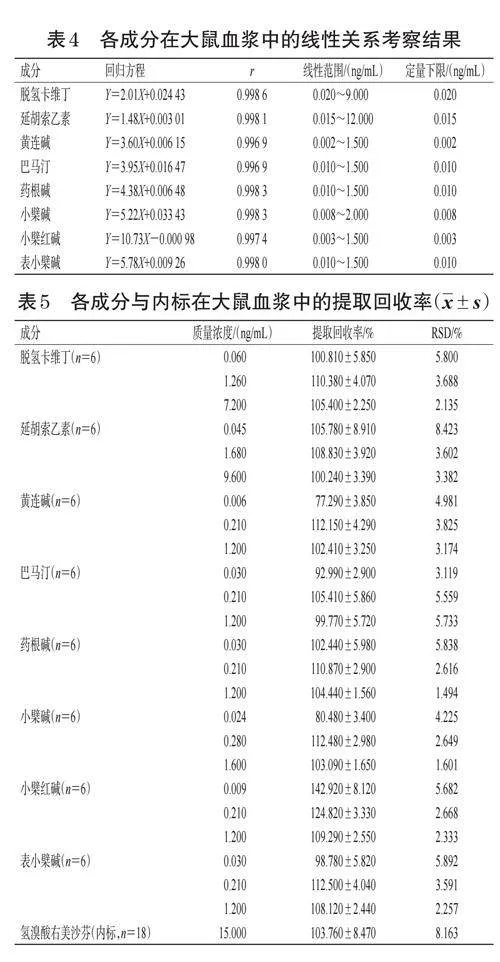
(2)标准曲线与线性范围:结果显示,血浆样品中各成分在其线性范围内线性关系良好,详见表4。
(3)准确度与精密度:脱氢卡维丁等8 种成分的日内和日间各实测浓度的RSD 均小于15%,RE 均在±15%范围内,符合2020 年版《中国药典》(四部)“生物样品定量分析方法验证指导原则”的相关规定。
(4)基质效应:在低、高质量浓度下,ME的RSD 均小于15%(n=6),表明待测成分受内源性物质影响较小,符合相关指导原则要求。
(5)提取回收率:各成分的提取回收率RSD不超过15%,说明该提取方法结果稳定,适用于本实验中生物样品处理。详见表5。
(6)稳定性:血浆中各成分在5 种储存条件下的准确度RE均在±15% 以内,RSD均不超过15%,说明血浆样品在5 种条件下均稳定,符合相关指导原则要求。
3.2.2 药动学研究结果
实验结果表明,与单药组比较,联合给药组大鼠体内黄连碱AUC0-t,药根碱AUC0-t、AUC0-∞、tmax、cmax,小檗红碱AUC0-t、AUC0-∞、t1/2、cmax,表小檗碱AUC0-t,脱氢卡维汀cmax,巴马汀cmax均显著升高(P<0.05)。结果见图3(仅展示部分成分结果)和表4。
4 讨论
本实验采用腹腔注射LPS构建大鼠急性抑郁模型。腹腔注射LPS 具有大鼠死亡率低及实际操作性强的特点,造模成功率高。炎症水平增加是抑郁症发生的重要机制之一。大量实验证据表明,神经炎症可诱导抑郁,致炎细胞因子水平与抑郁严重程度呈正相关[15―16]。IL-1β、IL-6 和TNF-α是抑郁症发病和疗效评估的重要生物标志物[17],因此,本研究选取以上3 个指标进行检测。本实验结果表明,LPS 腹腔注射制作抑郁大鼠模型成功。通过大鼠抑郁样行为学实验、炎症因子水平检测和海马组织病理形态学观察结果表明,冰片与岩黄连总碱联用后,能够有效增强岩黄连总碱的抗抑郁效果,减轻血清炎症因子,保护海马神经元,但与单用岩黄连总碱比较,并未表现出明显差异。
本实验建立了超高效液相色谱-三重四极杆串联质谱法同时测定大鼠血浆样品中脱氢卡维丁、延胡索乙素、黄连碱、巴马汀、药根碱、小檗碱、小檗红碱、表小檗碱8 种成分的分析方法。为了考察岩黄连总碱在大鼠体内的药动学,本文以岩黄连总碱中的脱氢卡维丁等8 种成分为检测指标,通过不同色谱条件对比改进后,确定以甲酸溶液- 乙腈(60∶40,V/V)为流动相,又比对了0.1%、0.2%、0.3%、0.4% 的甲酸溶液-乙腈,最终确定以0.3% 甲酸溶液(含1 mmol/L 甲酸铵)-乙腈(60∶40,V/V)为流动相等度洗脱。在此条件下,该方法基质效应较低,空白血浆中无明显干扰,分析物峰形良好,通过了完整的方法学验证,符合生物样品的定量分析要求,表明本实验所建立方法的灵敏度高、专属性强。
药动学结果表明,小檗碱等吸收难的结果与文献报道一致,但冰片与岩黄连总碱联用后,对黄连碱、小檗红碱、药根碱和表小檗碱等的吸收产生了显著影响,说明冰片一定程度上提高了岩黄连总碱在大鼠体内的生物利用度,促进岩黄连总碱吸收的作用显著。Brzozowska等[18]研究发现,抑郁状态下P-gp 的下调会导致生物碱血浆暴露量增加。有文献报道小檗碱可能是P-gp 的底物[19],而冰片作为P-gp 抑制剂抑制了P-gp 活性[20],从而影响小檗碱等生物碱的体内浓度,这为冰片与岩黄连总碱联用于临床治疗抑郁症提供了一定的依据。
综上所述,岩黄连总碱单用及与冰片联用均能改善抑郁症大鼠模型抑郁样行为,减轻血清炎症因子水平,保护海马神经元;冰片一定程度上提高了岩黄连总碱中药根碱、黄连碱等生物碱在大鼠体内的暴露量,提高其生物利用度,促进了岩黄连总碱的吸收,有利于岩黄连总碱发挥抗抑郁作用。
