注射用亚胺培南西司他丁钠用于儿童的分剂量及稳定性研究
2025-01-15张先明朱增燕王文静杜小换

关键词注射用亚胺培南西司他丁钠;亚胺培南;分剂量;儿童;稳定性
儿童适宜药品缺乏是全球普遍情况,儿童在使用成人剂型和规格的药品时,需要进行分剂量操作[1―2]。但如果分剂量操作不规范,就会产生剂量不准确、交叉污染等风险[3―5]。已有学者对口服剂型的分剂量方式、药物稳定性等方面开展研究[6],并制定了团体标准[7],但注射剂型的分剂量尚未得到关注,尤其是需要预先复溶的难溶性注射用无菌粉末,例如注射用亚胺培南西司他丁钠(imipenemandcilastatinsodiumforinjection,ICS)。
ICS是由亚胺培南(imipenem,IPN)和西司他丁按1∶1(m/m)制成的复方制剂,根据该药药品说明书中的用法用量[8],低体重患儿需要分剂量后才能使用。对包括ICS在内的注射用无菌粉末进行分剂量,医院静脉用药调配中心(PharmacyIntravenousAdmixtureServers,PIVAS)配制人员或护士多采用“规格法”配制,即取一定量的溶媒加入到西林瓶中制成初溶药液,然后根据医嘱用药量抽取相应体积的药液[9]。但IPN具有难溶性[10],即使以西林瓶可容纳的最大体积溶媒溶解,其初溶药液仍无法完全溶解,始终呈混悬状态,而从混悬状态的药液中抽取理论药量是否可能影响剂量的准确性和一致性有待验证。
IPN除了具有难溶性,其配制后药液的稳定性也较低。按ICS药品说明书配制的药液终浓度为5mg/mL,25℃条件下可放置4h[8]。但笔者在实际工作中发现,ICS药液终浓度低于5mg/mL的医嘱很常见。有研究显示,药液的浓度、存储温度以及pH变化等均可能影响IPN的稳定性[11―13],但目前尚未见有研究关注质量浓度低于5mg/mL的ICS药液的稳定性。因此,本研究拟通过建立一种超高效液相色谱-串联质谱联用(ultra-highperformanceliquidchromatography-tandemmassspectrometry,UPLC-MS/MS)法实现ICS主药IPN的含量测定,分析在现行ICS分剂量方式下其主药IPN的含量一致性情况,并考察在临床实际工作场景中不同质量浓度药液的稳定性,为促进儿童安全、有效使用ICS提供参考。
1 材料
1.1 主要仪器
ACQUITYUPLCI-Class型UPLC-MS/MS仪购自美国Waters公司;Fresco21型高速冷冻离心机购自美国ThermoFisherScientific公司;ME155DU型电子分析天平购自瑞士MettlerToledo公司;Direct-Q5型超纯水仪购自美国Millipore公司;Vortex-Genie2型涡旋振荡器购自美国ScientificIndustries公司。
1.2 主要试剂与药品
对照品IPN(纯度98.5%,批号FS1617612)和美罗培南(meropenem,MPN;内标,纯度99.9%,批号FS1645535)均购自天津阿尔塔科技有限公司;甲醇和乙腈均为色谱纯,均购自德国Merck公司;甲酸为质谱级,购自美国ACS公司;水为超纯水,由实验室自制。
ICS(国药准字HJ20181007、国药准字HJ20181008,规格:IPN500mg和西司他丁500mg)购自美国MerckSharp&DohmeLLC公司;氯化钠注射液(国药准字H12020024,规格:100mL∶0.9g)购自中国大冢制药有限公司。
2 方法与结果
2.1 色谱与质谱条件
色谱柱为WatersACQUITYUPLCBEHC18(2.1mm×100mm,1.7μm);流动相A相为含0.1%甲酸的水,B项为含0.1%甲酸的乙腈,采用梯度洗脱(0~1.0min,1%B→30%B;1.0~3.0min,30%B→98%B;3.0~3.5min,98%B;3.5~6.0min,98%B→1%B);流速为0.3mL/min;柱温为40℃;进样量为1μL。
采用电喷雾离子源,以多反应监测模式进行正离子扫描;毛细管电压为3.0kV;锥孔电压为50V;脱溶剂气温度为400℃;脱溶剂气流速为1000L/h;锥孔气流速为20L/h。用于定量分析的离子对分别为m/z300.1→142.0(IPN:锥孔电压30V,碰撞电压26V)、m/z384.2→141.1(MPN:锥孔电压8V,碰撞电压14V)。
2.2 溶液的配制与样品预处理
2.2.1 对照品和内标溶液的配制
精密称取IPN对照品3.99mg,置于棕色小瓶中,加水溶解后制得质量浓度为1mg/mL的IPN对照品储备液;取上述储备液,以水逐级稀释,得质量浓度分别为50、100、150、200、250μg/mL的IPN系列标准曲线工作液以及质量浓度分别为120、220μg/mL的质控工作液。精密称取MPN对照品2.36mg,置于棕色小瓶中,加水溶解后制得质量浓度为1mg/mL的MPN内标储备液;取该储备液,以水稀释成质量浓度为200μg/mL的MPN内标工作液。将各储备液和工作液分装成若干份,置于-80℃冰箱内保存,每次取用后不再冻存。
2.2.2 供试液的配制
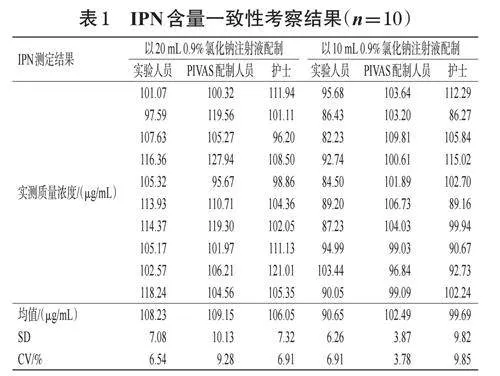
(1)含量一致性考察的供试液配制。为了考察操作人员之间的操作误差,分别由3名操作员(实验人员、PIVAS配制人员和护士)按照常用的“规格法”配制供试液。具体操作步骤如下:将0.9%氯化钠注射液10mL或20mL注入ICS西林瓶,充分混匀1~2min,晃动西林瓶使瓶内复溶液体保持混悬状态,用1mL注射器从同一个西林瓶内重复取样10份,再以0.9%氯化钠注射液稀释制得IPN理论质量浓度均为5mg/mL的供试液(不考虑装量差异)。
(2)稳定性考察的供试液配制。参照ICS药品说明书的标准配制方法,先从0.9%氯化钠注射液100mL输液袋中抽出20mL(10mL×2),再将10mL0.9%氯化钠注射液注入ICS西林瓶,充分摇匀1~2min,将复溶混悬液注入0.9%氯化钠注射液输液袋,然后以另外的10mL0.9%氯化钠注射液荡洗西林瓶并将液体注入输液袋,以确保西林瓶内容物完全转移至输液袋内,摇匀后即得澄清的供试液X1。取供试液X1适量,以0.9%氯化钠注射液分别按照1∶1和1∶2(V/V)的比例稀释,制成稀释2倍的供试液X2和稀释3倍的供试液X3。将供试液X1、X2和X3分别在室温[(23.0±0.5)℃]放置0、4、5、6h,或在30℃恒温水浴锅中放置0、2、4、6h;将供试液X2和X3在2~8℃冰箱内冷藏18h。各放置条件下,每个质量浓度水平的供试液分别平行配制3份。
2.2.3 样品预处理
分别取IPN标准曲线工作液、质控工作液和各供试液(先以水稀释至100μg/mL)30μL,加入MPN内标工作液20μL,再加入超纯水500μL,涡旋混匀2min,以14000r/min离心2min后取100μL上机,待测。
2.3 判定标准
2.3.1 含量一致性判定标准
在相同的检测条件下,分别测定“2.2.2(1)”项下各供试液中IPN的含量,并计算每组含量的均值、标准差(standarddeviation,SD)和变异系数(coefficientofvariation,CV)。参照2020年版《中国药典》定量分析方法中对于精密度的要求[14],若每组供试液的CV均小于15%,则表明IPN的含量具有一致性,即无论采用20mL或10mL0.9%氯化钠注射液配制ICS,其主药IPN的含量偏差都可控。
2.3.2 药液稳定性判定标准
以各质量浓度水平供试液0h的IPN质量浓度为初始值,供试液在规定的温度和时间放置后,若测得的IPN质量浓度与0h质量浓度均值之比≥90%,则该供试液被认为是稳定的[12―13]。
2.4 结果
2.4.1 方法学的建立和验证
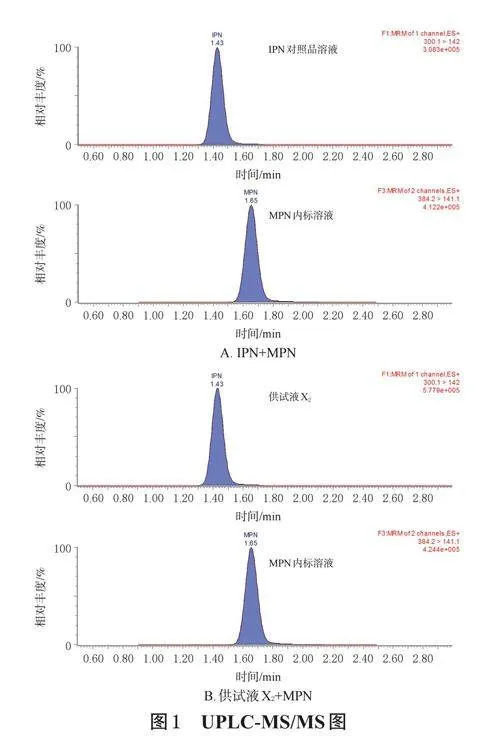
分别取空白溶液(0.9%氯化钠注射液)、IPN对照品溶液(50μg/mL)和供试液(X2),按“2.2.3”项下方法预处理,再按“2.1”项下色谱与质谱条件进样分析,记录色谱图(图1)。由图1可知,IPN和MPN的峰形良好,与其他色谱峰完全分离,保留时间分别为1.43、1.65min;空白溶液对测定无干扰(图略),说明该方法专属性良好。
取“2.2.1”和“2.2.3”项下的IPN标准曲线工作液及预处理后的IPN标准曲线工作液,按“2.1”项下色谱与质谱条件进样测定,记录峰面积,以IPN对照品质量浓度为横坐标(X)、IPN与内标MPN的峰面积比值为纵坐标(Y)进行线性回归,得回归方程为Y=0.049326X+0.979693(R2=0.9992),表明IPN的质量浓度在50~250μg/mL范围内与峰面积线性关系良好。取“2.2.1”和“2.2.3”项下的质控工作液及预处理后的质控工作液,按“2.1”项下色谱与质谱条件连续进样测定6次,记录峰面积,结果显示,IPN峰面积的RSD分别为1.90%、1.84%(n均为6),表明仪器精密度良好。取同一批次ICS,按“2.2.2(2)”和“2.2.3”项下方法平行制备6份供试液,按“2.1”项下色谱与质谱条件进样测定,记录峰面积,并根据标准曲线计算IPN含量,结果显示,IPN含量的RSD为3.46%(n=6),表明该方法重复性良好。
2.4.2 含量一致性考察结果
按“2.2.2(1)”项下方法配制的各供试液中IPN实测含量及其偏差结果见表1。由于ICS固有的装量差异,因此取自6支ICS制得的6组供试液中的IPN含量均值略有偏差。由CV结果可见,在相同的检测条件下,实验人员或PIVAS配制人员或护士采用20mL或10mL0.9%氯化钠注射液配制ICS,再以注射器从混悬状态的药液中随机吸取1mL所得的10份供试液中,IPN含量的CV均小于15%,表明不同的操作人员采用20mL或10mL0.9%氯化钠注射液配制ICS,其主药IPN的含量偏差较小,具有一致性。
2.4.3 不同浓度供试液的稳定性考察结果
供试液X1、X2和X3在室温条件下放置4h后,其IPN质量浓度与0h时的IPN质量浓度均值之比分别为97.45%、95.29%和93.86%;放置5h后的质量浓度均值之比分别为101.72%、95.36%和91.65%;放置6h后的质量浓度均值之比分别为98.86%、95.68%和96.78%。由此可见,ICS药液浓度为药品说明书所述药液终浓度的1/2或1/3时,在室温6h内可以保持稳定。结果见图2A。
供试液X1、X2和X3在30℃恒温水浴锅中放置2h后,其IPN质量浓度与0h的IPN质量浓度均值之比分别为91.90%、101.63%和94.52%;放置4h后的质量浓度均值之比分别为91.62%、96.28%和92.97%;放置6h后的质量浓度均值之比分别为91.11%、97.56%和80.05%。由此可见,ICS药液浓度为药品说明书中药液终浓度的1/2时,在30℃放置6h较为稳定;但ICS药液浓度为药品说明书终浓度的1/3时,在30℃放置6h后,IPN存在明显降解。结果见图2B。
在2~8℃冰箱内冷藏18h后,供试液X2和X3中的IPN质量浓度与0h的IPN质量浓度均值之比分别为101.42%和97.15%,均较为稳定。供试液X1为按照药品说明书方法配制,其药品说明书已记载“2~8℃冰箱内可冷藏24h”,因此本研究未对其进行稳定性考察。
3 讨论
3.1 分剂量操作对ICS中IPN含量一致性的影响
为了更好地了解国内其他儿童医院对ICS的分剂量方式,在开展本研究之初,本课题组先以问卷调查的形式对国内多家儿童医院PIVAS分剂量方式进行了初步调查(拟另文发表)。调查结果显示,在29家涉及ICS分剂量的医疗机构中,使用1.0g规格的占76%(22/29),使用0.5g规格的占24%(7/29);对1.0g规格的ICS分剂量,73%(16/22)的医疗机构采用10mL0.9%氯化钠注射液配制,23%(5/22)的医疗机构采用20mL0.9%氯化钠注射液配制。由此可见,了解这2种分剂量方式是否可能影响IPN的含量一致性具有实际的指导意义。
一项对新生儿常用14种抗生素用药剂量准确性的研究显示,采用“规格法”配制,除ICS和红霉素的实际用量与理论剂量之间的差异大于10%,其余12种抗生素的剂量差异均小于10%,提示上述2种药物以“规格法”配制时,药物剂量的准确性差异较大[9]。但该研究是以IPN含量500mg计,加入5mL0.9%氯化钠注射液作为溶媒,IPN的浓度是由量筒量取稀释后的药液体积推算得出,并未检测所制备药液中IPN的实际浓度。
本研究采用实际工作中常用的2种体积(10、20mL)的0.9%氯化钠注射液分别制备ICS初溶药液,从每份初溶药液中随机抽取1mL视为分剂量操作,同时考虑了不同操作人员之间可能存在的操作误差,对每组药液中的IPN含量进行测定和分析。由表1结果可知,每位操作员在2种分剂量方式下所制备药液中的IPN含量偏差≤10%,可见,从混悬状态的ICS药液中随机抽取一定量的药液,其主药IPN的含量偏差较小。需要注意的是,在每次抽取所需药量时,应当保持药液始终处于均匀分散的混悬状态。此外,ICS原研药与国内仿制药的复溶时间测定结果显示,原研产品的复溶时间更快(1min内溶解完全),仿制药则需要更长的复溶时间(1.5~4.5min)[10]。本研究以原研药为实验药物,复溶时间为1~2min,而对于应用仿制药的医疗机构在配制时还应当注意保证足够的复溶时间。
3.2 IPN在不同浓度、不同温度条件下的稳定性
与IPN治疗效果相关的药动学/药效学参数为游离药物浓度大于最低抑菌浓度的时间占给药间隔的百分比,因此通过延长输注时间(2~4h)可以提高ICS的临床有效率和细菌清除率,减少耐药菌的产生[15―16]。在采取延长输注时间的治疗方式时应当首先考虑不同浓度的药液在实际临床环境中的稳定性。
在一项考察以注射泵延长输注7种β-内酰胺类抗生素的可行性和稳定性研究中,研究者将ICS药液在重症监护病房实际工作环境中放置8h后的IPN质量浓度对比0h质量浓度的偏差<10%视为药液稳定[12]。该研究采用高效液相色谱法测定IPN质量浓度,与0h时的IPN质量浓度相比,放置2h和4h时的IPN质量浓度偏差分别保持在±5%和±10%范围内,放置6h和8h时的IPN质量浓度偏差>10%,因此该研究不建议重症监护病房采用注射泵延长输注ICS。但该研究仅考虑了按照药品说明书方式制得的一个质量浓度(5mg/mL)药液在室温条件下的稳定性。另一项来自泰国的研究评价了IPN2种品牌、2种常用质量浓度(5、10mg/mL)在3个不同温度(25、30、40℃)下在聚氯乙烯袋中的药液稳定性[13]。该研究结果显示,IPN质量浓度为5mg/mL时,2种品牌药液在3个温度下均可稳定6h;而IPN质量浓度为10mg/mL时,2种品牌药液在25℃环境下的稳定性存在明显差异——A品牌仅在3h内稳定,B品牌在6h内稳定,且2种品牌药液在30℃或40℃条件下的稳定时间均小于1h。由此可见,在更高浓度或更高温度下,IPN的稳定性更差,且不同品牌的IPN稳定性也存在差异。
PIVAS在实际医嘱审核时,一般仅控制所配制药液的终浓度不高于药品说明书规定的浓度,由于儿童用药剂量低,按医嘱溶媒量配制后的药液浓度往往低于药品说明书规定的浓度,因此,本研究考察了ICS药液浓度为药品说明书中药液终浓度的1/2和1/3时,在室温或更高温度下的稳定性。本研究发现,当所配制的ICS药液浓度为药品说明书所述终浓度的1/3时,其在室温和冰箱冷藏条件下稳定,但在30℃放置6h时,IPN存在明显降解——与0h相比,质量浓度下降约20%;而药液浓度为药品说明书所述终浓度的1/2时,ICS药液在30℃条件下放置6h可保持稳定。本研究结果提示,在开具或审核ICS医嘱时,应注意控制溶媒量以及配制、运输和输注药液时的环境温度;在考虑采取延长输注的方式时,应当注意药液配制完成时的时间。
综上所述,本研究验证了在儿童常用的2种ICS分剂量方式下,主药IPN的含量一致性较好。ICS药液的稳定性受浓度、温度和时间的影响,更低的浓度在更高的温度下会导致IPN的稳定性降低。临床应注意控制医嘱溶媒量以及配制和使用过程中的环境温度与时间。
