清血消脂降糖方对2型糖尿病大鼠胰岛素抵抗的影响及机制
2025-01-15洪雨欣张蕾周明学李思耐蔺莉张萌郭子轩刘卫红


关键词 清血消脂降糖方;2 型糖尿病;胰岛素抵抗;蛋白激酶R样内质网激酶;叉头框蛋白O1
2 型糖尿病(type 2 diabetes mellitus,T2DM)是以胰岛素抵抗(insulin resistance,IR)和胰岛β细胞功能不足导致血糖调节失常为主要特征的慢性代谢紊乱疾病[1]。在T2DM中,IR 导致的高胰岛素血症和高血糖会通过负反馈机制加剧IR;同时胰岛素反应性降低,无法有效抑制肝葡萄糖输出,导致肝脏发生IR,从而进一步加剧糖脂代谢紊乱[2]。故改善IR是治疗T2DM的关键策略。
IR、慢性低度炎症与氧化应激之间关系复杂。慢性炎症反应及氧化应激可通过损害胰岛素信号传导等途径诱发或加重IR;同时,IR 可导致糖脂代谢紊乱,进而加剧炎症反应和氧化应激,形成恶性循环[3]。内质网应激(endoplasmic reticulum stress,ERS)在IR 的发生发展中起着重要作用,当机体处于持续应激状态时,内质网无法正确折叠蛋白质,从而引发ERS[4]。蛋白激酶R 样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK)作为关键传感器,在肝脏糖代谢中扮演着重要角色。当发生ERS 时,肝脏PERK 信号通路被激活,进而调节下游叉头框蛋白O1(forkhead box O1,FOXO1)活性,促进糖异生,增加肝糖输出,最终加重IR引起的高血糖[5]。此外,PERK信号通路可通过抑制胰岛素受体酪氨酸激酶活性、促进胰岛素受体降解、抑制葡萄糖转运和促进脂质合成等,进一步抑制胰岛素信号传导,加剧IR[6]。
清血消脂降糖方是在首都医科大学附属北京中医医院名老中医临床经验方清血消脂方的基础上继承和创新而成,具有清热泻火、健脾化痰、活血消瘀的功效,临床用于治疗T2DM收效颇佳,但其具体作用机制尚不明确。本研究拟构建T2DM大鼠模型,初步探讨清血消脂降糖方对T2DM大鼠IR 的影响,并从PERK/FOXO1信号通路出发初步探讨其潜在作用机制,为该方防治T2DM提供科学依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器有ACCU-CHEK Active 型血糖仪[罗氏诊断产品(上海)有限公司]、Synergy H1 型多功能酶标仪(美国Bio-Tek 公司)、3-18K型高速冷冻离心机(美国Sigma 公司)、Aperio CS2 型玻片扫描仪、Autostainer XL 型全自动染色机(德国Leica 公司)、MM400 型高通量组织研磨系统(德国Retsch 公司)、Tanon 4600 型全自动化学发光图像分析系统(上海天能科技有限公司)等。
1.2 主要药品与试剂
黄连、虎杖、大黄、姜黄、泽泻、萆薢、茵陈、白术、石菖蒲、红花中药饮片(批号分别为23052405、20221106、230513001、21061003、20231024、20221116、20230731、23101202、20230727、20230922)均购于北京同仁堂制药有限公司,经首都医科大学附属北京中医医院药学部韩旭阳副主任药师鉴定均为真品;盐酸二甲双胍片(规格250 mg/片,批号H37020550)购于蓬莱诺康药业有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoproteincholesterol,LDL-C)、高密度脂蛋白胆固醇(high-densitylipoprotein cholesterol,HDL-C)、天冬氨酸转氨酶(aspartatetransaminase,AST)、丙氨酸转氨酶(alanine transaminase,ALT)、碱性磷酸酶(alkaline phosphatase,AKP)生化试剂盒(批号分别为20240123、20240123、20240123、20240123、20230714、20240120、20240120)均购于南京建成生物工程研究所;链脲佐菌素(streptozotocin,STZ)、柠檬酸钠缓冲液及丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(批号分别为S8085、C1013、BC0025、BC5165)均购于北京索莱宝科技有限公司;白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、C反应蛋白(C-reactive protein,CRP)酶联免疫吸附测定(ELISA)试剂盒(批号分别为A30640321、A38240412、A39440151)均购于杭州联科生物技术股份有限公司;胰岛素ELISA 试剂盒(批号BSI2405141864)购于上海爱萌优宁生物技术有限公司;鼠源β-肌动蛋白(β-actin)单克隆抗体(批号TA-09)购于北京中杉金桥生物技术有限公司;兔源PERK多克隆抗体(批号24390-1-AP)购于武汉三鹰技术有限公司;兔源磷酸化PERK(p-PERK)多克隆抗体(批号3179S)、兔源磷酸化FOXO1(p-FOXO1)单克隆抗体(批号84192S)均购于美国CST公司;兔源FOXO1 单克隆抗体、辣根过氧化物酶(HRP)标记的山羊抗鼠IgG 二抗、HRP标记的山羊抗兔IgG 二抗(批号分别为ab179450、ab6789、ab6721)均购于英国Abcam公司。
1.3 动物
本研究所用动物为SPF 级SD雄性大鼠,共84 只,6周龄,体重(200±30) g,购自北京维通利华实验动物技术有限公司[生产许可证号为SCXK(京)2021-0006]。大鼠购入后,饲养于首都医科大学附属北京中医医院北京市中医药研究所SPF 级动物房内,饲养环境为12 h 明/12 h 暗交替、温度(22±2) ℃、相对湿度(40±5)%,饲养期间大鼠自由活动。本实验已通过首都医科大学附属北京中医医院北京市中医药研究所实验动物伦理委员会审查批准(伦理审批号为SQ-2022-02-50)。
2 方法
2.1 药液制备
清血消脂降糖方组成:黄连30 g,虎杖、大黄、姜黄、泽泻、茵陈、白术各15 g,萆薢、石菖蒲各10 g,红花5 g。取以上药材,用10 倍量水浸泡60 min,煎煮1 h,趁热纱布过滤;取药渣加8 倍量水二次煎煮30 min,过滤,合并煎液,浓缩滤液质量浓度为1.305 g/mL(以生药量计)。使用研钵研磨二甲双胍片直至粉末状,计算所需给药剂量后以0.5% 羧甲基纤维素钠溶液进行溶解。
2.2 造模、分组与给药
SD大鼠适应性喂养1 周后,采用随机数字表法将其分为正常对照组(8 只)和造模组(76 只)。正常对照组大鼠予以普通饲料饲养,造模组大鼠予以高脂高糖饲料饲养。连续喂养4 周后,造模组大鼠隔天按30 mg/kg 腹腔注射1 次STZ溶液(0.1 mol/L;以pH4.5 柠檬酸钠无菌缓冲溶液为溶剂,现配现用),共注射3 次;正常对照组大鼠腹腔注射等量柠檬酸钠缓冲液。以大鼠非同日检测(隔天检测1 次)的3 次空腹血糖(fasting blood glucose,FBG)>11.1 mmol/L、随机血糖>16.7 mmol/L 为T2DM造模成功的判断标准[7],共有44 只大鼠造模成功。根据体重及FBG结果将造模成功的大鼠随机分为模型组及清血消脂降糖方低、高剂量组(6.525、13.05 g/kg;根据人与大鼠体表面积换算,分别为0.5、1 倍临床等效剂量)和二甲双胍组(阳性对照,0.18 g/kg,临床等效剂量),每组11 只。给药组大鼠灌胃相应药物,正常对照组、模型组大鼠灌胃等体积生理盐水;每日1 次,持续6 周。实验期间,正常对照组大鼠均存活,模型组大鼠因血糖持续升高死亡4 只,3 个给药组大鼠因在实验过程中操作不当共死亡4 只,每组最终均以8只大鼠进行实验。
2.3 体重、FBG测定及口服葡萄糖耐量试验
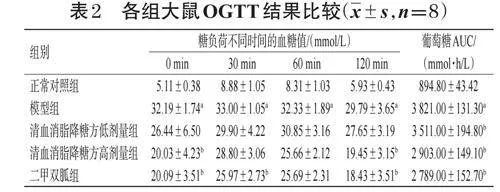
给药前及给药后每周末记录大鼠体重、FBG。末次给药后,大鼠禁食不禁水12 h,进行口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),测量各组大鼠FBG(即0 min 时血糖值),然后灌胃50% 葡萄糖溶液(2g/kg),分别于糖负荷30、60、120 min 时,采用尾尖取血法测定大鼠血糖值,绘制OGTT曲线并计算葡萄糖曲线下面积(area under the curve,AUC)。葡萄糖AUC=(0min 血糖值+2×30 min 血糖值+3×60 min 血糖值+2×120 min血糖值)/4。
2.4 取材及样本处理
OGTT后第2 天,大鼠禁食不禁水12 h,称重并测量大鼠FBG 后,处死大鼠,腹主动脉取血并以3 000 r/min离心10 min,留上清,置于-80 ℃冰箱中保存。取血后,解剖大鼠,迅速取相同部位的肝脏中叶,使用生理盐水漂洗干净,将部分组织固定于10% 中性固定液中,另一部分组织置于-80 ℃冰箱中保存。
2.5 血清胰岛素水平、生化指标及炎症因子检测
取血清样品,采用ELISA 法检测血清空腹胰岛素(fasting insulin,FINS)水平,并计算大鼠胰岛素抵抗指数(HOMA-IR)及胰岛素敏感指数(insulin sensitivity index,ISI)。HOMA-IR=FINS(mIU/L)×FBG(mmol/L)/22.5,ISI=1/(FBG×FINS)。由于ISI 为非正态分布,计算结果取自然对数[8]。采用微量法检测大鼠血清中血脂(TC、TG、LDL-C、HDL-C)、肝功能(ALT、AST、AKP)及氧化应激(MDA、SOD)指标水平;采用ELISA 法检测血清中炎症因子(IL-6、TNF-α、CRP)水平。
2.6 肝组织病理学观察
取10% 中性固定液固定的肝组织,经乙醇梯度脱水后,依次放入二甲苯中透明,再浸入石蜡中进行包埋,制成5 μm厚切片。使用全自动染色机进行HE染色后,采用玻片扫描仪进行成像。
2.7 肝组织中PERK/FOXO1 信号通路相关蛋白表达检测
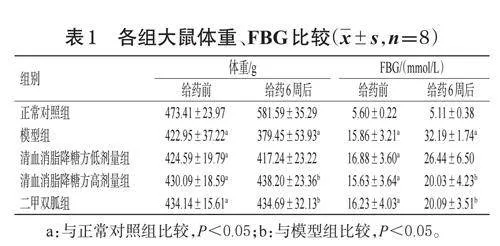
采用Western blot 法检测。取适量置于-80 ℃保存的大鼠肝组织,加入RIPA裂解液进行匀浆,静置30 min后,在4 ℃下以12 000 r/min 离心10 min,取上清,采用BCA 法检测总蛋白浓度。每组取15 μg 总蛋白煮沸变性,上样进行电泳(以恒压80 V启动,蛋白进入分离胶后调至120 V),在恒流400 mA下湿法转膜,以快速封闭液封闭;加入β-actin(稀释度为1∶2 000)、PERK(稀释度为1∶500)以及p-PERK、FOXO1、p-FOXO1(稀释度均为1∶1 000)一抗,4 ℃孵育过夜;漂洗3 次,加入对应二抗(稀释度均为1∶10 000),室温孵育40 min;漂洗3 次,应用化学发光仪进行成像,采用Image J 软件分析蛋白灰度值,以p-PERK 与PERK、p-FOXO1 与FOXO1 的灰度比值分别表示PERK、FOXO1蛋白的磷酸化水平。
2.8 统计学方法
采用GraphPad Prism 9.5 软件进行数据分析和作图。通过Shapiro-Wilk 进行正态性检验,符合正态分布的计量资料以x±s 表示。多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。检验水准α=0.05。
3 结果
3.1 清血消脂降糖方对T2DM大鼠体重、FBG的影响
给药前,与正常对照组比较,其余各组大鼠体重均显著降低(P<0.05),FBG均显著升高(P<0.05)。给药6 周后,与模型组比较,清血消脂降糖方高剂量组和二甲双胍组大鼠体重均显著升高(P<0.05),FBG 均显著降低(P<0.05)。结果见表1。
3.2 清血消脂降糖方对T2DM大鼠OGTT结果的影响
与正常对照组比较,模型组大鼠在糖负荷30 min时血糖值达峰值,且在糖负荷60、120 min 时血糖值及葡萄糖AUC 仍显著升高(P<0.05);与模型组比较,清血消脂降糖方高剂量组和二甲双胍组大鼠在糖负荷0、120 min 时的血糖值、葡萄糖AUC 以及二甲双胍组大鼠在糖负荷30 min 时的血糖值、清血消脂降糖方低剂量组大鼠葡萄糖AUC 均显著降低(P<0.05)。结果见表2。
3.3 清血消脂降糖方对T2DM大鼠血清胰岛素水平的影响
与正常对照组比较,模型组大鼠FINS、HOMA-IR显著升高(P<0.05),ISI 显著降低(P<0.05);与模型组比较,清血消脂降糖方高剂量组和二甲双胍组大鼠FINS、HOMA-IR 均显著降低(P<0.05),ISI 均显著升高(P<0.05)。结果见表3。
3.4 清血消脂降糖方对T2DM大鼠血脂水平的影响
与正常对照组比较,模型组大鼠血清中LDL-C、TC、TG水平均显著升高(P<0.05),HDL-C水平显著降低(P<0.05);与模型组比较,各给药组大鼠血清中LDLC、TC、TG水平均显著降低(P<0.05),清血消脂降糖方高剂量组和二甲双胍组大鼠血清中HDL-C水平均显著升高(P<0.05)。结果见表4。
3.5 清血消脂降糖方对T2DM大鼠肝功能、氧化应激及炎症相关指标的影响
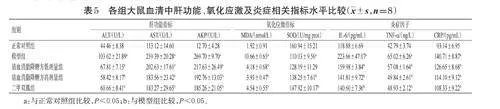
与正常对照组比较,模型组大鼠血清中ALT、AST、AKP、MDA、IL-6、TNF- α、CRP 水平均显著升高(P<0.05),SOD水平显著降低(P<0.05);与模型组比较,各给药组大鼠血清中ALT、AST、AKP、MDA、IL-6、TNF-α、CRP 水平均显著降低(P<0.05),清血消脂降糖方高剂量组和二甲双胍组大鼠血清中SOD水平均显著升高(P<0.05)。结果见表5。
3.6 清血消脂降糖方对T2DM大鼠肝组织病理学的影响
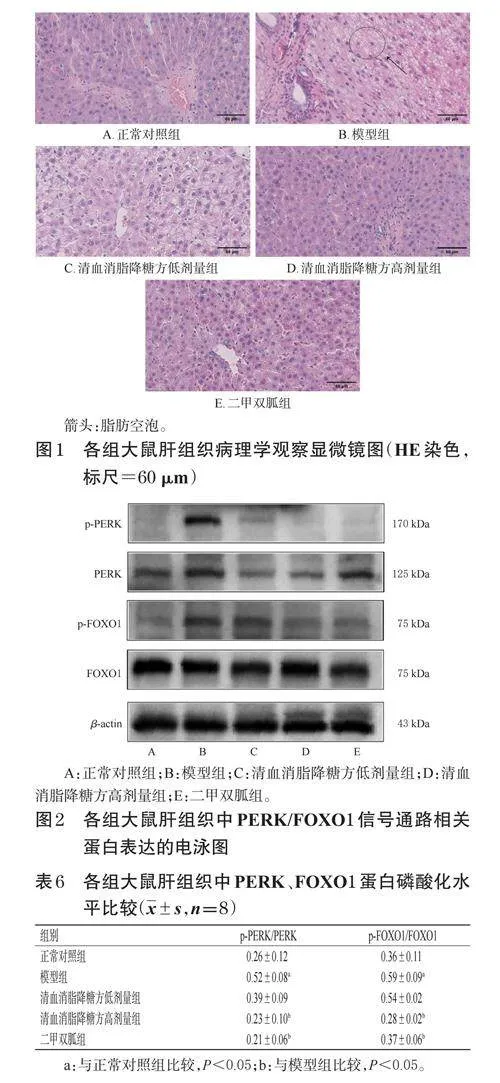
正常对照组大鼠肝组织形态规则,肝小叶结构紧密,肝细胞排列有序,肝血窦界限清晰,周围未见明显纤维组织增生或炎症细胞浸润,胆小管和门管区结构较为完整。模型组大鼠肝组织结构异常,肝细胞排列紊乱,出现明显空泡变性及脂肪变性;胞浆内可见脂滴空泡,肝血窦出现少量瘀血现象,炎症细胞浸润明显。与模型组比较,各给药组大鼠肝组织形态及病理变化均有不同程度改善。结果见图1。
3.7 清血消脂降糖方对T2DM大鼠肝组织中PERK/FOXO1 信号通路相关蛋白表达的影响
与正常对照组比较,模型组大鼠肝组织中PERK、FOXO1 蛋白磷酸化水平显著升高(P<0.05);与模型组比较,清血消脂降糖方高剂量组和二甲双胍组大鼠肝组织中PERK、FOXO1 蛋白磷酸化水平显著降低(P<0.05)。结果见图2、表6。
4 讨论
T2DM属中医“消渴”范畴,首见于《素问·奇病论》。《重广补注黄帝内经素问》言:“中满则宿食积滞,脾气上溢……终致消渴之疾”。这提示恣食肥甘厚味,致使胃热炽盛,乃消渴主要病机。《医门法律》认为:消渴病始于胃热,形成中消之症。可见,T2DM早期多以实热证为主,尤以胃热炽盛为要。再者,过食肥甘,胃失和降,脾失健运,致痰湿内生;脾失运化,水谷精微不得输布,影响宗气生成,而血行瘀滞,凝而留止[9]。如此,热、痰、湿、浊、瘀等病理因素相互交织,共同促进了消渴初期的发生与进展。针对此病机,清血消脂降糖方精妙配伍,以黄连为君,其味苦、性寒,专于清热燥湿、泻火解毒,尤善清除胃热、治疗湿热壅滞之症;虎杖助其利湿化痰、散瘀解毒;大黄则通腑降浊、活血祛瘀。三药合用,既增强清热解毒之力,又通腹泄浊,使毒邪从下而出,同时避免黄连燥湿过甚之弊。姜黄性温、活血行气,既助虎杖、大黄活血之力,又消君药之苦寒;茵陈、泽泻、萆薢共为臣药,强化利湿化痰之效;佐以白术、石菖蒲健脾醒脾、和胃化痰;更用红花为使药,加强活血之力,引诸药之力祛除血脉之瘀滞。在临床应用中,该方不仅能有效缓解T2DM患者早期口渴多饮、消谷善饥等胃火炽盛症状,还能通过健脾化湿、祛痰活血的作用,改善患者乏力、肢体困重、舌厚苔腻等症状,促进体内热毒、脂浊、痰湿、瘀血等病理产物排出,切中T2DM早期关键病机环节。
肝脏是调节血糖平衡的重要器官,可通过糖原合成与分解、糖异生等途径维持血糖的稳定。健康状态下,肝脏对胰岛素的敏感性较高,能迅速响应胰岛素信号,降低血糖浓度;而在T2DM患者中,肝脏IR 现象显著,导致其对胰岛素敏感性降低,无法有效调控血糖[10]。本研究结果显示,清血消脂降糖方可降低T2DM大鼠FBG,改善葡萄糖耐量异常,降低血清胰岛素水平,增加胰岛素敏感性,降低血清中LDL-C、TC、TG水平,提高血清中HDL-C水平,改善肝功能及肝组织病理变化,纠正糖脂代谢紊乱。
慢性低度炎症在T2DM的发病机制中发挥着重要作用。长期的高血糖和代谢紊乱会引发持续性炎症反应,损害胰岛β细胞功能,并导致胰岛素反应减弱,进而引发IR。此外,相关研究提出了“肠道-下丘脑-肝脏/脂肪/胰腺轴”的新概念,认为在代谢紊乱和炎症条件下,这些器官之间的相互作用形成的局部炎症微环境会加剧全身的炎症,推动T2DM的发展[11]。因此,降低机体炎症反应对防治T2DM具有重要意义。IL-6 在高水平时可损坏胰岛β细胞功能;TNF-α可通过不同机制干扰胰岛素信号传导,导致IR;CRP 水平升高会加重IR[12]。本研究结果显示,清血消脂降糖方可降低T2DM大鼠血清中IL-6、TNF-α、CRP 水平,表明清血消脂降糖方可以缓解T2DM大鼠炎症状态。
氧化应激与T2DM的发生发展密切相关,是诱发IR的重要因素之一。MDA是脂质过氧化的产物,可作为衡量氧化损伤程度的重要指标;而SOD为抗氧化酶,能清除超氧阴离子自由基,保护细胞免受氧化损伤[13]。在T2DM大鼠模型中发现,升高血清SOD活性、降低MDA水平,可保护胰岛β细胞功能免受氧化应激的损害,缓解IR[14]。本研究结果显示,清血消脂降糖方可降低T2DM大鼠血清中MDA水平并升高SOD活性,这对于缓解T2DM大鼠IR 具有重要意义。
ERS是细胞应对各种压力的保护性反应。PERK作为ERS 的关键传感器,在维持细胞稳态中发挥重要作用。然而,PERK的长期或过度激活会导致细胞功能紊乱,并与多种代谢性疾病相关,包括T2DM[15]。FOXO1作为关键转录因子之一,在T2DM的发生发展中扮演着重要角色。具体而言,FOXO1 可通过抑制胰岛素信号传导及葡萄糖摄取、促进糖异生及脂质合成等机制,导致糖脂代谢紊乱,引发IR,增加T2DM及其并发症的发生风险[16]。当细胞发生氧化应激时,PERK被激活,进而使FOXO1 磷酸化,增强其转录活性。激活的FOXO1 一方面可以诱导抗氧化酶的表达,发挥保护作用;另一方面,过度激活FOXO1 会加剧氧化应激和炎症反应,进一步损害胰岛β细胞功能,促进IR 的发生发展[17]。本研究结果显示,经清血消脂降糖方干预后,T2DM大鼠肝脏组织中PERK、FOXO1 蛋白磷酸化水平降低,表明清血消脂降糖方可能通过抑制PERK/FOXO1 信号通路调控T2DM大鼠炎症反应及氧化应激水平,改善IR。
综上,清血消脂降糖方可调节T2DM大鼠糖脂代谢、氧化应激和炎症水平,同时提高胰岛素敏感性,缓解肝脏损伤,从而改善IR,其作用机制可能与抑制PERK/FOXO1 信号通路有关。本研究为清血消脂降糖方防治T2DM提供了实验依据,后续本课题组将深入研究其涉及的分子机制。
