磁共振动态增强和弥散加权成像评估直肠癌术前壁外血管侵犯的价值分析
2025-01-01丁伟莉毛龙云方权

【摘要】目的 探讨动态增强(DCE)和弥散加权磁共振成像(DWI-MRI)评估直肠癌术前壁外血管侵犯(EMVI)的价值,为临床治疗提供参考。方法 针对2022年1月至2024年1月期间,义乌市中心医院接收并治疗的72例直肠腺癌病例,分析其临床诊疗资料,以进行回顾性探究。根据EMVI病理诊断结果分为阴性组(35例)和阳性组(37例)。所有患者术前均接受常规序列、DCE及DWI-MRI检查,获得体积转移常数(Ktrans)、细胞外血管外体积分数(Ve)、反流速率常数(Kep)和标准表观扩散系数(ADC)检测。对EMVI阳性与阴性两组患者的临床病理资料进行详尽对比,并深入剖析这两类患者在MRI参数上的差异;同时,评估MRI-EMVI检测结果与病理EMVI诊断结果之间的一致性程度。绘制受试者操作特征(ROC)曲线分析MRI参数诊断病理-EMVI阳性的诊断效能。结果 两组患者性别、年龄、肿瘤位置比较,差异均无统计学意义(均Pgt;0.05)。病理EMVI阳性组患者CEA水平高于阴性组,肿瘤浸润深度大于阴性组,环周浸润率、Ki67阳性表达率均高于阴性组,组织中低分化、T分期3~4期及N分期阳性占比均高于阴性组(均Plt;0.05)。病理-EMVI阳性组患者Ktrans、Kep、ADC均高于阴性组,MRI-EMVI阳性率高于阴性组(均Plt;0.05)。两组患者Ve比较,差异无统计学意义(Pgt;0.05)。与病理EMVI结果比较,MRI-EMVI具有较好的一致性(Kappa值=0.789,Plt;0.05),准确率为83.33%[(29+31)/72],敏感度为78.38%(29/37),特异度为88.57%(31/35)。ROC结果显示:Ktrans、Kep、ADC联合诊断病理-EMVI阳性的曲线下面积(AUC)为0.879,敏感度为89.53%,特异度为85.67%,均优于各项单一诊断(均Plt;0.05)。结论 在直肠腺癌的术前评估中,DCE与DWI-MRI技术均展现出与病理结果的高度一致性,特别是在确定EMVI阳性状态方面的诊断效能颇为显著。这两项技术不仅能揭示肿瘤的恶性侵袭程度,而且通过联合应用Ktrans、Kep及ADC定量参数,进一步提升EMVI阳性诊断的精确性,预示其在临床实践中具有广阔的应用前景与重要价值。
【关键词】磁共振成像;动态增强;弥散加权;直肠癌;壁外血管侵犯;体积转移常数;反流速率常数;标准表观扩散系数
【中图分类号】R445.2 【文献标识码】A 【文章编号】2096-2665.2025.02.0125.04
DOI:10.3969/j.issn.2096-2665.2025.02.039
壁外血管侵犯(EMVI)是指固有肌层以外血管内存在恶性细胞,手术病理证实约1/3直肠癌患者存在EMVI,其被视为直肠癌早期复发及远端转移的一个关键风险要素,且为评估不良预后情况的独立指标[1-2]。国家综合癌症网络直肠癌指南推荐, EMVI可作为新辅助治疗的重要影像学参数[3]。然而, EMVI目前主要基于术中标本的病理结果,完全依赖组织学标本可能会低估EMVI的灵敏度[4]。 MRI技术能清晰展现直肠及其周围组织的全面状况,通过功能磁共振成像技术识别的直肠EMVI情况,与直肠癌的组织病理学检查结果往往高度吻合[5]。弥散加权成像(DWI)和动态对比增强(DCE)是临床广泛使用的功能成像技术,DCE通过量化通透性、灌注和肿瘤微血管生成相关的参数,反映肿瘤微血管属性和血流动力学,还可整合肿瘤形态学改变特征[6]。定量DCE参数与多种恶性肿瘤的临床特征、组织学分级、新辅助放化疗反应及预后因素密切相关[7]。此外, DWI计算标准表观扩散系数(ADC)能反映水分子的扩散运动情况。直肠癌中的ADC指标与癌症的分期阶段、恶性程度高低及患者的临床预后情况均存在密切的关联性,因此,ADC是直肠癌诊断中具有高度敏感性的图像生物学标志物[8]。基于此,本研究分析DCE和DWI-MRI评估直肠腺癌术前EMVI的应用价值,现报道如下。
1 资料与方法
1.1 一般资料 针对2022年1月至2024年1月期间,义乌市中心医院接收并治疗的72例直肠腺癌病例,分析其临床诊疗资料,以进行回顾性探究。根据EMVI病理诊断结果分为阴性组(35例)和阳性组(37例)。两组患者一般资料,见表1。本研究经义乌市中心医院医学伦理委员会批准。纳入标准:⑴病理证实直肠腺癌[9],无盆腔手术史;⑵术前接受常规序列、 DCE和DWI-MRI检查。排除标准:⑴存在直肠转移癌或其他部位原发恶性肿瘤者,如肺癌;⑵既往行新辅助放化疗者;⑶存在黏液腺癌者。
1.2 研究方法
1.2.1 分组方法 将患者根据病理诊断分为EMVI阴性组(35例)和阳性组(37例)。所有患者术前均接受常规序列、 DCE及DWI-MRI检查,获得体积转移常数(Ktrans)、细胞外血管外体积分数(Ve)和反流速率常数(Kep)和标准ADC值。统计患者性别、年龄、癌胚抗原(CEA)水平、肿瘤浸润深度、环周浸润率、肿瘤位置、组织分化程度、 T分期、 N分期和Ki67阳性表达率。病理EMVI阳性标准[10]: HE染色显示固有肌层外的内皮细胞排列空间内存在圆形肿瘤组织,肿瘤细胞侵入血管腔或淋巴管。
1.2.2 MRI检查和分析 使用磁共振成像系统[美国 GE Medical Systems, LLC,型号: GE Signa HDxt 1.5 T]进行常规序列、 DCE和DWI-MRI检查。扫描参数: T2WI序列TR=4 800 ms, TE=115 ms, FOV=220 mm×220 mm,厚度3 mm,矩阵320×256; DWI序列TR=5 700 ms, TE=85 ms,FOV=340 mm×340 mm,厚度3 mm,矩阵288×192, b值为0、 100和800 s/mm2; DCE序列TR=5.1 ms, TE=1.7 ms,FOV=340 mm×340 mm,厚度3 mm,矩阵288×192。屏气多相肝脏加速容积采集序列进行DCE扫描。钆喷酸葡胺注射液[广州康辰药业有限公司,国药准字H10950272,规格:15 mL∶7.04 g(按C14H20GdN3O10·2C7H17NO5计)],剂量为0.1 mmol/kg弹丸式注入掌骨背静脉(最大剂量0.6 mL),速率2.5 mL/s,后立即使用20 mL生理盐水冲洗。每个阶段获得30个轴向切片,共35个连续自动扫描,整个扫描时间35~40 min。
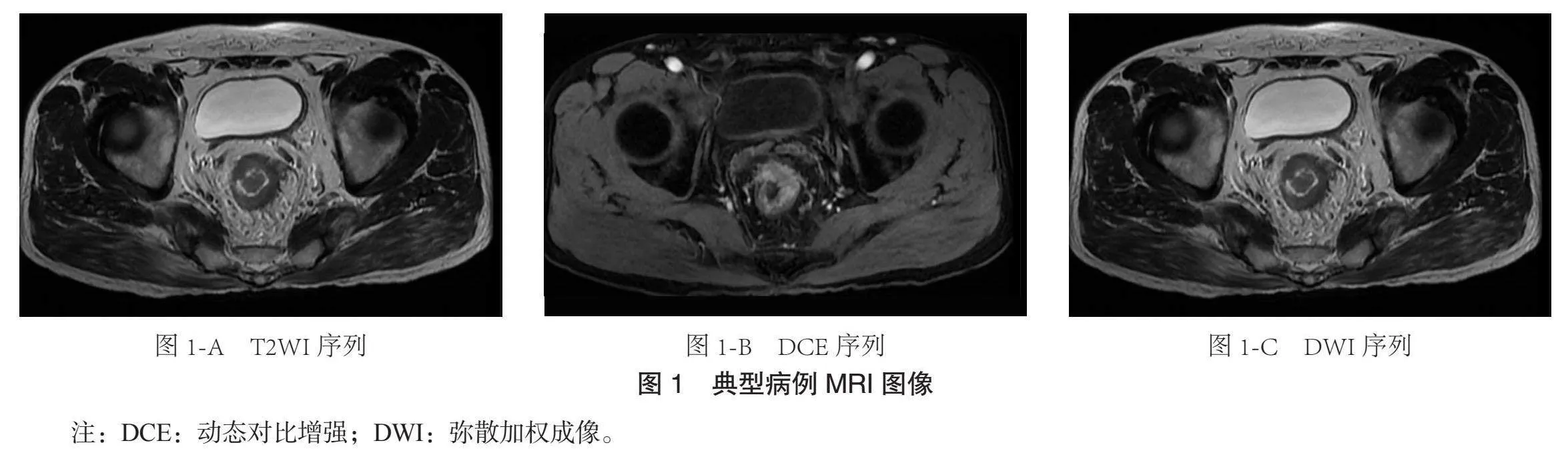
由两名多年腹部成像经验的放射科医生对MRI图像进行独立分析,根据Smith等[11]意见,MRI-EMVI被划分为5个等级,0~2分被界定为阴性范畴,3~4分则归属于阳性范畴。T2WI显示肿瘤展现出螺旋状延伸形态,其信号强度清晰可辨于直肠系膜血管结构内内,伴随不规则血管扩张和血管边界轮廓;DWI显示血管系统内高信号特征,腔内充盈缺损;DCE显示血管腔被充盈缺损或肿瘤信号影取代。分别在ADC图和DCE上测量参数,避开血管、钙化、坏死和囊性部分,在可见肿瘤的最大尺寸上手动追踪感兴趣区(ROI),以T2WI和DWI图像作为参考,确保ROI准确定位。ADC在GE工作站上使用Functool软件自动计算,使用tissue 4D软件获取DCE定量参数Ktrans、Ve、Kep。典型病例,见图1。患者为男性,58岁,因“排便习惯改变1月”就诊,直肠MRI T2WI序列(见图1-A)、DCE序列(见图1-B)和DWI序列(见图1-C)。提示“中位直肠癌,T3N2,EMVI(+)。行“腹腔镜下直肠癌根治”术。病理结果:⑴直肠溃疡型,浸润性腺癌(中分化),浸润至肌层下纤维脂肪组织,肿块大小:4 cm×4 cm×1 cm,侵犯神经,1枚淋巴结脉管内见肿瘤细胞团。⑵肿瘤出芽分级:中级别,病理分期为pT3N1M0。⑶肠周2/11枚淋巴结见癌转移(其中1枚淋巴结为脉管内见肿瘤细胞团)。⑷上、下切缘阴性,局灶环周切缘阳性。
1.3 统计学分析 采用SPSS 23.0统计学软件进行数据分析,计数资料[例(%)]组间比较采用χ2检验;计量资料(x)两组间比较采用t检验;采用组内相关系数(ICC)评价MRI-EMVI与病理-EMVI的一致性,以ICCgt;0.70为相关性良好;绘制受试者操作特征(ROC)曲线,并计算曲线下面积(AUC)。以Plt;0.05为差异有统计学意义。
2 结果
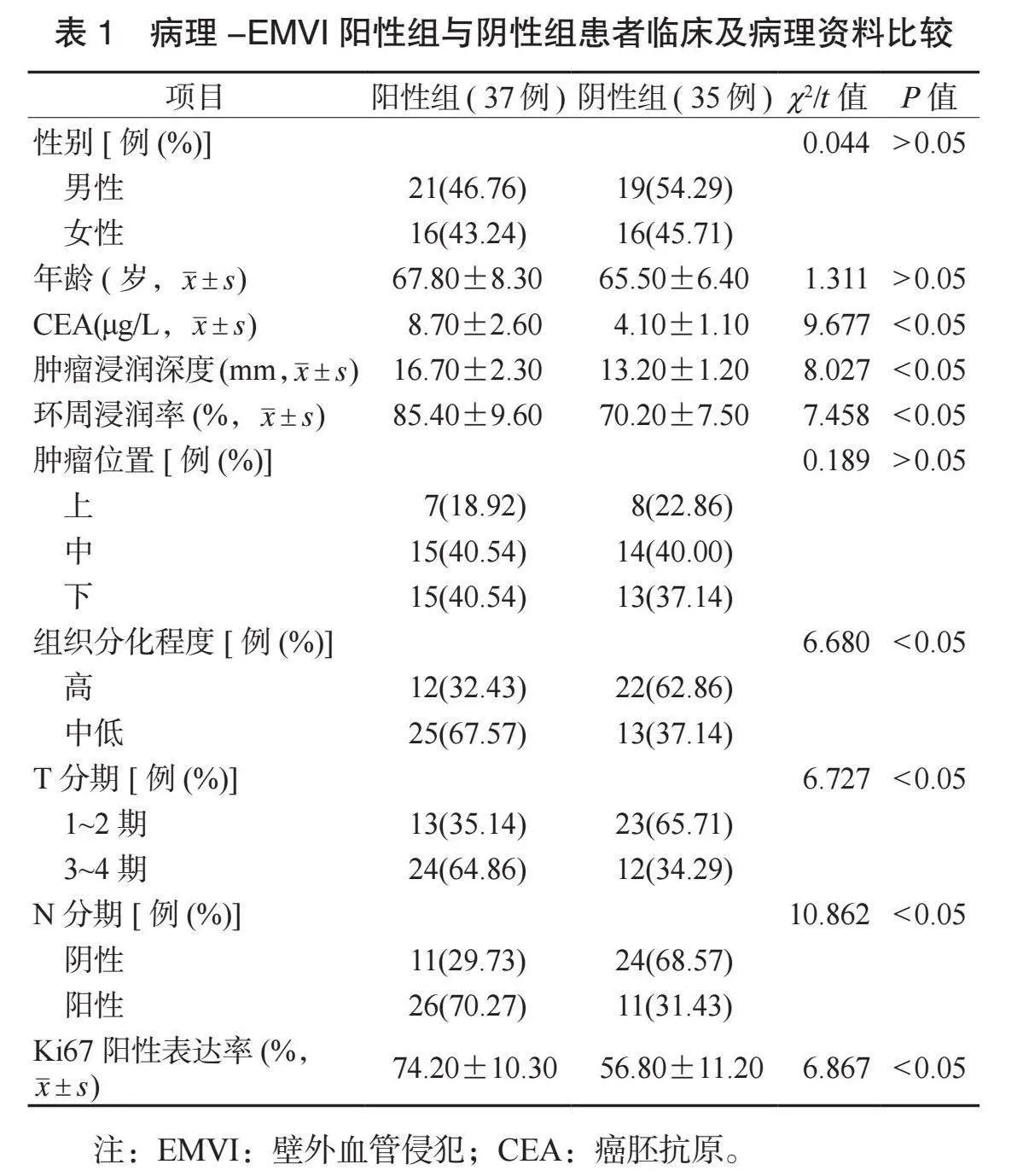
2.1 病理-EMVI阳性组与阴性组患者临床及病理资料比较 两组患者性别、年龄、肿瘤位置比较,差异均无统计学意义(均Pgt;0.05)。病理EMVI阳性组患者CEA水平高于阴性组,肿瘤浸润深度大于阴性组,环周浸润率、Ki67阳性表达率均高于阴性组,组织中低分化、T分期3~4期及N分期阳性占比均高于阴性组,差异均有统计学意义(均Plt;0.05),见表1。
2.2 病理-EMVI阳性组与阴性组患者MRI参数比较 病理-EMVI阳性组患者Ktrans、 Kep、 ADC均高于阴性组, MRI-EMVI阳性率高于阴性组,差异均有统计学意义(均Plt;0.05)。两组患者Ve比较,差异无统计学意义(Pgt;0.05),见表2。
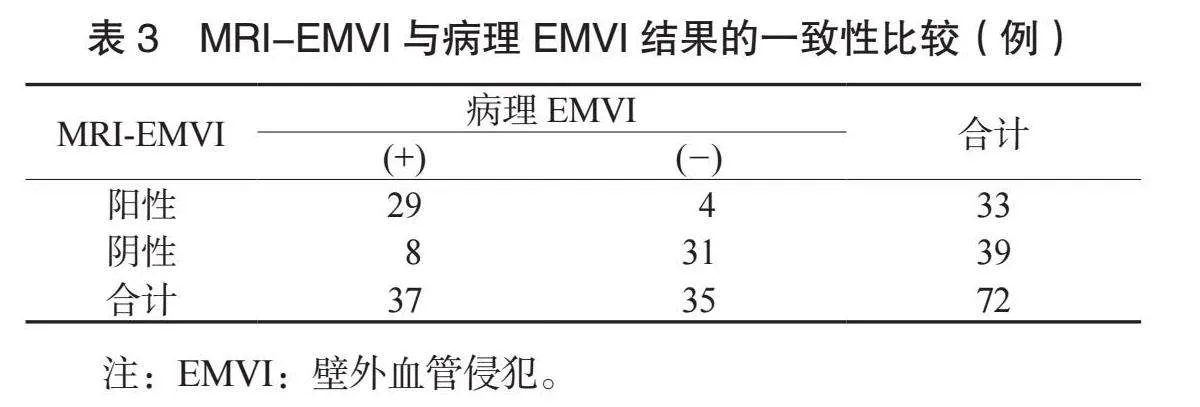
2.3 MRI-EMVI与病理EMVI结果的一致性比较 与病理EMVI结果比较, MRI-EMVI具有较好的一致性(Kappa值=0.789, Plt;0.05),准确率为83.33%[(29+31)/72],敏感度为78.38%(29/37),特异度为88.57%(31/35),见表3。
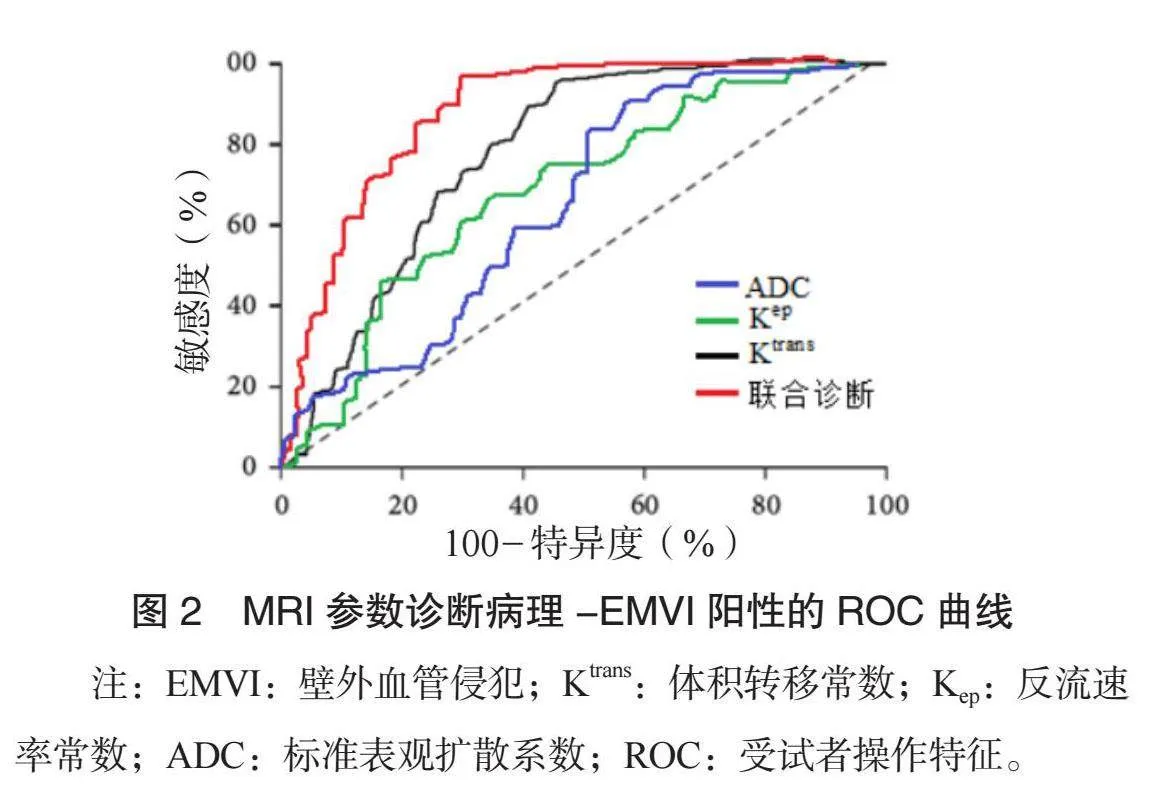
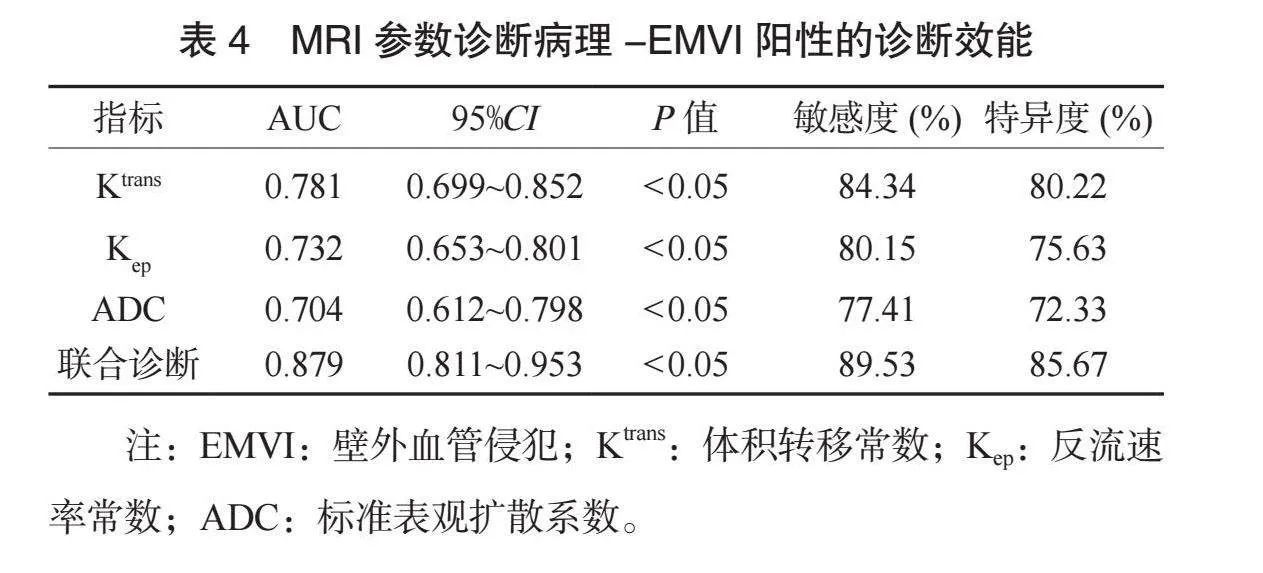
2.4 MRI参数诊断病理-EMVI阳性的诊断效能 ROC结果显示: Ktrans、 Kep、 ADC联合诊断病理-EMVI阳性的AUC为0.879,敏感度为89.53%,特异度为85.67%,均优于各项单一诊断(均Plt;0.05),见表4、图2。
3 讨论
MRI对软组织敏感,能清楚地显示直肠肿瘤对黏膜和黏膜下的浸润程度;DCE技术能揭示肿瘤局部区域的血液灌注状况;而DWI技术则通过评估肿瘤内部水分子活动的状态,从另一维度展现肿瘤的恶性增殖及侵袭力度[12-13]。
本研究结果显示,病理-EMVI阳性率为51.4%;病理EMVI阳性组患者CEA水平高于阴性组,肿瘤浸润深度大于阴性组,环周浸润率、Ki67阳性表达率均高于阴性组,组织中低分化、T分期3~4期及N分期阳性占比均高于阴性组。EMVI阳性是肿瘤术后早期复发和远程转移的重要原因,直接关系到患者的不良预后[14]。MRI-EMVI阳性被定义为肿瘤信号在血管结构内螺旋状延伸;CEA是消化道恶性肿瘤的重要生化标志物,浸润深度、环周浸润率、Ki67阳性表达率、组织分化程度、T分期和N分期是直肠肿瘤的重要病理特征;EMVI阳性是淋巴结转移、局部复发、远程同步转移和总生存率的独立预测因素[15-16]。
本研究结果显示,病理-EMVI阳性组患者Ktrans、Kep、ADC均高于阴性组,MRI-EMVI阳性率高于阴性组;与病理EMVI结果比较,MRI-EMVI具有较好的一致性、准确率、敏感度和特异度;ROC结果显示:Ktrans、Kep、ADC联合诊断病理-EMVI阳性的AUC为0.879,敏感度为89.5%,特异度为85.6%,均优于各项单一诊断。分析原因为,直肠癌若具备更高的恶性特征,则其毛细血管通透性会相应增强,导致患者的康复前景更为严峻,Ktrans与直肠癌的血管受侵程度间,存在正向的关联性[17]。Kep仅由肿瘤血管外细胞外空间的对比剂浓度和分数体积决定,其水平升高表明血液回流血管系统的程度越大,可更准确地反映肿瘤毛细血管的灌注功能[18]。Zhu等[19]通过总结DCE-MRI检测局部进展期胃癌EMVI患者,发现EMVI阳性组Ktrans和Kep高于阴性组,与本研究结果一致。直肠癌的微循环结构复杂,加之其血流分布呈现出异质性,这些都是导致其特定状况的重要因素,而ADC与直肠癌的预后评估及分期判断间存在密切的关联性[20]。
综上所述,在直肠腺癌的术前评估中,DCE与DWI-MRI技术均展现出与病理结果的高度一致性,特别是在确定EMVI阳性状态方面的诊断效能颇为显著。这两项技术不仅能揭示肿瘤的恶性侵袭程度,而且通过联合应用Ktrans、Kep及ADC定量参数,进一步提升EMVI阳性诊断的精确性,预示其在临床实践中具有广阔的应用前景与重要价值。
参考文献
Christou N, Meyer J, Combescure C, et al. Prevalence of metastatic lateral lymph nodes in Asian patients with lateral lymph node dissection for rectal cancer: A meta-analysis[J]. World J Surg, 2021, 45(5): 1537-1547.
Tripathi P, Guo W, Rao S, et al. Additional value of MRI-detected EMVI scoring system in rectal cancer: applicability in predicting synchronous metastasis[J]. Tumori, 2020, 106(4): 286-294.
Kim T H, Woo S, Han S, et al. The diagnostic performance of MRI for detection of extramural venous invasion in colorectal cancer:A systematic review and meta-analysis of the literature[J]. AJR Am J Roentgenol, 2019, 213(3): 575-585.
Gürses B, Böge M, Altınmakas E, et al. Multiparametric MRI in rectal cancer[J]. Diagn Interv Radiol, 2019, 25(3): 175-182.
Chen Y, Yang X, Wen Z, et al. Association between high-resolution MRI-detected extramural vascular invasion and tumour microcirculation estimated by dynamic contrast-enhanced MRI in rectal cancer:preliminary results[J]. BMC Cancer, 2019, 19(1): 498.
李修奎,孟德杰.术前ceMDCT用于原发性胃癌壁外静脉血管侵犯诊断与术后无病生存的相关性分析[J].现代消化及介入诊疗, 2020, 25(10): 1367-1372.
吕霞,刘强,刘岘,等.直肠癌DCE-MRI定量参数与病理分化程度和p53的相关性[J].实用医学杂志, 2022, 38(4): 479-483.
李建华,曾剑兵,于大飞,等. DCE-MRI在直肠癌术前TN分期中的应用价值[J].中国现代普通外科进展, 2020, 23(12): 979-981.
中华医学会肿瘤学分会早诊早治学组.中国结直肠癌早诊早治专家共识[J].中华医学杂志, 2020, 100(22): 1691-1698.
van den Broek JJ, van der Wolf FSW, Heijnen LA, et al. The prognostic importance of MRI detected extramural vascular invasion (mrEMVI) in locally advanced rectal cancer[J]. Int J Colorectal Dis, 2020, 35(10): 1849-1854.
Smith N J, Barbachano Y, Norman A R, et al. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer[J]. Br J Surg, 2008, 95(2): 229-236.
Delli Pizzi A, Chiarelli A M, Chiacchiaretta P, et al. MRI-based clinical-radiomics model predicts tumor response before treatment in locally advanced rectal cancer[J]. Sci Rep, 2021, 11(1): 5379.
章俊,夏鹏,李君君,等. MRI定量分析与影像组学评估直肠癌壁外血管侵犯研究进展[J].临床误诊误治, 2024, 37(8): 95-100.
Haak H E, Maas M, Lahaye M J, et al. Selection of patients for organ preservation after chemoradiotherapy: MRI identifies poor responders who can go straight to surgery[J]. Ann Surg Oncol, 2020, 27(8): 2732-2739.
张景,靳恒军,张芳,等. DWI和T2WI直肠癌体积测量与壁外血管侵犯、淋巴结转移的相关性[J].放射学实践, 2020, 35(9): 1151-1156.
Yu X, Song W, Guo D, et al. Preoperative prediction of extramural venous invasion in rectal cancer: comparison of the diagnostic effcacy of radiomics models and quantitative dynamic contrast-enhanced magnetic resonance imaging[J]. Front Oncol, 2020, 10(4): 459.
刘颖平,易文中,丁如.多模态影像学在直肠癌壁外血管侵犯中的研究进展[J].医学影像学杂志, 2023, 33(1): 131-134.
rampolini F, Taschini S, Pecchi A, et al. Magnetic resonance imaging performed before and after preoperative chemoradiotherapy in rectal cancer: predictive factors of recurrence and prognostic significance of MR-detected extramural venous invasion[J]. Abdom Radiol, 2020, 45(10): 2941-2949.
Zhu Y, Zhou Y, Zhang W, et al. Value of quantitative dynamic contrast-enhanced and dfusion-weighted magnetic resonance imaging in predicting extramural venous invasion in locally advanced gastric cancer and prognostic significance[J]. Quant Imaging Med Surg, 2021, 11(1): 328-340.
Schurink N W, Lambregts D M J, Beets-Tan R G H. Diffusion-weighted imaging in rectal cancer: current applications and future perspectives[J].Br J Radiol, 2019, 92(1096): 20180655.
