替雷利珠单抗、仑伐替尼联合肝动脉持续灌注化疗治疗不可切除肝癌患者的效果观察
2025-01-01王瑞丽黄春霞
【摘要】目的 探讨替雷利珠单抗、仑伐替尼联合肝动脉灌注化疗(HAIC)治疗不可切除肝癌患者的效果,为临床治疗提供参考。方法 选取2022年4月至2023年5月江门市人民医院收治的86例不可切除肝癌患者的临床资料,进行回顾性分析。根据治疗方法不同分为化疗方案组和单抗联合组,每组43例。化疗方案组患者采用奥沙利铂、亚叶酸钙、氟尿嘧啶(mFOLFOX)方案行HAIC治疗,单抗联合组患者在化疗方案组基础上联合替雷利珠单抗、仑伐替尼治疗。比较两组患者临床疗效、肿瘤标志物[糖类抗原199(CA199)、甲胎蛋白(AFP)、癌胚抗原(CEA)]水平、肝功能指标[谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、谷草转氨酶(AST)]水平及不良反应发生情况。结果 单抗联合组患者临床疗效优于化疗方案组,客观缓解率高于化疗方案组(均Plt;0.05)。治疗后,两组患者CA199、AFP、CEA、ALT、ALP、TBIL、AST水平均降低,且单抗联合组均低于化疗方案组(均Plt;0.05)。两组患者消化道反应、肾功能异常、白细胞减少、脱发、手足综合征、发热的不良反应发生率比较,差异均无统计学意义(均Pgt;0.05)。结论 替雷利珠单抗、仑伐替尼联合HAIC治疗不可切除肝癌患者的效果较好,有利于改善肿瘤标志物及肝功能指标表达水平,且安全性较高,值得临床应用。
【关键词】替雷利珠单抗;仑伐替尼;肝动脉持续灌注化疗;肝癌
【中图分类号】R735.7 【文献标识码】A 【文章编号】2096-2665.2025.02.0055.04
DOI:10.3969/j.issn.2096-2665.2025.02.017
在全球范围内,肝癌发病率、病死率分别位于恶性肿瘤疾病的第6位、第3位,其中85%~90%为肝细胞癌,该病无特异性症状,多数患者确诊时已进入中晚期,易错过手术治疗的最佳时间[1]。肝动脉灌注化疗(HAIC)是治疗不可切除肝细胞癌患者的首选方法,但远期治疗效果不理想[2]。目前,程序性死亡蛋白1(PD-1)抑制剂在肝细胞癌治疗中能取得良好临床效果,但单一PD-1治疗效果有效,临床主张联合分子靶向药物、免疫抑制剂等药物治疗,提升疗效,延长患者总体生存期[3]。仑伐替尼是临床新型靶向药物,可抑制肿瘤新生血管生成;替雷利珠单抗是一种免疫治疗药物,可阻断肿瘤细胞结合T淋巴细胞,促使T淋巴细胞精确识别肿瘤细胞,进而杀灭肿瘤细胞[4]。但临床关于HAIC、免疫与靶向药物在不可切除肝癌治疗中应用的研究报道较少,其如何选择尚存在争议。基于此,本研究探讨替雷利珠单抗、仑伐替尼联合HAIC治疗不可切除肝癌患者的效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2022年4月至2023年5月江门市人民医院收治的86例不可切除肝癌患者的临床资料,进行回顾性分析。根据治疗方法不同分为化疗方案组和单抗联合组,每组43例。化疗方案组患者中男性25例,女性18例;年龄44~65岁,平均年龄(52.57±6.71)岁; BMI 19~25 kg/m2,平均BMI(22.32±1.64)kg/m2;肿瘤最大直径4~10 cm,平均肿瘤最大直径(7.64±1.29)cm;肿瘤数量1~4个,平均肿瘤数量(2.58±0.73)个;巴塞罗那临床(BCLC)肝癌分期[5]: A期29例, B期14例;肝功能child-Pugh分级[6]: A级30例, B级13例;肿瘤部位:右肝25例,左肝18例。单抗联合组患者中男性28例,女性15例;年龄45~67岁,平均年龄(53.49±6.85)岁; BMI 19~25 kg/m2,平均BMI(22.45±1.58)kg/m2;肿瘤最大直径4~9 cm,平均肿瘤最大直径(7.51±1.33)cm;肿瘤数量1~4个,平均肿瘤数量(2.62±0.71)个; BCLC肝癌分期: A期31例, B期11例;肝功能child-Pugh分级:"A级29例, B级14例;肿瘤部位:右肝27例,左肝16例。
两组患者一般资料比较,差异无统计学意义(Pgt;0.05),组间具有可比性。本研究经江门市人民医院医学伦理委员会批准。纳入标准:⑴符合《原发性肝癌诊疗规范(2019年版)》[7]中原发性肝癌的诊断标准,且经病理学、影像学等检查确诊为中晚期肝癌患者;⑵无手术切除治疗或其他根治性治疗、局部治疗指征[7];⑶年龄18~75周岁;
⑷美国东部肿瘤协作组体力状况(ECOG-PS)[6]评分≤2分;⑸BCLC肝癌分期[5]B期或C期;⑹肝功能child-Pugh分级[6]A级或B级;⑺预计生存时间gt;3个月。排除标准:⑴对本研究所用药物存在禁忌证者;⑵存在肿瘤远处转移或血管浸润者;⑶既往有肝癌治疗史者;⑷存在凝血功能障碍、肾脏疾病、心脑血管系统疾病、免疫系统疾病者;⑸存在其他恶性肿瘤者;⑹存在严重认知障碍或精神疾病者。
1.2 治疗方法 两组患者均行常规镇痛、护胃、止吐、保肝等对症治疗。化疗方案组患者采用奥沙利铂、亚叶酸钙、氟尿嘧啶(mFOLFOX)方案HAIC治疗:给予患者局部浸润麻醉,根据Seldinger法经股动脉穿刺置入导管,于CT透视引导下确定肿瘤供血动脉,后将微导管置入左(右)肝肿瘤主要供血动脉,导管置入完成后可先输注20 mL肝素抗凝,并妥善固定导管,链接输液泵。取注射用奥沙利铂(先声药业有限公司,国药准字H20093899,规格:50 mg)85 mg/m2、注射用亚叶酸钙(江苏奥赛康药业有限公司,国药准字H20060198,规格:50 mg)400 mg/m2,进行灌注,均于2 h内灌注完成;静脉推注氟尿嘧啶注射液(辽宁新高制药有限公司,国药准字H21024236,规格:0.25 g)400 mg/m2,后以2 400 mg/m2持续灌注46 h氟尿嘧啶注射液。化疗结束后拔除鞘组并按压穿刺点30 min,每3周治疗1次,共治疗12周。
单抗联合组患者在化疗方案组基础上联合替雷利珠单抗、仑伐替尼治疗:将200 mg替雷利珠单抗注射液(广州百济神州生物制药有限公司,国药准字S20190045,规格:100 mg)与100 mL 0.9%NaCl溶液混合后静脉输注,每3周治疗1次。同时,口服甲磺酸仑伐替尼胶囊[南京正大天晴制药有限公司,国药准字H20213638,规格:4 mg(按C21H19ClN4O4计)],体质量≥60 kg患者12 mg/次、1次/d;体质量lt;60 kg患者8 mg/次、1次/d。共治疗12周。
1.3 观察指标 ⑴临床疗效。参照《实体瘤疗效评价标准》[8]评估患者临床疗效,完全缓解(CR):病灶、体征、症状基本消失,维持时间≥4周;部分缓解(PR): CT显示病灶最大病灶直径缩短≥30%,体征、症状明显改善;疾病稳定(SD): CT显示病灶最大病灶直径缩短lt;30%或增大≤20%,病情无恶化现象;疾病进展(PD): CT显示病灶最大病灶直径增大gt;20%或出现新病灶,病情恶化。客观缓解率=[(CR+PR)例数/总例数]×100%。
⑵肿瘤标志物水平及肝功能指标水平。于治疗前及治疗后,采集两组患者空腹静脉血5 mL,以3 000 r/min的转速(离心半径10 cm)离心10 min,取上清液,保存于-80 ℃环境中待测。采用酶联免疫吸附试验检测糖类抗原199(CA199)、甲胎蛋白(AFP)、癌胚抗原(CEA)水平,试剂盒购自南京卡米洛生物工程有限公司;使用全自动生化分析仪(基蛋生物科技股份有限公司,型号: MAGICL6800)检测谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、谷草转氨酶(AST)水平。
⑵不良反应发生情况。观察并记录两组患者不良反应发生情况,包括消化道反应(恶心、呕吐、腹泻、腹痛、消化道出血、厌食)、肾功能异常、白细胞减少、脱发、手足综合征、发热。
1.4 统计学分析 使用SPSS 24.0统计学软件计算数据。计数资料采用[例(%)]表示,采用χ2检验,等级资料比较采用秩和检验;计量资料采用(x)表示,采用t检验。以Plt;0.05为差异有统计学意义。
2 结果
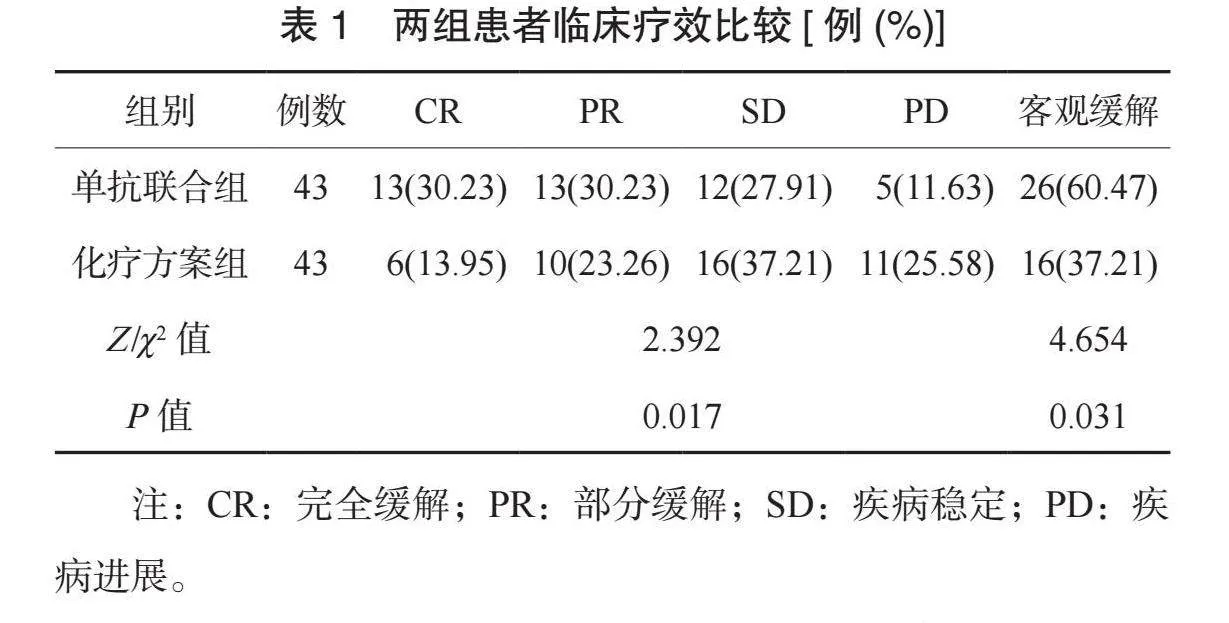
2.1 两组患者临床疗效比较 单抗联合组患者临床疗效优于化疗方案组,客观缓解率高于化疗方案组,差异均有统计学意义(均Plt;0.05),见表1。
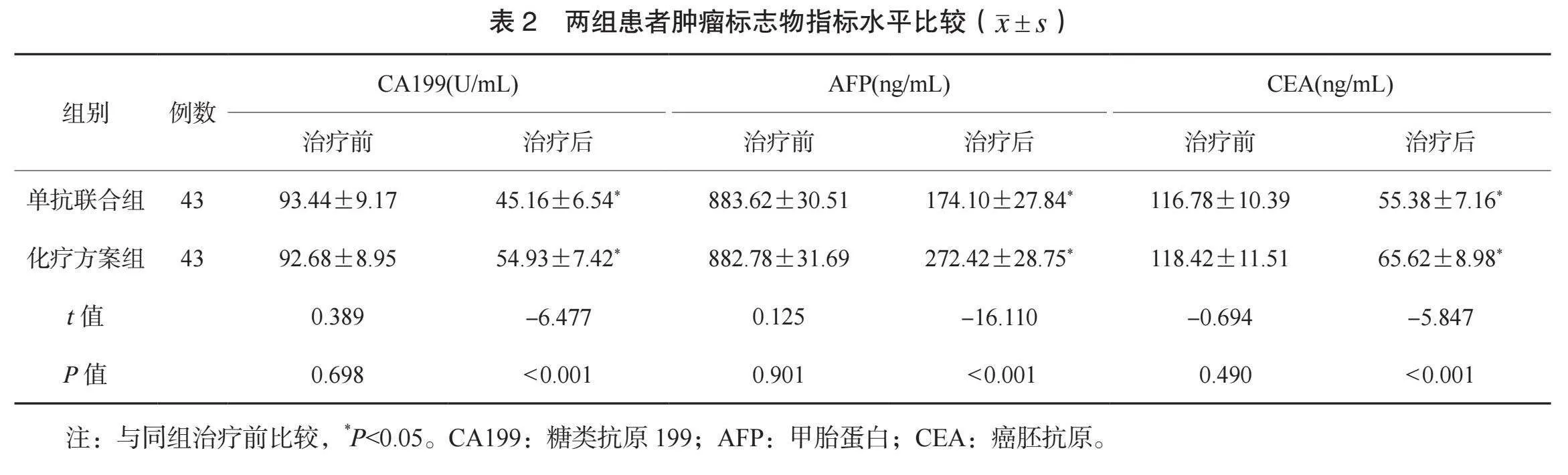
2.2 两组患者肿瘤标志物指标水平比较 治疗前,两组患者CA199、 AFP、 CEA水平比较,差异均无统计学意义(均Pgt;0.05)。治疗后,两组患者CA199、 AFP、 CEA水平均降低,且单抗联合组均低于化疗方案组,差异均有统计学意义(均Plt;0.05),见表2。
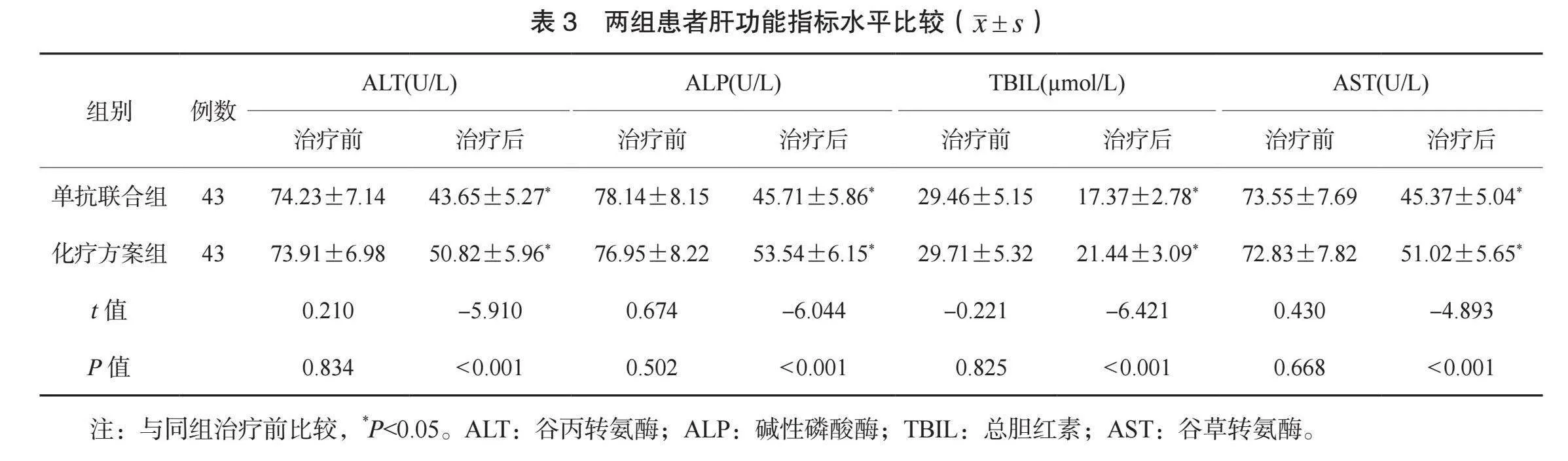
2.3 两组患者肝功能指标水平比较 治疗前,两组患者ALT、 ALP、 TBIL、 AST水平比较,差异均无统计学意义(均Pgt;0.05)。治疗后,两组患者ALT、 ALP、 TBIL、 AST水平均降低,且单抗联合组均低于化疗方案组,差异均有统计学意义(均Plt;0.05),见表3。
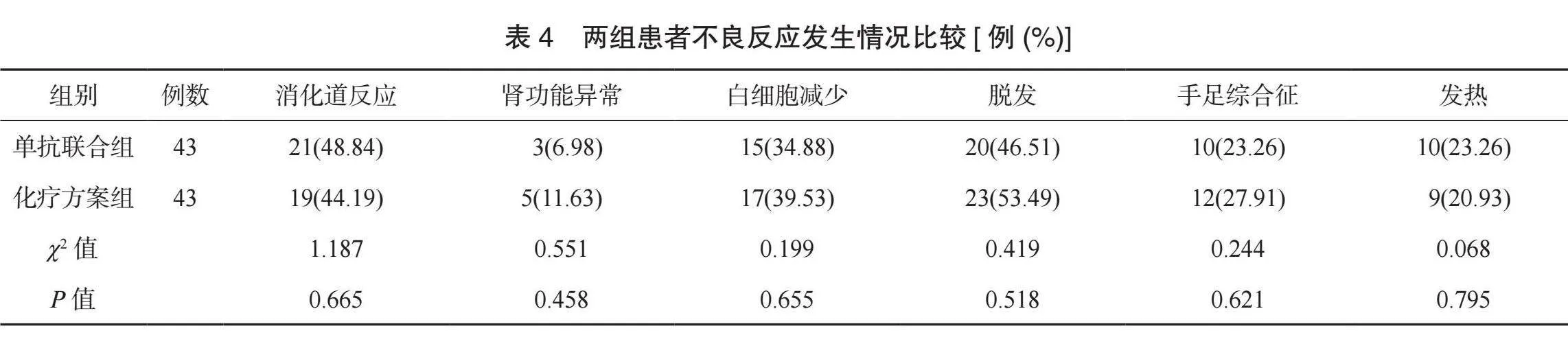
2.4 两组患者不良反应发生情况比较 两组患者消化道反应、肾功能异常、白细胞减少、脱发、手足综合征、发热的不良反应发生率比较,差异均无统计学意义(均Pgt;0.05),见表4。
3 讨论
原发性肝癌是全球范围内常见的消化系统恶性肿瘤,其发病率在中国恶性肿瘤中居第2位,死亡率居第2位[9]。由于该病缺乏特异性症状,多数患者确诊时已处于中晚期,无法接受手术治疗,所以转化治疗成为目前不可切除肝癌临床治疗的研究热点。在众多转化治疗手段中,HAIC通过介入技术可将化疗药物直接注入肿瘤供血动脉,提升局部肿瘤组织中药物浓度,与全身化疗相比毒副反应更少,患者耐受性更好,但单一治疗方案的肿瘤复发和远处转移情况不可控,远期疗效有限[10]。
本研究单抗联合组患者应用替雷利珠单抗、仑伐替尼联合mFOLFOX方案HAIC治疗,与单纯应用mFOLFOX方案HAIC治疗的化疗方案组相比,临床疗效更优,客观缓解率更高;治疗后,两组患者CA199、AFP、CEA水平均降低,且单抗联合组均低于化疗方案组。这提示不可切除肝癌患者应用替雷利珠单抗、仑伐替尼联合HAIC治疗的临床效果较好,能有效控制疾病进展,降低肿瘤标志物水平。分析原因为,mFOLFOX方案HAIC治疗中,奥沙利铂可作用于DNA,抑制其转录及复制,并能诱导细胞凋亡,从多种途径达到抗肿瘤效果;氟尿嘧啶进入机体后可被活化为氟尿嘧啶脱氧核苷酸,抑制胸苷酸合成酶,进而抑制细胞DNA合成,同时对RNA合成也具有一定抑制作用,与奥沙利铂可产生协同作用;亚叶酸钙是抗肿瘤辅助药物,能增强DNA合成抑制、氟尿嘧啶抗肿瘤效应,减轻毒副反应[11]。不可切除肝癌发生发展常伴随复杂免疫逃逸,PD-1是一种免疫检查点蛋白,能与肿瘤细胞表面的程序性死亡配体1(PD-L1)相互作用,抑制T淋巴细胞功能,PD-1/PD-L1细胞信号转导通路可有效推动肿瘤免疫逃逸。免疫检测点阻断是免疫治疗的重要方法,替雷利珠单抗为PD-1阻断剂,能与PD-1结合并阻断其与配体PD-L1间的联系,激活T淋巴细胞,增强机体抗肿瘤活性,从而抑制或杀灭癌细胞,发挥抗肿瘤效果,使机体肿瘤标志物水平显著下降[12]。仑伐替尼是一种血管内皮生长因子抑制剂,作为临床抗血管生成的一线靶向治疗药物,其能抑制病理性肿瘤血管生长,从而达到抗肿瘤目的。上述治疗方式联合应用可作用于多个信号通路,阻断肿瘤血管生成途径,促使肿瘤细胞凋亡,进而提升治疗效果,使得肿瘤标志物水平显著下降。因此,mFOLFOX方案HAIC治疗基础上联合免疫、靶向治疗可发挥协同作用,抑制肿瘤扩散、生长,并增强机体免疫系统抗肿瘤能力,治疗效果更好,能使机体肿瘤标志物水平显著下降。
本研究结果显示,治疗后,单抗联合组患者肝功能指标ALT、ALP、TBIL、AST水平均低于化疗方案组。分析原因为,HAIC治疗注射的药物虽可最大程度杀伤肿瘤细胞,且不会对肝脏细胞产生不利影响,但其对患者肝纤维化的改善效果不够理想,对提升患者机体功能的效果有限。采用仑伐替尼抑制肿瘤细胞代谢,可减轻机体炎症反应,改善肝功能,调节肝细胞氧化应激状态,进而降低肝功能相关指标。此外,该药物可抗纤维化,抑制肿瘤相关纤维化过程中细胞增殖,减轻肝脏纤维化程度[13]。
因此,替雷利珠单抗、仑伐替尼联合mFOLFOX方案HAIC治疗不可切除肝癌患者可提升其肝功能。联合疗法虽可提升疗效,但也可能增加不良反应,临床应加以重视。
本研究结果显示,两组患者不良反应发生情况比较均无显著差异,这提示mFOLFOX方案HAIC治疗基础上联合替雷利珠单抗、仑伐替尼治疗不会显著增加患者不良反应发生率。分析原因为,HAIC无需采用栓塞材料,可减少栓塞带来的不良反应。该治疗手段使药物局部维持高浓度,杀灭肿瘤的同时,可减轻全身不良反应。仑伐替尼可影响组织氧合状态及机体代谢功能,使机体出现疲劳感,同时还可影响血管紧张素转换酶的活性,使血管紧张素Ⅱ生成受到影响,进而导致血管扩张,患者血压升高。替雷利珠单抗会对肠道黏膜产生毒性,影响消化道功能,导致患者食欲下降。以上药物联合治疗,不会增加不良反应,与各自良好的耐受性有关。
综上所述,替雷利珠单抗、仑伐替尼联合HAIC治疗不可切除肝癌患者的效果较好,有利于改善肿瘤标志物及肝功能指标表达水平,且安全性较高,值得临床应用。
参考文献
Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
骆亿,丁国善,董家勇.不可切除晚期肝癌的转化治疗策略研究进展[J].解放军医学杂志, 2022, 47(7): 731-738.
李有赞,陈凯,赵冀,等.肝动脉灌注化疗联合免疫及靶向治疗不可切除肝癌的临床研究[J].实用医院临床杂志, 2022, 19(3): 42-46.
王寅淼.替雷利珠单抗联合仑伐替尼对不可切除肝细胞癌患者的作用效果[J].河南医学研究, 2024, 33(13): 2436-2439.
代月黎,欧阳晨雨,方向军,等.阿帕替尼对巴塞罗那临床肝癌分类B/C期肝癌的疗效[J].实用放射学杂志, 2022, 38(6): 923-927.
陈方红,刘娱,边界.PD-1抑制剂治疗肝癌患者的临床疗效及ECOG-PS评分联合Child-Pugh分级对肿瘤超进展的预测价值[J].广西医学, 2023, 45(15): 1800-1806.
中华人民共和国国家卫生健康委员会医政医管局.原发性肝癌诊疗规范(2019年版)[J].中华消化外科杂志, 2020, 19(1): 1-20.
张百红,岳红云.实体瘤疗效评价标准简介[J].国际肿瘤学杂志, 2016, 43(11): 845-847.
刘江勇,胡蓓,赵林,等. TACE联合或不联合仑伐替尼及PD-1抑制剂治疗不可切除肝癌的疗效及对供血动脉影响[J].临床放射学杂志, 2023, 42(4): 665-671.
杨宇光,唐辉,谭志明,等.仑伐替尼、PD-1抑制剂联合肝动脉栓塞灌注化疗治疗不可切除肝癌疗效[J/CD].中华肝脏外科手术学电子杂志, 2023, 12(1): 55-60.
徐军红,姚红兵,王雪尧,等. FOLFOX-肝动脉灌注化疗联合应用仑伐替尼和程序性死亡受体1抑制剂治疗中晚期肝癌[J].实用医学杂志, 2024, 40(6): 762-767.
朱九荣,冯潇,李芸蕊. FOLFOX、SOX、mFOLFOX6方案用于治疗晚期胃癌的临床观察[J].实用癌症杂志, 2024, 39(2): 274-278.
肖玉腾. HAIC联合免疫药物和贝伐珠单抗对比免疫药物联合贝伐珠单抗治疗不可切除肝细胞癌的临床疗效及安全性研究[D]. 湛江:广东医科大学, 2024.
