植物同源域指蛋白6对肝癌Hep-G2细胞迁移能力的影响
2025-01-01杨明妍包欣玥汪水莲刘盛源刘妍君张灵玉孟凡骏李丹


【摘要】目的 探讨植物同源域指蛋白6(PHF6)对肝癌Hep-G2细胞迁移能力的影响,为临床诊疗提供参考。方法 根据癌症基因组图谱(TCGA)数据库分析PHF6在人正常肝脏和肝癌组织的表达情况,以及其表达对300余例肝癌患者近十年生存率的影响。比较siNC组(转染PHF6无义序列)和siPHF6组(转染siRNA-PHF6)细胞PHF6 RNA表达水平,利用划痕和Transwell实验检测两组细胞迁移能力,通过实时荧光定量聚合酶链式反应检测两组细胞上皮间质转化(EMT)相关基因表达情况。结果 PHF6在肝癌患者中存在明显过表达现象,高表达PHF6患者存活率降低。转染48 h后,siPHF6组细胞中PHF6 RNA表达水平低于siNC组(P=0.0016)。划痕后12、24、48、72 h,siPHF6组细胞划痕距离均大于siNC组,siPHF6组细胞迁移数量小于siNC组。与siNC组相比,siPHF6组细胞神经钙黏蛋白(CDH2)、纤连蛋白(FN1)的表达水平均降低,CDH1的表达水平升高(Plt;0.0001、Plt;0.0001、P=0.0018)。结论 沉默PHF6可显著抑制肝癌细胞的迁移和EMT进程,靶向PHF6治疗肝癌具有应用前途。
【关键词】植物同源域指蛋白6;肝癌;Hep-G2;上皮间质转化
【中图分类号】R394 【文献标识码】A 【文章编号】2096-2665.2025.02.0045.04
DOI:10.3969/j.issn.2096-2665.2025.02.014
肝癌是全球死亡率排名第三的癌症,肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌的主要类型,占85%~90%[1-2]。目前,肝切除手术和肝移植能显著延长早期HCC患者的生存时间,但晚期患者复发率高、预后较差[3-4]。上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞转化为具有迁移能力的间充质细胞的过程。在这一过程中,上皮细胞逐渐失去黏附性,并明显表现出间充质细胞的特征,即细胞角蛋白Cytokeratins、上皮细胞钙黏蛋白(CDH1)等上皮细胞标志物的表达下调,神经钙黏蛋白(CDH2)、波形蛋白(Vimentin)、纤连蛋白(FN1)等间充质细胞标志物的表达增强[6]。癌症分子靶向治疗对治疗肝细胞癌具有重要临床意义。植物同源域指蛋白6(PHF6)是一种位于细胞核的染色质结合调节蛋白,具有转录调控功能。该基因位于人类染色体Xq26.3,属于X连锁基因,其突变在Börjeson-Forssman-Lehmann综合征中被发现[7-8]。 PHF6几乎表达于所有组织,对神经发育和造血很重要。在造血干细胞中敲除PHF6,可增加细胞自我更新能力,驱动血癌发生,因此PHF6被认为是一种抑癌基因[9-10]。敲除PHF6损害细胞增殖使其停滞在G(2)/M期,表明PHF6缺乏导致细胞DNA损伤的积累[11]。然而, PHF6是否影响肝癌生长和转移及作用机制尚未报道。基于此,本研究探究PHF6对肝癌细胞Hep-G2迁移能力的影响。
1 材料和方法
1.1 细胞培养和分组 取Hep-G2肝癌细胞株(购自美国模式培养保藏中心),在饱和湿度细胞培养箱内培养(5% CO2、 37 ℃),培养基含有10%胎牛血清(FBS)(购自Sigma公司)和1%青链霉素的DMEM(购自Gibco公司)。细胞融合率达≥80%时用0.25%的胰酶(购自Gibco公司)37 ℃消化1 min后传代。实验分为siNC组(转染 PHF6无义序列)、 siPHF6组(转染siRNA-PHF6),每组使用的细胞数均为8×104个/ml细胞,每组设置3组重复实验。
1.2 转染PHF6基因 将8×104个/ml Hep-G2细胞接种于6孔板,每孔2 mL培养液,培养8~12 h,融合率达40%进行转染实验。将转染试剂 Lipofectamine ® RNAiMAX Reagent (购自Invitrogen公司)9 µL稀释于150 µL Opti-MEM® Medium中,同时将2 µL(30 pmol)siRNA 储存液加入150 µL opti-MEM® Medium中混合,室温孵育5 min 后将二者混匀, 4 ℃ 孵育15 min后滴加到对应孔中,培养6 h后更换培养液, 24~48 h后进行后续实验。 siRNA-PHF6核酸序列如下:正义链, 5'-GGCCUACAAGACAGCGCAATT3'-;反义链:5'-UUGCGCUGUCUUGUAGGCCTT3'-,由金拓思(武汉)生物科技有限公司进行设计并合成。
1.3 划痕实验 将转染后的siNC组和siPHF6组细胞进行培养,细胞融合度≥90%时用10 µl枪头垂直划痕,随后用磷酸盐缓冲液(购自Gibco公司)清洗细胞,去除杂质和脱落的细胞,于培养0、 12、 24、 48、 72 h拍照记录相同位置细胞的迁移变化,统计不同组别间细胞迁移差异。
1.4 实时荧光定量聚合酶链式反应 在6孔板的每孔Hep-G2细胞中添加500 µl Trizol裂解液(购自TAKARA)以提取RNA,随后测定提取RNA的浓度,并通过凝胶电泳实验对其质量进行检测。利用PrimeScriptTMII cDNA Synthesis Kit(购自TAKARA)进行反转录,稀释反转录产物cDNA,以此作为实时荧光定量聚合酶链式反应的模板。检测两组细胞基因表达变化,实时荧光定量聚合酶链式反应引物序列,见表1。反应条件:起始95 ℃、 5 min;随后变性温度为95 ℃,维持 15 s,退火温度为60 ℃,维持30 s,此过程共进行40个循环。根据2-△△CT方法计算基因表达差异, 18S作为内参。
1.5 Transwell迁移实验 使用Transwell小室(孔径8 μm,购于Corning公司)进行迁移实验,转染后的细胞重悬于200 μL不含血清的DMEM溶液中,然后接种于上室。下室加入500 μL含10 % FBS的DMEM培养基作为催化剂。 37 ℃孵育24 h后,将已迁移至下室的细胞用100%甲醇在室温下固定30 min,利用0.5%结晶紫溶液进行30 min染色。对染色细胞进行观察,显微镜拍照。
1.6 数据统计 使用GraphPad Prism 9软件对实验数据进行统计分析并绘图,数据表示为(mean±SEM);两组间比较进行Student t-test分析;对癌症基因组图谱(TCGA)数据库中患者生存率进行对数秩检验分析。0.01lt;Plt;0.05标记为*, 0.001lt;Plt;0.01标记为**, Plt;0.001标记为***,Plt;0.0001标记为****。
2 结果
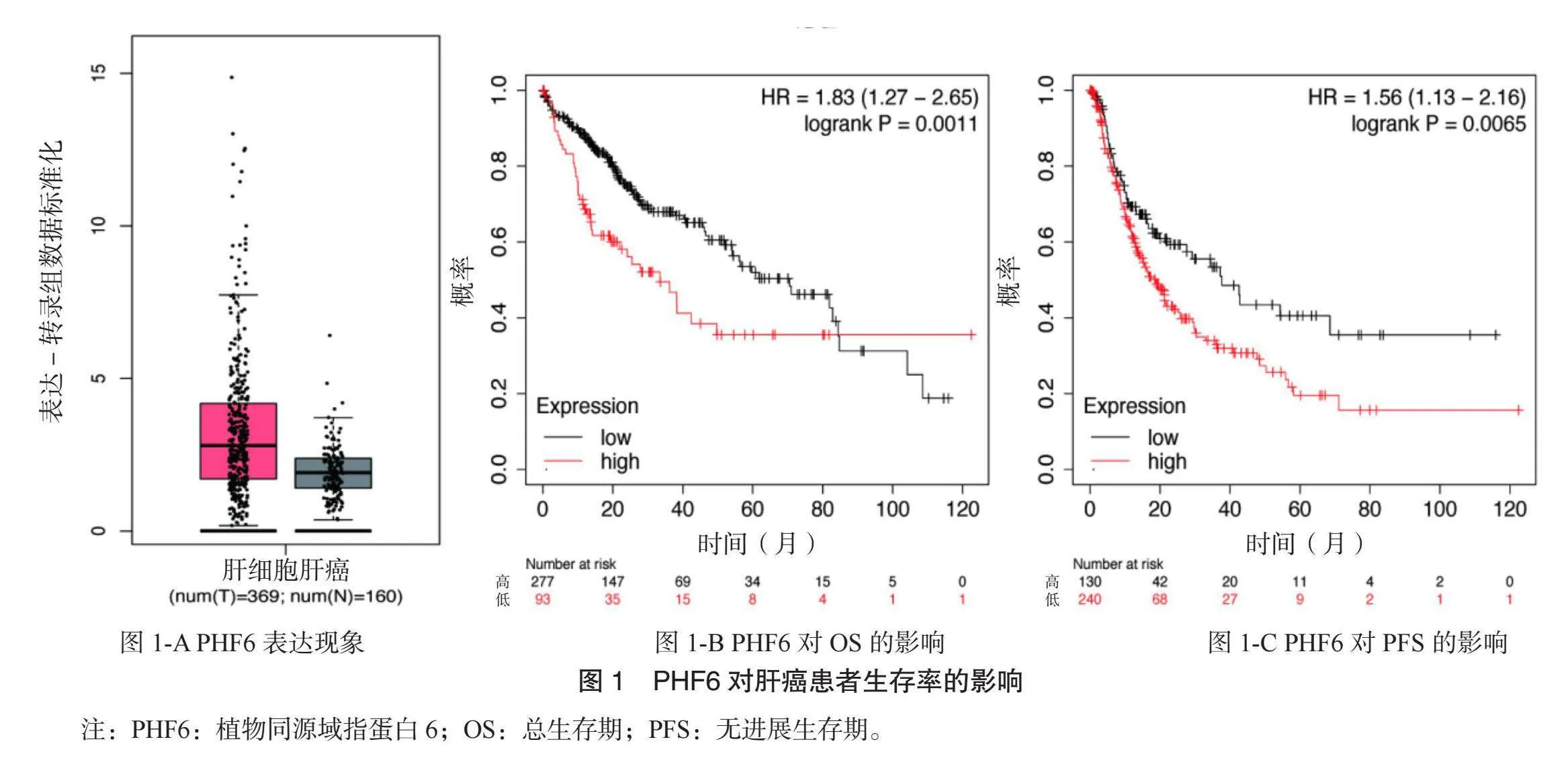
2.1 TCGA数据库肝癌患者存活率分析 PHF6在肝癌患者中存在明显过表达现象,见图1-A;高表达PHF6患者存活率降低,见图1-B、图1-C。
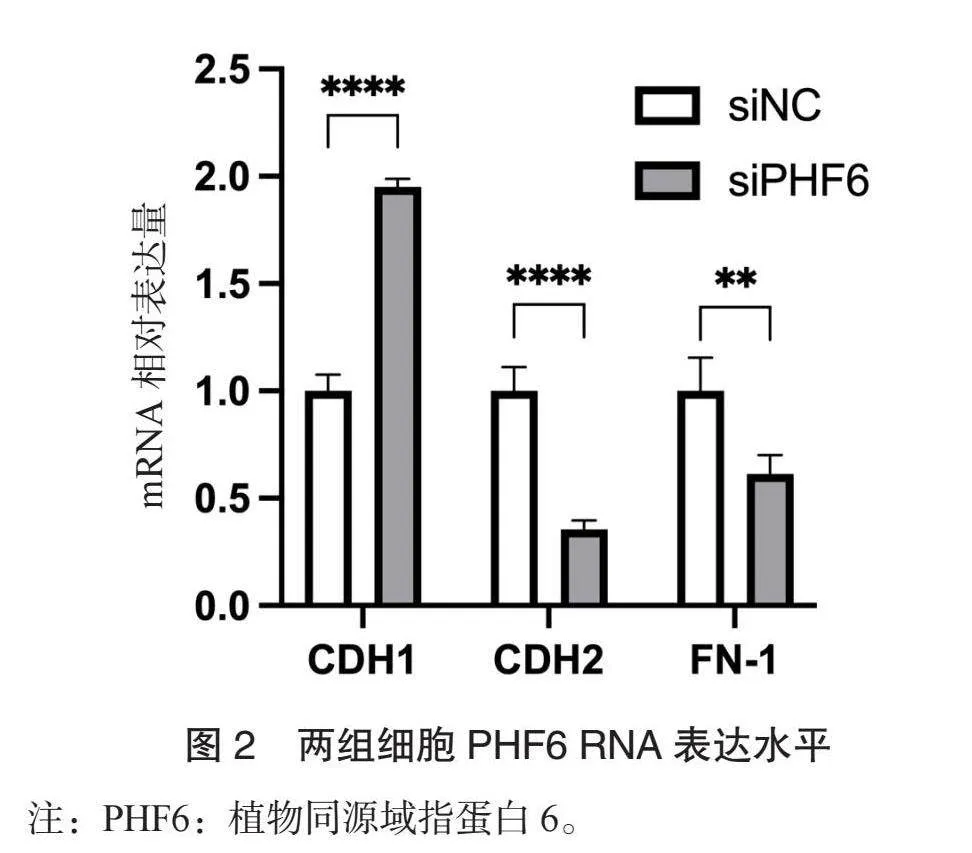
2.2 两组细胞PHF6 RNA表达水平比较 转染48 h后, siPHF6组细胞PHF6 RNA表达水平低于siNC组(P=0.0016),见图2。
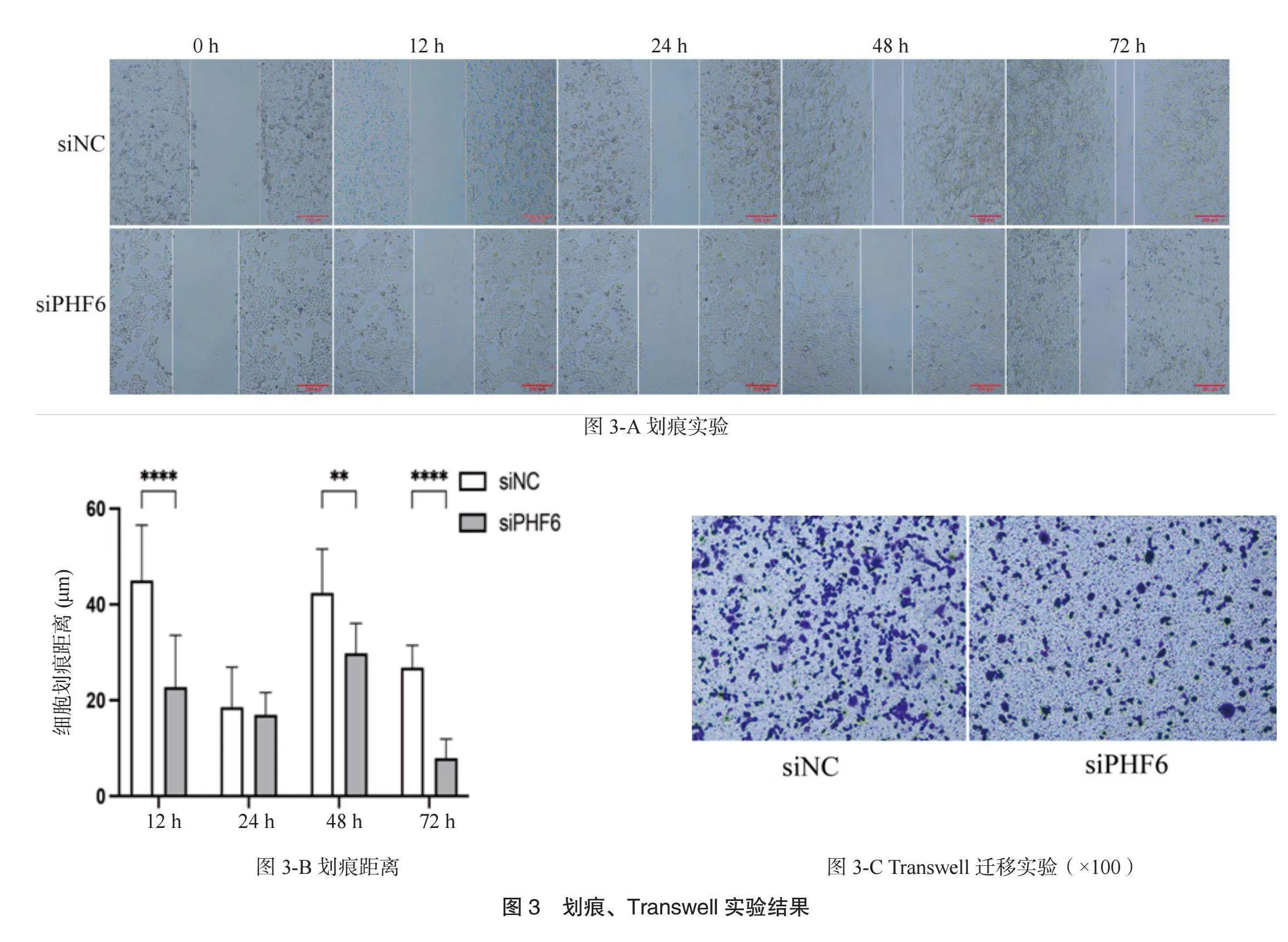
2.3 划痕、Transwell实验结果分析 划痕后12、 24、 48、 72 h, siPHF6组细胞划痕距离均大于siNC组,见图3-A、图3-B。 siPHF6组细胞迁移数量小于siNC组,见图3-C。
2.4 实时荧光定量聚合酶链式反应分析结果 与siNC组相比, siPHF6组细胞CDH2、 FN-1的表达水平降低, CDH1的表达水平升高(Plt;0.0001、 Plt;0.0001、 P=0.002),见图4。
3 讨论
PHF6的体细胞功能突变在T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL)中非常普遍,也存在于急性骨髓白血病(acute myeloid leukemia,AML)中,且敲除PHF6基因的造血干细胞(HSC)的重建和自我更新能力增强,这均表明PHF6可能是一种抗癌基因[12-14]。然而,PHF6在乳腺癌和结直肠癌中显著高表达,提示PHF6可能参与其他恶性肿瘤,本研究将探讨其在肝癌中的作用机制。
本研究结果显示,PHF6在肝癌患者中存在明显过表达现象,高表达PHF6患者存活率降低;转染48 h后,siPHF6组细胞中PHF6的RNA表达水平低于siNC组;划痕后12、24、48、72 h,siPHF6组细胞划痕距离均大于siNC组,siPHF6组细胞迁移数量小于siNC组;与siNC组相比,siPHF6组细胞CDH2、FN-1的表达水平降低,CDH1的表达水平升高。分析原因为,EMT是指上皮细胞失去相互连接和极性,转化为间质细胞的现象。这一过程的激活是上皮癌细胞获得恶性表型的核心机制,也是癌症转移和侵袭的重要环节[15]。因此,抑制EMT会干扰肿瘤的进展。敲低PHF6可能通过上调E-cadherin和下调N-cadherin和Fibronectin-1来抑制EMT过程,继而肝癌细胞Hep-G2细胞的迁移能力减弱。
此外, PHF6能招募组蛋白赖氨酸甲基转移酶SUV39H1至rDNA(核糖体DNA)区域,并借助SUV39H1的三甲基化酶活性来提升rDNA区域组蛋白H3的9位赖氨酸残基甲基化(H3K9me3)的水平,从而抑制rDNA转录。敲低PHF6则能够通过促进 rDNA的转录,进而增强细胞增殖和肿瘤生长[16]。但在T-ALL和AML的小鼠动物模型中,敲低PHF6后肿瘤增长速率却加快;而在小鼠的急性B细胞淋巴白血病(B-cell acute lymphoblastic leukemia,B-ALL)模型中,通过慢病毒技术敲低PHF6后,观察到肿瘤的增长速率显著减缓[17]。本研究证明敲低PHF6可抑制肝癌细胞的迁移,进而起到治疗肝癌的作用,但这是否也是PHF6作为转录因子调控表观遗传进程来实现的,仍需进一步研究。
综上所述,沉默PHF6可显著抑制肝癌细胞的迁移和EMT进程,靶向PHF6治疗肝癌具有应用前途。通过基因编辑技术降低PHF6的表达或开发PHF6的小分子抑制剂,特异性地降低PHF6的表达或功能,从而抑制肝癌细胞的生长和转移,可作为肝癌治疗的新思路。
参考文献
Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
Heimbach J K, Kulik L M, Finn R S, et al. AASLD guidelines for the treatment of hepatocellular carcinoma[J]. Hepatology, 2018, 67(1): 358-380.
Li X, Ramadori P, Pfister D, et al. The immunological and metabolic landscape in primary and metastatic liver cancer[J]. Nat Rev Cancer, 2021, 21(9): 541-557.
Johnson P, Zhou Q, Dao D Y, et al. Circulating biomarkers in the diagnosis and management of hepatocellular carcinoma[J]. Nat Rev Gastroenterol Hepatol, 2022, 19(10): 670-681.
Yan S, Tang Z, Chen K, et al. Long noncoding RNA MIR31HG inhibits hepatocellular carcinoma proliferation and metastasis by sponging microRNA-575 to modulate ST7L expression[J]. J Exp Clin Cancer Res, 2018, 37(1): 214.
Lamouille S, Xu J, Derynck R. Molecular mechanisms of epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2014, 15(3): 178-196.
Kurzer J H, Weinberg O K. PHF6 mutations in hematologic malignancies[J]. Front Oncol, 2021, 11: 704471.
Todd M A M, Ivanochko D, Picketts D J. PHF6 degrees of separation: The multifaceted roles of a chromatin adaptor protein[J]. Genes (Basel), 2015, 6(2): 325-352.
黄可秀.伴PHF6突变急性髓系白血病的临床结局研究[D].广州: 南方医科大学, 2023.
郭腾霄.表观遗传因子CELF2和PHF6在MLL-AF9诱导的急性髓系白血病中的作用及机制研究[D].北京:北京协和医学院, 2024.
Wang J, Leung J W, Gong Z, et al. PHF6 regulates cell cycle progression by suppressing ribosomal RNA synthesis[J]. J Biol Chem, 2013, 288(5): 3174-3183.
Chao M M, Todd M A, Kontny U, et al. T-cell acute lymphoblastic leukemia in association with Börjeson-Forssman-Lehmann syndrome due to a mutation in PHF6[J]. Pediatr Blood Cancer, 2010, 55(4): 722-724.
Cancer Genome Atlas Research Network, Ley T J, Miller C, et al. Genomic and epigenomic landscapes of adult de novo acute myeloid leukemia[J]. N Engl J Med, 2013, 368(22): 2059-2074.
Hsu Y C, Chen T C, Lin C C, et al. Phf6-1 hematopoietic stem cells have enhanced self-renewal capacity and oncogenic potentials[J]. Blood Adv, 2019, 3(15): 2355-2367.
Seton-Rogers S. Epithelial-mesenchymal transition: Untangling EMT’s functions[J]. Nat Rev Cancer, 2016, 16(1): 1.
吴彦萍. PHF6和SUV39H1相互作用调节rDNA转录的机制研究[D].北京:清华大学, 2019.
Mavrakis K J, Van Der Meulen J, Wolfe A L, et al. A cooperative microRNA-tumor suppressor gene network in acute T-cell lymphoblastic leukemia (T-ALL)[J]. Nat Genet, 2011, 43(7): 673-678.
