SYT7调控Hedgehog/Gli信号通路对胶质母细胞瘤进展的影响
2024-12-31肖兵

[摘要]"目的"探讨人突触结合蛋白Ⅶ(synaptotagmin-7,SYT7)通过调控Hedgehog/Gli信号通路对胶质母细胞瘤进展的影响。方法"通过构建并转染短发夹RNA(short"hairpin"RNA,shRNA)慢病毒载体,利用定量反转录聚合酶链反应(quantitative"reverse"transcriptase-mediated"polymerase"chain"reaction,qRT-PCR)分析SYT7在人脑胶质瘤U87细胞系中的表达,采用蛋白质印迹和qRT-PCR分析U87细胞中SYT7"shRNA的敲低效率。通过细胞计数、细胞周期分析和动物实验验证SYT7在胶质母细胞瘤中的作用。结果"qRT-PCR分析显示SYT7在U87细胞系中的表达高于正常脑细胞系。蛋白质印迹和qRT-PCR分析证实SYT7"shRNA在U87细胞中的有效敲低。细胞计数显示SYT7"shRNA的表达通过慢病毒载体下调SYT7,抑制U87细胞的生长;流式细胞术证实细胞周期阻滞。此外,基因富集分析和蛋白质印迹发现SYT7通过促进p53磷酸化与Hedgehog/Gli信号通路相关,进而在胶质母细胞瘤中发挥作用。结论"SYT7通过调控Hedgehog/Gli信号通路促进胶质母细胞瘤的生长,因此SYT7可能是治疗胶质瘤的潜在靶点。
[关键词]"突触结合蛋白Ⅶ;p53;胶质母细胞瘤
[中图分类号]"R473.73""""""[文献标识码]"A""""""[DOI]"10.3969/j.issn.1673-9701.2024.33.004
Effect"of"SYT7"regulation"of"Hedgehog/Gli"signaling"pathway"on"the"progression"of"glioblastoma
XIAO"Bing
Department"of"Neurosurgery,"the"Second"Affiliated"Hospital"of"Nanchang"University,"Nanchang"330006,"Jiangxi,"China
[Abstract]"Objective"To"investigate"the"effect"of"synaptotagmin-7"(SYT7)"on"the"progression"of"glioblastoma"by"regulating"Hedgehog/Gli"signaling"pathway."Methods"The"expression"of"SYT7"in"U87"cell"line"was"analyzed"by"quantitative"reverse"transcriptase-mediated"polymerase"chain"reaction"(qRT-PCR)"and"transfection"with"short"hairpin"RNA"(shRNA)"lentiviral"vector."Western"blotting"and"qRT-PCR"were"used"to"analyze"the"knockdown"efficiency"of"SYT7"shRNA"in"U87"cells."Cell"counting,"cell"cycle"analysis,"and"animal"studies"confirm"the"role"in"glioblastoma."Results"qRT-PCR"analysis"showed"that"the"expression"of"SYT7"in"U87"cell"line"was"higher"than"human"normal"glial"cell"line."Western"blotting"and"qRT-PCR"analysis"showed"low"knockdown"efficiency"of"SYT7"shRNA"in"U87"cells."Cell"counts"showed"that"the"lentiviral"vector"expressing"SYT7"shRNA"down-regulated"SYT7"and"inhibited"the"growth"of"U87"cells."Flow"cytometry"confirmed"cell"cycle"block,"gene"enrichment"analysis"and"Western"blotting"revealed"that"SYT7"was"associated"with"Hedgehog/Gli"signaling"pathway"by"promoting"p53"phosphorylation."It"was"further"demonstrated"in"glioblastoma"by"animal"experiments."Conclusion"The"results"of"this"study"suggest"that"SYT7"promotes"glioblastoma"growth"by"regulating"the"Hedgehog/Gli"signaling"pathway,"so"SYT7"may"be"a"potential"therapeutic"target"for"glioma.
[Key"words]"Synaptotagmin-7;"p53;"Glioblastoma
胶质母细胞瘤是最常见的中枢神经系统恶性肿瘤之一,其整体预后较差,复发率较高[1]。胶质母细胞瘤的确切发病机制尚不清楚[2]。人突触结合蛋白Ⅶ(synaptotagmin-7,SYT7)是突触结合蛋白(synaptotagmin,SYT)家族中的一员,该家族包含17个亚型,是细胞分泌过程中钙信号通路的受体,参与钙依赖性跨膜转运[3-5]。研究表明SYT7可调节细胞分化、凋亡、细胞因子活性、转录调控和胺类生物合成,参与溶酶体介导的修复,并诱导细胞凋亡[6]。SYT7作为溶酶体分泌的细胞外激活剂,与多种疾病相关,包括自身免疫性肌炎、糖尿病、炎症性关节炎、肺纤维化等。
研究显示Hedgehog/Gli信号通路与皮肤基底细胞癌、胃肠道肿瘤、前列腺癌、胰腺癌和肺癌的形成有关[7]。该信号通路由靶细胞膜上的两个受体Patched和Smoothened控制[8]。核转录因子Gli在这一通路中发挥关键作用[9]。Gli有3个同源基因,分别编码Gli1、Gli2和Gli3。其中,Gli1因其与胶质瘤的发生有关且被首次命名[10]。随着Hedgehog信号通路的激活,Gli1相关的下游靶基因(如n-myc、CyclinD1、Foxm1、bcl-2)的表达发生变化,从而影响胶质瘤细胞的生物学行为[11]。
p53作为肿瘤抑制基因在抑制胶质瘤进展中发挥重要作用[12]。P53蛋白可防止细胞癌变,维持基因组稳定,避免突变。研究表明p53与Gli1密切相关,p53通过调节Gli1蛋白水平抑制Gli1活性[13]。笔者推测SYT7通过调控p53介导的Hedgehog/Gli信号通路参与胶质母细胞瘤的发生发展,p53可能是SYT7调控Hedgehog/Gli信号通路的关键桥梁。为验证这一推测结果进行本研究,并报道如下。
1""材料与方法
1.1""材料和试剂
DMEM基础培养基购自武汉赛维尔公司;SYT7基因阴性对照(5′-TCACCGTGAAGATCATGAA-3′)购自上海基因化学有限公司;定量反转录聚合酶链反应(quantitative"reverse"transcriptase-mediated"polymerase"chain"reaction,qRT-PCR)检测试剂盒购自日本Takara公司;SYT7引物购自上海基因化学有限公司;U87细胞系和正常脑细胞系为本实验室保有。4周龄雄性SCID小鼠购自北京维通利华生物科技有限公司,饲养于SPF级实验动物中心。动物实验符合3R原则,经南昌大学批准许可[许可证号:SYXK(赣)2021-0004]。本研究经南昌大学第二附属医院伦理委员会审批通过(伦理审批号:NCULAE-20221031035)。
1.2""细胞培养
细胞于37℃、5%"CO2条件下进行常规传代培养。
1.3""RNA提取和qRT-PCR分析
使用短发夹RNA(short"hairpin"RNA,shRNA)转染U87细胞48h,用TRIzol(赛默飞世尔科技)试剂提取总RNA。使用qRT-PCR检测试剂盒按说明书要求检测SYT7"mRNA表达水平。SYT7的定量聚合酶链反应(quantitative"PCR,qPCR)采用甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate"dehydrogenase,GAPDH)为内参。SYT7正向引物:5′‐ACTCCATCATCG"TGAACATCATC‐3′,反向引物:5′‐TCGAAGGCGA"AGGACTCATTG‐3′;GAPDH正向引物:5'-TGACTT"CAACAGCGACACCA-"3';反向引物:5'-CACCCTGT"TGCTGTAGCCAAA-3'。采用生物系统7300荧光定量PCR系统,qPCR分析采用Takara"Bio公司的SYBR"PrimeScript"qPCR试剂盒。反应混合物在95˚C条件下孵育30s,在95˚C条件下扩增45次,扩增时间分别为5s,60˚C条件下扩增30s,72˚C条件下扩增60s,72˚C条件下扩增7min。通过2–ΔΔCq方法计算SYT7"mRNA的相对表达量,用GAPDH"mRNA表达量进行归一化[14]。
1.4""shRNA慢病毒载体的构建及转染
表达shRNA的慢病毒和SYT7基因阴性对照(5′-TCACCGTGAAGATCATGAA-3′)购自上海基因化学有限公司。将以上shRNA克隆到具有AgeI/EcoRI位点的pgcsil-绿色荧光慢病毒载体中,获得重组慢病毒shRNA的表达载体。将U87MG胶质瘤细胞接种于6孔板中,每孔种植4×105个细胞。用shSYT7慢病毒(4×108TU/ml×2.5μl)或阴性对照(8×108TU/ml×1.25μl)感染6孔板细胞,分为shSYT7组和对照组。感染后5d采用qPCR检测shRNA-SYT7载体的敲除效率。
1.5""细胞增殖
转染48h后,用胰蛋白酶消化U87细胞,以5×103个/孔的密度接种于12孔板。shSYT7组和对照组在显微镜下计数5d。
1.6""蛋白质印迹分析
转染48h后收集细胞,在Beyotime缓冲液中裂解30min,用二氢二酸蛋白检测试剂盒提取细胞蛋白。离心后进行上清电泳。将样品转移到聚偏二氟乙烯膜密封1h。一抗为小鼠抗syt7、小鼠抗p53、小鼠抗p-p53和抗GAPDH抗体,4℃过夜。以山羊抗小鼠免疫球蛋白G偶联辣根过氧化物酶为二抗,1∶2000稀释,室温作用2h。增强化学发光和蛋白质印迹检测系统检测结合抗体。GAPDH为内参。
1.7""细胞周期分析
采用2ml–20°C预冷的70%乙醇收集细胞,重悬,在–20°C下固定过夜。离心后丢弃上清液,加入1ml预冷的磷酸缓冲盐溶液(phosphate"buffered"saline,PBS)重悬细胞沉淀,37℃孵育30min。在细胞悬液中加入1∶20"1mg/ml的碘化丙啶储存液,在37℃黑暗中孵育30min。使用BD"FACSCalibur流式细胞仪(Becton,Dickinson"Bioscience)。FlowJo软件分析DNA倍性和细胞数量及细胞周期分布。
1.8""动物实验
将4周龄雄性SCID小鼠腹腔皮下注射与基质胶混合的3×106"U87细胞(shSYT7组和对照组)。将20只小鼠在恒湿(40%~70%)、恒温[(21±2)℃]条件下饲养,在特定的无菌设施中自由摄食和饮水。研究结束后2周用卡尺测量肿瘤大小。所有数据按公式v=0.5×a×b2(v为肿瘤体积;a为肿瘤长径;b为肿瘤宽径)计算体积。实验结束后处死小鼠或在肿瘤直径达到15mm时取肿瘤组织进一步检查。部分肿瘤组织石蜡包埋切片。
1.9""免疫组织化学
首先对肿瘤组织切片进行脱蜡处理,切片组织置于烤箱。对切片进行常规二甲苯脱蜡,酒精梯度脱水:顺序为二甲苯Ⅰ15min,二甲苯Ⅱ15min,无水乙醇Ⅰ15min,无水乙醇Ⅱ15min,95%乙醇15min,80%乙醇15min,蒸馏水中15min,1×PBS洗涤5min,3次。抗原修复:将切片置于0.01mol/L枸橼酸缓冲液(pH"6.0)中,煮沸(95℃,15~20min),待其自然冷却至室温,1×PBS洗涤5min,共3次。在组织切片上滴加10%山羊血清封闭液,37℃下孵育30min,倒去封闭液。滴加一抗:一抗稀释液对一抗稀释后滴加在切片上,4℃过夜,1×PBS洗涤5min,3次。在37℃下孵育30~60min,1×PBS洗涤5min,3次。组织切片上滴加Ⅲ抗(辣根酶标记链霉卵白素工作液),在37℃下孵育30min,1×PBS洗涤5min,3次。滴加二氨基联苯胺(diaminobenzidine,DAB)显色液(新鲜配制),遵循现用现配原则。以水冲洗组织切片,应用苏木精进行复染,乙醇梯度脱水,二甲苯透明,使用中性树胶进行封片,37℃下干燥,显微镜观察并拍照。
1.10""统计学方法
采用SPSS"21.0统计学软件对数据进行处理分析。符合正态分布的计量资料以均数±标准差( )表示,比较采用t检验;计数资料以例数(百分率)[n(%)]表示,比较采用c2检验。P<0.05为差异有统计学意义。
)表示,比较采用t检验;计数资料以例数(百分率)[n(%)]表示,比较采用c2检验。P<0.05为差异有统计学意义。
2""结果
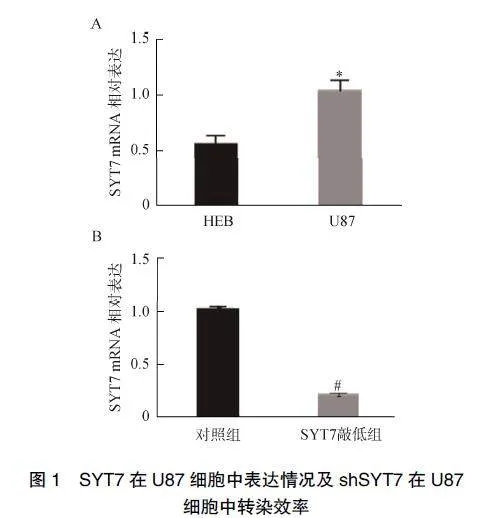
2.1""SYT7在U87细胞中表达情况及shSYT7在U87细胞中转染效率
通过RT-qPCR评估SYT7"mRNA的表达水平,见图1A。与正常脑细胞(HEB)比较,在U87细胞中SYT7"mRNA的表达水平显著升高。用shSYT7敲低SYT7,通过RT-qPCR评估SYT7"mRNA的表达水平,见图1B。与对照组比较,shSYT7可显著降低SYT7"mRNA的表达水平。
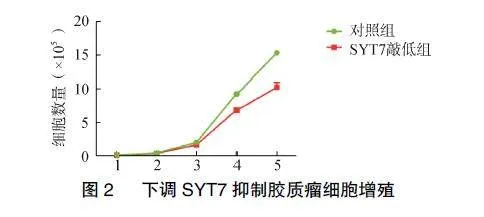
2.2""下调SYT7可抑制细胞增殖
细胞计数结果显示,与对照组比较,shSYT7对U87细胞生长有抑制作用(Plt;0.05),见图2。
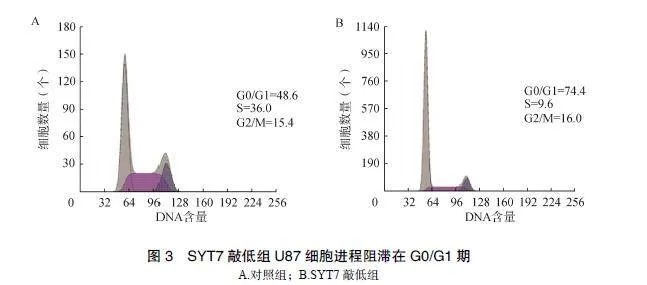
2.3""SYT7敲低组U87细胞进程阻滞在G0/G1期
流式细胞术结果显示,与对照组比较,shSYT7将U87细胞周期阻滞在G0/G1期,见图3。
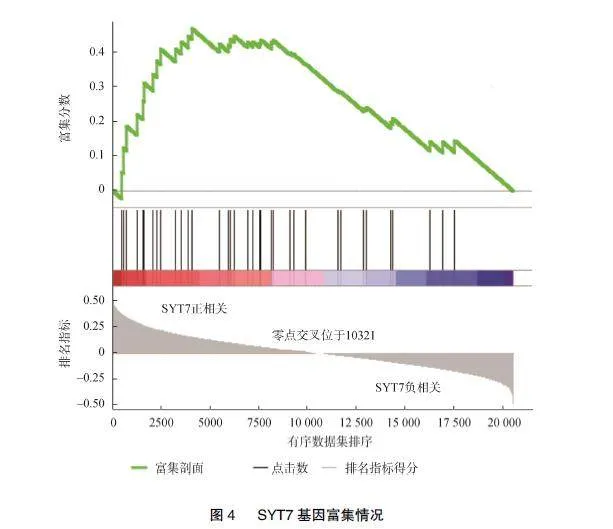
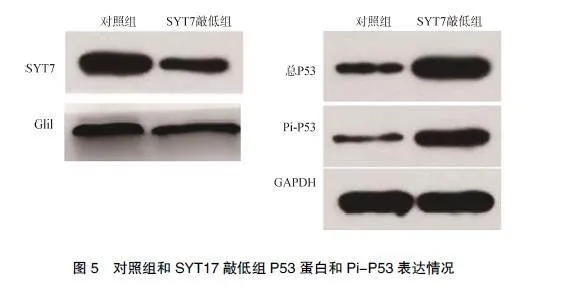
2.4""SYT7与Hedgehog/Gli信号通路密切相关
基因富集结果显示SYT7与胶质瘤的Hedgehog/"Gli信号通路密切相关,见图4,蛋白质印迹显示抑制SYT7可促进p53磷酸化,导致P53蛋白聚集,Gli1蛋白也受到抑制,见图5。
2.5""SYT7的下调抑制肿瘤生长
对SCID小鼠进行异种移植试验。在U87细胞系中,shSYT7在整个实验过程中均可减缓肿瘤的生长,SYT7敲低组小鼠的肿瘤大小明显小于对照组,见图6A;肿瘤体积明显小于对照组,见图6B;肿瘤质量明显小于对照组,见图6C。Ki-67免疫组化显示,对照组小鼠的Ki-67表达更高,见图6D。
3""讨论
胶质瘤是中枢神经系统最常见的恶性肿瘤,在中国的年发病率为(3~6)例/10万人[15]。目前,基于神经外科、放疗、肿瘤学的影像、病理相结合的多学科综合诊疗模式已应用于胶质瘤的治疗,但整体治疗效果较差,靶向生物治疗给患者带来新的希望。寻找新的治疗靶点,探索胶质瘤发生发展的分子机制具有十分重要的意义。生物靶向治疗的前提和关键是靶点选择。目前肿瘤血管生成、免疫检查点、癌基因等生物治疗靶点已取得很大进展,相应的靶向药物已用于临床治疗[16-25]。但大多数肿瘤具有异质性特征,导致同一药物靶点在不同类型的肿瘤或不同患者中存在较大差异。因此,探索肿瘤发病的分子机制是目前治疗胶质瘤的最佳途径。
本研究结果显示SYT7通过调节Hedgehog/Gli信号通路促进胶质母细胞瘤生长;检测SYT7在U87细胞系中的表达水平,但仅检测mRNA的表达,SYT7在肿瘤样本中的表达情况仍需进一步研究。蛋白质印迹和qPCR结果显示,shSYT7可有效抑制SYT7蛋白水平,并在U87MG细胞中发挥作用。细胞计数实验表明,shSYT7显著抑制U87MG细胞的增殖;流式细胞术检测显示,shSYT7使U87细胞周期停滞在G0/G1期。本研究发现SYT7通过调节Hedgehog/Gli信号通路促进胶质母细胞瘤的生长。SYT7的抑制可促进p53的磷酸化,导致P53蛋白积累,同时抑制Gli1蛋白的表达,这表明SYT7通过促进p53的磷酸化与Hedgehog/Gli信号通路相关。在SCID小鼠的异种移植实验中,shSYT7可显著减缓肿瘤的生长,SYT7敲低组小鼠的肿瘤大小、体积明显小于对照组,Ki-67免疫组化结果与前期实验一致,表明shSYT7可抑制异种移植物中U87细胞的增殖。以上结果表明下调SYT7在体内可抑制肿瘤的生长。然而,本研究结论仅基于单个细胞系,需要体外和体内实验进一步确定SYT7的生物学作用。
综上所述,SYT7通过调节Hedgehog/Gli信号通路促进胶质母细胞瘤的生长,SYT7可能是胶质母细胞瘤新的治疗靶点。SYT7在胶质母细胞瘤中的作用机制有待进一步研究。
利益冲突:作者声明不存在利益冲突。
[参考文献]
[1] WANGL"M,"ENGLANDER"Z"K,"MILLER"M"L,"et"al."Malignant"glioma[J]."Adv"Exp"Med"Biol,"2023,"1405:"1–30.
[2] XIAO"B,"ZHOU"X,"YE"M,"et"al."MicroRNA-566"modulates"vascular"endothelial"growth"factor"by"targeting"Von"Hippel-Landau"in"human"glioblastoma"in"vitro"and"in"vivo[J]."Mol"Med"Rep,"2015,"12(4):"6089–6094.
[3] BAI"H,"XUE"R,"BAO"H,"et"al."Different"states"of"synaptotagmin"regulate"evoked"versus"spontaneous"release[J]."Nat"Commun,"2016,"7:"10971.
[4] SEGOVIA"M,"ALÉS"E,"MONTES"M"A,"et"al."Push-and-pull"regulation"of"the"fusion"pore"by"synaptotagmin-7[J]."Proc"Natl"Acad"Sci"USA,"2010,"107(44):"19032–19037.
[5] HAN"W."Dual"functions"of"adaptor"protein,"phosphotyrosine"interaction,"PH"domain"and"leucine"zipper"containing"1"(APPL1)"in"insulin"signaling"and"insulin"secretion[J]."Proc"Natl"Acad"Sci"USA,"2012,"109(23):"8795–8796.
[6] JACKMAN"S"L,"TURECEK"J,"BELINSKY"J"E,"et"al."The"calcium"sensor"synaptotagmin"7"is"required"for"synaptic"facilitation[J]."Nature,"2016,"529(7584):"88–91.
[7] JAGANI"Z,"MORA-BLANCO"E"L,"SANSAM"C"G,"et"al."Loss"of"the"tumor"suppressor"Snf5"leads"to"aberrant"activation"of"the"Hedgehog-Gli"pathway[J]."Nat"Med,"2010,"16(12):"1429–1433.
[8] TAN"I"L,"WOJCINSKI"A,"RALLAPALLI"H,"et"al."Lateral"cerebellum"is"preferentially"sensitive"to"high"sonic"hedgehog"signaling"and"medulloblastoma"formation[J]."Proc"Natl"Acad"Sci"USA,"2018,"115(13):"3392–3397.
[9] PIETROBONO"S,"SANTINI"R,"GAGLIARDI"S,"et"al."Targeted"inhibition"of"Hedgehog-GLI"signaling"by"novel"acylguanidine"derivatives"inhibits"melanoma"cell"growth"by"inducing"replication"stress"and"mitotic"catastrophe[J]."Cell"Death"Dis,"2018,"9(2):"142.
[10] YAO"Z,"YANG"C,"MA"L,"et"al."Hedgehog"pathway"transcription"factor"Gli1"promotes"glioma"invasiveness"through"up-regulating"aquaporin"1[J]."Cancer"Res,"2016,"76(14):"5075.
[11] WANG"Y"Z,"HAN"J"J,"FAN"S"Q,"et"al."miR-132"weakens"proliferation"and"invasion"of"glioma"cells"via"the"inhibition"of"Gli1[J]."Eur"Rev"Med"Pharmaco,"2018,"22(7):"1971–1978.
[12] SUBBURAYAN"K,"THAYYULLATHIL"F,"PALLICHANKANDY"S,"et"al."Par-4-dependent"p53"up-regulation"plays"a"critical"role"in"thymoquinone-"induced"cellular"senescence"in"human"malignant"glioma"cells[J]."Cancer"Lett,"2018,"426:"31–42.
[13] YOON"J"W,"LAMM"M,"IANNACCONE"S,"et"al."p53"modulates"the"activity"of"the"GLI1"oncogene"through"interactions"with"the"shared"coactivator"TAF9[J]."Dna"Repair,"2015,"34:"9–17.
[14] ZHAO"H,"LIU"X,"XU"D,"et"al."Circ_0022340"promotes"colorectal"cancer"progression"via"HNRNPC/EBF1/SYT7"or"miR-382-5p/ELK1"axis[J]."Cell"Mol"Biol,"2022,"68(7):"107–116.
[15] CHEN"W,"ZHENG"R,"BAADE"P"D,"et"al."Cancer"statistics"in"China,"2015[J]."CA"Cancer"J"Clin,"2016,"66(2):"115–132.
[16] ERDEM-ERASLAN"L,"VAN"DEN"BENT"M"J,"HOOGSTRATE"Y,"et"al."Identification"of"patients"with"recurrent"glioblastoma"who"may"benefit"from"combined"bevacizumab"and"CCNU"therapy:"A"report"from"the"BELOB"trial[J]."Cancer"Res,"2016,"76(3):"525–534.
[17] YEN"Y"F,"DA"X,"CATANA"C,"et"al."Penetration"of"radiolabeled"temozolomide"correlates"with"contrast"enhancement"in"patients"with"recurrent"GBM"treated"with"bevacizumab[J]."Neuro"Oncology,"2016,"18(6):"133.
[18] KOVIC"B,"XIE"F."Economic"evaluation"of"bevacizumab"for"the"first-line"treatment"of"newly"diagnosed"glioblastoma"multiforme[J]."J"Clinoncol,"2015,"33(20):"2296–2302.
[19] WOLF"I"M,"FAN"Z,"RAUH"M,"et"al."Histone"deacetylases"inhibition"by"SAHA/Vorinostat"normalizes"the"glioma"microenvironment"via"xCT"equilibration[J]."Sci"Rep,nbsp;2014,"4:"6226.
[20] PARKER"KERRIGAN"B"C,"HOSSAIN"A,"YAMASHITA"S,"et"al."Stem"cell"therapy"of"gliomas[J]."Prog"Neurol"Surg,"2018,"32:"124–151.
[21] TOBIAS"A,"AHMED"A,"MOON"K"S,"et"al."The"art"of"gene"therapy"for"glioma:"A"review"of"the"challenging"road"to"the"bedside[J]."J"Neurol"Neurosurg"Psychiatry,"2013,"84(4):"213–222.
[22] MELEN"G"J,"FRANCO-LUZÓN"L,"RUANO"D,"et"al."Influence"of"carrier"cells"on"the"clinical"outcome"of"children"with"neuroblastoma"treated"with"high"dose"of"oncolytic"adenovirus"delivered"in"mesenchymal"stem"cells[J]."Cancer"Lett,"2016,"371(2):"161–170.
[23] WHITLEY"R"J,"MARKERT"J"M."Viral"therapy"of"glioblastoma"multiforme[J]."Proc"Natl"Acad"Sci"USA,"2013,"110(29):"11672–11673.
[24] CHEEMA"T"A,"WAKIMOTO"H,"FECCI"P"E,"et"al."Multifaceted"oncolytic"virus"therapy"for"glioblastoma"in"an"immunocompetent"cancer"stem"cell"model[J]."Proc"Natl"Acad"Sci"USA,"2013,"110(29):"12006–12011.
[25] VAN"MEIR"E"G,"HADJIPANAYIS"C"G,"NORDEN"A"D,"et"al."Exciting"new"advances"in"neuro-oncology:"The"avenue"to"a"cure"for"malignant"glioma[J]."CA"Cancer"J"Clin,"2010,"60(3):"166–193.
(收稿日期:2024–03–29)
(修回日期:2024–11–21)
