达格列净对2型糖尿病合并非酒精性脂肪性肝病患者影响的Meta分析
2024-12-31黄虹
【摘要】目的 探究达格列净对2型糖尿病(T2DM)合并非酒精性脂肪性肝病(NAFLD)患者的影响,为临床治疗提供参考。方法 筛选中国知网期刊全文数据库(CNKI)、万方数据知识服务平台、维普数据库、Pubmed数据库、Web of science数据库截至2024年7月发表的关于达格列净治疗T2DM合并NAFLD患者的随机对照试验(RCT),根据纳入和排除标准筛选文献并提取研究数据。使用RevMan 5.3软件对纳入文献进行质量评价、对各结局指标进行Meta分析,运用逐一排除法对Meta分析结果进行敏感性分析,针对内脏脂肪面积绘制漏斗图进行发表偏倚分析。结果 本研究纳入14篇文献,共1 215例患者,纳入研究均存在实施偏倚。Meta分析结果显示:试验组患者肝脏脂肪面积小于对照组[MD=-14.44,95%CI(-18.36,-10.52),Plt;0.001]、天门冬氨酸氨基转移酶(AST)水平低于对照组[MD=-3.77,95%CI(-7.43,-0.11),P=0.040]、丙氨酸氨基转移酶(ALT)水平高于对照组[MD=-3.28,95%CI(-8.44,-0.11),P=0.040]、谷氨酰转肽酶(GGT)水平低于对照组[MD=-3.28,95%CI(-8.44,-0.11),P=0.040]、总胆固醇(TC)水平高于对照组[MD=-0.70,95%CI(-0.82,-0.59),Plt;0.001]、三酰甘油(TG)水平高于对照组[MD=-0.53,95%CI(-0.59,-0.47),Plt;0.001]、低密度脂蛋白胆固醇(LDL-C)水平高于对照组[MD=-0.50,95%CI(-0.57,-0.43),Plt;0.001]、高密度脂蛋白胆固醇(HDL-C)水平高于对照组[MD=0.34,95%CI(0.31,0.38),Plt;0.001]、BMI低于对照组[MD=-1.93,95%CI(-2.25,-1.61),Plt;0.001]、空腹血糖(FPG)水平低于对照组[MD=-1.37,95%CI(-1.50,-1.25),Plt;0.001]、糖化血红蛋白(HbA1c)水平低于对照组[MD=-0.47,95%CI(-0.60,-0.34),P=0.020]。敏感性分析结果显示:Meta分析结果的MD和95%CI均有变动,但与原结果统计学意义一致,Meta分析结果较为稳健。漏斗图分析结果显示:各研究呈对称分布,P=0.300,不存在发表偏倚。结论 达格列净治疗T2DM合并NAFLD患者的效果较好,可减小肝脏脂肪面积、改善糖脂代谢、降低体质量、保护肾功能,值得临床应用。
【关键词】达格列净;2型糖尿病;非酒精性脂肪性肝病;Meta分析
【中图分类号】R587.1 【文献标识码】A 【文章编号】2096-2665.2024.23.0103.05
DOI:10.3969/j.issn.2096-2665.2024.23.032
2型糖尿病(type 2 diabetes mellitus, T2DM)是由胰岛素分泌缺陷导致糖代谢异常及相关代谢紊乱引起的慢性疾病,已成为全球性公共卫生问题[1]。非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)和T2DM是密切相关的两种代谢性疾病,常共存且相互促进病情的进展[2-3]。有研究表明, 60%~75%的T2DM患者会并发NAFLD[4]。 T2DM合并NAFLD患者的胰岛素抵抗及血脂水平较高,发生心血管疾病及发展为肝硬化、肝癌的风险较高[5-6]。达格列净作为钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂的代表药物,可有效控制血糖并降低体质量和血压,减少心血管事件的发生[7]。目前,国内外已有部分随机对照试验(RCT)初步探讨达格列净在T2DM合并NAFLD患者中的应用效果,显示出良好的治疗潜力和安全性。但各研究的设计、样本量、随访时间等方面存在差异,单独的研究结果可能存在偏倚。基于此,本研究系统性回顾14篇相关研究,对达格列净对T2DM合并NAFLD患者的影响进行分析,现报道如下。
1 资料与方法
1.1 一般资料 筛选中国知网期刊全文数据库(CNKI)、万方数据知识服务平台、维普数据库、 Pubmed数据库、Web of science数据库截至2024年7月发表的关于达格列净治疗T2DM合并NAFLD患者的RCT。纳入标准:⑴ 研究对象为T2DM患者,且经肝组织活检或影像学检查确诊为NAFLD[8-9];⑵试验组患者接受达格列净治疗,对照组患者接受其他临床疗法治疗;⑶主要研究指标包括肝脏脂肪面积及丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、谷氨酰转肽酶(GGT)水平,次要研究指标包括总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、 BMI、空腹血糖(FPG)、糖化血红蛋白(HbA1c)水平。排除标准:⑴横断面研究或动物实验研究;⑵病例报道、会议论文、综述、评价性文章等;⑶重复发表的文章;⑷无法获取全文内容或关键研究数据缺失的文章。
1.2 筛选方法 采用主题词与自由词相结合进行检索,围绕“非酒精性脂肪肝”“达格列净”及其相关自由词。具体检索式可适当调整,主要检索式参考如下:⑴中文数据库检索:(主题:非酒精性脂肪肝) OR[(篇关摘:非乙醇性脂肪肝+非酒精性脂肪性肝病+假性酒精性肝病(精确)]AND(主题:达格列净) OR[(篇关摘:安达糖+钠-葡萄糖协同转运蛋白2抑制剂+SGLT2抑制剂+达格列嗪(精确)]AND(主题:随机对照) OR[(篇关摘:随机+对照(精确)]。⑵英文数据库检索:(\"Non-alcoholic Fatty Liver Disease\"[Mesh])OR(Non-alcoholic Fatty Liver Disease[Title/Abstract])OR(Nonalcoholic Fatty Liver Disease[Title/Abstract])OR(NAFLD[Title/Abstract])OR(NASH[Title/Abstract])OR(Fatty Liver, nonalcoholic[Title/Abstract])OR(nonalooholic Steatohepatis[Title/Abstract])OR(Liver, Nonalooholic Fatty[Title/Abstract])OR (Steatohepatis, Non-al cobolic[Title/Abstract])AND(\"Randomized Controlled Trial\" [Publication Type])OR(randomized controlled trialsmh[Title/Abstract])OR(random allocation[Title/Abstract])OR(random allocat[Title/Abstract])OR(randomly allocat[Title/Abstract])AND(\"Randomized Controlled Trial\" [Publication Type])OR(randomized controlled trialsmh[Title/Abstract])OR(random allocation[Title/Abstract])OR(random allocat[Title/Abstract])OR(randomly allocat[Title/Abstract])OR(double-blind method[Title/Abstract])OR(double blind[Title/Abstract])。
1.3 观察指标 ⑴提取研究数据,包括作者、患者数量、干预措施、干预时间、结局指标等信息。⑵由2位独立的研究者协同筛选文章类型及确认疾病诊断的准确性。采用RewMan 5.3统计软件对文章的随机分配方法、盲法、结果数据完整性及其他偏倚风险来源依次进行质量评价,并绘制偏倚风险图。偏倚风险由 Cochrane 量表[10]进行meta分析评估。若评价存在分歧,由第3位研究者裁定。⑶采用RewMan 5.3软件对纳入文献的结局指标进行Meta分析。⑷运用逐一排除法对Meta分析结果进行敏感性分析。⑸针对内脏脂肪面积绘制漏斗图进行发表偏倚分析。
1.4 统计学分析 采用RewMan 5.3统计软件对数据进行分析。连续性变量以均数差(MD)表示,所得效应以95%CI表示。利用I2统计量评估不同研究间的异质性程度, I2≤50%表明各研究间缺乏显著的统计学异质性,选用固定效应模型; I2gt;50%表明研究间存在统计学上的异质性,选用随机效应模型。以Plt;0.05为差异有统计学意义。
2 结果
2.1 文献检索结果 根据检索策略检索到108篇文献,排除80篇(去除重复项、非原创综述、 meta分析、研究进展汇总、其他形式的荟萃研究、动物实验及不符合主题内容的文献),后阅读剩余文献的全文内容,依据纳入与排除标准,共纳入14篇文献。文献筛选流程图,见图1。
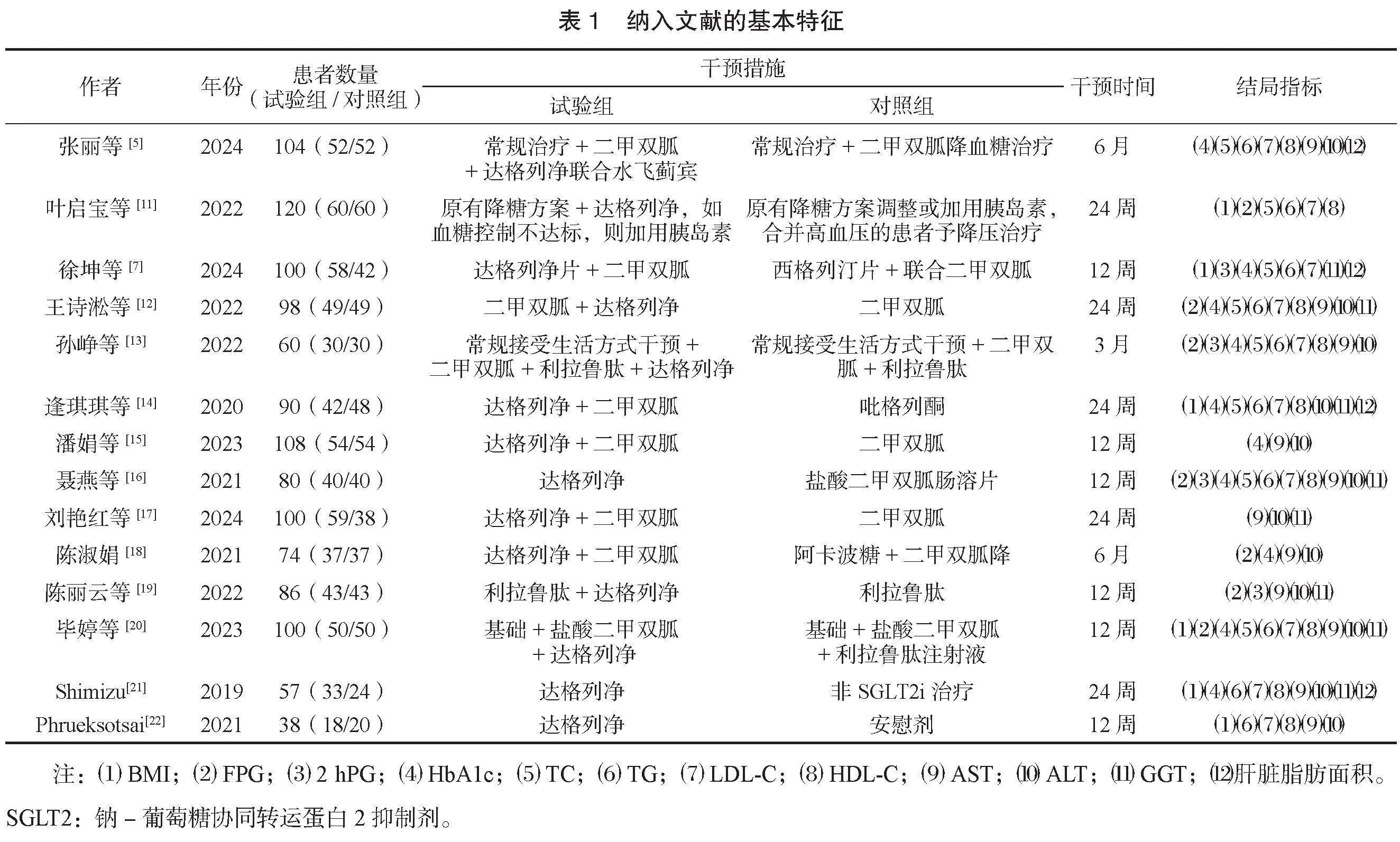
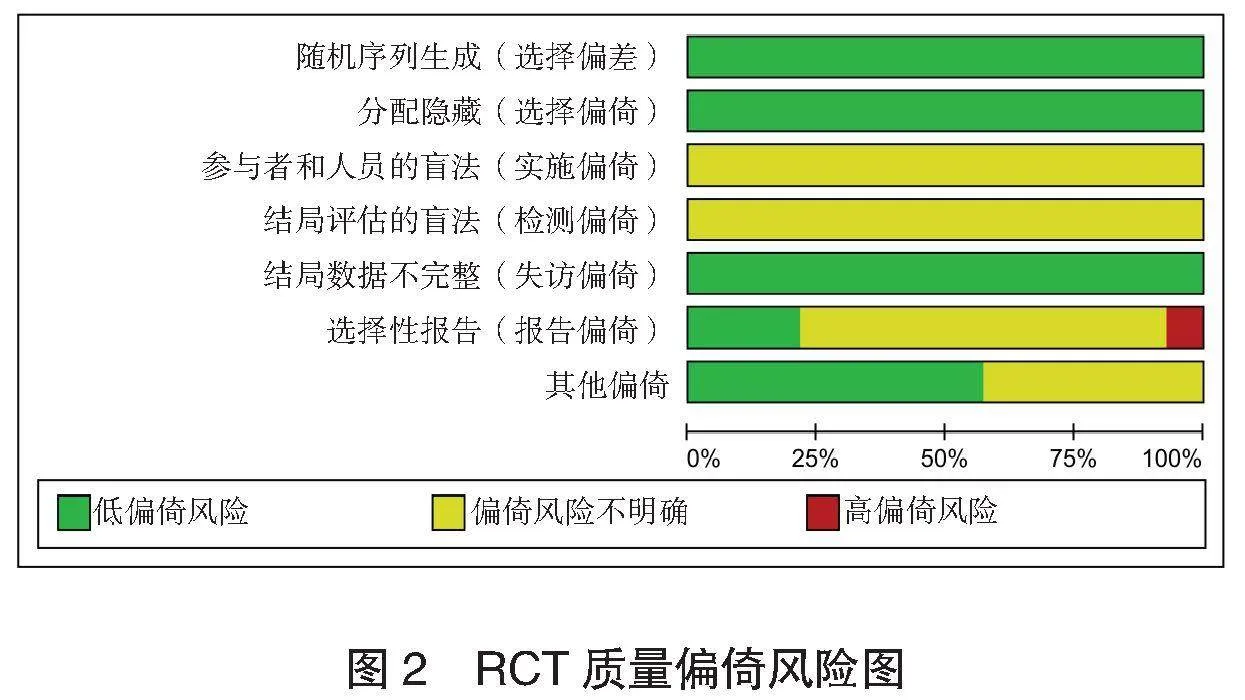
2.2 纳入文献的基本特征及质量评价 纳入文献的基本特征,见表1。所有研究均存在实施偏倚,见图2。
2.3 纳入文献的meta分析结果
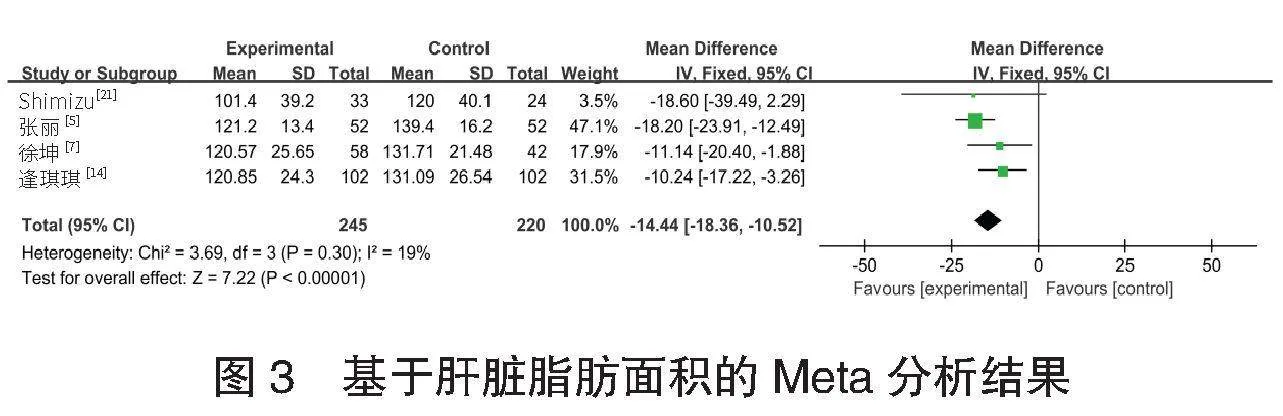
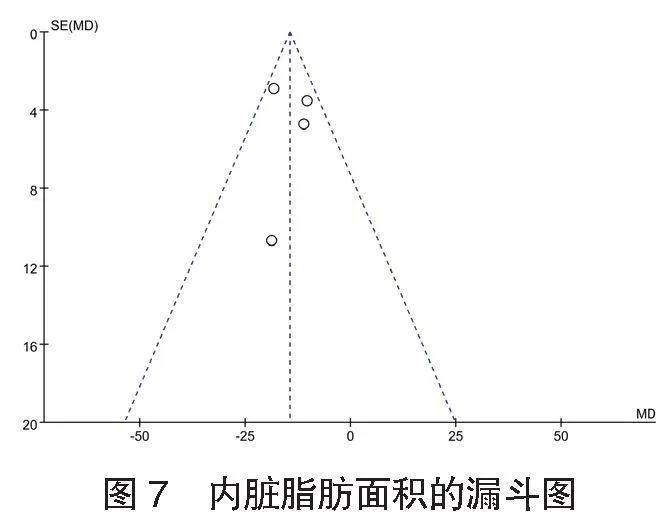
⑴肝脏脂肪面积的meta分析 共4项[5,7,14,21]研究报道了465例患者的肝脏脂肪面积情况。各研究间无异质性(I2=19%,P=0.300),采用固定效应模型进行Meta分析,结果显示:试验组患者肝脏脂肪面积小于对照组,差异有统计学意义[MD=-14.44,95%CI(-18.36,-10.52), Plt;0.001],见图3。
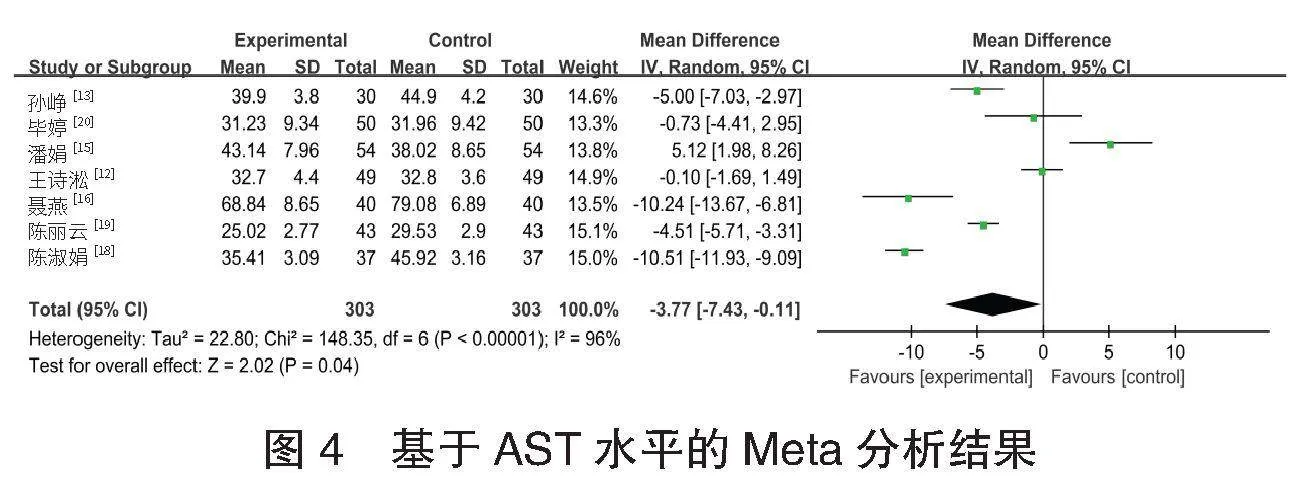
⑵AST水平的meta分析 共7项[12-13,15-16,18-20]研究报道了606例患者的AST水平情况。各研究间异质性较高(I2=96%, Plt;0.001),采用随机效应模型进行Meta分析,结果显示:试验组患者AST水平低于对照组,差异有统计学意义[MD=-3.77,95%CI(-7.43,-0.11),P=0.040],见图4。
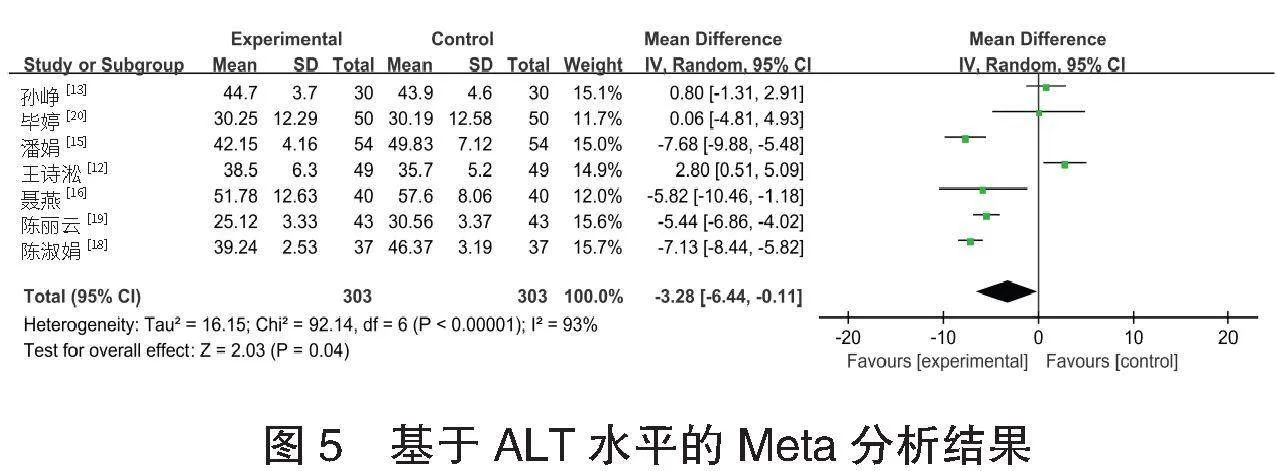
⑶ALT水平的meta分析 共7项[12-13,15,16,18-20]研究报道了606例患者的ALT水平情况研究。各研究间异质性较高(I2=93%,Plt;0.001),采用随机效应模型进行Meta分析,结果显示:试验组患者ALT水平高于对照组,差异有统计学意义[MD=-3.28,95%CI(-8.44,-0.11),P=0.040],见图5。
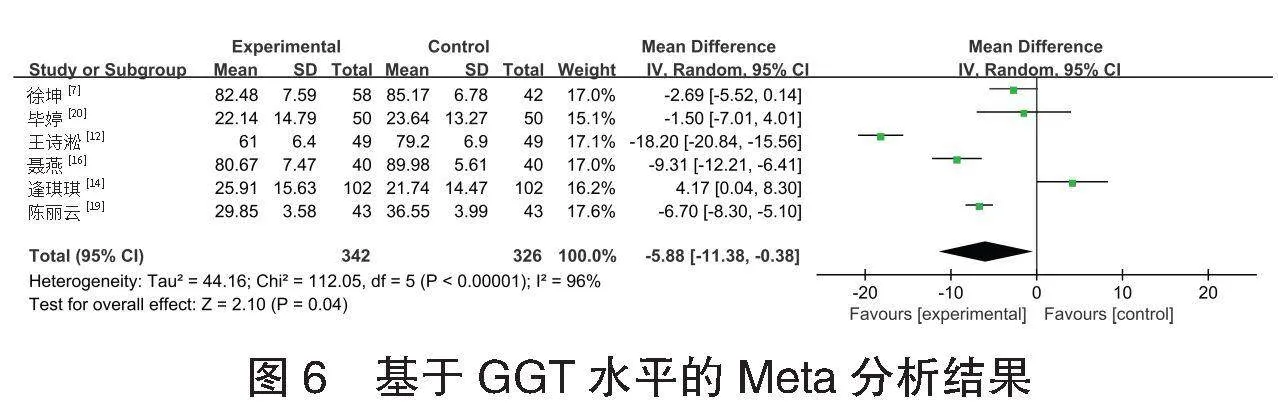
⑷GGT水平的meta分析 共6项[7,12,14,16,19-20]研究报道了668例患者的GGT水平情况。各研究间异质性较高(I2=96%,Plt;0.001),采用随机效应模型进行Meta分析,结果显示:试验组患者GGT水平低于对照组,差异有统计学意义[MD=-3.28,95%CI(-8.44,-0.11),P=0.040],见图6。
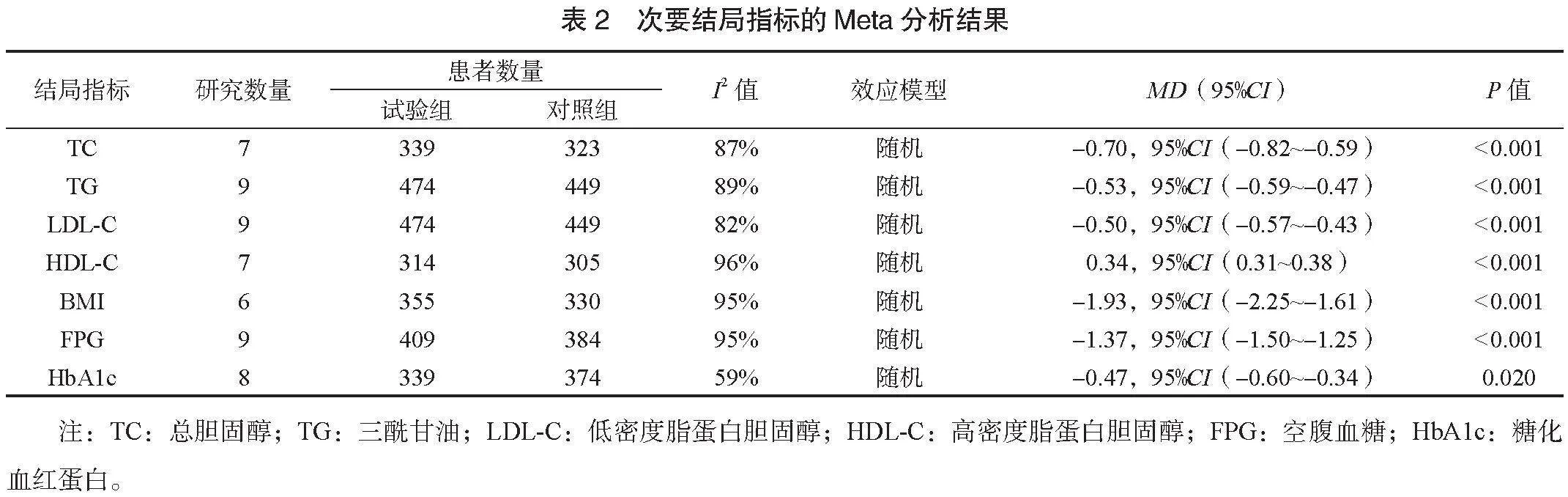
⑸次要结局指标的meta分析 试验组患者TC水平[MD=-0.70,95%CI(-0.82,-0.59),Plt;0.001]、TG水平[MD=-0.53,95%CI(-0.59,-0.47),Plt;0.001]、LDL-C水平[MD=-0.50,95%CI(-0.57,- 0.43),Plt;0.001]、HDL-C水平[MD=0.34,95%CI(0.31,0.38)],Plt;0.001]均高于对照组;试验组患者BMI[MD=-1.93,95%CI(-2.25,-1.61)、Plt;0.001]、FPG水平[MD=-1.37,95%CI(-1.50,-1.25),Plt;0.001]、HbA1c水平[MD=-0.47,95%CI(-0.60,-0.34),P=0.020]均低于对照组,差异均有统计学意义,见表2。
2.4 敏感性分析结果 运用RevMan5.3软件逐一排除法对Meta分析结果进行敏感性分析,逐一剔除单个研究后,对剩余研究重新进行合并分析,结果显示: Meta分析结果的MD和95%CI均有变动,但与原结果统计学意义一致,该Meta分析结果较为稳健。
2.5 发表偏倚分析结果 针对内脏脂肪面积绘制漏斗图进行发表偏倚分析,结果显示:各研究呈对称分布,P=0.300,不存在发表偏倚,见图7。
3 讨论
达格列净与其他降血糖药物协同作用,不仅能显著提高血糖控制效果,还能降低患者的BMI、减少内脏脂肪积累、有效调整血脂和血压[23]。目前,国内外已有部分综述探究SGLT2抑制剂对T2DM合并NAFLD患者的潜在益处,但聚焦于达格列净这一特定药物的Meta分析较少。
一项研究表明,选择性SGLT2抑制剂达格列净可减少T2DM 患者的脂肪量,降低内脏脂肪厚度、皮下脂肪厚度,进而减轻总体质量[24]。Yang等[25]研究表明,达格列净可通过双能X线吸收测定法显著降低患者的总体脂肪量,且磁共振成像观察到皮下和内脏脂肪组织减少。初期体质量的下降可归因于达格列净引发的轻微渗透性利尿作用,后续体质量的下降则归因于达格列净增强尿液中葡萄糖的排出。这一过程与脂肪量的减少趋势相吻合,进一步证明了达格列净在体质量管理方面的积极作用。本研究结果显示,试验组患者肝脏脂肪面积小于对照组,提示T2DM合并NAFLD患者应用达格列净可有效减小肝脏脂肪面积。
ALT和AST是肝细胞损伤的指标,GGT水平升高是NAFLD晚期纤维化的危险因素。本研究结果显示,达格列净可降低T2DM合并NAFLD患者的ALT、AST、GGT水平,提示达格列净对肝脏具有保护作用。Kato等[26]在一项随机、交叉、对照的临床试验中发现,肥胖的T2DM患者进行12周的达格列净治疗后,体质量、血压、总脂肪量、内脏脂肪面积、HbA1c水平均得到明显改善。本研究结果显示,试验组患者TC、TG、LDL-C、HDL-C水平均高于对照组,BMI、FPG、HbA1c均水平低于对照组。这提示在减少脂质、控制血糖方面达格列净更具优势。
综上所述,达格列净治疗T2DM合并NAFLD患者的效果较好,可减小肝脏脂肪面积、改善糖脂代谢、降低体质量、保护肾功能,值得临床应用。
参考文献
曾佳玲,蒙艳,邓婷婷,等. 2型糖尿病患者非酒精性脂肪肝与内脏脂肪面积及甲状腺结节的相关性研究[J].中国全科医学, 2024.
Targher G, Tilg H, Byrne C D. Non-alcoholic fatty liver disease: a multisystem disease requiring a multidisciplinary and holistic approach[J]. Lancet Gastroenterol Hepatol, 2021, 6(7): 578-588.
STEFAN N, CUSI K. A global view of the interplay between non-alcoholic fatty liver disease and diabetes[J]. Lancet Diabetes Endocrinol, 2022, 10(4): 284-296.
En Li Cho E, Ang C Z, Quek J, et al. Global prevalence of non-alcoholic fatty liver disease in type 2 diabetes mellitus: an updated systematic review and meta-analysis[J]. Gut, 2023, 72(11): 2138-2148.
张丽,王晨菲,陆春晖,等.达格列净联合水飞蓟宾治疗2型糖尿病合并非酒精性脂肪肝患者疗效分析[J].疑难病杂志, 2024, 23(3): 328-333.
高秀莹,朱传明,郭彩红,等.达格列净对中青年2型糖尿病患者非酒精性脂肪肝的改善作用[J].山东医药, 2023, 63(36): 82-86.
徐坤,张晓敏,张燕燕,等.达格列净治疗老年2型糖尿病合并非酒精性脂肪性肝病患者的临床研究[J].中国临床药理学杂志, 2024, 40(5): 635-639.
中华医学会糖尿病学分会.中国2型糖尿病防治指南(2020年版)[J].中华糖尿病杂志, 2021, 13(4): 315-409.
中华医学会肝病学分会.代谢相关(非酒精性)脂肪性肝病防治指南(2024年版)[J].中华肝脏病杂志, 2024, 32(5): 418-434.
马捷,刘莹,钟来平,等. Jadad量表与Cochrane偏倚风险评估工具在随机对照试验质量评价中的应用与比较[J].中国口腔颌面外科杂志, 2012, 10(5): 417-422.
叶启宝,王国娟,陈望,等.达格列净对老年2型糖尿病合并非酒精性脂肪肝患者血糖、血脂及颈动脉内膜中层厚度的影响[J]. 中国老年学杂志, 2022, 42(19): 4652-4655.
王诗淞,林辉雄,张泰胜,等.二甲双胍联合达格列净治疗T2DM合并NAFLD患者疗效及血清二肽基肽酶4和C肽变化[J].实用肝脏病杂志, 2022, 25(3): 379-382.
孙峥,王笑烨,袁景,等.达格列净联合利拉鲁肽治疗非酒精性脂肪性肝病合并2型糖尿病患者短期疗效研究[J].实用肝脏病杂志, 2022, 25(6): 796-799.
逄琪琪,王美荣,高倩,等.达格列净或吡格列酮联合二甲双胍治疗2型糖尿病合并非酒精性脂肪性肝病的疗效比较[J].中国新药与临床杂志, 2020, 39(11): 675-679.
潘娟,王琪,张燕.达格列净联合二甲双胍治疗2型糖尿病合并非酒精性脂肪性肝病的疗效及安全性观察[J].贵州医药, 2023, 47(3): 406-407.
聂燕,丁洪成,李艳丽,等.达格列净和二甲双胍治疗2型糖尿病伴非酒精性脂肪肝患者的临床疗效[J].江苏医药, 2021, 47(3): 286-289.
刘艳红,杨颖,卢英萍,等.达格列净治疗对2型糖尿病合并非酒精性脂肪性肝病患者肝纤维化及脂肪变性影响的研究[J].医师在线, 2024, 14(4): 38-41.
陈淑娟.达格列净与阿卡波糖在2型糖尿病并发非酒精性脂肪性肝病患者辅助治疗中的应用比较[J].首都食品与医药, 2021, 28(2): 81-82.
陈丽云,黄文森.达格列净结合利拉鲁肽对2型糖尿病合并非酒精性脂肪性肝病的CRP, D-二聚体及肝功能的影响[J].罕少疾病杂志, 2022, 29(9): 39-40, 45.
毕婷,于添伟,武丽华.达格列净与利拉鲁肽治疗2型糖尿病合并非酒精性脂肪肝的疗效对比[J].糖尿病新世界, 2023, 26(8): 94-97.
Shimizu M, Suzuki K, Kato K, et al. Evaluation of the effects of dapagliflozin, a sodium-glucose cotransporter-2 inhibitor, on hepatic steatosis and fibrosis using transient elastography in patients with type 2 diabetes and non-alcoholic fatty liver disease[J]. Diabetes Obes Metab, 2019, 21(2): 285-292.
Phrueksotsai S, Pinyopornpanish K, Euathrongchit J, et al. The effects of dapagliflozin on hepatic and visceral fat in type 2 diabetes patients with non-alcoholic fatty liver disease[J]. J Gastroenterol Hepatol, 2021, 36(10): 2952-2959.
叶娟,陈冬,邱振汉,等.司美格鲁肽联合达格列净、二甲双胍在肥胖型2型糖尿病合并非酒精性脂肪肝患者中的疗效分析[J].糖尿病新世界, 2024, 27(1): 19-22.
Bolinder J, Ljunggren Ö, Kullberg J, et al. Effects of dapagliflozin on body weight, total fat mass, and regional adipose tissue distribution in patients with type 2 diabetes mellitus with inadequate glycemic control on metformin[J]. J Clin Endocrinol Metab, 2012, 97(3): 1020-1031.
Yang W, Han P, Min K W, et al. Efficacy and safety of dapagliflozin in Asian patients with type 2 diabetes after metformin failure: A randomized controlled trial[J]. J Diabetes, 2016, 8(6): 796-808.
Kato K, Suzuki K, Aoki C, et al. The effects of intermittent use of the SGLT-2 inhibitor, dapagliflozin, in overweight patients with type 2 diabetes in Japan: a randomized, crossover, controlled clinical trial[J]. Expert Opin Pharmacother, 2017, 18(8): 743-751.
