基于X 射线荧光光谱分析水稻籽粒离子组
2024-12-31游思亮刘向前席庆赵方杰黄新元
摘要: 【目的】水稻籽粒离子组通常采用电感耦合等离子体质谱(ICP-MS) 和电感耦合等离子体发射光谱(ICPOES)等技术进行分析,需要破坏性取样且样品前处理过程复杂。X 射线荧光光谱法(XRF) 一般无需进行样品处理,可以快速无损地检测样品中的元素含量。本研究建立和优化了利用XRF 进行水稻籽粒离子组分析的方法。【方法】通过比较不同的试验条件对水稻籽粒中不同元素XRF 谱图的影响,确定适合进行XRF 分析的元素及试验条件,通过与ICP-MS 定量结果的相关性分析,检验XRF 定量方法的适用性、定量结果的准确性。【结果】在样品室抽真空时,光源在30 kV 和 600 μA 并且不使用滤光片的条件下,使用50 μm 步长面扫描时,样品中的P、S、Cl、K、Ca、Mn、Fe 和Zn 等元素信号与背景对比明显。同时,XRF 扫描获得的Mn 和Zn 的荧光定量结果与ICP-MS 的测定结果具有较高的相关性,线性拟合的决定系数分别为0.8415 (Plt;0.001) 和0.7736(Plt;0.001)。采用优化的分析条件,水稻籽粒中Cd 的两条特征谱线La 和Ka 分别受到K 和Mn 信号的压抑,不能用于Cd 含量的定量分析。【结论】采用优化的试验条件,XRF 方法可以无损地同时测定稻米中多个营养元素,特别是锌和锰。但由于Cd 特征图谱与稻米中含量较高的K 和Mn 接近,信号无法清楚识别,因此,XRF 仪无法快速测定水稻籽粒中Cd 含量是否超标。
关键词: 水稻; 籽粒离子组; X 射线荧光; 电感耦合等离子体质谱; 无损分析
水稻(Oryza sativa L.) 是重要的粮食作物之一,为全球一半以上的人口提供淀粉、蛋白质和必需矿质营养元素。亚洲人口每天卡路里摄入量的75% 来自大米,虽然一般大米品种矿质营养元素含量并不丰富,但它仍然为人们提供一定量的热量、维生素和矿物质[1]。矿物质直接或间接地影响人类的新陈代谢及生理过程,人体矿质营养元素摄入不足可能会导致多种功能障碍和疾病,导致所谓的“隐形饥饿”[2]。据统计,世界上大约有60% 的人口铁缺乏,超过30% 的人口锌缺乏,而缺铁会导致贫血,缺锌则会导致生长迟缓和智力迟钝[3]。生物强化育种可以有效地增加主食中矿质元素的含量,被认为是解决人体微量元素摄入不足的一种低成本和可持续的方法[4]。要开展水稻的矿质元素强化育种,首先需要对大量育种材料的籽粒矿质营养元素和有毒有害元素的含量进行快速准确地检测,特别是对一些珍贵且稀有的样本,开发一种无损快速的检测技术非常有必要。
水稻籽粒离子组是指水稻籽粒中所有矿质营养元素和微量元素的总和,既包括了磷(P)、硫(S)、钾(K)、钙(Ca) 等大量和中量元素,也包括铁(Fe)、锌(Zn)、硒(Se)、铜(Cu)、锰(Mn) 等人体必需的微量元素以及镉(Cd)、砷(As) 等有毒有害元素[5−6]。目前水稻籽粒中矿质元素含量的检测技术主要有原子吸收光谱技术[7] (flame atomic absorption spectrometry,FAAS)、电感耦合等离子体质谱技术[8] (inductivelycoupled plasma mass spectrometry,ICP-MS)、电感耦合等离子体发射光谱技术[9] (inductively coupled plasmaoptical emission spectroscopy,ICP-OES),这些技术需要将待测部位从整株中分离、研磨、加酸消解。前处理方法复杂,容易引起离子污染,此外由于样品的消解导致元素的原位分布信息丢失,且原始的样品也无法继续用于繁种。相比于传统的化学技术,X 射线荧光光谱技术[10−11] (X-ray fluorescence,XRF)具有制样简单、检测成本低、无损检测、分析速度快、可同时检测多种元素、结果重复性好、不改变元素形态以及可以检测元素的原位分布等特点[12−14],在农业研究领域已经得到了广泛的应用[15−18]。
XRF 技术的原理是当原子核周围的低能态电子受到一定能量的X 射线照射跃迁到高能态,低能态电子轨道上会产生空位,于是高能态电子会自动跃迁到低能态填补空位,两个轨道的能量差以二次X射线的形式释放,不同元素所释放的二次射线具有各自的特征,通过检测二次X 射线的特征和强度,可以确定元素的种类以及该元素的含量[12]。有研究者利用XRF 技术研究不同植物组织中部分元素的含量[16−17]和分布[19−21],但定量分析时对样品进行研磨,无法保持样品的结构完整性,元素的原位分布结果虽然直观,但无法得到元素的定量结果。本研究旨在确定利用 XRF 技术快速无损分析水稻籽粒中元素含量的条件。
1 材料与方法
1.1 试验材料
本试验选用水稻粳稻品种‘中花11’的籽粒进行XRF 参数比较。选用19 份不同水稻品种籽粒样品进行XRF 荧光值与ICP-MS 测定的元素含量的相关分析。上述品种均种植于南京农业大学白马基地无Cd 污染水稻田块。Cd 污染稻米样品来源于江苏常熟某地Cd 污染田块和未污染田块种植的水稻品种‘常农粳12 号’。
1.2 试验仪器
X 射线荧光光谱仪(M4 Tornado plus,BRUKER),未装双曲面弯晶光学晶体,配备了30 W Rh 靶X 射线光管(最大工作电压50 kV,最大工作电流600 μA,光斑直径20 μm) 和两个60 mm2 硅漂移探测器(能量分辨率lt; 145 eV@600000 cps),仪器工作距离9 mm,点扫描时积分时间30 s,面扫描时像素积分时间2 ms,其他参数见1.3 试验设计。
1.3 籽粒样品处理及分析
手工剥离稻壳获得供试糙米样品。先将‘中花11’的籽粒样品固定在载物台上,分别用点、面两种模式扫描,以确定后续样品的扫描方式和参数。
点扫描:样品置于真空条件下,光源在50 kV电压和600 μA 电流且不加滤光片,分别从样品环境(真空环境0.2 Kpa 和非真空环境100 KPa),滤光片(不使用滤光片,以及使用厚度分别为12.5、25 和100 μm 的铝滤光片),光源电流(光源电流分别为200、400、600 μA),光源电压(光源电压分别为30、40、50 kV) 4 个方面筛选。面扫描:经筛选后,在样品室抽真空,设定光源为30 kV 和600 μA 并且不使用滤光片条件下,分别采用10、20、50、75、100 μm 步长对同一样品的5 个籽粒进行面扫描,计算各元素的XRF 定量分析结果,并比较定量结果的变异系数,确定用于定量研究的最佳扫描步长参数。采用确定的扫描参数对19 份水稻籽粒样品进行面扫描。用仪器自带软件,依据19 份水稻品种籽粒样品的相对荧光强度,得到各元素的定量分析结果。
然后,每个糙米样品选5 粒(约0.1 g) 置于消煮管内,加入5 mL 优级纯浓硝酸,置于石墨消解仪(DigiPREP MS,SCP SCIENCE) 上消解。消解程序如下:采取程序升温的方式,首先升温至115℃,保持3 h;继续升温至180℃,最终获得少量澄清浅黄色油状液体,用2% 硝酸定容至10 mL,离心转移后,用电感耦合等离子质谱分析仪(ICP-MS, PerkinElmer Nexion 300 X) 测定元素含量,每个样品测定3 次。用ICP-MS 测定上述19 份水稻籽粒中的元素含量。
随机选取200 粒‘中花11’野生型籽粒,其中100粒不进行扫描作为对照组,另100 粒用试验筛选的扫描条件扫描之后作为处理组,进行发芽试验,测定发芽率,每组处理3 个重复。
1.4 数据处理
元素的谱线图和实时荧光图通过仪器自带分析软件M4 Tornado 获取。所有样品籽粒同时进行面扫描,然后计算每个样品籽粒中不同元素的含量。XRF和ICP-MS 定量结果,采用Excel (Office 2016) 计算平均值、标准误差、变异系数及决定系数。
2 结果与分析
2.1 试验参数对XRF 谱图的影响
2.1.1 样品室真空度
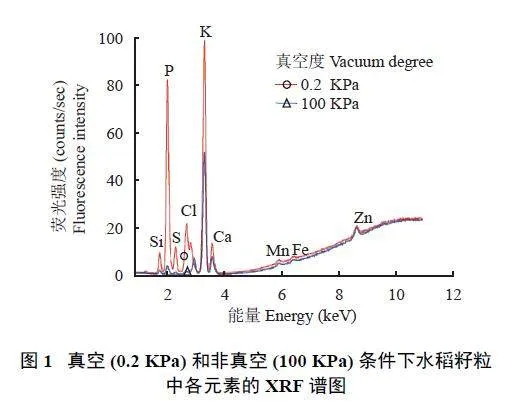
样品在真空环境(0.2 KPa)下,轻质元素Si、P、S 的信号值分别较非真空环境(100 KPa) 提高了7、26、18 倍,Cl 元素在非真空环境下不出峰,真空环境下信号值也大幅提高,矿质元素K、Zn、Fe、Mn、Ca 的信号值略有提高,但提高幅度没有轻质元素大(图1)。表明真空环境降低了空气介质对荧光信号的吸收,特别是降低了对轻质元素荧光信号的影响[22]。所以,多元素同时检测应尽量在真空环境下进行。
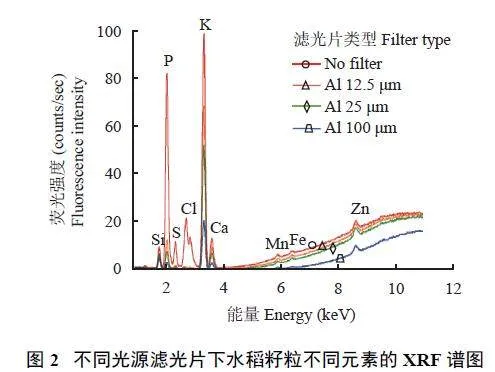
2.1.2 光源滤光片
滤光片位于X 射线光源和多导毛细管入口之间,适当使用滤光片可以提高金属元素的信噪比和检出限,但是也会使所有元素的信号响应值明显下降[23]。当增加滤光片厚度之后,所有元素的信号值都会随之降低,但相对来说对轻质元素的影响更大[24]。相对于不使用滤光片,滤光片不同程度地降低了元素的信号值(图2)。使用100 μm Al 滤光片后,各元素的信号值下降幅度从96% 到29%,其中P 和S 元素下降幅度最大为96%,Zn 元素下降幅度最小为29%。因此,多元素分析不使用滤光片。
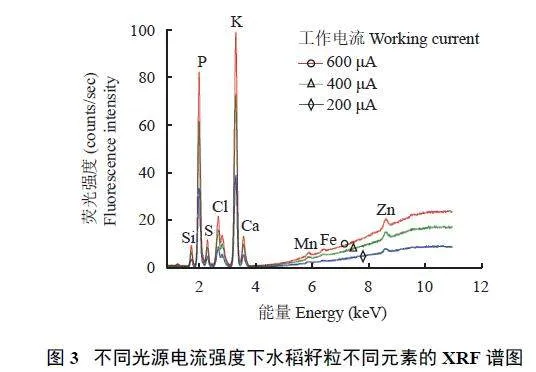
2.1.3 光源电流强度
元素的信号值随着光源电流强度的增大而增大。与200 μA 光源相比,采用600 μA光源,所有元素的信号值均提高,其中,P 元素的信号值提高了1.4 倍,Fe 元素提高了3.1 倍,Zn 元素提高了1.8 倍(图3)。因此,采用仪器能达到的最高工作电流600 μA,以提高元素检测的识别率和灵敏度。
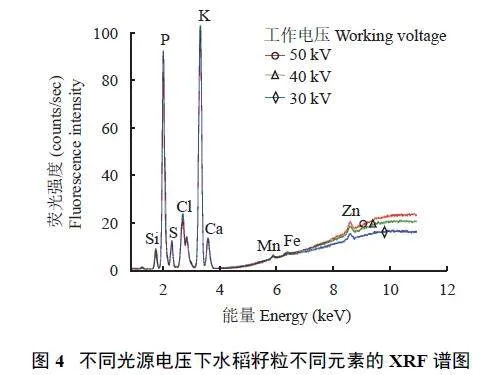
2.1.4 光源电压
改变光源工作电压,除Zn 外的其他各元素的信号值没有特别明显的变化(图4)。考虑到光源使用寿命,后续试验选择能激发600 μA 工作电流的最小电压30 kV。
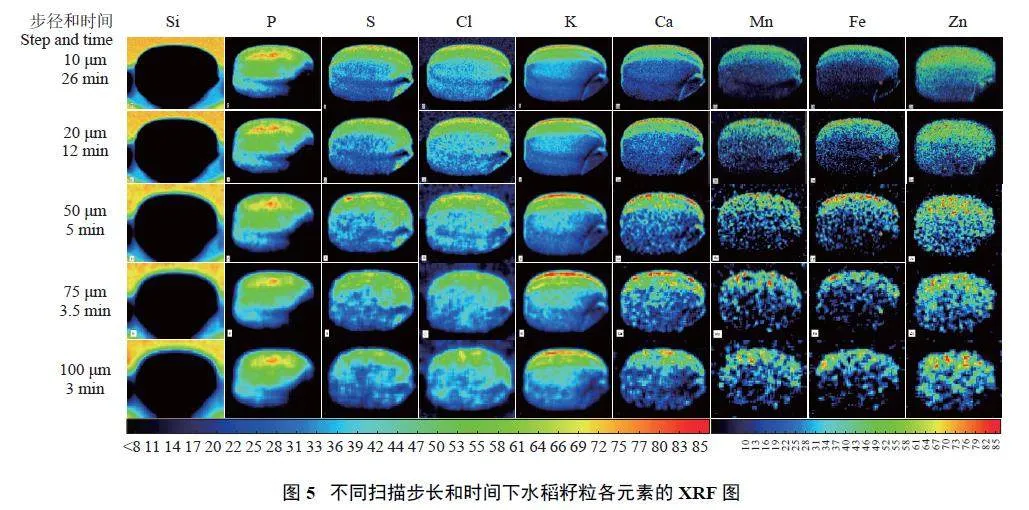
2.1.5 扫描步长
图5 结果表明,采用的扫描步长越小,图像分辨率越高,所用时间也越长。其中Si 元素在样品区域的含量远低于背景,可能是背景如载物台中Si 元素含量相对样品区域较高,因此面扫描方法不适宜于Si 元素定量分析。
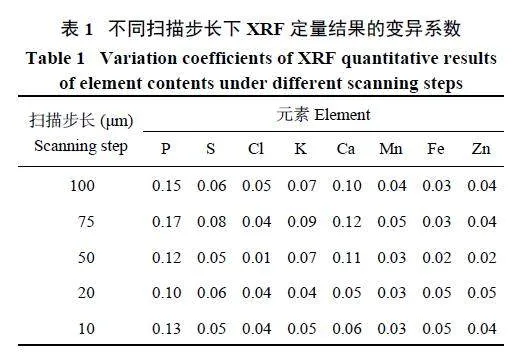
使用不同扫描步长,对同一样品的5 个籽粒同时进行面扫描,计算各元素的XRF 定量分析结果,其变异系数如表1 所示。在50 μm 扫描步长下,S、Cl、Mn、Fe 和Zn 元素的定量结果变异系数最小,而K、P 和Ca 在20 μm 扫描步长下变异系数最小。因此,在50 μm 扫描步长条件下,大部分元素的定量结果重复性都较好。综合考虑图像分辨率、扫描时间以及定量结果重复性,后续采用50 μm 扫描步长作为面扫描的试验条件。
2.2 XRF 法扫描水稻籽粒光谱结果
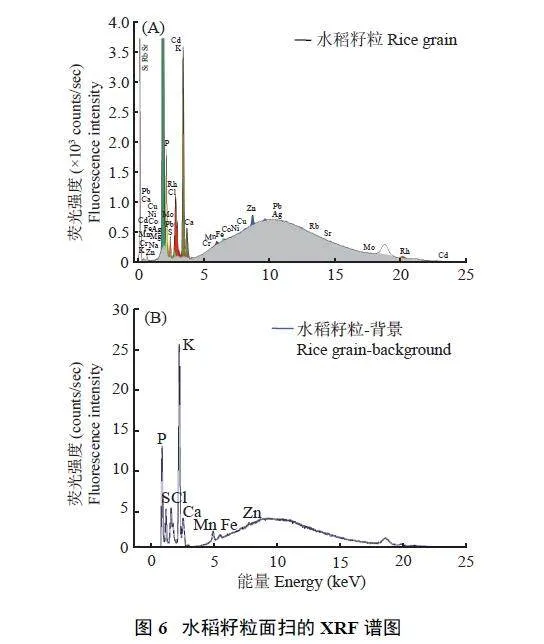
采用优化后的参数,对水稻品种‘中花11’同一株上的5 粒水稻籽粒进行XRF 面扫描。在50 μm 扫描步长下,得到样品区域和背景区域整体XRF 谱图(图6A)。然后选择面积接近的样品区域和背景区域,分别生成XRF 谱图,并将两者谱图相减得到差值谱(图6B),从结果可知,水稻籽粒中P、S、Cl、K、Ca、Mn、Fe 和Zn 元素对比背景有明显的信号差异,表明可以利用XRF 对这些元素进行分析。
2.3 XRF 与ICP-MS 测定结果的相关性分析
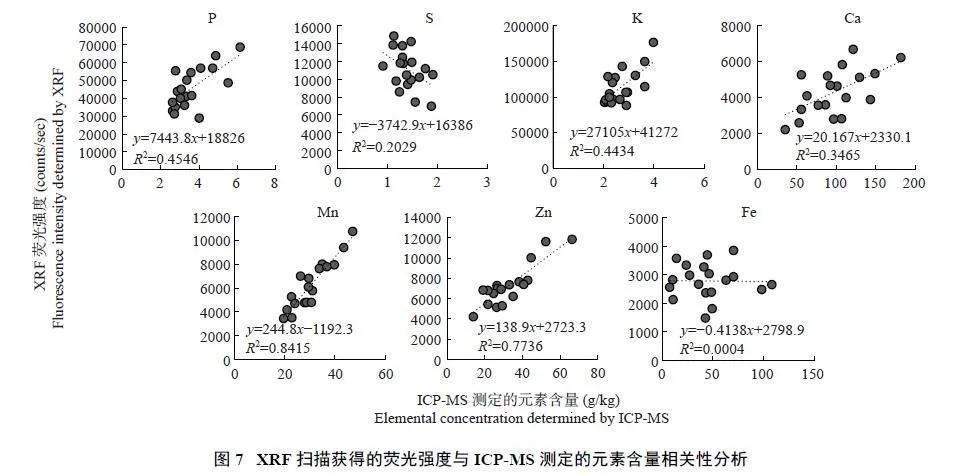
这19 个品种由于遗传背景和种植环境等差异导致籽粒中元素的含量存在差异。首先利用XRF 方法,在面扫描模式下,样品室抽真空时,光源在30 kV和600 μA 并且不使用滤光片的条件下,用50 μm 扫描步长获得P、S、Cl、K、Ca、Mn、Fe 和Zn 的荧光强度值。同时,用ICP-MS 测定19 个品种水稻籽粒中上述元素P、S、K、Ca、Mn、Fe 和Zn 的含量,并分析二者的相关性(图7)。由于Cl 元素无法使用ICP-MS 准确定量,无法计算两种方法测定的Cl 元素含量相关性。
结果表明,两种方法测定的Mn 和Zn 含量值呈现显著相关关系,线性拟合的决定系数分别为0.8415(Plt;0.001) 和0.7736 (Plt;0.001) (图7)。而XRF 扫描获得P、S、K、Ca、Fe 的荧光信号值与ICP-MS 测定得到的元素含量相关性较弱或者不存在相关性,线性拟合的决定系数分别为0.4546 (P = 0.002)、0.2029(P = 0.051)、0.4434 (P = 0.002)、0.3465 (P = 0.008)和0.0004 (P = 0.939)。其中,S 的XRF 荧光强度与ICP-MS 测定的S 含量存在负相关关系,可能由于所使用的条件不适合于扫描籽粒中S 元素,同时也可能因为利用ICP-MS 测定籽粒中S 的含量准确度不高,因为ICP-MS 测定S 用的32S 与氧(O2) 的质荷比非常接近,信号值受反应器中的氧影响较大。因此,XRF 快速定量方法可用于水稻籽粒中Mn 和Zn 元素含量的快速无损检测。
2.4 利用XRF 对Cd 污染水稻籽粒进行扫描分析
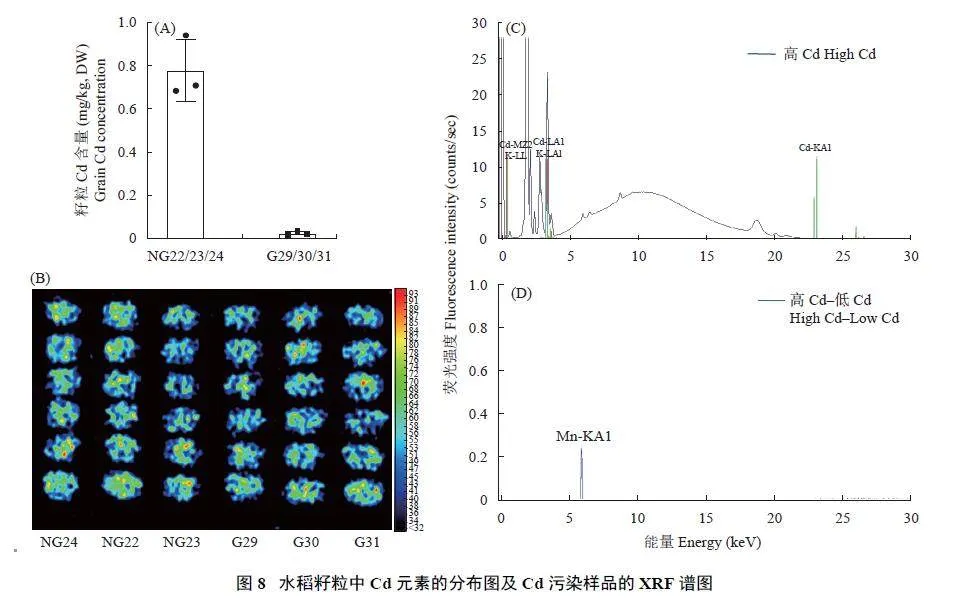
为研究X 射线荧光光谱仪(M4 Tornado plus,BRUKER) 是否可以用于无损测定水稻籽粒Cd 的超标,本研究选用了种植于Cd 污染农田和非污染农田的水稻品种常农粳12 号各3 份材料。通过ICP-MS测定,Cd 污染农田收获的3 份样品籽粒Cd 含量为0.683~0.944 mg/kg,超过国家稻米Cd限量值(0.2mg/kg) 3~4 倍,而非污染农田收获的3 份样品籽粒Cd 含量为0.019~0.034 mg/kg (图8A),超标的3 份样品和未超标的3 份样品稻米Cd 含量相差32 倍。
在面扫描模式下,将样品室抽真空,设置光源在30 kV 和600 μA 并且不使用滤光片,用50 μm 扫描步长对上述6 份样品进行XRF 扫描,每份样品扫描6 个籽粒(图8B)。Cd 元素主要的特征谱线有两条,分别为Lα 线和Kα 线,其中Lα 线与K 元素的特征谱线非常接近。其中K 元素Kα 线位于3.313 keV,而Cd 元素Lα 线位于3.132 keV。而且K 是大量元素,Cd 的Lα 线信号容易受到K 元素信号的影响,故只能使用Cd 的Kα 线,而在谱图中Cd 的Kα 线处没有明显的信号峰(图8C),这说明Cd 的样品信号与背景信号不能有效区分。计算Cd 污染籽粒与未污染籽粒的XRF 差值谱,发现两者谱图主要表现为Mn 元素信号差异(图8D)。因此,在水稻籽粒Cd 超标2~3 倍左右的水平上,本研究选用的X 射线荧光光谱仪(M4 Tornado plus,BRUKER) 不能用于快速检测水稻籽粒中Cd 是否超标。
2.5 XRF 扫描对水稻种子发芽的影响
筛选水稻种子中元素含量发生改变的突变体,是定位和克隆控制元素在水稻籽粒积累相关基因和解析籽粒元素积累分子机理的重要手段。相对于FAAS、ICP-MS、ICP-OES 等需要对种子样品进行破坏性消解后再进行定量测定,XRF 的优点是可以对种子进行无损检测。但是经过XRF 扫描的水稻种子能否正常萌发以繁殖足够的种子进行验证和后续遗传分析,将决定了是否可以利用XRF 扫描的方法,对通过诱变获得的当代突变体种子进行元素含量突变体筛选。为了检测经过XRF 扫描是否影响水稻种子的萌发,对XRF 扫描之后的‘中花11’种子进行发芽试验。未经过XRF 扫描的‘中花11’种子发芽率为95.3%±2.08%,而采用光源在30 kV 和600 μA并且不使用滤光片时,进行50 μm 步长面扫描之后的种子发芽率为95.3% ± 1.53%,与未扫描种子的发芽率不存在显著差异(Pgt;0.05)。上述结果表明XRF仪器的X 射线对中花11 种子发芽率没有任何影响,经XRF 扫描后的种子可以正常萌发。因此,XRF 适用于对当代收获突变体种子进行元素含量突变体筛选,而无需像基于FAAS、ICP-MS、ICP-OES 等破坏性筛选方法需要对突变体进行1~2 代的繁种以获得纯合突变种子才可以进行筛选,节约了工作量和时间成本。
3 讨论
近年来,由于X 射线荧光光谱技术众多的优越性和广泛的适应性,已在环境污染和农产品及其产地质量探测等方面广泛应用。但是由于X 射线光源的限制,配备常规Rh 光源的仪器无法检测到水稻籽粒中的轻质元素,而对Si、P、Cl、S、K、Ca、Mn、Fe、Zn 元素的信号响应较好。同时,在水稻籽粒Mn 和Zn 元素的快速定量研究中,XRF 法与ICPMS法测定结果相关性较好,可作为这两种元素育种材料鉴定筛选的一种方法。而且水稻籽粒在经过优化的试验条件下扫描后,发芽率没有任何变化,说明仪器光源产生的X 射线在工作时间内对籽粒的发芽率没有影响,XRF 测定方法可应用于水稻籽粒离子组突变体材料的筛选。
XRF 法在元素定量应用方面也有一些不足。如大量元素K 和Ca,XRF 法与ICP-MS 法定量结果之间并没有很好的相关性。特别是Ca 元素,其XRF信号值与ICP-MS 测定的含量之间相关性较差,可能与样品形态、元素在籽粒中的空间分布以及XRF 光源在样品中的穿透厚度等因素有关。有研究表明,谷类作物籽粒发育中各微量元素的分布规律不尽相同[25],大量元素K 的移动性较大,精米中的含量达到颖壳中的52.5%~90.6%。中量元素钙在颖壳中含量非常高,而其他元素最高含量均在糊粉层[ 2 1 ],XRF 的穿透性有限,对分布在籽粒表面的元素更为适用,对于胚中含量较高的元素则不能准确的测定,所以这可能是某些元素如Ca 和K 的XRF 扫描定量结果与ICP-MS 测定结果相关性不高的原因之一,其他原因还需要进一步研究。另外有研究显示,样品的含水量也会影响定量结果[24],但是试验中所用到的水稻籽粒材料保存条件相同,可认为其含水量基本一致,所以并没有开展该项研究。
基于同步辐射的XRF 可以显著提升元素定量分析的准确性,尤其是配备了Maia 高性能荧光检测系统的XRF 仪[ 2 6 ]。比如,通过基于同步辐射的微区X 射线荧光(SR-mXRF) 对50 份稻米籽粒横切面的元素进行扫描,发现所获得的相对荧光值与ICP-MS 测定的含量具有较高的相关性,尤其是对于原子序数较大的元素[27]。其中Cu 和Zn 的SR-mXRF 荧光值和ICP-MS 测定含量值之间的一致性最高,斜率接近1。As 和Mn 在SR-mXRF 和ICP-MS 之间也表现出显著的相关性,且准确性较高(As 斜率=0.46, Mn斜率=0.58)。K 和S 在SR-mXRF 和ICP-MS 数据之间表现出弱相关性(R²lt;0.1 或Pgt;0.1)。Fe 和P 在两种方法之间均未表现出相关性。在SR-mXRF 测量中观察到了Ca,但ICP-MS 的回收率较差(12%),无法进行比较。在SR-mXRF 测量中也观察到了Si,但其在参考材料中的浓度未经认证,且石英载玻片中的硅影响了定量结果,导致SR-mXRF 测定结果不准。以上结果表明,采用亮度更高的光源以及性能更强的检测器都能提高XRF 检测的灵敏度和定量结果的准确性。但是由于同步辐射光源结构复杂,造价昂贵,并不适合在普通实验室推广使用,因此,应用范围受到了一定局限。
对稻米Cd 超标的快速检测是目前开展重金属污染阻控研究的一个重要方向。我们发现即使稻米Cd超标3~4 倍的情况下,利用本实验室购买的X 射线荧光光谱仪(M4 Tornado plus,BRUKER) 对稻米进行扫描仍很难区分Cd 超标和未超标的样品。这主要由于Cd 的两条XRF 特征谱线Lα 线和Kα 线中的Lα 线与K 元素的特征谱线非常接近(K 元素Kα 线位于3.313 keV,Cd 元素Lα 线位于3.132 keV)。由于水稻籽粒中K 的含量通常远高于Cd 含量,因此,Cd 的Lα 线信号极易受到K 信号的影响,从而无法检出。而Cd 的Kα 线在XRF 图谱中的信号值很弱,也无法用于对Cd 进行定性或者定量分析。因此,未装备双曲面弯晶光学晶体的X 射线荧光光谱仪无法应用于高通量检测稻米Cd 的超标情况。目前,市面多款XRF 仪器通过装备单色和聚焦光学器件双曲面弯晶光学晶体,可以将设备信噪比大幅提高,使得与传统能量色散X 射线荧光技术(EDXRF) 相比的检测精度大大提升,可以应用于稻米Cd 超标的快速筛查。
4 结论
利用XRF 扫描,可以无损并同时检测P、S、K、Fe、Mn、Zn、Ca 元素含量,不适宜测定Si、Cl、Cd 含量。最适合的测定条件为:样品室处于真空状态,XRF 光源为30 kV、600 μA,不使用滤光片,在50 μm 步长下进行面扫描。XRF 扫描对水稻种子发芽率无不良影响。
参 考 文 献:
[ 1 ]Zhang M, Pinson S R M, Tarpley L, et al. Mapping and validation ofquantitative trait loci associated with concentrations of 16 elements inunmilled rice grain[J]. Theoretical and Applied Genetics, 2014,127(1): 137−165.
[ 2 ]Sautter C, Poletti S, Zhang P, Gruissem W. Biofortification ofessential nutritional compounds and trace elements in rice andcassava[J]. Proceedings of the Nutrition Society, 2006, 65(2):153−159.
[ 3 ]Umeta M, West C E, Haidar J, et al. Zinc supplementation andstunted infants in Ethiopia: A randomised controlled trial[J]. Lancet,2000, 355: 2021−2026.
[ 4 ]Kanatti A, Rai K N, Radhika K, et al. Grain iron and zinc density inpearl millet: Combining ability, heterosis and association with grainyield and grain size[J]. Springerplus, 2014, 3(1): 763.
[ 5 ]Huang X Y, Salt D E. Plant ionomics: From elemental profiling toenvironmental adaptation[J]. Molecular Plant, 2016, 9(6): 787−797.
[ 6 ] Salt D E, Baxter I, Lahner B. Ionomics and the study of the plant ionome[J]. Annual Review of Plant Biology, 2008, 59(1): 709−733.
[ 7 ]Trindade A S N, Dantas A F, Lima D C, et al. Multivariate optimizationof ultrasound-assisted extraction for determination of Cu, Fe, Ni andZn in vegetable oils by high-resolution continuum source atomicabsorption spectrometry[J]. Food Chemistry, 2015, 185: 145−150.
[ 8 ]Yenisoy-Karakas S. Estimation of uncertainties of the method todetermine the concentrations of Cd, Cu, Fe, Pb, Sn and Zn in tomatopaste samples analysed by high resolution ICP-MS[J]. Food Chemistry,2012, 132(3): 1555−1561.
[ 9 ]Alexander D, Ellerby R, Hernandez A, et al. Investigation ofsimultaneous adsorption properties of Cd, Cu, Pb and Zn by pristinerice husks using ICP-AES and LA-ICP-MS analysis[J]. MicrochemicalJournal, 2017, 135: 129−139.
[10]Lahmar L, Benamar M E A, Melzi M A, et al. Determination of traceelements Fe, Cu and Zn in the Algerian cancerous plasma using Xrayfluorescence (XRF)[J]. X-Ray Spectrometry, 2019, 49(2): 313−321.
[11]Chen Z, Williams P N, Zhang H. Rapid and nondestructivemeasurement of labile Mn, Cu, Zn, Pb and As in DGT by using fieldportable-XRF[J]. Environmental Science-Processes amp; Impacts, 2013,15(9): 1768−1774.
[12]何姣姣, 江荣风, 王雁峰, 等. X射线荧光光谱法在测定土壤及植物矿质养分方面的应用[J]. 中国土壤与肥料, 2020, (1): 1−7.
He J J, Jiang R F, Wang Y F, et al. Application of X-ray fluorescencespectroscopy in determination of soil and plant mineral nutrients[J].Soil and Fertilizer Sciences in China, 2020, (1): 1−7.
[13]章连香, 符斌. X−射线荧光光谱分析技术的发展[J]. 中国无机分析化学, 2013, 3(3): 1−7.
Zhang L X, Fu B. Advances in X-ray fluorescence spectrometry[J].Chinese Jorunal of Inorganic Analytical Chemistry, 2013, 3(3): 1−7.
[14]Reidinger S, Ramsey M H, Hartley S E. Rapid and accurate analysesof silicon and phosphorus in plants using a portable X-ray fluorescencespectrometer[J]. New Phytologist, 2012, 195(3): 699−706.
[15]吴雅清. X射线荧光光谱法半定量和电感耦合等离子体质谱法全定量快速测定花草茶中多种元素[J]. 理化检验(化学分册), 2021,57(2): 132−139.
Wu Y Q. Rapid determination of multi-elements in herb tea by semiquantitativeXRFS and quantitative ICP-MS[J]. Physical Testing andChemical Analysis Part B: Chemical Analysis, 2021, 57(2): 132−139.
[16]王广西, 胡燕, 罗琼, 等. 波长色散X射线荧光光谱法分析小麦籽粒中矿质元素[J]. 分析试验室, 2017, 36(6): 663−666.
Wang G X, Hu Y, Luo Q, et al. Analysis of mineral elements inwheat grains by wavelength dispersive X-ray fluorescencespectrometry[J]. Chinese Journal of Analysis Laboratory, 2017,36(6): 663−666.
[17]王君玲, 黎龙辉, 段泽明, 等. X射线荧光分析测定不同品牌大米中的微量元素[J]. 北京师范大学学报(自然科学版), 2016, 52(2):156−160.
Wang J L, Li L H, Duan Z M, et al. Trace elements analysis inChinese rice of different brands as studied by X-ray fluorescence[J].Journal of Beijing Normal University (Natural Science), 2016, 52(2):156−160.
[18] 王佳妮, 张晗, 洪子肖, 等. X射线荧光光谱法测定螺旋藻中23种微量元素[J]. 分析试验室, 2016, 35(2): 130−134.
Wang J N, Zhang H, Hong Z X, et al. Determination of 23 traceelements in spirulina using X-ray fluorescence spectrometry[J].Chinese Journal of Analysis Laboratory, 2016, 35(2): 130−134.
[19]Gomes M H F, Machado B A, Rodrigues E S, et al. In vivoevaluation of Zn foliar uptake and transport in soybean using X-rayabsorption and fluorescence spectroscopy[J]. Journal of Agriculturaland Food Chemistry, 2019, 67(44): 12172−12181.
[20]沈亚婷. 原位微区同步辐射X射线荧光和近边吸收谱研究拟南芥幼苗及根际土壤中铅分布与形态特征[J]. 光谱学与光谱分析,2014, 34(3): 818−822.
Shen Y T. Distribution and speciation of Pb in Arabidopsis thalianashoot and rhizosphere soil by in situ synchrotron radiation micro Xrayfluorescence and X-ray absorption near edge structure[J].Spectroscopy and Spectral Analysis, 2014, 34(3): 818−822.
[21]陈莉, 吴超, 廖海兵, 等. 不同锌效率基因型水稻籽粒中矿质元素的原位微区分布研究[J]. 中国水稻科学, 2012, 26(6): 706−714.
Chen L, Wu C, Liao H B, et al. In situ micro-distribution of mineralelements in rice grains with diffent zinc efficifency[J]. ChineseJournal of Rice Science, 2012, 26(6): 706−714.
[22]Towett E K, Shepherd K D, Cadisch G. Quantification of totalelement concentrations in soils using total X-ray fluorescence spectroscopy (TXRF)[J]. Science of the Total Environment, 2013,374-388.
[23]黄秋鑫, 孙秀敏. 粉末标准曲线XRF法检测土壤中的重/类金属[J].环境科学与技术, 2014, 37(9): 92−98.
Huang Q X, Sun X M. Determination of heavy metals in soil usingpowder calibration and X-Ray fluorescence spectrometry[J].Environmental Science amp; Technology, 2014, 37(9): 92−98.
[24]Towett E K, Shepherd K D, Lee D B. Plant elemental compositionand portable X-ray fluorescence (pXRF) spectroscopy: Quantificationunder different analytical parameters[J]. X-Ray Spectrometry, 2015,45(2): 117−124.
[25]Wang Y X, Specht A, Horst W J. Stable isotope labelling and zincdistribution in grains studied by laser ablation ICP-MS in an earculture system reveals zinc transport barriers during grain filling inwheat[J]. New Phytologist, 2011, 189(2): 428−437.
[26]Ryan C G, Siddons D P, Kirkham R, et al. The new Maia detectorsystem: Methods for high definition trace element imaging of naturalmaterial[J]. X-Ray Optics and Microanalysis, 2010, 1221(1): 9−17.
[27]Limmer M A, Webb S M, Seyfferth A L. Evaluation of quantitativesynchrotron radiation micro-X-ray fluorescence in rice grain[J].Journal of Synchrotron Radiation, 2023, 30(2): 407−416.
基金项目:国家重点研发计划项目(2023YFC3708104);常熟市耕地质量提升技术支撑服务项目(JSJY-Z2021D002)。
