超低剂量胸部CT结合深度学习重建可用于肺结节评估
2024-12-31樊秋菊吴海波谭辉郭炎兵马光明于楠
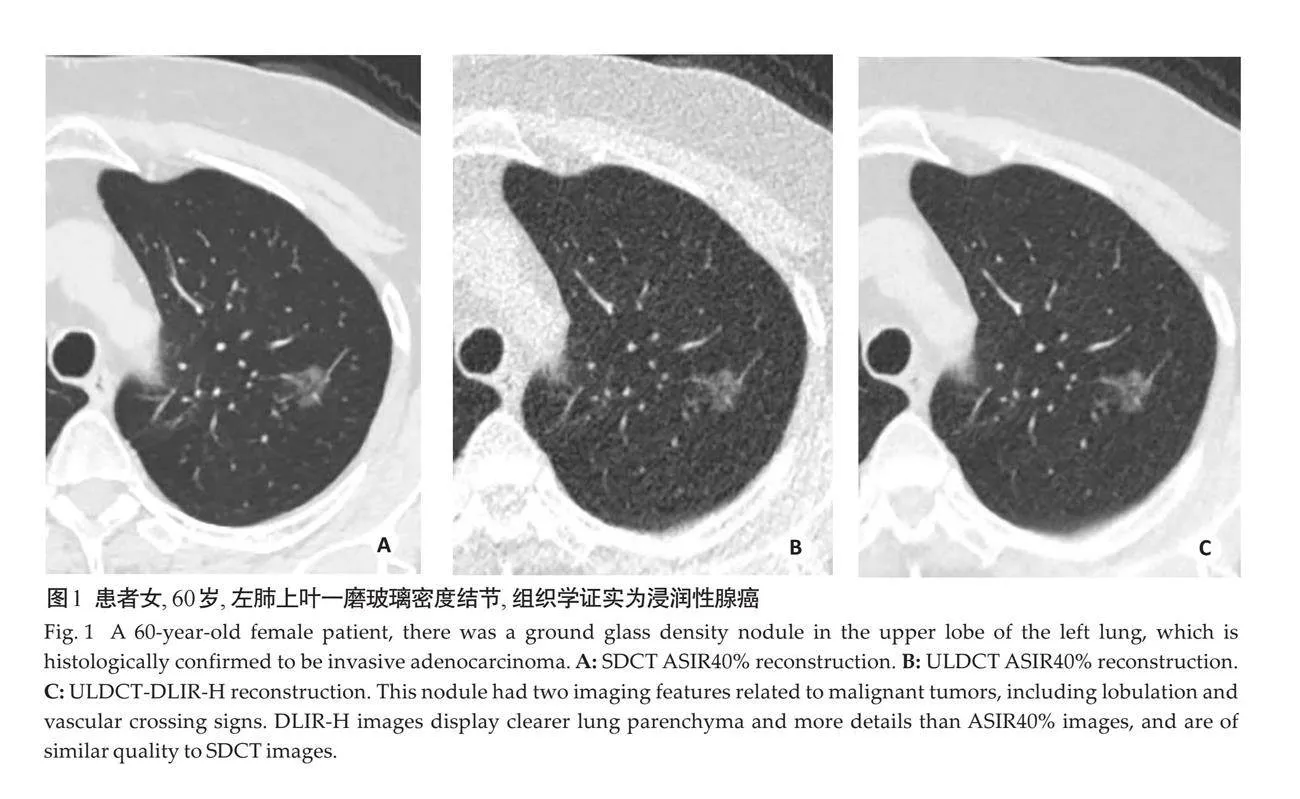
摘要:目的 探讨超低剂量CT(ULDCT)结合深度学习重建(DLIR)算法在肺结节评估中的可行性。方法 于2023年6月~11月在陕西中医药大学附属医院前瞻性纳入142例因肺结节复查的患者,同时接受标准剂量CT检查(SDCT)和超低剂量CT检查(ULDCT)。SDCT采用基于多模型的迭代重建40%(ASIR-V40%)(A组),ULDCT分别采用ASIR-V40%(B组)和高强度深度学习重建(DLIR-H)(C组)。记录两种扫描方式的辐射剂量和3组图像人工检测结节数。测量3组图像肺组织、主动脉、肌肉的CT值和噪声值(SD),并计算各组织的信噪比(SNR)。采用双盲法对3组图像肺结节的恶性征象(毛刺、分叶、空洞或空泡、胸膜牵拉征、血管穿行)进行5分制主观评分。以病理诊断为金标准,对比分析超低剂量和常规剂量胸部 CT 检查对肺结节恶性征象的诊断效能。对3组图像的定量指标和主观评分进行统计学分析。结果 ULDCT相较于SDCT辐射剂量降低约92.7%,差异有统计学意义(Plt;0.05)。C组图像肺组织、主动脉和肌肉的SD值低于B组,信噪比高于B组,肺结节恶性征象的显示能力优于B组(Plt;0.05),与A组的差异无统计学意义(Pgt;0.05)。3组图像肺结节检出数量分别为187、179、187个。与病理结果对照,A组和C组诊断恶性肺结节的效能均高于B组,差异有统计学意义(Plt;0.05)。结论 超低剂量胸部CT结合深度学习重建能够获得与标准剂量 ASIR-V40%重建相当的图像质量,且对肺结节的检出及征象显示良好,临床可用于对肺结节的评估。
关键词:肺结节;超低剂量;深度学习重建;图像质量
Ultra-low-dose chest CT combined with deep learning reconstruction can be used for
pulmonary nodule assessment
FAN Qiuju 1 , WU Haibo 2 , TAN Hui 1 , GUO Yanbing 1 , MA Guangming 1 , YU Nan 1
1 Department of Medical Image, Affiliated Hospital of Shannxi University of Chinese Medicine, Xianyang 712000, China;" 2 Department of
Encephalopathy, Zhongwei City People's Hospital, Zhongwei 755000, China
Abstract: Objective To evaluate the feasibility of using deep learning reconstruction (DLIR) for pulmonary nodule assessmentunder ultra-low dose CT (ULDCT) scanning. Methods A total of 142 patients who underwent CT scans for pulmonarynodules re-examination included. All patients were examined by both standard-dose CT (SDCT) and ULDCT. SDCT imageswere reconstructed with adaptive statistical iterative reconstruction-V 40% (ASIR-V40%), ULDCT images were reconstructedwith ASIR-V40% and DLIR-H, respectively.A total of three sets of images were obtained (Group A, group B, group C).Theradiation dose of both scanning modes and the number of lung nodules were recorded manually. The CT values and noisevalues (SD) of lung tissue, aorta and muscle were measured in 3 groups images, and the signal-to-noise ratio (SNR) wascalculated for each tissue.The malignant signs of lung nodules in the three groups were scored by double-blind method. Usingthe pathological diagnosis as the gold standard, the diagnostic efficacy of ULDCT and SDCT examination on the malignantsigns (burr, lobular, pleural traction sign, vacuole or void, vascular perforation) of pulmonary nodules was analyzed bycomparison. Statistical analysis was performed on the quantitative indicators and subjective scores of these three sets ofimages. Results The radiation dose of ULDCT was reduced by about 92.7% compared with SDCT, and the difference wasstatistically significant (Plt;0.05).The SD values of lung tissue, aorta and muscle in group C were lower than those in group B,and the SNR was higher than that in group B (Plt;0.05), and the ability to display malignant signs of nodules were better thanthose in group B, and there was no statistical difference between group C and group A (Pgt;0.05).The number of pulmonarynodules detected in the three groups was 187, 179 and 187, respectively. Compared with the pathological results, the efficacy ofgroup A and group C in diagnosing malignant pulmonary nodules was higher than that of group B, and the difference wasstatistically significant (Plt;0.05). Conclusion Ultra-low-dose chest CT combined with deep learning reconstruction can obtainimage quality comparable to ASIR-V40% of SDCT, and show good detection and signs of nodules, which can be used forclinical evaluation of pulmonary nodules.
Keywords: pulmonary nodules; ultra-low dose; deep learning reconstruction; image quality
随着CT技术的广泛应用,肺结节的检出率大幅提高,根据LUNG-RADS分类标准,肺结节随访观察是分类管理的重要方式之一。然而反复CT检查必然会导致受检者的辐射剂量累积增加,有研究认为重复CT检查可能增加肺癌的风险[1] 。近年来,低剂量CT技术发展迅速,辐射剂量大幅减少。当辐射剂量明显降低,随之带来的图像质量下降问题促使研究者开发更高效的重建技术[2] 。迭代重建(IR)已经成为大多数CT供应商的标准重建技术。但是迭代重建算法可改变图像的纹理特征,当迭代权重过大时,影响空间分辨率,重建图像会变得“塑料样”[3, 4]。深度学习重建算法(DLIR)选择高度精选的、无伪影的人体模型和患者图像集来训练软件,基于深度卷积神经网络的模型用于模拟标准剂量FBP图像的纹理,同时提供低图像噪声、条纹伪影抑制,提高低对比度病灶检测能力和高分辨率[5, 6]。
目前,算法在腹部、头颅以及胸部体模中应用较多[7-9] ,超低剂量CT检查(ULDCT)结合DLIR在临床实验研究中多集中在肺结节大小、CT值等客观结果测量的研究[10] ,主观评价以及征象评估的研究较少,但Lung‑RADS的结构化报告中,肺结节形态特征亦为重要评估指标。本研究拟采用DLIR用于ULDCT的重建对比,以验证其在肺结节综合诊断中的实际应用效果。
1 资料与方法
1.1 一般资料
本研究为前瞻性研究,已获得陕西中医药大学附属医院审查委员会的批准(审批号:SZFYIEC-YJ-KYBC-2023年第[07]号)。研究对象为2023年6~11月在我院接受CT扫描的肺结节复查患者。纳入标准:年龄18~80岁;行常规胸部CT检查证实肺部有结节,并且肺结节长径6~15 mm;肺内无明显其他肺部疾病(结核、间质纤维化、严重感染及恶性肿瘤等)。排除标准:无法配合完成预检呼吸训练;有肺部手术史患者;图像存在金属或呼吸运动伪影的或图像不全的;共扫描142例患者,最终纳入的受检者数量为 109 例,其中男性 41例,女性68 例,年龄63.2±11.3岁。记录接受检查的患者性别、年龄、身高、体质量、BMI。
1.2 检查方法与图像重建
受试者均采用256排Revolution Apex CT机(GE)先后行标准剂量(SDCT)和超低剂量(ULDCT)胸部CT检查,2次检查间隔约30 s。患者平躺在检查床上,双手上举。扫描范围从肺尖至肺底。患者在 CT 扫描前进行2~3次标准呼吸和憋气练习。标准剂量扫描参数如下:噪声指数设置为15 HU,固定管电压120 kVp,自动管电流,旋转时间为0.5 s,螺距为0.992:1,层间隔、层厚均为5.0 mm。超低剂量根据患者体质量采用个性化扫描方案:根据患者BMI将受试者分为低体质量或正常者(BMIlt;24 kg/m 2 )、超重者(24≤BMIlt;28 kg/m 2 )以及肥胖者(≥28 kg/m 2 ),分别设置管电流为10 mA、20 mA、35mA,其它扫描参数与标准剂量相同。
检查完毕后对受试者的原始数据进行重建:SDCT采用自适应统计迭代重建40%(ASIR-V40%),ULDCT分 别 采 用 ASIR-V40% 和 高 强 度 深 度 学 习 重 建(DLIR‑H),共 获 得 SDCT-ASIR-V40% 组、ULDCT-ASIR-V40%组、ULDCT-DLIR-H组(分别定义为A组、B组、C组)。所有图像层间隔、层厚均重建为0.625 mm,图像的窗宽、窗位分别设置为1200 HU、-600 HU。最后,将重建后的数据传输到GE AW 4.7工作站及PACS系统。
1.3 图像分析
辐射剂量评估:分别记录SDCT和LDCT成像的体积CT剂量指数(CTDIvol)和剂量长度乘积(DLP),估计有效剂量(ED)计算公式为:ED(mSv)=k×DLP[k=0.014 mSv/ (mGy·cm)]。图像客观分析:由1位具有3年工作经验的放射科医师对轴面图像进行客观分析。在重建肺窗中,将大小为100 mm 2 的感兴趣区放置于主动脉弓(主动脉)、左肺上叶无血管区(肺实质),胸大肌(肌肉)测量CT值和标准差(SD),以SD作为噪声值,每个区域测量3次并取平均值。测量时采用系统中复制粘贴(同步)的方法,保持感兴趣区大小、面积一致。最后分别计算3组重建图像主动脉、肺实质、肌肉的信噪比(SNR):SNR 主动脉 =CT 值 主动脉 /SD 主动脉 、SNR 肺实质 =CT值 肺实质 /SD 肺实质 、SNR 肌肉 =CT值 肌肉 /SD 肌肉 。
图像主观评价:由2位分别具有10年和16年工作经验的胸部影像医师在工作站上分别独立阅片,图像以随机顺序呈现,阅片医师不知道所评估图像的扫描技术及重建方法。人工计算结节个数,用五分评分法对图像质量进行主观评分[11] ;评估内容包括:肺结节特殊形态学征象(分叶、毛刺、胸膜牵拉、空泡、血管穿行)。5分,结节可见,细微征象显示清晰,完全满足诊断要求;4分,结节可见,细微征象显示良好,不影响诊断信心;3分,结节可见,细微征象显示欠清,基本满足诊断要求;2分,结节模糊可见,细微征象不清,诊断受限;1分,结节显示不清,无法诊断;采用观察者间一致性(Kappa)评价2位医师判定肺结节特殊征象的准确性。与病理结果对照,对比分析3组重建方式对肺结节恶性征象的诊断效能。
1.4 统计学分析
采用SPSS 26.0软件进行统计学分析,计量数据以均数±标准差表示。不同重建算法下图像质量客观对比采用单因素方差分析;5分法主观图像质量评估采用Kendall W检验;采用Cochran's Q检验分析3组图像检出肺结节各恶性征象的率的差异;与病理结果对比,3种重建算法对肺结节良恶性检验效能的差异采用多个样本χ 2 检验及事后两两比较。采用Kappa统计量计算观察者间的一致性。以Plt;0.05为差异有统计学意义。
2 结果
2.1 基本资料和辐射剂量
ULDCT相较于SDCT辐射剂量降低约92.7%,差异有统计学意义(Plt;0.05)。
2.2 客观对比结果
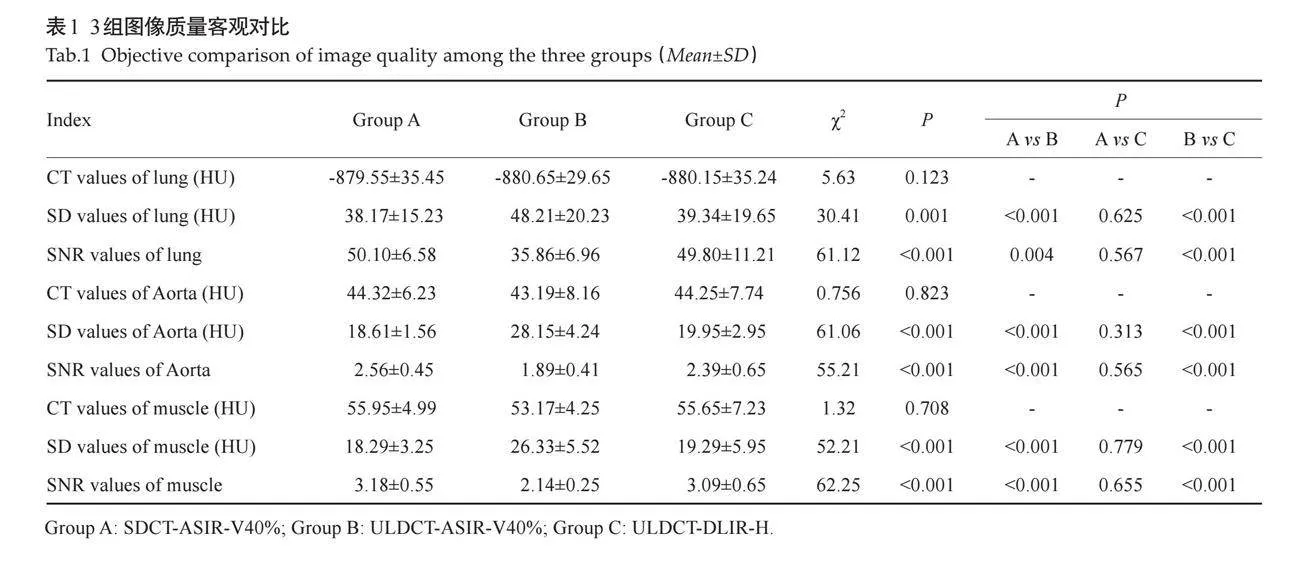
3组图像的肺组织、主动脉、肌肉的CT值经组间和两两对比,差异均无统计学意义(Pgt;0.05);C组图像各组织的SD值低于B组,SNR高于B组(Plt;0.05),C组与A组的差异无统计学意义(Pgt;0.05,表1)。
2.3 主观对比结果
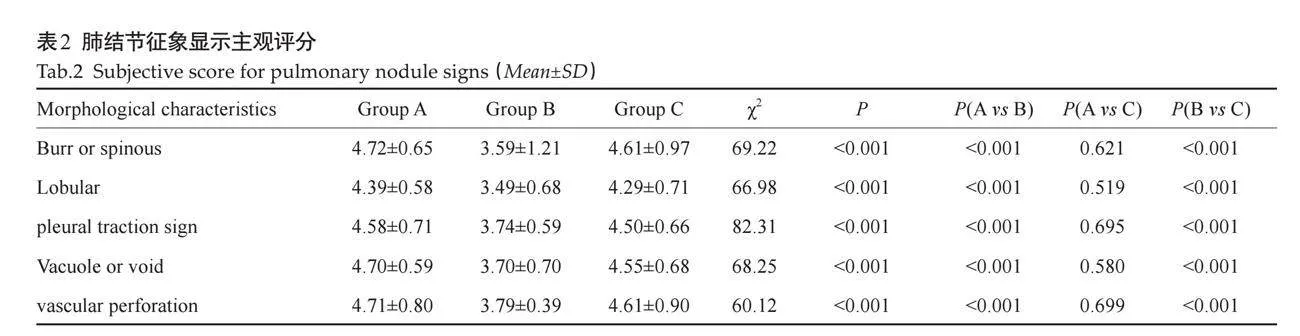
2.3.1 肺结节特殊征象诊断信心比较 A组和C组主观评分均高于B组,差异有统计学意义(Plt;0.001)。C组与A组的主观评分差异无统计学意义(Pgt;0.05,表2)。2位观察者对特殊征象判定的一致性较高(Kappa=0.80,Plt;0.05)。
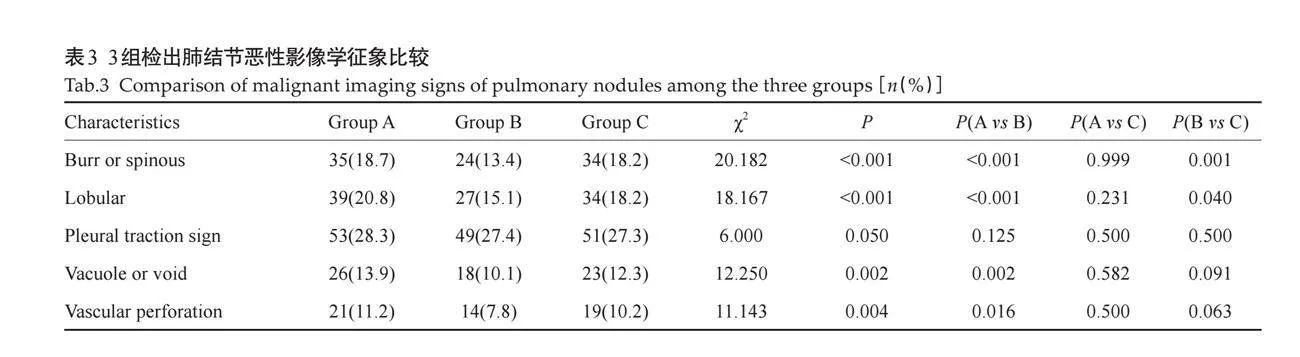
2.3.2 特殊征象的显示率" 3组图像肺结节检出数量分别为187、179、187,其中毛刺、分叶、空洞或空泡、血管穿行征象的显示率在3组间的差异有统计学意义(Plt;0.05),两两比较显示C组的显示率与A组差异无统计学意义(Pgt;0.05),且均优于B组。胸膜牵拉征象3组间的差异无统计学意义(Pgt;0.05,表3)。
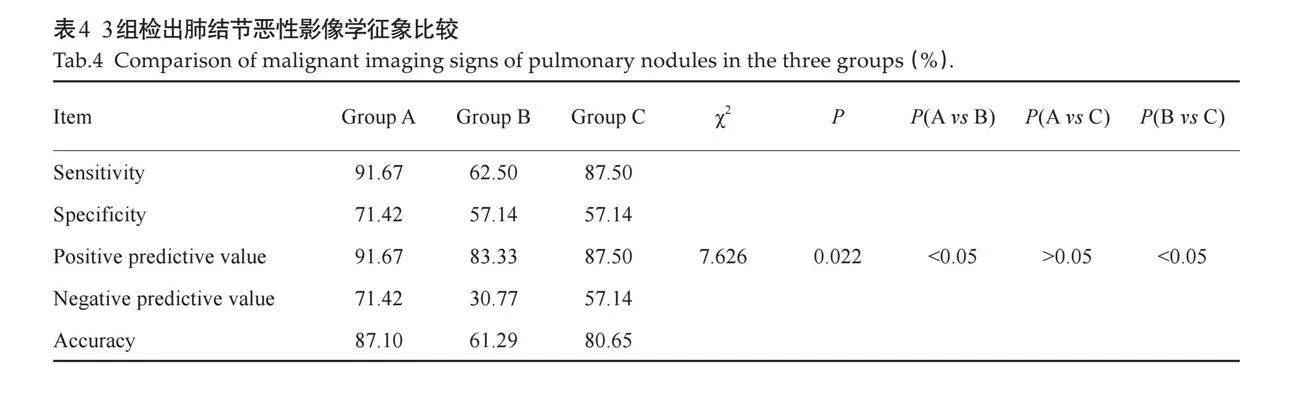
2.3.3 与病理结果的对比 定义每个结节中至少有2个与恶性肿瘤相关的特征可以认为该结节具有恶性倾向。一共31个结节有病理结果,其中24个恶性,7个良性。与病理结果对比,3组诊断肺结节良恶性效能比较,敏感度、特异度、阳性预测值、阴性预测值和准确率的差异有统计学意义(Plt;0.05);显示C组与A组间的差异无统计学意义(Pgt;0.05),C组与B组、A组与B组之间的差异有统计学意义(Plt;0.05,表4)。
3 讨论
本研究以ASIR-V40%重建的标准剂量图像为参考,比较了在超低剂量扫描条件下,ASIR-V40% 和DLIR-H的不同重建算法对胸部图像质量以及肺结节形态分析的影响,与传统的 ASIR-V40% 算法相比,DLIR-H在超低剂量条件下显著提高了图像质量,生成了与标准剂量ASIR-V40%图像相似的图像质量、肺结节检测效率和征象,节省了92.7%的辐射剂量。既往研究指出,罹患恶性肿瘤的人群中,大约有2%的患者与辐射剂量暴露有关[12]。故将CT检查的辐射剂量降低到尽可能低的水平是研究的重点内容,而ULDCT扫描是减少辐射暴露的一种潜在选择。本研究根据BMI个性化选择10、20、30 mA扫描,结果显示胸部低剂量扫描有效剂量为0.25±0.08 mSv,ULDCT相较于SDCT辐射剂量降低约92.7%。有研究基于深度学习图像重建验证超低剂量应用的研究中辐射剂量为0.75±0.03 mSv[13] ,高于本研究结果。但在一项肺癌筛查实验中,超低辐射剂量为0.07~0.14 mSv[14] ,较本研究的结果剂量更低。分析原因可能为,该研究排除了BMIgt;30 kg/m 2 的患者,而本研究包括超重患者。另有研究显示男性与女性有效辐射剂量有差异[15],所以可以认为不同样本中男女比例的差异也可能是影响剂量的因素。本研究中,ULDCT检查的辐射剂量明显低于1年的天然本底辐射剂量水平(约 2.0 mSv),减少了不必要的辐射对人体的潜在伤害。
本次实验评估了超低剂量扫描条件下经 DLIR-H重建的胸部CT图像,并与标准剂量和超低剂量条件下ASIR-V40%水平的图像进行了比较,结果表明3组之间肺组织、大血管以及肌肉的CT值的差异无统计学意义,说明本次研究的超低剂量条件下,不会影响病灶密度的评估。3组之间SNR值对比结果显示,超低剂量结合DLIR技术的图像SNR值和标准剂量相当,差异无统计学意义,均高于ASIR-V40%的图像。在对肺结节内部特征及周围形态变化的主观评价中,ULDCT联合DLIR在一定程度上补偿了低剂量引起的较高的图像噪声,使低剂量CT图像具有与标准剂量扫描相同的质量,图像质量完全符合临床诊断要求。而且肺结节与肺组织之间呈高对比度,在一定范围内,图像噪声的增加对肺结节的详细显示和观察影响并不显著。研究结果证实DLIR算法在不改变噪声纹理的情况下降低了噪声,提高了空间分辨率和可检测性,进一步证实了DLIR算法不仅具有优良的降噪能力,而且比迭代重建具有更大的剂量优化潜力,与文献中结论相符[16-18]。
本研究显示,标准剂量和超低剂量DLIR-H均检出肺结节187个,表明即使在剂量降低了92%的情况下,DLIR-H重建检测肺结节的能力与标准剂量相当,检测效能大于ASIR-V重建,对直径≥6 mm的任意密度结节,可以做到不漏诊,这与文献报道的DLIR预测结节检测的比值高于ASIR-V[14]相符。本研究结果中超低剂量结合DLIR组对主观征象的诊断信心和标准剂量组相当,因为DLIR可以识别图像的正常组织与噪声,可以针对性地剔除图像中的噪声,在进一步降低噪声的同时,并未产生模糊伪影而影响病灶显示的效果[19, 20] ,同时保持图像纹理,能清晰地显示肺结节的形态。有研究指出,相比迭代重建,DLIR图像的噪声更低,具备较高的空间分辨力,且低剂量扫描条件下病变检出率更高[21] ,亦与本次结果相符。然而本研究并未对结节分类,也未对大小、CT值进行测量。一项对COPD患者肺结节的研究中表明与标准剂量CT对比,ULDCT辐射剂量减少了 83%,但在结节测量和大小分类方面没有相关差异[22] 。然而,超低剂量筛查肺结节,检出结节只是第一步,临床工作中更多的需要尽可能地清晰显示结节的内外部细节征象,如分叶征、毛刺征、血管集束征、细支气管充气征等,这有助于鉴别肺结节的良性与恶性[23-25] 。一项描述大学肺癌筛查项目中Lung-RADS 4类病变特征的研究认为,在Lung-RADS 4A和4B类结节的多变量分析中,额外的影像学特征是肺癌的重要预测因子,可以指导管理和预测肺癌的风险[26] 。也有研究认为胸部放射科医师的视觉分析对结节分类准确性最高[27] 。因此,本研究还在不同的 ULDCT重建序列中观察了与恶性肿瘤相关的影像学特征,并与病理证实恶性的结节征象做对比。文献表明鉴别孤立性肺结节良恶性最敏感的征象为毛刺、分叶及肿瘤血管征[28] ,本研究在对这些肺结节周围形态变化的主观评价中,发现超低剂量联合DLIR组对于这3种征象的显示能力可以和标准剂量组相当,但对于胸膜牵拉和空泡的显示,3组之间的差异无统计学意义,证明深度重建算法对于毛刺、分叶这种需要高空间分辨率显示的征象更具有优势。当进一步把视觉判断的良恶性结节与病理结果对照后,发现深度学习算法重建组诊断恶性肺结节具有较高度敏感度、特异度和阳性预测值,说明DLIR可以最大程度减少重建图像与真实图像的细微结构误差,与文献中结论一致[29] ,从而使医师对恶性征象的识别率高于迭代重建,诊断信心明显提高。也有文献报道了在超低辐射剂量下,与迭代重建相比,深度学习重建算法在图像质量和Lung-RADS评估方面具有优势[30, 31] 。研究的结果进一步证实超低剂量联合深度学习算法将为超低剂量CT用于肺癌筛查做出积极贡献。
综上,超低剂量胸部CT结合深度学习重建能够获得与标准剂量 ASIR-V40%重建相当的图像质量,且对肺结节的检出及征象显示良好,临床可用于对肺结节的评估。但本研究也有一些局限性:本研究并未纳入直径lt;6 mm的结节,所以对于此类结节超低剂量是否适用,深度学习重建是否具有优势尚未清楚,未来仍然需要进一步的多中心验证;本研究中恶性征象的病例数相对较小,结果在一定程度上可能存在偏差,需要进一步扩大样本量。
参考文献:
[1] Perisinakis K, Seimenis I, Tzedakis A, et al. Radiation burden andassociated cancer risk for a typical population to be screened forlung cancer with low-dose CT: a phantom study[J]. Eur Radiol,2018, 28(10): 4370-8.
[2] Yao Y, Guo BB, Li JY, et al. The influence of a deep learning imagereconstruction algorithm on the image quality and auto-analysis ofpulmonary nodules at ultra-low dose chest CT: a phantom study[J].Quant Imaging Med Surg, 2022, 12(5): 2777-91.
[3] Chen GH, Li YS. Synchronized multiartifact reduction withtomographic reconstruction (SMART-RECON): a statistical modelbased iterative image reconstruction method to eliminate limited-view artifacts and to mitigate the temporal-average artifacts in time-resolved CT[J]. Med Phys, 2015, 42(8): 4698-707.
[4] Ellmann S, Kammerer F, Allmendinger T, et al. Advanced modelediterative reconstruction (ADMIRE) facilitates radiation dosereduction in abdominal CT[J]. Acad Radiol, 2018, 25(10): 1277-84.
[5] Brady SL, Trout AT, Somasundaram E, et al. Improving imagequality and reducing radiation dose for pediatric CT by using deeplearning reconstruction[J]. Radiology, 2021, 298(1): 180-8.
[6] Dadoun H, Rousseau AL, de Kerviler E, et al. Deep learning for thedetection, localization, and characterization of focal liver lesions onabdominal US images[J]. Radiol Artif Intell, 2022, 4(3): e210110.
[7] Akagi M, Nakamura Y, Higaki T, et al. Deep learning reconstructionimproves image quality of abdominal ultra-high-resolution CT[J].Eur Radiol, 2019, 29(11): 6163-71.
[8] 刘娜娜, 吕培杰, 王会霞, 等. 基于深度学习图像重建算法的低管电压腹部CT平扫图像质量价值评估[J]. 临床放射学杂志, 2023, 42(11): 1820-5.
[9] 刘海法, 杨 丽, 王 琦, 等. 深度学习重建算法对胸部低剂量CT肺结节测量及显示影响的模体研究[J]. 放射学实践, 2023, 38(8): 977-84.
[10]窦越群, 吴海波, 于 勇, 等. 超低剂量CT扫描结合深度学习图像重建对计算机辅助诊断系统定量分析肺结节的影响[J]. 中国介入影像与治学, 2024, 21(7): 418-22.
[11]Kanii Y, Ichikawa Y, Nakayama R, et al. Usefulness of dictionarylearning-based processing for improving image quality of sub-millisievert low-dose chest CT: initial experience[J]. Jpn J Radiol,2020, 38(3): 215-21.
[12]Miglioretti DL, Johnson E, Williams A, et al. The use of computedtomography in pediatrics and the associated radiation exposure andestimated cancer risk[J]. JAMA Pediatr, 2013, 167(8): 700-7.
[13]Kim JH, Yoon HJ, Lee E, et al. Validation of deep-learning imagereconstruction for low-dose chest computed tomography scan:emphasis on image quality and noise[J]. Korean J Radiol, 2021, 22(1): 131-8.
[14]Jiang BB, Li NY, Shi XM, et al. Deep learning reconstruction showsbetter lung nodule detection for ultra-low-dose chest CT[J].Radiology, 2022, 303(1): 202-12.
[15]Carey S, Kandel S, Farrell C, et al. Comparison of conventionalchest x ray with a novel projection technique for ultra-low dose CT[J]. Med Phys, 2021, 48(6): 2809-15.
[16]Greffier J, Hamard A, Pereira F, et al. Image quality and dosereduction opportunity of deep learning image reconstructionalgorithm for CT: a phantom study[J]. Eur Radiol, 2020, 30(7):3951-9.
[17]付 芮, 张成亮, 沈 云, 等. 深度学习图像重建算法对图像质量的影响: 体模研究[J]. 放射学实践, 2023, 38(12): 1617-22.
[18]曾 文, 曾令明, 徐 旭, 等. 基于深度学习的图像重建算法在胸部薄层CT中的降噪效果评估[J]. 四川大学学报: 医学版, 2021, 52(2):286-92.
[19]Zhong JY, Shen HL, Chen Y, et al. Evaluation of image quality anddetectability of deep learning image reconstruction (DLIR)algorithm in single- and dual-energy CT[J]. J Digit Imaging, 2023,36(4): 1390-407.
[20]Oostveen LJ, Meijer FJA, de Lange F, et al. Deep learning-basedreconstruction may improve non-contrast cerebral CT imagingcompared to other current reconstruction algorithms[J]. Eur Radiol,2021, 31(8): 5498-506.
[21]Higaki T, Nakamura Y, Zhou J, et al. Deep learning reconstruction atCT: phantom study of the image characteristics[J]. Acad Radiol,2020, 27(1): 82-7.
[22]Han DW, Cai JL, Heus A, et al. Detection and size quantification ofpulmonary nodules in ultralow-dose versus regular-dose CT: acomparative study in COPD patients[J]. Br J Radiol, 2023, 96(1144): 20220709.
[23]Lv YG, Bao JH, Xu DU, et al. Characteristic analysis of pulmonaryground-glass lesions with the help of 64-slice CT technology[J].Eur Rev Med Pharmacol Sci, 2017, 21(14): 3212-7.
[24]王金华, 宋 兰, 隋 昕, 等. 深度学习重建改善胸部低剂量CT图像质量的价值[J] .中华放射学杂志, 2022, 56(1): 74‑80.
[25]张 艳, 吕发金, 褚志刚, 等. 基于CT薄层影像特征的肺结节良恶性评估[J]. 中国医学影像学杂志, 2019, 27(3): 182-7.
[26]Kocher Wulfeck M, Plesner S, Herndon JE 2nd, et al. CharacterizingLung-RADS category 4 lesions in a university lung cancer screeningprogram[J]. Lung Cancer, 2023, 186: 107420.
[27]Gupta S, Jacobson FL, Kong CY, et al. Performance of lung nodulemanagement algorithms for lung-RADS category 4 lesions[J]. AcadRadiol, 2021, 28(8): 1037-42.
[28]李 辉, 姜春霞, 宁培刚, 等. 肺内孤立结节的高分辨 CT征象诊断价值[J]. 郑州大学学报: 医学版, 2014, 49(6): 872-5.
[29]Franck C, Zhang GZ, Deak P, et al. Preserving image texture whilereducing radiation dose with a deep learning image reconstructionalgorithm in chest CT: a phantom study[J]. Phys Med, 2021, 81:86-93.
[30]Hata A, Yanagawa M, Yoshida Y, et al. Combination of deeplearning-based denoising and iterative reconstruction for ultra-low-dose CT of the chest: image quality and lung-RADS evaluation[J].AJR Am J Roentgenol, 2020, 215(6): 1321-8.
[31]Yoo SJ, Park YS, Choi H, et al. Prospective evaluation of deeplearning image reconstruction for Lung-RADS and automaticnodule volumetry on ultralow-dose chest CT[J]. PLoS One, 2024,19(2): e0297390.(编辑:郎 朗)
