右室量化分析系统联合心肌损伤标志物可指导脓毒性休克患者的预后
2024-12-31张懿瑶牛凯旋吕宏安赵士兵
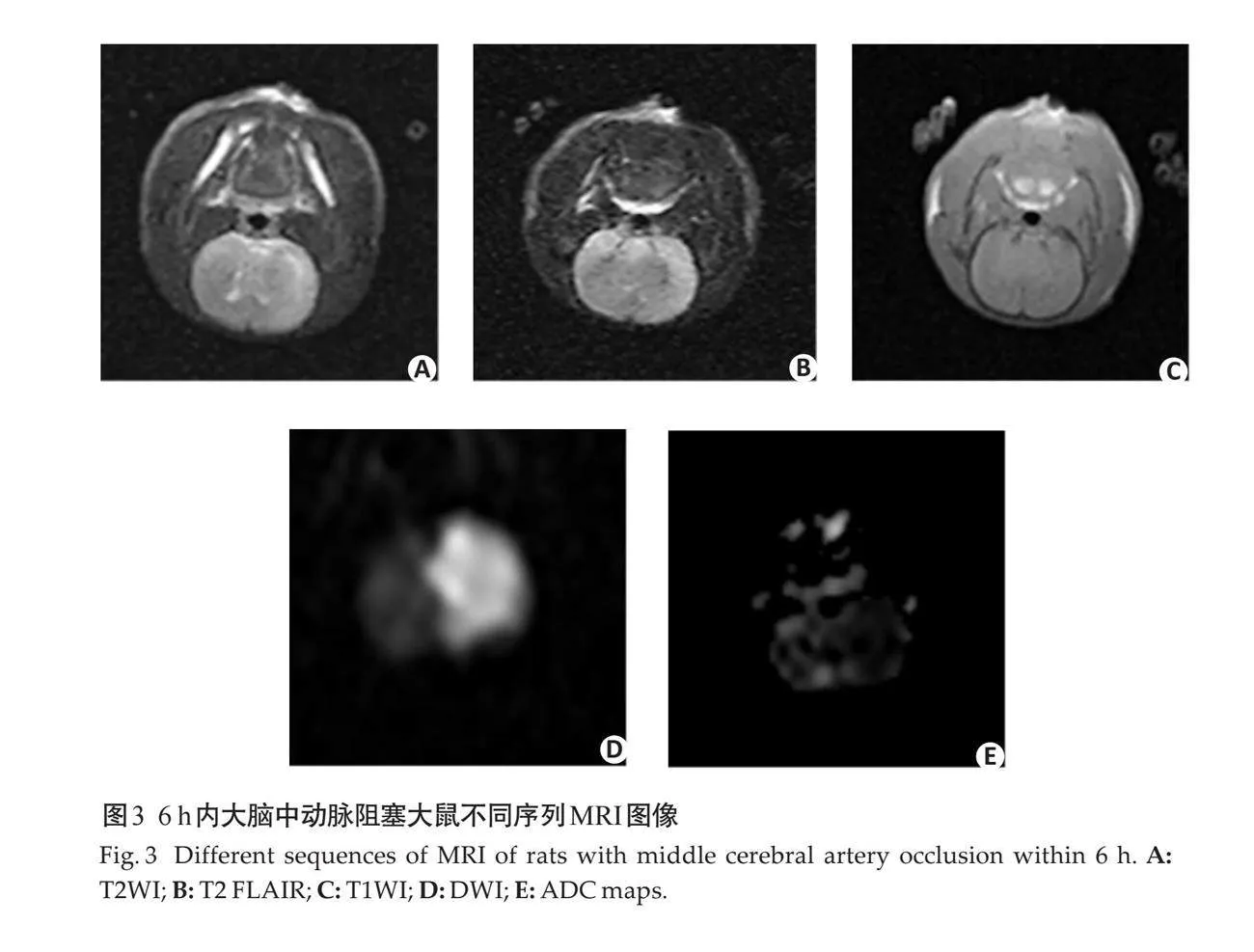
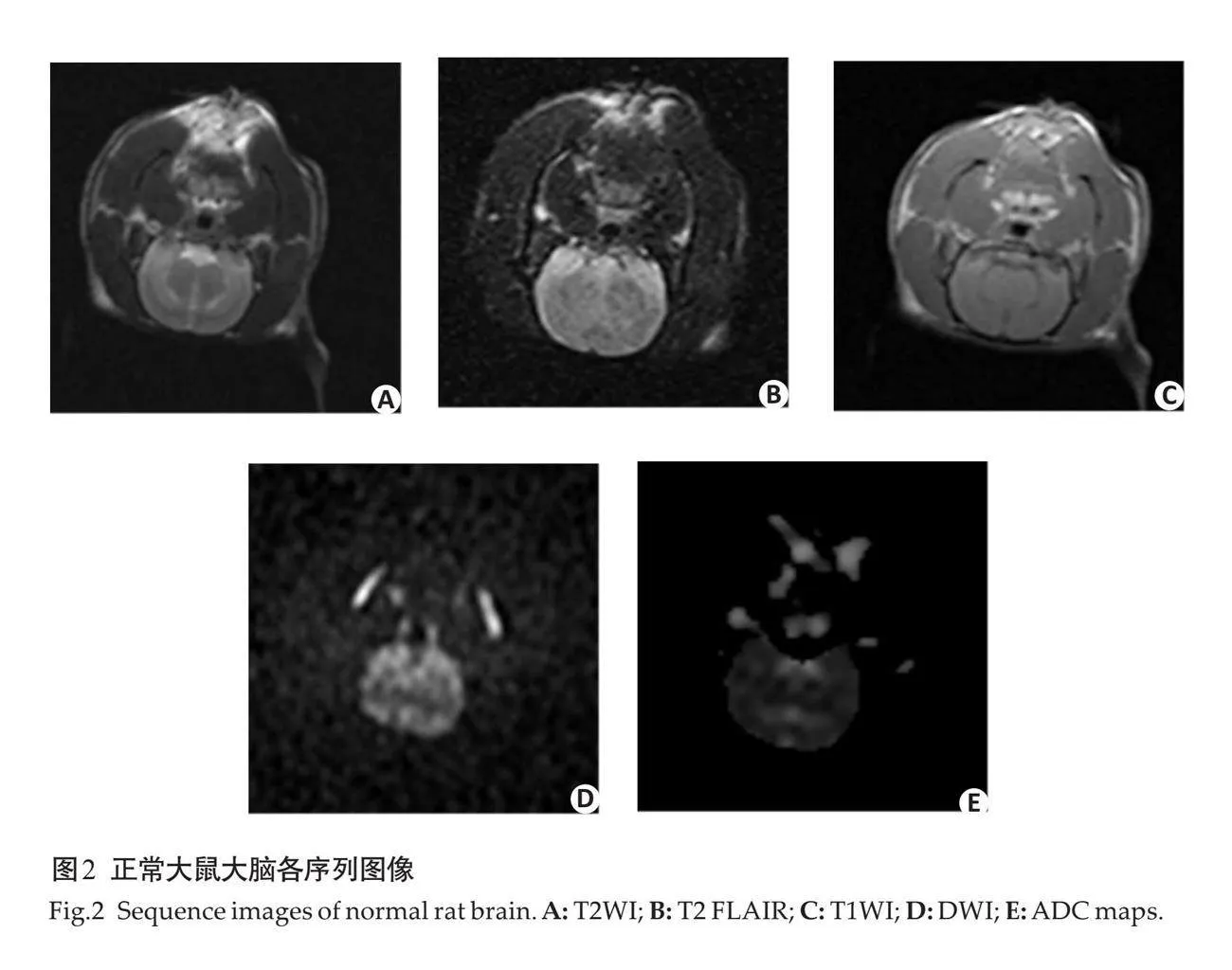
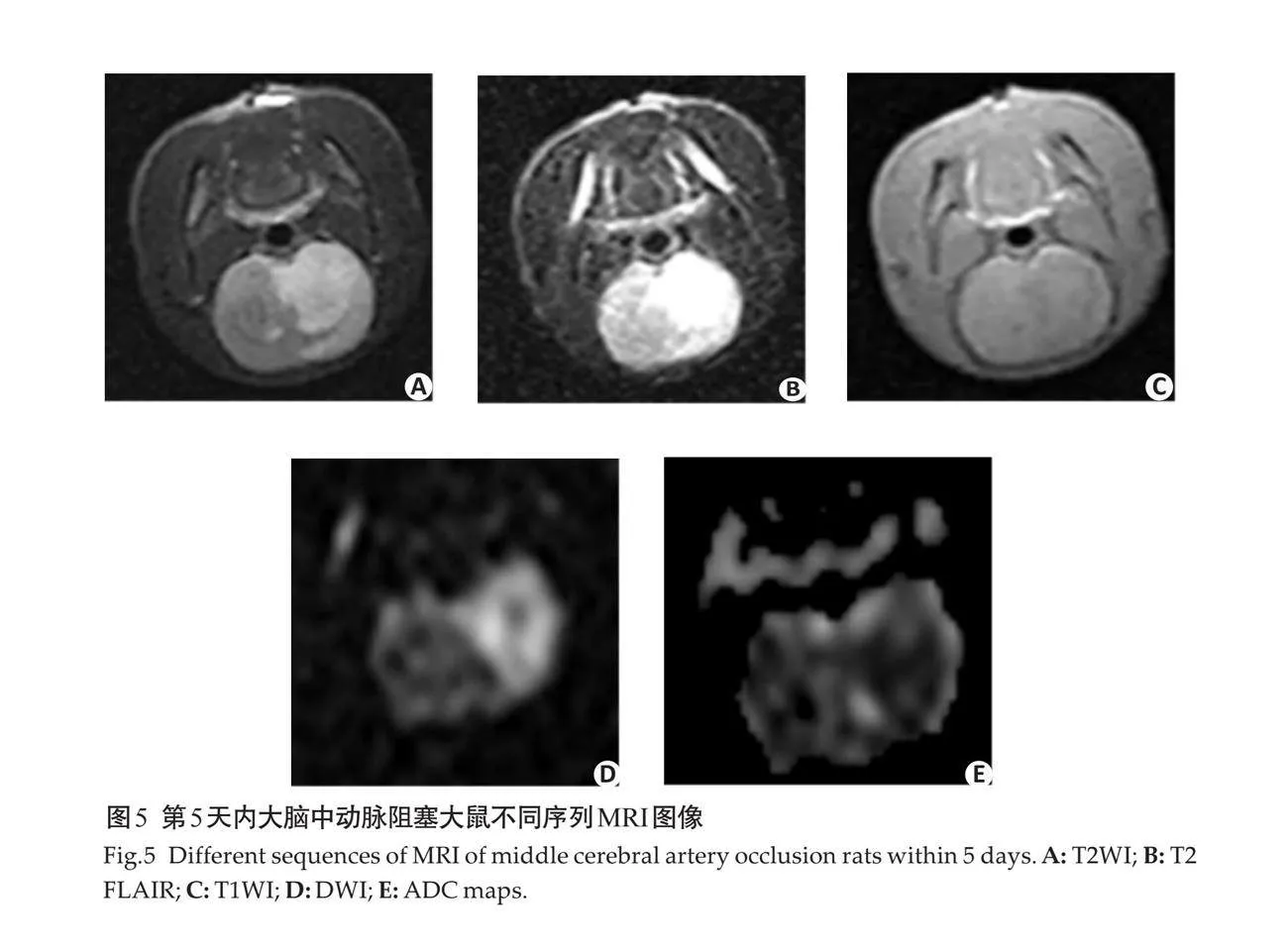
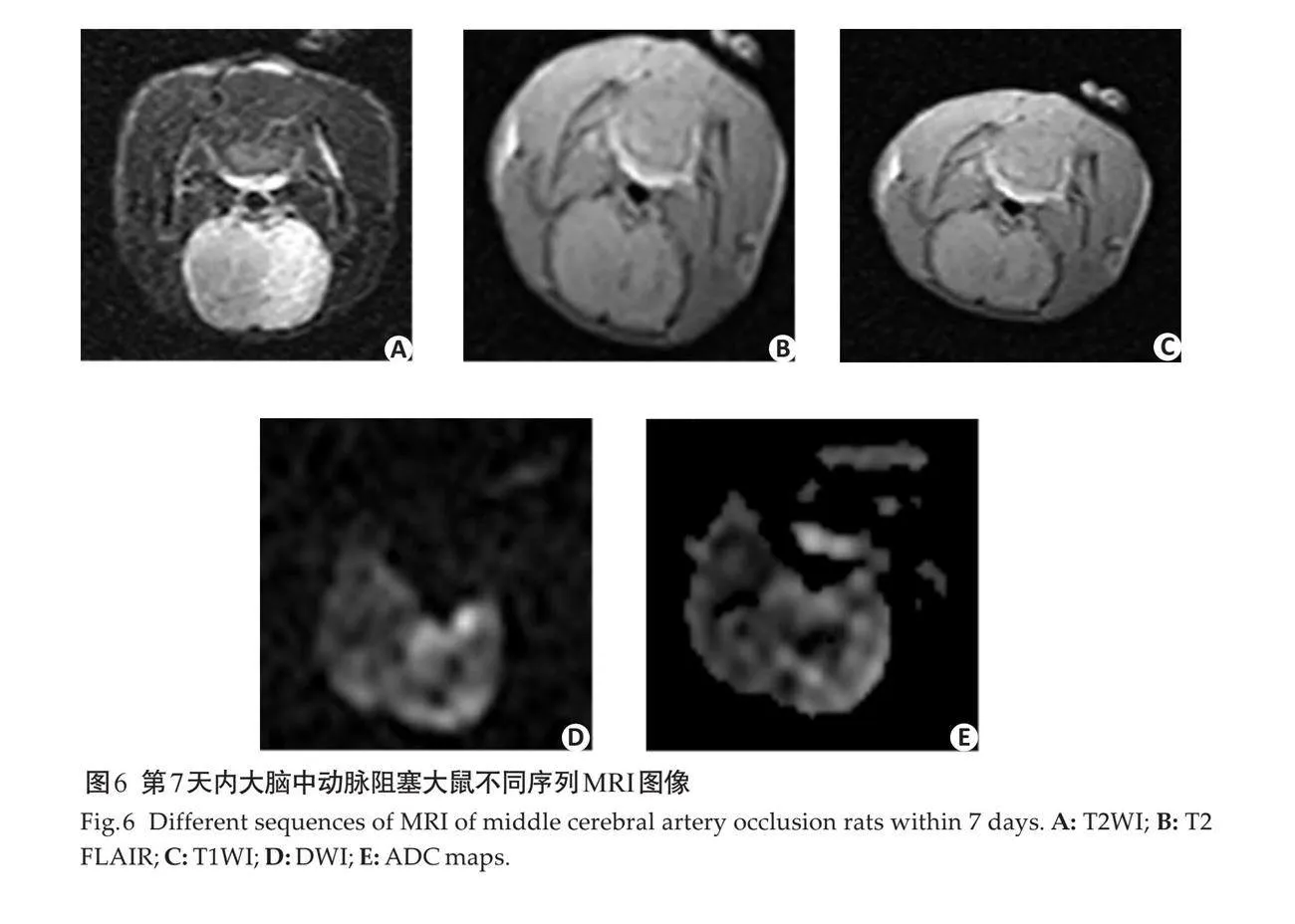
摘要:目的 应用右室量化分析系统(RVQAS)联合心肌损伤标志物在脓毒性休克患者预后的相关性研究。方法 选取2018年5月~2023年5月蚌埠医科大学第一附属医院重症医学科收治的脓毒性休克患者100例,根据患者28 d后的预后结果,分为生存组(n=76)和死亡组(n=24),使用床边超声通过RVQAS记录患者右室的定量医学参数。同时采集患者入院当天血清中相关心肌损伤标志物浓度,将上述结果纳入统计分析。结果 死亡组中右心室舒张末期容积(RVEDV)、右心室舒张末期容积指数(RVEDVI)、右心室收缩末期容积(RVESV)、右心室收缩末期容积指数(RVESVI)高于生存组,死亡组中右心室射血分数(RVEF)、右心室心输出量、右心室心指数、右心室每搏输出量、右心室每搏输出量指数低于生存组(Plt;0.05)。死亡组血清中的肌酸激酶(CK)、肌酸激酶同工酶及心肌肌钙蛋白I (cTnI)的浓度高于生存组(Plt;0.05)。Spearman相关性分析结果显示,患者死亡与RVEDV、RVEDVI、RVESV、RVESVI、CK和cTnI呈正相关,与RVEF呈负相关(Plt;0.05)。以脓毒性休克死亡者为阳性样本,存活者为阴性样本,ROC曲线显示单个指标RVESVI诊断的曲线下面积最大为0.948,联合诊断中RVESVI联合CK诊断的曲线下面积最大为0.999,对死亡的预测价值最高。结论 通过RVQAS测定患者右室功能可以为脓毒性休克患者进行及时有效的治疗提供更多参考信息,其中RVESVI联合CK对患者死亡预测价值最高,应更早应用于临床,为患者早期诊疗带来较大获益。
关键词:右室量化分析系统;心肌标志物;脓毒性休克
Right ventricular quantitative analysis system combined with myocardial injury markers
can guide the prognosis of patients with septic shock
ZHANG Yiyao 1 , NIU Kaixuan 2 , LÜ Hongan 1 , ZHAO Shibing 2
1 Department of Ultrasound Medicine," 2 Department of Critical Care Medicine, the First Affiliated Hospital of Bengbu Medical University,
Bengbu 233004, China
Abstract: Objective To investigate the prognostic value of right ventricular quantitative analysis system (RVQAS) combinedwith myocardial injury markers in patients with septic shock. Methods A total of 100 patients with septic shock admitted tothe Department of Critical Care Medicine of the First Affiliated Hospital of Bengbu Medical University from May 2018 to May2023 were selected and divided into survival group (n=76) and death group (n=24) according to the prognosis after 28 days,Quantitative medical parameters of the right ventricle of patients were recorded by RVQAS using bedside ultrasound. At thesame time, the serum concentrations of myocardial injury markers on the day of admission were collected, and the aboveresults were included in the statistical analysis. Results Right ventricular end-diastolic volume (RVEDV), Right ventricularend-diastolic volume index (RVEDVI), Right ventricular end-systolic volume (RVESV) and Right ventricular end-systolicvolume index (RVESVI) in the death group were higher than those in the survival group (Plt;0.05). right ventricular ejectionfraction (RVEF), right ventricular cardiac output, right ventricular cardiac index, right ventricular stroke volume and rightventricular stroke volume index were lower in the death group than in the survival group (Plt;0.05). The serum concentrationsof creatine kinase (CK), creatine kinase isoenzyme and cardiac troponin I (cTnI) in the death group were higher than those inthe survival group (Plt;0.05). Spearman correlation analysis showed that the death of patients was positively correlated withRVEDV, RVEDVI, RVESV, RVESVI, CK and cTnI, and negatively correlated with RVEF (Plt;0.05). The ROC curve showed thatthe area under the curve of RVESVI alone was 0.948, and the area under the curve of RVESVI combined with CK was 0.999 inthe diagnosis of septic shock, and the predictive value of RVESVI for death was the highest. Conclusion RVQAS measurementof right ventricular function can provide more reference information for the timely and effective treatment of patients withseptic shock. RVESVI combined with CK has the highest predictive value for the death of patients, and should be used inclinical practice earlier to bring greater benefits for the early diagnosis and treatment of patients.
Keywords: right ventricular quantitative analysis system; myocardial markers; septic shock
脓毒症是以多器官功能障碍为特征的炎症反应综合征,其中累及心肌被称为脓毒症心肌病[1, 2] 。据统计,脓毒性休克合并脓毒症心肌病患者的死亡率达70%~90%[3, 4]。心肌收缩力下降,心肌损伤标志物升高以及器官灌注不足共同构成了脓毒症心肌病的诊断[5] 。目前临床上常使用超声心动图评估脓毒性休克患者的心肌收缩力及患者预后[6] 。通过超声心动图2D斑点追踪技术评价左心室收缩功能已经得到广泛认可[7] ,但对于右室结构的临床分析仍相对较少。在右室射血分数、右室容积测量等方面,与超声心动图2D技术相比,实时心脏3D模型与心脏磁共振的差距更为有限,提供了极大的应用前景[8] 。右室量化分析系统(RVQAS)通过构建实时心脏3D模型在右室收缩功能评价中具有较高临床价值[9] 。在此基础上,脓毒性休克患者的心肌损伤标志物如:心肌肌钙蛋白I (cTnI)及氨基末端脑钠肽前体(NT-proBNP)的浓度变化同样可作为患者病情严重程度的早期预测和补充指标,从而进一步提高临床诊断的敏感度和患者的生存率[10] 。基于此,本实验将RVQAS及心肌损伤标志物共同纳入分析,以提高对于脓毒性休克患者预后的早期判断及临床应用。
1 资料与方法
1.1 一般资料
回顾性分析2018年5月~2023年5月蚌埠医科大学第一附属医院重症医学科收治的脓毒性休克患者100例,根据患者28 d的预后结果,将其分为生存组(n=76)和死亡组(n=24)。纳入标准:≥18周岁;符合脓毒症3.0的诊疗标准[11] ;于入院24 h内完成急性生理及慢性健康(APACHE II)评分[12] 者;患者一般资料完整。排除标准:合并不可逆脑损伤及多器官功能衰竭者;存在其他脏器无法控制的大出血;存在无法逆转的恶性心律失常;合并恶性肿瘤伴全身转移者;妊娠期或哺乳期妇女;合并重度贫血者(血红蛋白lt;7 g/dL)。本研究已经通过蚌埠医学院伦理委员会审批(审批号:伦科批号2022第191号),所有患者均签署知情同意书。
1.2 仪器与研究方法
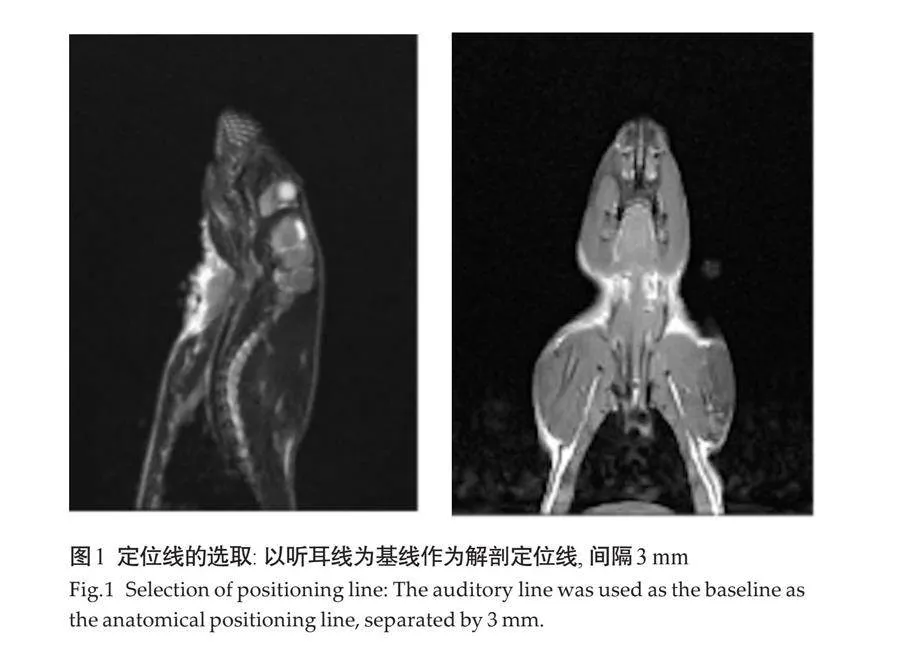
1.2.1 床旁心脏超声联合RVQAS 使用迈瑞M-9超声诊断仪(Z50BW)配置RVQAS,输入患者基本信息,从顶端换能器位置进行超声心动图成像。在二维超声心动视图的基础上,稳定换能器位置在单次呼气末获得一个全容积数据集。根据美国超声心动图学会指南[13],采集具有代表性的二维超声心动图成像切面,包括:心尖四腔心(三尖瓣环、右室室间隔、右室心内膜 、基底部、心尖),胸骨旁长轴左室流出道(右室室间隔 、右室心内膜),胸骨旁长轴右心室流出道(三尖瓣环、右室心内膜),右室流出道短轴(右室心内膜、肺动脉环 、圆锥间隔),近乳头肌水平短轴(右室心内膜 、右室室间隔边缘、右室室间隔)及胸骨旁心尖短轴(右室室间隔边缘),根据解剖学的结构在每个成像切面的舒张末和收缩末进行标记,创建一个三维模型至少需要12个标记点(图1)。根据患者二维超声心动图成像切面解剖标记点的数据,构建患者右室三维成像模型,该模型可以将单个有意义的二维超声切面扫描图像进行叠加。为了优化图像质量及输出结果,可以在相应的二维超声平面上进行删除、添加或重新定位标记点,以此确保在二维切面上重构边界与真实边界的相交。通过将所有采集的二维超声切面图像的面积和厚度的乘积相加,控制成像深度和扇区宽度,获得优化的三维模型图像。所有三维数据都以数字方式存储,并使用机器内置的云端智库进行分析,在HeartModel模式下选择RV 3DE数据后,在多个二维成像切面图视中连续识别和追踪右心室心内膜,通过三维模型自动计算得出右室的定量医学参数,包括右心室舒张末期容积(RVEDV)、右心室舒张末期容积指数(RVEDVI)、右心室收缩末期容积(RVESV)、右心室收缩末期容积指数(RVESVI)、右心室射血分数(RVEF)、右心室心输出量(RVCO)、右心室心指数(RVCI)、右心室每搏输出量(RVSV)、右心室每搏输出量指数(RVSVI)。
1.2.2 心肌损伤标志物检测 入院后24 h内,采集患者空腹5 mL肘静脉血置于试剂管中,管中含肝素作为抗凝剂,样品收集后,在2~8℃离心30 min采集血清,使用全自动生化分析仪使用干化学法及荧光磁微粒酶免法检测标本中的NT-proBNP、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)、乳酸脱氢酶(LDH)、天冬氨酸氨基转移酶(AST)、cTnI等水平。
1.3 观察指标
比较生存组与死亡组的一般资料,包括患者的性别、年龄、体表面积、初诊心率及原发部位,通过APACHE II评分表得出APACHE II分数,由In[(R/ (1-R))]=-3.517+(0.146×(APACHE II评分)+0.603(仅限于急诊手术后患者)+患者入ICU的主要疾病得分,计算公式得出预测死亡率R值。比较两组患者的右室定量参数的情况。比较两组患者的心肌损伤标志物的浓度变化。采用Spearman分析死亡率与右室定量参数、心肌损伤标志物的相关性。绘制ROC曲线评估右室定量参数与心肌标志物对脓毒性休克患者死亡的相关性及对死亡的预测效能,当曲线下面积(AUC)gt;0.85时认为二者显著相关。
1.4 样本量计算
根据 20 例患者预实验,RVESVI 在生存组中为21.56±3.52 mL/m 2 ,在死亡组中为 28.18±8.13 mL/m 2 ,且依据脓毒性休克患者死亡率为30%以上,设定a=0.05,1-β =0.8,生存组/死亡组=3,通过PASS2021软件计算生存组为56例,死亡组为19例,结合患者失访率,最终纳入生存组患者76例,死亡组患者24例,共100例研究样本。
1.5 统计学分析
采用SPSS 21.0软件进行统计分析,计量资料以均数±标准差表示,组间比较采用两独立样本t检验;计数资料以n(%)表示,组间比较采用卡方检验。相关性分析采用Spearman分析研究。采用ROC曲线分析右室医学定量参数、心肌损伤标志物及联合检查对于脓毒性休克患者预后的预测价值,获取AUC,以最大约登指数确定指标最佳截断值。以Plt;0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组性别、年龄、体表面积、初诊心率及原发部位的差异无统计学意义(Pgt;0.05)。生存组APACHE II评分及预测死亡率R值低于死亡组,差异有统计学意义(Plt;0.001,表1)。
2.2 两组患者的右室医学定量参数的比较
死亡组RVEDV、RVEDVI、RVESV、RVESVI较生存组升高,死亡组RVEF、RVCO、RVCI、RVSV、RVSVI较生存组下降,差异有统计学意义(Plt;0.05,表2)。
2.3 两组患者的心肌标志物指标比较
死亡组血清中 CK、CKMB及cTnI的浓度高于生存组,差异具有统计学意义(Plt;0.05,表3)。
2.4 相关性分析
Spearman 相 关 性 分 析 结 果 显 示 ,RVEDV、RVEDVI、RVESV、RVESVI、CK及cTnI与患者死亡呈正相关,RVEF与患者死亡呈负相关(Plt;0.05,表4)。
2.5 右室医学定量参数联合心肌损伤标志物对患者死亡的预测效能
以脓毒性休克死亡患者为阳性样本,存活患者为阴性样本,绘制ROC曲线,结果显示, RVESVI的AUC为0.948(95% CI:0.90~0.99),截断值为 28.48 mL/m 2 ,其敏感度为79.2%,特异度为96.1%。心肌损伤标志物中CK 的 AUC 为 0.921(95% CI:0.84~1.00),截断值为145.53 U/L,其敏感度为0.833,特异度为0.961(表5、图2)。
2.6 右室定量参数联合心肌损伤标志物对患者死亡的预测效能
以脓毒性休克死亡患者为阳性样本,以脓毒性休克存活患者为阴性样本,绘制 ROC 曲线,结果显示RVESVI联合CK诊断的AUC最大为0.999,敏感度为98.7%,特异度为100%(表6、图3)。
3 讨论
心脏磁共振是目前世界上被认定为评估右室容积和功能的金标准[14] ,但由于其成本高、耗时长,因此妨碍了其作为常规方法的广泛应用。床旁超声能够快速评估脓毒性休克患者的心脏功能指数,指导休克患者的液体复苏治疗,帮助患者缩短ICU住院时间,促进病情好转[15]。本实验结合ICU危重患者的救治经验,在保证患者安全的基础上,采用床旁超声的方法快速床旁心脏评估。但仅床旁评估仍不充分,因为对传统的床旁二维超声而言,其不能准确评估右室的容量和功能。三维立体成像可以克服右室复杂的解剖问题,从而精准测量右室功能[16-18] 。三维斑点追踪成像技术可作为补充,对于右心室心肌改变具有早期诊断价值[19] 。因此美国超声心动图学会和欧洲心血管成像协会于2016年更新了心室量化建议[20],建议使用三维立体模型测量心室容积。本研究结合了上述实验的诸多优势,在三维斑点追踪技术的基础上,基于人工智能创建的三维立体模型快速直观准确地测量右室体积,识别右室功能障碍及输出医学右室定量参数,实时准确评估右室功能,同时避免了患者在搬运及检查过程中的风险。
脓毒性休克患者心肌损伤、一氧化氮代谢改变、线粒体功能障碍、氧化应激、细胞内钙运动异常、心肌细胞凋亡和自主神经失调等发挥联合作用,导致心脏收缩力下降,心肌细胞凋亡,引起CK及CKMB的释放量大大增加[21] 。且既往研究已经证实CKMB升高与心脏功能障碍有较好的相关性[22]。在此基础上,CKMB的敏感度远高于NTpro BNP[23],这与本实验结果基本相符。在本研究中不仅发现死亡组CK、CKMB、cTnI三种心肌损伤标志物死亡组较生存组明显升高,同时证实NTpro BNP在生存组和死亡组间未发现明显差异,表明NTpro BNP在脓毒性休克病人中的极大差异性,因此该指标可能并不能为脓毒性休克患者预后提供参考。同时在脓毒性休克患者中,血清中cTnI浓度与心脏功能障碍、疾病严重程度和死亡率呈正相关[24] 。因此推荐在脓毒性休克患者入重症医学科时使用cTnI对患者进行风险分层[25] 。本实验中cTnI不仅在生存组和死亡组中存在明显差异,且对于cTnIgt;0.09 μg/L的患者而言,其死亡风险更高,为临床上重症脓毒性休克患者死亡风险预测提供进一步参考价值。其内在的病理生理基础在于,脓毒性休克患者心肌水肿程度与cTnI的升高呈正相关[26],因此可以通过cTnI升高程度反映心肌细胞的损伤面积,这也就揭示了本实验中脓毒性休克死亡组患者中RVEF值更低,而cTnI更高的原因,为进一步相关性研究提供更多临床信息。
脓毒性休克死亡组中RVEDV、RVEDVI、RVESV及 RVESVI 均高于生存患者(Plt;0.05),且 RVEDV、RVEDVI、RVESV 及 RVESVI与患者死亡呈正相关。可能的原因在于RVEDV、RVEDVI、RVESV、RVESVI反映心脏的收缩及舒张功能,当脓毒症患者出现休克状态,患者的心肌收缩力下降、肺血管阻力升高,同时全身血管阻力降低,右室容量负荷过重,从而导致右室功能障碍。这与既往研究[27]的观点基本一致,该研究发现近一半的脓毒症患者存在右室功能障碍,右心室功能障碍与死亡率增加相关,而左室收缩功能障碍与死亡率增加无关。但该研究并未进一步阐述右室具体数值的改变。本研究弥补了这一区域空白,并且发现RVEF在脓毒性休克死亡组中存在显著下降。可能的原因在于当患者出现右室功能障碍,右室后负荷变化导致RVEF值的相对变化,引起心输出量的进一步降低,并最终加速患者死亡。另外,本研究纳入大量脓毒症心肌病患者右室舒张及收缩容积的改变,为心肌应变力变化的进一步研究提供了实验基础。
对于心室测量结合心肌损伤标志物的联合诊断价值,既往曾有研究发现,脓毒症合并心肌损伤患者cTnI,CKMB、CK水平高于脓毒症未合并心肌损伤患者,且左室射血分数明显下降[28] 。但该实验仅针对左室功能,未进一步探究右室功能联合心肌损伤标志物的价值。目前急性右心室衰竭是重症监护室常见的临床危重症,不仅会提高重症患者死亡率,而且还会使危重患者治疗策略更加复杂。与左心室相比,右心室的研究相对较少,对孤立性右心室衰竭的治疗研究更少[29] 。在另一项急性心肌梗死的研究中发现,心肌损伤标志物联合右室功能测量对于患者预后有较大诊断价值[30] ,但联合诊断在脓毒症患者的右心室功能测量中仍然是一片空白。在本项实验中证实了 RVESVIgt;28.48 mL/m 2 且CKgt;145.53 U/L的脓毒症患者预后极差,这为临床上此类患者的病情评估提供了进一步的参考。心脏磁共振对于呼吸循环支持的危重患者仍存在较大限制,但床旁RVQAS操作便捷且实用,结合心肌损伤标志物可为临床广泛应用。
本研究仍存在局限性,对脓毒性休克合并肺气肿的患者,床旁超声所显示的图像质量较差,受到气体干扰容易产生伪影,进而导致测量出现误差。对于脓毒症患者而言,血流动力学可能在短期内发生巨大改变,并导致难以纠正的心律失常;而对于心房颤动以及频发室性心律失常的患者而言,不同时相测量可能带来较大误差,临床工作者需多次测量并估算均值,以减少差异。
综上所述,本实验为脓毒性休克患者的右心功能提供新的评估思路,对明确脓毒性休克患者各阶段的心脏变化具有重要指导意义,为临床及时调整,指导治疗和优化患者血流动力学提供新思路,但由于个体差异以及左心室的相关影响,右心室功能测定有待于临床进一步研究。
参考文献:
[1] Kamath S, Hammad Altaq H, Abdo T. Management of sepsis andseptic shock: what have we learned in the last two decades? [J].Microorganisms, 2023, 11(9): 2231.
[2] Gu H, Yang L. Transesophageal echocardiography combined withProAQT/PulsioFlex" hemodynamic" monitoring" in" anestheticmanagement of a patient with septic shock associated with septiccardiomyopathy: a case report[J]. Clin Case Rep, 2023, 11(12):e8266.
[3] Wang J, Wang XT, Liu DW, et al. Induction and deduction in sepsis-induced cardiomyopathy: five typical categories[J]. Chin Med J,2020, 133(18): 2205-11.
[4] Chotalia M, Ali M, Hebballi R, et al. Hyperdynamic left ventricularejection fraction in ICU patients with sepsis[J]. Crit Care Med,2022, 50(5): 770-9.
[5] Hollenberg SM, Singer M. Pathophysiology of sepsis-inducedcardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-34.
[6] Wasyluk W, Nowicka-Stążka P, Zwolak A. Heart metabolism insepsis-induced cardiomyopathy-unusual metabolic dysfunction ofthe heart[J]. Int J Environ Res Public Health, 2021, 18(14): 7598.
[7] Liu S, Wang YH, Li J, et al. Incremental value of three-dimensionalspeckle-tracking echocardiography for evaluating left ventricularsystolic function in patients with coronary slow flow[J]. Curr ProblCardiol, 2022, 47(9): 100928.
[8] Dissabandara T, Lin K, Forwood M, et al. Validating real-time three-dimensional echocardiography against cardiac magnetic resonance,for the determination of ventricular mass, volume and ejectionfraction: a meta-analysis[J]. Clin Res Cardiol, 2024, 113(3): 367-92.
[9] 练菲菲, 纪文艳, 丁 静, 等. 二维斑点追踪技术和右室量化分析系统评估尿毒症患者透析前后右室收缩功能的临床价值[J]. 临床超声医学杂志, 2023, 25(4): 241-5.
[10]张照龙, 王金忠. 脓毒症心肌损伤患者血清NT-proBNP及cTnⅠ、BUN、Cr水平的变化[J]. 中华保健医学杂志, 2021, 23(6): 569-71.
[11]Singer M, Deutschman CS, Seymour CW, et al. The thirdinternational consensus definitions for sepsis and septic shock(sepsis-3)[J]. JAMA, 2016, 315(8): 801-10.
[12]Bylapudi SK, Nanjan S, Ramasamy S, et al. Role of acutephysiology, age, and chronic health evaluation (APACHE) II score inpredicting outcomes of peritonitis due to hollow viscous perforation:a prospective observational study[J]. Cureus, 2021, 13(12): e20155.
[13]Othman F, Abushahba G, Salustri A. Adherence to the Americansociety of echocardiography and European association ofcardiovascular imaging recommendations for the evaluation of leftventricular diastolic function by echocardiography: a qualityimprovement project[J]. J Am Soc Echocardiogr, 2019, 32(12):1619-21.
[14]Badano LP, Addetia K, Pontone G, et al. Advanced imaging of rightventricular anatomy and function[J]. Heart, 2020, 106(19): 1469-76.
[15]刘志远, 杨桂才, 王 春, 等. 动态床旁超声IVC及变异率联合CVP在脓毒症休克患者液体复苏中的监测价值[J]. 河北医学, 2024, 30(3):457-62.
[16]Karima A, Tatsuya M, Vivekanandan A, et al. Normal values of 3Dright ventricular size and function measurements: Results of theWorld Alliance of Societies of Echocardiography Study[J]. J AmSoc Echocardiogr, 2023 36(8): 858-66.
[17]Liu BY, Wu WC, Zeng QX, et al. The value of three-dimensionalechocardiography in risk stratification in pulmonary arterialhypertension: a cross-sectional study[J]. Int J Cardiovasc Imaging,2020, 36(4): 577-84.
[18]Muraru D, Badano LP, Nagata Y, et al. Development and prognosticvalidation of partition values to grade right ventricular dysfunctionseverity using 3D echocardiography[J]. Eur Heart J CardiovascImaging, 2020, 21(1): 10-21.
[19]王 燕, 张平洋, 刘 琨, 等. 三维斑点追踪成像技术评价乳腺癌患者接受吡柔比星化疗后右心室心肌力学特性改变[J]. 南方医科大学学报, 2018, 38(9): 1032-8.
[20]Lang RM, Badano LP, Mor-Avi V, et al. Recommendations forcardiac chamber quantification by echocardiography in adults: anupdate from the American Society of Echocardiography and theEuropean Association of Cardiovascular Imaging[J]. Eur Heart JCardiovasc Imaging, 2015, 16(3): 233-70.
[21]严 颜, 魏 捷, 吴 淼, 等. 脓毒症的微循环监测与管理:从临床实践出发[J].临床急诊杂志, 2024, 25(2): 99-104.
[22]Loots FJ, Smits M, Jenniskens K, et al. Added diagnostic value ofbiomarkers in patients with suspected sepsis: a prospective cohortstudy in out-of-hours primary care[J]. J Appl Lab Med, 2022, 7(5):1088-97.
[23]罗友军, 谭转欢, 李新君, 等. 血清cTnI、 CK-MB、 NT-proBNP联合检验在脓毒症患儿中的作用探讨[J]. 中国现代医生, 2016, 54(11):107-9.
[24]Masson S, Caironi P, Fanizza C, et al. Sequential N-terminal pro-B-type natriuretic peptide and high-sensitivity cardiac troponinmeasurements during albumin replacement in patients with severesepsis or septic shock[J]. Crit Care Med, 2016, 44(4): 707-16.
[25]Bessière F, Khenifer S, Dubourg J, et al. Prognostic value oftroponins in sepsis: a meta-analysis[J]. Intensive Care Med, 2013,39(7): 1181-9.
[26]Vasques-Nóvoa F, Laundos TL, Madureira A, et al. Myocardialedema: an overlooked mechanism of septic cardiomyopathy? [J].Shock, 2020, 53(5): 616-9.
[27]Lanspa MJ, Cirulis MM, Wiley BM, et al. Right ventriculardysfunction in early sepsis and septic shock[J]. Chest, 2021, 159(3):1055-63.
[28]朱玉菡, 陈腾飞, 宋麦芬, 等. 心肌损伤对ICU脓毒症患者的影响及其危险因素分析的临床研究[J]. 中国循证心血管医学杂志, 2023,15(3): 336-40.
[29]Lahm T, McCaslin CA, Wozniak TC, et al. Medical and surgicaltreatment of acute right ventricular failure[J]. J Am Coll Cardiol,2010, 56(18): 1435-46.
[30]Radwan HI, Alhoseeny AMA, Ghoniem SM, et al. Early rightventricular dysfunction after primary percutaneous coronaryintervention in anterior versus isolated inferior myocardial infarctionassessed by tissue Doppler imaging and speckle trackingechocardiography[J]. Heart Fail Rev, 2023, 28(2): 407-17.(编辑:熊一凡)
