假地蓝组培快繁体系的初步建立
2024-12-31李金凤杜梦杨张建杨香娟赵继鑫李俊强

关键词:假地蓝;组织培养;快繁技术;植物激素
假地蓝(CrotalariaferrugineaGrah.)为豆科(Leguminosae)猪屎豆属(Crotalaria)植物,别名黄花野百合,属多年生草本,具有多种活性成分.其干燥全草入药可滋肾养肝,止咳平喘,利湿解毒,用于耳鸣,耳聋,头目眩晕,久咳痰血,肾炎,疔疮肿毒等症状[1-2],主要分布在贵州、云南、四川等地,是四川、云南、贵州白族、彝族和侗族常用的民间药材[3].在现代医学应用中,其提取物还具有重要的抗癌和抗菌作用,具有较高的药用价值,应用前景广阔[4-6].假地蓝还可以杀灭蝇蛆、孑孓,也能作为绿肥使用.
近年来,假地蓝药用价值的发掘越来越深,但由于生态环境被破坏,假地蓝的数量减少,现有野生资源无法满足临床上对慢性肾炎、支气管炎和膀胱炎等症治疗的持续需求.而国内对假地蓝组培快繁体系的相关研究成果少,多数集中在药用及化学成分研究.周英等[7]报道了假地蓝干草响铃草的体外抑菌作用,其不同溶剂提取物对金黄色葡萄球菌、大肠杆菌、藤黄微球菌、绿脓杆菌以及黄霉菌均有一定的抑制作用.张旭[8]报道了响铃草的化学成分,从中分离催吐萝芙木叶醇(3-氧化-6-羟基紫罗兰醇,Ⅰ)、染料木素(Ⅱ)、对羟基苯甲酸(Ⅲ)、5,7-二羟基-4-甲氧基黄酮-7-O-β-D-葡萄糖苷(Ⅳ)等10种化合物.夏勇兵等[9]确定了响铃草正丁醇萃取部位为响铃草的抗炎镇痛部位.但针对假地蓝组织培养及快繁体系的建立,尚未见文献报道.本实验以假地蓝无菌苗叶片为外植体,通过愈伤组织诱导、增殖、不定芽分化以及生根培养建立假地蓝的组织培养体系,缩短种植周期,提高资源利用,实现持续大批量药材供应,弥补假地蓝以及猪屎豆属等近缘植物再生技术研究的空白,实现假地蓝的资源充分利用.
1 材料与方法
1.1 试验材料
自然条件下种植的假地蓝植株,其茎上密布绒毛,携带大量微生物,常规方法难以获得无菌材料,本实验以宜宾市翠屏区金秋湖镇邱场社区野外采集的假地蓝成熟种子为材料,获得无菌苗,以开展组培相关研究.
1.2 培养基及培养条件
基本培养基采用MS,添加不同种类和浓度的6-BA(6-苄氨基嘌呤)、2,4-D(2,4-二氯苯氧乙酸)、NAA(a-萘乙酸)、IBA(吲哚丁酸)和TDZ(噻苯隆),添加琼脂5g/L,蔗糖30g/L,按配方添加0.5g/LPVP,pH6.0,高压灭菌锅(121℃)灭菌20min.培养室温度23±2℃,每日光照12h.
1.3 试验方法
(1)无菌苗的获取.选择成熟饱满的假地蓝种子,流水冲洗干净,用75%的酒精表面消毒,移入超净工作台内,0.1%的升汞处理8min进行消毒,用无菌水清洗2~3次,在无菌滤纸上擦干水分,将种子接入1/2MS+6-BA1.0mg/L+2,4-D1.5mg/L+NAA0.5mg/L培养基中,获得无菌苗,待无菌苗长到7~8cm高、叶片长2cm时,进行后续实验.
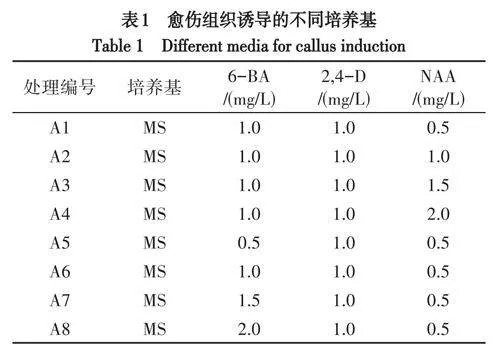
(2)愈伤组织诱导.取无菌苗上的嫩叶叶片,切割成0.5cm×0.5cm大小,接种在表1的培养基上,每组处理接20瓶,1-2片/瓶,观察愈伤组织诱导情况,30d记录诱导率、褐化率及愈伤情况.
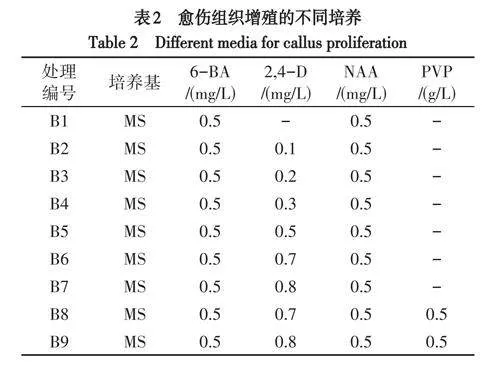
(3)愈伤组织增殖.取30d后成功诱导的愈伤组织,切割成0.5cm×0.5cm小块,接种在表2培养基上,每组处理接20瓶,1块/瓶,30d记录愈伤情况及褐化率.
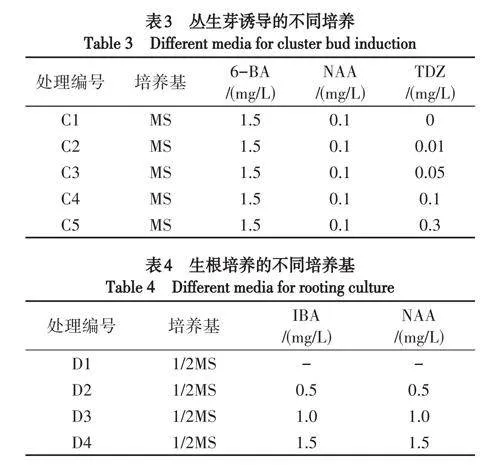
(4)丛生芽诱导.取增殖20d的愈伤组织,切割成0.5cm×0.5cm小块,接种在表3培养基上,每组处理接20瓶,2块/瓶,观察丛生芽诱导情况,90d计算诱导率.
(5)生根培养.取分化出的丛生芽,保留其顶端2~3片较小叶片,接种在表4培养基上,每组处理接20瓶,2根/瓶,观察茎段生根情况,60d计算生根率.
1.4 数据统计与计算
污染率=污染数/接种数×100%
萌发率=萌发个体数/接种数×100%
诱导率=诱导成功个体数/接种数×100%
褐化率=褐化个体数/接种数×100%
增值倍数=增值后愈伤数/增殖前愈伤数
平均株高=总株高/总株数
平均丛生芽数=总丛生芽数/总株数
生根率=生根数/接种数×100%
平均根长=总根长/接种数
平均主根数=总主根数/接种数
2 结果与分析
按试验设计建立假地蓝再生体系如图1所示.
2.1 无菌苗培养
假地蓝种子萌发较快,在添加有6-BA、2,4-D和NAA的培养基中培养,45d开始萌发出白色的芽,60d种子长出叶片(图1A).
2.2 愈伤组织诱导
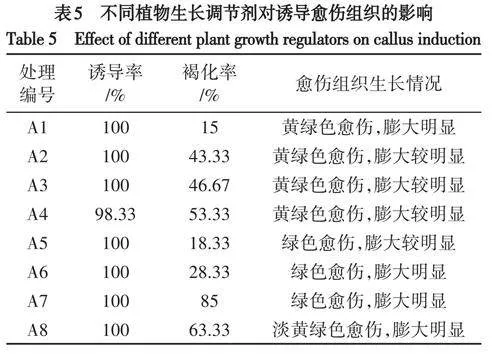
在添加有不同浓度的6-BA、2,4-D和NAA的培养基中培养30d,愈伤组织切口处膨大,且均有小颗粒黄绿色组织出现,愈伤组织生长速度快且长势好,45d时愈伤组织均开始不同程度的褐化.在MS培养基中,当添加2,4-D浓度为1.0mg/L不变时,添加不同浓度的6-BA与NAA组合对假地蓝叶片的愈伤组织诱导率无明显影响,但诱导效果不同(表5).当6-BA浓度不变时,随着NAA浓度的升高,愈伤膨大效果和长势呈下降趋势,褐化率呈上升趋势,NAA浓度为2.0mg/L时愈伤诱导率为98.33%,其余组合愈伤诱导率均为100%.当NAA浓度不变时,随着6-BA浓度的升高,愈伤组织诱导率均为100%,愈伤膨大效果呈上升趋势,褐化率先升高后降低,6-BA浓度为0.5mg/L时褐化率最低,6-BA浓度为1.5mg/L时褐化率最高.6-BA浓度为2.0mg/L时,在30d的愈伤组织呈现为与其他浓度不同的淡黄绿色,45d时愈伤组织生长为绿色.当NAA浓度为0.5~1.5mg/L、6-BA浓度为0.5~1.0mg/L时愈伤组织呈绿色,膨大较明显,长势好.其中,当添加1.0mg/L6-BA、0.5mg/LNAA时,诱导率达100%的同时,愈伤组织呈翠绿色,膨大最明显,褐化率低,长势最好(图1B).因此,愈伤组织诱导的适宜培养基为MS+6-BA1.0mg/L+NAA0.5mg/L+2,4-D1.0mg/L.
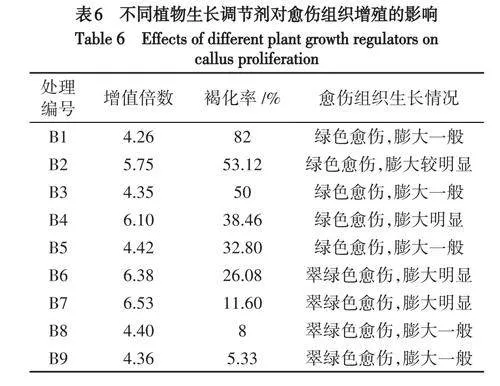
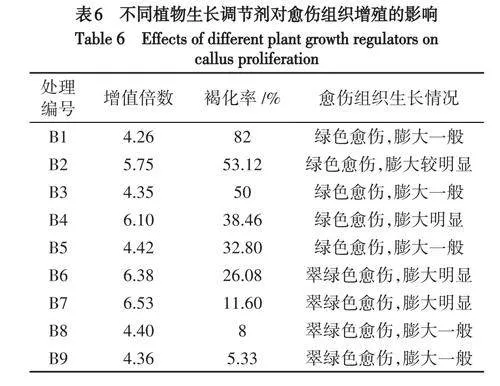
2.3 愈伤组织增殖
假地蓝愈伤组织生长速度快,均在20d形成大块愈伤组织,30d开始褐化且褐化速度快.不同浓度激素配比对假地蓝愈伤组织增殖的差异显著(表6).当2,4-D浓度为0mg/L时,愈伤组织仍膨大生长,但褐化率高,愈伤膨大较慢.当6-BA和NAA浓度为0.5mg/L时,随着2,4-D的浓度升高,愈伤组织褐化率呈下降趋势,愈伤组织膨大速度呈上升趋势.当2,4-D浓度为0.7~0.8mg/L时,愈伤组织30d时呈黄绿色,45d时呈绿色,膨大速度快,长势好,褐化率低.其中,当添加0.8mg/L2,4-D时褐化率最低,为11.6%,愈伤组织呈翠绿色,膨大最明显,长势最好(图1C).PVP对避免假地蓝的愈伤组织褐化有显著作用效果,但对其膨大生长速度有一定抑制作用.当6-BA、2,4-D和NAA的浓度不变时,添加PVP的组合在45d时的褐化率低于不加PVP的组合,但不加PVP的组合愈伤组织的膨大速度更快.因此,愈伤组织增殖的适宜培养基为MS+6-BA0.5mg/L+NAA0.5mg/L+2,4-D0.8mg/L.
2.4 丛生芽诱导
假地蓝的愈伤组织45d左右开始分化,当TDZ浓度为0mg/L时,愈伤组织可以分化成功,添加不同浓度TDZ的MS培养基均能诱导愈伤组织分化,但对诱导分化的影响差异显著(表7).当6-BA浓度为1.5mg/L、NAA浓度为0.1mg/L时,随着TDZ浓度的升高,分化率呈先升高后降低的趋势.当TDZ的浓度为0.01~0.05mg/L时,30d愈伤组织开始褐化,60d时愈伤组织严重褐化,此时开始分化出丛生芽,90d时分化率高达100%;此范围内随TDZ浓度升高,愈伤组织的分化效果显著变好.其中,当TDZ的浓度为0.05mg/L时,诱导分化的丛生芽数目最多,叶色绿、叶片大而多,茎较粗壮,节间均匀,株型统一(图1D).TDZ浓度过高不利于愈伤组织分化,当TDZ浓度大于1.0mg/L时,愈伤组织90d后分化出小芽,分化率低,分化时间长,分化后芽的生长状况一般,植株矮,茎粗壮.因此,诱导丛生芽分化的适宜培养基为MS+6-BA1.5mg/L+NAA0.1mg/L+TDZ0.05mg/L.
在诱导丛生芽的过程中,发现处理C1、C2、C3都会发生瓶内开花现象(图1E),且部分丛生芽在后期会自主生根,较多数的根系生理状态较差(图1F),极少部分的生理状态较好(图1G).
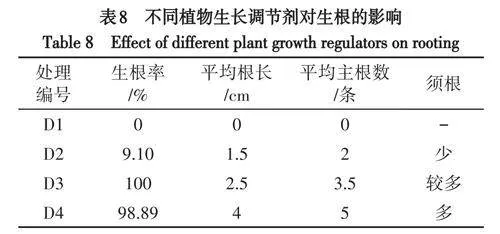
2.5 生根培养
添加不同浓度NAA和IBA的1/2MS培养基均能诱导假地蓝茎段生根,但对生根诱导的影响差异显著(表8),在不添加激素的1/2MS培养基中不能诱导生根,30d后苗的长势变差,叶片变黄,逐渐死亡.随着NAA和IBA浓度的升高,根长、根数及生根率呈上升趋势.当NAA和IBA浓度为1.0~1.5mg/L时,生根率高,平均生根数多且粗壮,平均根长较长,须根多,长势好.其中,当添加1.0mg/LNAA和IBA时,生根率最高达100%;当添加1.5mg/LNAA和IBA时,60d生根率高达98.89%,平均根长达4cm,平均主根5条,须根最多,长势最好,后续移栽成活率高(图1H、图1I).因此,生根的适宜培养基为1/2MS+IBA1.5mg/L+NAA1.5mg/L.
3 讨论与结论
3.1 褐化现象在假地蓝愈伤分化中的作用
本试验发现,愈伤组织褐化是假地蓝丛生芽诱导成功的前提条件.分化初期丛生芽底部愈伤迅速生长膨大,45d愈伤组织外层褐化较重时,培养材料并未死亡,开始长出芽点,形成丛生芽并在60d内持续生长、保持活力,此现象与丁旭峰等[10]对园艺植物组织培养中的褐化现象研究相违背.在假地蓝的愈伤组织外部有较重程度的褐化后才开始进行丛生芽分化,与其他植物材料的组培不同.一般认为愈伤组织褐化会影响植物组培,甚至导致植物材料死亡,如兰花根状茎的分化会受到褐化物质的不利作用[11],冬凌草愈伤组织的分化需要抑制愈伤组织的褐化[12].试验中,切开正在分化的褐化愈伤发现其外部是褐化状态,内部呈青绿色,说明愈伤组织在分化过程中的褐化可能并不会从外部蔓延至内部或蔓延速度极慢,故愈伤的生理状态较好,丛生芽由内部未褐化的愈伤中分化出来,较长一段时间内保持较好的长势,直至愈伤组织完全褐化失去活力;也可能是假地蓝的愈伤组织在由外层向内部褐化的过程中产生了某些代谢产物,促进了假地蓝愈伤组织的分化.大多研究认为,褐化主要是由多酚氧化酶作用于酚类化合物而引起的[13-14].推测可能与此类化合物或反应有关.目前试验局限于对褐化现象促进丛生芽诱导这一结果的发现,还未进行代谢研究,现阶段仍无法确定褐化时促进假地蓝愈伤分化的具体物质,未来将进一步进行试验,以期为猪屎豆属及易褐化植物组培提供一定参考.
3.2 分化自主生根和诱导生根的比较
不定芽生根是组培苗成苗的关键步骤,在诱导假地蓝茎段生根的过程中发现,假地蓝组培苗易诱导出根系,在营养成分减半的1/2MS中添加IBA和NAA能成功诱导生根,这与覃春梅等[15]对百花悬钩子的叶片组培快繁与植株再生研究一致,且较高的生长素浓度更利于假地蓝生根,与郭丽等[16]对野生薄皮木的组培快繁体系优化的研究结果相违背.留有2~3片嫩叶的茎段材料比不带叶的生根效果更好,生根时间更短,不带叶的茎段在培养基中需先长叶后生根.诱导生根过程中,新生根系呈现白色,根系长度一般,数量较多,但茎段底部愈伤组织褐化速度快,导致靠近愈伤的根系褐化,生理状态变差,给后续移栽带来一定困难,存活率低.部分诱导的丛生芽在约60d后会自主生根,形成完整植株,此时多数根系呈现暗红或褐色,数量较少但根较长,此类丛生芽移栽后大部分无法成活,说明其根基本不具备活力和吸取养分的能力;极少数根系呈现白紫色,数量多且根系长,能够成功移栽存活.
3.3 瓶内开花
外源激素是在诱导组培苗开花中起重要作用的因素,细胞分裂素类激素更是花芽形成的必需因子[17-18].通过施用一定浓度的6-BA、GA3、NAA能够成功诱导露薇花组培苗瓶内开花[19],施用一定浓度的IBA、CCC能够诱导石竹试管苗开花[20].本试验用于丛生芽诱导的两种浓度的TDZ处理都能成功诱导组培苗瓶内开花,其TDZ浓度分别为0.03mg/L、0.05mg/L,在愈伤组织分化的后期丛生芽生长旺盛,长势好,三种处理的组培苗都能在同一时间前后逐渐长出花芽,形成花苞,花期可长达15d.说明对于假地蓝来说,细胞分裂素可能对其花芽分化产生了一定的作用,但TDZ浓度为0mg/L时仍出现瓶内开花现象,与施用了TDZ的两组无较明显区别,故细胞分裂素的处理并不是其花芽分化的必需因子.之后长达一年的组培实验也未发现丛生芽诱导过程中出现瓶内开花现象,但后续愈伤组织诱导分化出的丛生芽有一个共同特征,即植株矮小,后期生长状态一般直至彻底死亡失去活力.植物完整的生命周期包括营养生长和生殖生长,开花的启动代表植物生活周期由前者步入后者[21-22].故假地蓝瓶内开花的主要影响因素是植株生长的生理发展阶段,后续实验中的假地蓝丛生芽在营养生长过程中的状态较差,还未进入生殖生长发育时期就已经死亡,而发现瓶内开花的几组材料,其丛生芽在营养生长阶段生长旺盛,成功发育至生殖生长阶段,分化出花芽并开花.光照是许多植物瓶内开花的一个重要因素,适宜的光照可以诱导兰花瓶内开花[23].假地蓝丛生芽生长的过程需一直保持较强光照,这可能也是促进假地蓝瓶内开花的原因之一.
