果梨多酚氧化酶特性及抑制剂研究
2024-12-01田昊川





摘要:梨汁褐变会导致其色泽、风味与状态等品质受到影响。本文以延边苹果梨为原材料,采用丙酮粉法从苹果梨中提取多酚氧化酶,研究了底物浓度、pH值与温度对多酚氧化酶活性的影响,并测定了不同浓度Vc、柠檬酸和荞麦提取物对多酚氧化酶的抑制效果,结果表明:酶与底物最适比例为0.01 mL酶+0.18 mL底物,最适pH值6.4,最适温度为25 ℃。柠檬酸、Vc和荞麦提取物浓度分别在0.005 g/l、0.2 g/l、0.05 g/l时,抑制效果最好。
关键词:苹果梨汁;褐变;多酚氧化酶
在果蔬的储藏、加工过程中容易发生褐变,根据发生机理不同包括酶促褐变或非酶促褐变[1]。酶促褐变是指多酚氧化酶(PPO)与多酚类物质和氧气接触,酚类物质被氧化成羟基醌,羟基醌易聚合成黑色素物质,使果汁颜色加深从而引起褐变[2]。行业内主要根据酶促褐变的发生机制,应用物理或化学手段寻找抑制方法,常用化学抑制剂有二氧化硫、亚硫酸盐、L-半胱氨酸等,例如亚硫酸盐通过阻止发生美拉德反应从而抑制褐变,但是因为化学抑制剂的残毒性,为避免环境污染从而限制用量,物理手段有降低温度、改变pH值、降低果汁成品浓度等方法[3]。
随着我国经济快速发展,梨果消费形式种类日益增加,对梨汁加工的研究方面逐渐深化[4]。褐变大大损害了果汁加工的商业价值[5]。本实验探讨了几种褐变抑制剂对苹果梨中多酚氧化酶的影响,意在确定多酚氧化酶的最适宜生理反应条件并筛选出对苹果梨褐变效果作用最好的抑制剂,为苹果梨汁的加工提供实验依据。
1 材料与方法
1.1 材料
苹果梨采购于吉林农业大学农贸市场,产地为吉林省延边自治州。苹果梨大小均匀,色泽良好,外观完整且无机械外伤。
1.2 方法
1.2.1 PPO提取
采用丙酮粉法。取苹果梨果肉样品40 g,加入预冷的丙酮液研磨,抽滤制成干燥酶粉。加入PBS缓冲液(pH值6.8)20 mL,在4 ℃下离心(4 000 r/min)30 min,取上清液为PPO粗酶液[6]。
1.2.2 PPO活性测定
采用比色法测定。将0.01 mL酶液、0.01 mL水,加入0.18 mL邻苯二酚溶液(pH值6.8)中。测定吸光度的变化,波长420 nm。每隔30 s记录一次,共记录20 min。吸光度变化0.001mol/min为一个PPO酶活性单位[7]。
1.2.3 最适酶量与底物浓度比例的确定
在室温(20 ℃)下,将pH值6.8的PBS缓冲液0.01 mL和粗酶液0.01、0.02、0.03、0.04 mL,再加入1 mL邻苯二酚溶液(浓度分别为0.015、0.016、0.017、0.018M)中,方法同1.2.2,测定不同底物浓度下的PPO活性。
1.2.4 PPO最适pH值确定
配制不同pH值的PBS缓冲液,取粗酶液0.01 mL、0.02 M邻苯二酚溶液0.18 mL分别加入不同pH值的磷酸缓冲液0.01 mL,测定吸光度值,波长420 nm下[8]。以不加粗酶液的不同pH值反应液做对照,测定方法同1.2.3。
1.2.5 PPO最适反应温度确定
在pH值6.8下,将0.02 M邻苯二酚溶液0.18 mL、酶液0.01 mL与水0.01 mL混合。在不同温度(25~60 ℃,梯度为5 ℃)中分别水浴4 min后加入三氯乙酸,冷却至室温,测定420 nm吸光度值。
1.2.6 不同抑制剂对PPO活性影响
根据不同抑制剂的抑制原理,试验选用柠檬酸、抗坏血酸、荞麦提取物这三种抑制剂。用pH值6.8磷酸缓冲液配制浓度为0.005 g/l、0.05 g/l、0.1 g/l、0.2 g/l、0.5g/l的抑制剂溶液。在20 ℃条件下,将0.01 mL酶液、0.01 mL抑制剂溶液加入0.02 M邻苯二酚溶液0.18 mL中, 迅速混匀后,测定PPO的活性方法同2.2.2。
抑制率计算方法:抑制率(%)=[(对照酶活-加入抑制剂后酶活)/对照酶活]×100%
2 结果与分析
2.1 反应体系的最适底物浓度
不同粗酶液添加量与底物浓度对苹果梨PPO活性影响见图1。图示表明,吸光值随酶反应时间的变化均符合标准酶促反应变化规律,呈抛物线上升趋势。酶的反应速率与酶和底物接触面积等因素有关,而如何选择最适底物浓度是酶促反应关键。通常酶随着反应时间的增加,底物逐渐减少,酶促反应速率逐渐减慢。而将整个酶促反应时间作为计算酶活时会比实际值小。图1曲线表明,PPO粗酶液在开始反应的前四分钟酶与底物存在一定的线性关系,斜率代表酶促反应的酶活,R2可以作为衡量酶促反应的好坏。在不同体积粗酶液和不同浓度的底物(0.01 mL酶液+0.018 M底物、0.02 mL酶液+0.017 M底物、0.03 mL酶液+0.016 M底物、0.04 mL酶液+0.015 M底物)体系中,在0~4 min的回归方程率分别为:0.1958、0.0556、0.0647、0.0804。R2分别为:0.9985、0.9455、0.9462、0.9102。综上所述,酶活最大、酶促反应速率最大的是当底物浓度为0.015 M时,加入0.01 mL粗酶液的反应体系。本试验选用该体系作为酶促反应的标准体系。
2.2 PPO的最适pH值
pH值对 PPO酶活的影响见图2。pH值2.8~5.8范围内时苹果梨肉PPO活性随着pH值的升高而上升, pH值6.1时,酶活稍有下降,而后又继续上升,在pH值6.4时酶活性达到最高;pH值2.8的PPO相对活性仅为pH值6.4的28.94%;但pH值在6.4~6.6时,酶活性随着pH值的升高或下降,pH值6.6时PPO相对活性仅为pH值6.4的55.26%;pH值进一步上升,pH值6.6~7.0时,酶活随着pH值的升高而上升,并在pH值7.0达到另一高峰,为pH值6.4的86.84%,随后开始下降;pH值7.3~7.5酶活小幅度上升,而后直线下降,pH值8.0酶活下降至最低值(0%),PPO几乎丧失活力。其原因可能是强酸性条件下,PPO的辅基Cu2+被解离,从而失去活性。在强碱条件下,Cu2+转化为Cu(OH)2沉淀,脱离了酶蛋白,也会失去活性[9];另外由于pH值对底物的解离使之不能被催化也是原因之一。由此可见pH值对PPO酶活性有一定影响。从整个图表来看,在pH值6.4和7.0时分别出现较高的酶活值,使图表呈现出“双峰”现象,双峰曲线可能是由于苹果梨中的多酚氧化酶是复合酶,各个酶的最适pH值。根据图表2判断,PPO的最适pH值为6.4。
2.3 PPO的最适反应温度
温度对 PPO 酶活的影响结果如图3。由于PPO酶活受pH值变化影响的图表出现了“双峰”的现象,在研究最适反应温度时,把pH值条件分别设定为6.4和7.0,观察其影响。在两个不同pH值条件下,温度变化趋势基本相同。温度为25-45℃时,pH值6.4时PPO酶活随温度下降而缓慢减小;而pH值7.0时,酶活随温度下降的幅度要更大一些。在超过40 ℃时,两个不同pH值条件下,酶活均急剧下降至负值,完全抑制酶促化。由图3可知,反应PPO的最适温度为25 ℃。温度对PPO酶活的影响是双重的。在一定范围内呈正相关,随着温度升高加快PPO酶催化反应速度,但超过一定阈值会导致酶蛋白变性,所以温度对PPO的影响是由以上两个方面叠加的效果。高温酶失活主要因为酶活性部位三维结构的完整性与稳定性遭到破坏。
2.4 不同浓度抑制剂对PPO活性影响
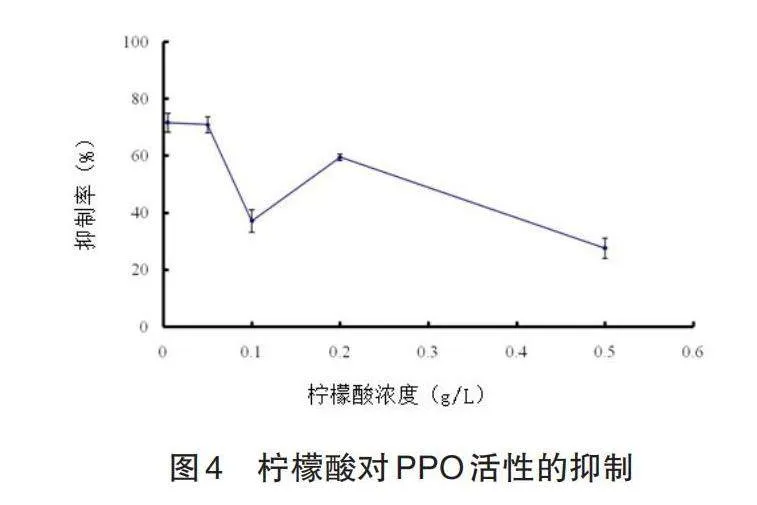
2.4.1 柠檬酸对褐变反应的抑制作用
柠檬酸对PPO酶活性的抑制率见图4。由图4可知,随着柠檬酸浓度的增加,PPO酶活性的抑制率呈现先下降后上升再下降趋势。原因可能是PPO受pH值影响。PPO酶对pH值较为敏感,柠檬酸含量升高,pH值随之下降,PPO酶中的铜被解离从而失去活性,pH降低到一定程度造成蛋白质变性也是酶失去活性的一个原因,一定酸浓度后PPO酶活性抑制率呈线性下降趋势。在试验范围内,柠檬酸抑制 PPO酶活性的最适浓度为0.005 g/l。
2.4.2 Vc对褐变反应的抑制作用
Vc对PPO酶活性的抑制率见图5。由图5可知,抗坏血酸对PPO酶活性具有较好的抑制作用,抑制率均在89%以上。Vc对PPO酶活性的抑制率随浓度增加,先下降后上升。反应伊始,抑制作用下降的原因可能是由于抗坏血酸极易氧化分解。当浓度为 0.2 g/l时,抑制率为100%。在试验范围内,Vc抑制 PPO 酶活性的最适浓度为0.2 g/l。
2.4.3 荞麦提取物对褐变反应的抑制作用
荞麦提取物对 PPO 酶活性的抑制率见图5。由图5可知,荞麦提取物对PPO酶活性具有较好的抑制作用,抑制率均在85%以上。荞麦提取物对PPO酶活性的抑制率随浓度增加,先上升后下降。其原因可能是荞麦提取物里含多酚类物质,随荞麦提取物浓度增大,酶促反应体系中多酚类底物浓度也增大,反应力度增强,从而降低了抑制作用。在试验范围内,荞麦提取物抑制 PPO 酶活性的最适浓度为0.05 g/l。
3 结论
本试验首先研究了苹果梨多酚氧化酶的底物浓度、pH值和反应温度对多酚氧化酶活性的影响,在此基础上研究了不同浓度抑制剂(Vc、柠檬酸和荞麦提取物)对多酚氧化酶的抑制效果。结果表明:在0.01 mL酶液中加入0.018 M底物浓度的体系,酶活最高;酶促反应的最适pH值6.4,反应最适温度为25 ℃。对苹果梨PPO酶活性抑制作用由强到弱的抑制剂依次是荞麦提取物、Vc、柠檬酸。这三种抑制剂抑制苹果梨PPO酶活性的最佳浓度分别为0.05 g/l、0.2 g/l、0.005 g/l,在该浓度下PPO活性抑制率分别为85%、89%、76%。
参考文献
[1] 马烁,赵华.果蔬汁防褐变的研究进展[J].农产品加工,2023,(11):76-79+83.
[2] 蔡惠.安梨果实抗褐变机理的研究[D].河北科技师范学院,2010.
[3] 闫路娜,王英泽,李晨,刘瑞,于天英.食品生物化学[M].北京师范大学出版社,202108.361.
[4] 杨念.河北省梨果产业发展对策研究[D].河北农业大学,2013.
[5] 苏菲烟.澄清雪梨汁加工关键技术研究[D].西华大学,2020.
[6] 徐芹,乔勇进,方强,张绍铃,王海宏等.砀山酥梨多酚氧化酶酶学特性及抑制效应的研究[J].食品科学,2008,(04):74-77.
[7] 庄尹宏.丝瓜褐变分级与总酚及相关酶活性分析[D].福建农林大学,2016.
[8] 李梅,吴小波,李萌,吕聪,董旭杰,曹福祥.糙皮侧耳以果皮为基质固态发酵产漆酶及其酶学性质的研究[J]. 食用菌学报,2018,25(01):60-66.
[9] 薛楚然.影响荔枝及荔枝酒酶促褐变的因素及控制研究[D].西北农林科技大学,2015.
