慢性鼻窦炎小鼠建模研究进展
2024-11-19陈源沈暘王吉卢韬郑博文杨玉成


【摘要】 慢性鼻部炎症如鼻炎、鼻窦炎是一类常见慢性疾病,长期影响人们的生活质量,其发病原因和致病机制仍尚不明确,动物模型的构建是探寻致病机制有效途径,其中小鼠慢性鼻部炎症模型的建立在近几年得到快速发展。本综述旨在总结国内外小鼠慢性鼻窦炎、过敏性鼻炎建模情况,特别是嗜酸性粒细胞性慢性鼻窦炎小鼠模型的进展,这对于开发防治慢性鼻部炎症的新药或进一步阐明其发病机制均有重要作用。
【关键词】 小鼠模型;嗜酸性粒细胞;鼻息肉;慢性鼻窦炎;过敏性鼻炎
Research progress in the establishment of mouse models of chronic rhinosinusitis
CHEN Yuan, SHEN Yang, WANG Ji, LU Tao, ZHENG Bowen, YANG Yucheng
(Department of Otolaryngology, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China)
Corresponding author: YANG Yucheng, E-mail: yychxh@163.com
【Abstract】 Chronic nasal inflammation, such as rhinitis and sinusitis, is a common chronic disease that affects people’s quality of life for a long period of time. Its pathogenesis and mechanism are still unclear. The establishment of animal models is an effective approach to explore the pathogenesis, among which the establishment of mouse models of chronic nasal inflammation has been rapidly developed in recent years. The aim of this review is to summarize the research status of chronic rhinosinusitis and allergic rhinitis modeling in mice at home and abroad, especially the progress in eosinophilic chronic rhinosinusitis mouse models, which plays an important role in the development of new drugs to prevent and control chronic nasal inflammation or further elucidation of its pathogenesis.
【Key words】 Mouse model; Eosinophil; Nasal polyps; Chronic rhinosinusitis; Allergic rhinitis
慢性鼻窦炎是常见的慢性疾病之一,流行病学数据表明,我国人群慢性鼻窦炎总体患病率为8%,略低于欧洲(10.9%)和美国(12%~14%)[1-3]。慢性鼻窦炎在临床上被定义为鼻或鼻窦和黏膜的局部炎症,主要症状为鼻塞、流涕、嗅觉丧失和面部疼痛,持续至少12周。其发病机制主要包括先天性鼻上皮屏障功能障碍、黏膜纤毛清除功能受损、免疫系统紊乱和病原体入侵等。动物模型的构建是模拟疾病的有效途径,因此众多学者致力于寻找一种能替代该疾病的动物模型,在基于饲养条件、饲养周期、饲养空间、药品试剂以及疾病分子和基因水平上的研究需要,小鼠疾病模型的构建是最优选择。从解剖方面看,小鼠的鼻窦结构与人类鼻窦结构有差异,但从鼻黏膜上皮细胞来看,小鼠的鼻黏膜上皮与人类是相同的,因此可以通过小鼠来展现人类慢性鼻窦炎患病过程中鼻上皮黏膜的损伤与修复的变化[3]。
在目前已有文章使用的慢性鼻窦炎动物模型中,主要是用小鼠、大鼠、兔和羊进行建模,建模方法包括滴鼻、腹腔注射、雾化吸入、手术填塞等,建模时间各有长短,其中小鼠是使用次数最多、方法最简便、最经济实惠的一种模型。慢性鼻窦炎伴鼻息肉(chronic rhinosinusitis with nasal polyps,CRSwNP)按照细胞学分型主要分为中性粒细胞浸润、嗜酸性粒细胞浸润、淋巴细胞浸润、浆细胞浸润为主的类型以及混合型。在之前综述中主要是对嗜酸性粒细胞浸润模型的方法概括,但对于其他炎症细胞的浸润以及过敏性鼻炎的模型构建方法的总结相对缺乏,因此在本文中,我们归纳整理了目前几种用小鼠来构建慢性鼻窦炎模型的方法、周期、结果和意义,着重探讨小鼠慢性鼻窦炎模型构建的方法和使用试剂的多样性,同时对目前近十年已有文献报道小鼠鼻窦炎伴或不伴息肉模型建模方法进行简要概述,旨在为目前慢性鼻窦炎小鼠模型提供参考依据。
1 资料与方法
1.1 资料来源
检索数据库:外文数据库包括PubMed、Web of Science、Embase、The Cochrane Library;中文数据库包括中国生物医学文献服务系统、中国知网期刊全文数据库(CNKI)、万方数字化期刊全文数据库、中国科技期刊数据库(维普)数据库。
检索文献时限:2013年1月至2023年12月。
检索文献类型:研究性论文。
检索词:采用主题词方式进行检索,外文数据库以PubMed为例,英文检索词为model of chronic sinusitis、nasal polyps、model of mouse;中文数据库以CNKI为例,中文检索词为慢性鼻窦炎模型、息肉模型、小鼠建模。
检索策略:以CNKI和PubMed为例,检索公式分别如下:
#1慢性鼻窦炎模型
#2息肉模型
#3小鼠建模
#4 #1 AND #2
#5 #2 AND #3
#1 model of chronic sinusitis
#2 nasal polyps
#3 model of mouse
#4 #1 AND #2
#5 #2 AND #3
1.2 纳入与排除标准
纳入标准:①文章标题或摘要与主题词相关;②文章内容涉及小鼠鼻息肉建模相关研究;③发表于权威杂志的文章;④研究内容完整充实,论点论据可靠可信。
排除标准:①研究内容与本专业疾病无关;②综述或meta分析类型文章,检索流程见图1。
2 结 果
2.1 鼻息肉
CRSwNP是一种多因素异质性疾病,已知细菌超抗原等多种病原体可导致该病的发生,息肉样病变常被定义为上皮增厚剥脱、基底膜增厚、腺体增生、间质水肿、免疫细胞浸润[4]。现国际最常用表型分型即依据症状、内镜检查以及鼻窦CT结果将CRS分为2种主要表型:①CRSwNP,通常具有嗜酸性粒细胞成分;②慢性鼻窦炎不伴鼻息肉(chronic rhinosinusitis nasal polyps,CRSsNP)。在日本难治性嗜酸性粒细胞性慢性鼻窦炎流行病学调查研究中,通过在400倍显微镜下对鼻息肉进行组织学检查,嗜酸性粒细胞性鼻息肉(eosinophilic chronic rhinosinusitis with nasal polyps,ECRSwNP)的诊断标准:3个视野中嗜酸性粒细胞的平均数≥70[5]。ECRSwNP主要表现为2型免疫反应,伴随免疫球蛋白E(immunoglobulin E,IgE)、白介素(interleukin,IL)-4、IL-5、IL-13、IL-25、IL-33、胸腺基质淋巴细胞生成素(thymicstromal lymphopoietin,TSLP)水平升高,以及嗜酸性粒细胞计数增多[6-7]。
鼻息肉即良性炎性包块,起源于鼻窦和鼻黏膜的任何部分,可导致慢性鼻塞。这些息肉被认为是慢性鼻窦炎的一个亚组,临床诊断是根据鼻腔中的息肉显影和超过3个月的鼻腔鼻窦症状[8]。鼻黏膜显示组织学重塑,有上皮-间质转化(epithelial-mesenchymal transition,EMT)和纤维蛋白沉积以及杯状细胞增生[9-10]。CRSwNP的特征是继发于辅助性T细胞(T helper cell,Th)2型的免疫反应,包括嗜酸性粒细胞浸润和Th2型细胞炎症因子的过度表达[11]。相比之下,在亚洲患者中,常出现的是与Th1型和Th17型反应相关的中性粒细胞鼻息肉,主要和基质金属蛋白酶-7(matrix metalloproteinase 7,MMP-7)、MMP-9有关[12-13]。但有文献显示ECRSwNP临床症状更为严重,按照指南治疗3年内复发率高,对患者生活质量和经济负担造成严重影响,且我国慢性鼻窦炎有朝Th2型炎症转换的趋势[1]。
鼻息肉的形成是个体易感性和环境因素共同作用的结果[14-15],目前我国新版指南所推荐的针对CRSwNP的治疗手段主要为以手术治疗为主的综合治疗,总体疗效尚可,但不乏疗效不佳的患者,据报道,CRSwNP术后半年的总体复发率为35%,术后1年为38%[16-17]。从患者自身的角度,复发原因与患者的炎症类型、变应性体质、细菌生物膜及环境因素等有关;从医师角度,与药物治疗是否准确、充分、手术方式的选择是否合理,术中、术后处理是否恰当有关,其根本原因在于CRSwNP致病因素混杂,患者存在较大的异质性,而我们目前对其认识有限,治疗手段相对比较均一。
鼻黏膜是人体与外界环境直接接触的器官,是宿主抵御病原体的重要组成部分,是人体的第一道防御屏障,鼻黏膜表面定植的细菌群落对宿主健康有深远影响,鼻腔正常菌群在抵抗病原菌侵袭、维护人体与微生物之间的内环境稳态中发挥重要作用,鼻腔菌群的失衡与多种疾病的发生关系密切,但其中关键菌群标志物在疾病发生发展中的作用机制有待阐明。
小鼠模型鼻息肉的形成主要是通过2种途径实现的。一种方法是在缺氧诱导因子、炎症因子等多种因素的作用下,细胞外基质分泌增加,鼻黏膜增厚受损并脱落进入窦腔,鼻窦黏膜与浸润的炎症细胞聚集形成组织团块,在增生的基底膜环包下重塑形成鼻息肉。另一种方法是鼻黏膜受反复的炎症刺激,局部组织增殖和隆起,进而发展为息肉。鼻息肉形成标准包括黏膜厚度增加、腺体结构增生、嗜酸性粒细胞浸润、局部有明显突起呈息肉样病变。因此造模要求理想的动物模型应该满足以下要求:①没有直接损害窦腔;②符合鼻源性鼻窦炎的病理生理要求;③这些模型复制来的鼻窦炎具有向其他鼻窦侵犯的能力;④在病理学上具有炎症分期分级的征象;⑤方法简便,造模成功率高[3]。
2.2 中性粒细胞性慢性鼻窦炎伴鼻息肉小鼠模型的建立
脂多糖(lipopolysaccharide,LPS)是细菌内毒素的主要化学成分之一,是革兰阴性菌细胞壁的基本成分,位于其细胞壁的外层。LPS除了其毒性作用外,还可以通过Toll样受体(toll-like receptor,TLR)4识别和信号传导,是免疫系统的强效激活剂。已知LPS可诱导强烈的气道炎症和促进局部中性粒细胞聚集,一些研究已经使用小鼠模型报道了LPS可诱导中性粒细胞浸润。Kim等[18]通过在大鼠鼻腔中滴注LPS建立慢性鼻窦炎动物模型,连续滴鼻4 d后,观察到大鼠鼻窦黏膜明显增厚。Wang等[19]通过鼻内持续滴注LPS建立了中性粒细胞性鼻息肉模型,表明TLR4信号通路可促进Th1和Th17相关反应的增强[20]。TLR4已被证明在调节中性粒细胞的迁移、活化和寿命中起关键作用[21-22]。尽管中性粒细胞性鼻息肉与多种细菌感染有关,但难治性鼻息肉已被证实与革兰阴性菌感染密切相关,且革兰阴性菌释放的内毒素和LPS被认为是重要的致病机制[23]。
聚肌苷酸:聚胞苷酸[poly(I: C)]是一种人工合成的病毒类似物,主要通过启动TLR3信号通路,在抗病毒免疫的启动中发挥着至关重要的作用。在Clarke等[24]研究中显示哮喘小鼠模型引起以中性粒细胞浸润为主的炎症。Bae等[25]在鼻炎小鼠模型的建立中使用poly(I: C)触发了中性粒细胞性炎症。Wee等[26]的研究探讨了细菌和病毒来源的LPS和poly(I: C)是否影响中性粒细胞性鼻息肉的形成,为LPS 与TLR4串联、IL-17表达和中性粒细胞浸润之间的关系提供进一步的支持证据。
2.3 嗜酸性粒细胞性慢性鼻窦炎伴鼻息肉小鼠模型的建立
有研究报道,67%的CRSwNP患者鼻腔定植金黄色葡萄球菌,在几乎一半的鼻息肉组织匀浆中发现了抗金黄色葡萄球菌肠毒素的特异性IgE[27]。金黄色葡萄球菌被认为是人鼻黏膜上皮细胞中重要的炎症诱导剂,其分泌的5种毒素作为超抗原可放大免疫反应,激活TLR2,将炎症向Th2型转变,这种炎症类型的主要病理变化为嗜酸性粒细胞浸润和活化。嗜酸性粒细胞呈圆形,胞质内充满粗大、均匀、略带折光性的嗜酸性粒细胞颗粒,可以被苏木精-伊红(hematoxylin-eosinstaining,HE)染色染成橘红色,细胞核常分为2~3叶,呈凹形或肾形,着色较浅。金黄色葡萄球菌肠毒素B型(Staphylococcus aureus enterotoxin B,SEB)是金黄色葡萄球菌分泌的一种内毒素,与主要组织相容性复合物Ⅱ类和T细胞受体结合来激活免疫系统,造成T细胞的激活和促炎因子的全身释放。烟曲霉菌是另一种致病抗原,诱导鼻腔鼻窦上皮细胞释放IL-33,增强Th2型炎症[28]。
Yoon等[29]的研究证明SEB还参与ECRSwNP患者上皮细胞内质网应激反应、活性氧(reactive oxygen species,ROS)的产生、线粒体功能的破坏和鼻上皮细胞结构的变化。Kim等[30]报道SEB通过激活TLR2导致IL-6和IL-8的产生。在Didehdar等[31]的研究中,SEB可能诱导与鼻窦炎相关的低气道高敏感个体产生持续的Th2反应,Th2极化的细胞因子如IL-4可触发浆细胞产生IgE。随后,IgE覆盖的嗜酸性粒细胞可以与SEB结合并导致阳离子蛋白的释放、嗜酸性粒细胞脱颗粒和局部嗜酸性炎症。为此,有研究报道ECRSwNP患者中嗜酸性粒细胞阳离子蛋白与抗原特异性IgE呈正相关[32]。以往的研究显示金黄色葡萄球菌在中国人群的鼻腔中有定植,并且在Cheng等[33]发表的一项研究中,所有36例CRSwNP患者的鼻腔组织(鼻甲和息肉)中SEB水平均显著增加。在Cheng等[34]的研究中,嗜酸性粒细胞性CRSwNP和非嗜酸性粒细胞性CRSwNP组织与正常上皮组织相比,均观察到总IgE、SEA和SEB的增加。Okano等[35]发现将SEB作用于鼻息肉细胞时,IL-5和IL-13等细胞因子水平都有上升,这些细胞因子募集嗜酸性粒细胞,管理嗜酸性粒细胞的分化,引起嗜酸性粒细胞性炎症。Khalmuratova等[36]使用3%卵清蛋白(ovalbumins,OVA)加用10 ng SEB作用于BALB/C
小鼠来建立ECRSwNP,与使用相同剂量磷酸盐缓冲液(phosphate buffer saline,PBS)的对照组相比,实验组显示黏膜增厚并伴有息肉样病变,破骨细胞和成骨细胞以及窦壁的不规则增厚。Rouyar等[37]研究证明连续使用22周SEB加屋尘螨会诱导小鼠的Th2型炎症反应,并且通过食物埋藏试验证明影响了未成熟嗅觉神经元但不影响嗅觉。Martens等[27]使用SEB对小鼠鼻部进行刺激,观察到了鼻黏膜上皮屏障功能的损害,并降低了紧密连接蛋白1 (zona occludens1,ZO-1)和闭合蛋白(occludin,OCLN)mRNA的表达。金黄色葡萄球菌产生的肠毒素不仅可以诱导特异性IgE,还可以作为超抗原,促进T细胞释放Th2型细胞因子[38]。Shin等[39]在ECRSwNP患者中发现缺氧诱导因子1(hypoxia inducible factor 1,HIF-1)高表达,并用SEB建立的ECRSwNP模型验证了HIF-1 通路通过诱导上皮-间质转化促进了鼻息肉的发生,提出了HIF-1抑制剂或HIF-1通路可能成为治疗和预防嗜酸性粒细胞性慢性鼻窦炎的潜在靶点。
Kagoya等[40]使用卡泊三醇(calcipotrol,MC903)维生素D3的类似物,在19 d内建立了ECRSwNP小鼠模型,在此模型中嗜酸性粒细胞和M2巨噬细胞都有增加,IL-4、IL-5、IL-13、TSLP等炎症因子都有显著升高,趋化因子11(chemokine CC-motif ligand 11,CCL11)和CCL24的表达也升高。同时,在ECRSwNP小鼠模型中观察到嗅觉上皮变薄和成熟嗅觉感觉神经元减少。
总而言之,我们可以合理推测金黄色葡萄球菌分泌的SEB可能在ECRSwNP的发病机制中起重要作用,并且SEB主要诱导Th2型炎症,调节Th2型炎症因子的产生,通过抑制调节性T细胞,增强嗜酸性粒细胞和肥大细胞功能来损伤和重塑组织[41]。前列腺素E2(prostaglandin E2,PGE2)可以调节原代鼻上皮细胞对SEB刺激后嗜酸性粒细胞相关细胞因子/趋化因子的产生[42]。SEB破坏上皮细胞的完整性,抑制ZO-1和Occludin的表达,而壳聚糖-葡聚糖凝胶、PGE2、地塞米松和钙通道阻滞剂等抗炎剂可以抑制SEB诱导的促炎细胞因子,发挥抗炎作用[27]。
2.4 变应性鼻炎小鼠模型的建立
由于变应性鼻炎确切的发病机制不明,建立能够更好模拟人类变应性鼻炎的动物模型有助于研究工作的开展及深入。国内外学者已经用不同的变应原建立了多种稳定可靠的变应性鼻炎的动物模型,如Tofukuji等[43]使用特异性过敏原免疫疗法花粉病来构建小鼠过敏性鼻炎模型,该模型可有效模拟人类疾病。Takahashi等[44]用OVA建立了过敏性鼻炎的小鼠模型,国内也有用蒿属花粉变应原、蛔虫变应原、豚草花粉变应原等建立过敏性鼻炎动物模型的报道。用OVA激发小鼠造模已是一种被国内外学者广泛采取相当成熟的方法。因此选用OVA作为变应原,行腹腔注射致敏,滴鼻激发,建立小鼠过敏性鼻炎模型,经过实验证明致敏效果良好。
小鼠变应性鼻炎模型的鼻黏膜组织形态学表现为光镜下可见鼻黏膜水肿,黏膜下血管扩张,腺体增生,黏膜固有层见大量嗜酸性粒细胞及淋巴细胞浸润,纤毛有脱落现象,其与人类变应性鼻炎的病理学表现相似。激发后鼻黏膜中嗜酸性粒细胞比例增高明显。嗜酸性粒细胞在鼻黏膜内聚集和激活后,释放白三烯和血小板凝集因子,引起肥大细胞释放组胺和趋化因子,吸引更多的嗜酸性粒细胞聚集,形成一种周而复始的持续性炎症反应,这种病理变化与人类季节性变应性鼻炎花粉症的速发相和迟发相反应相似。
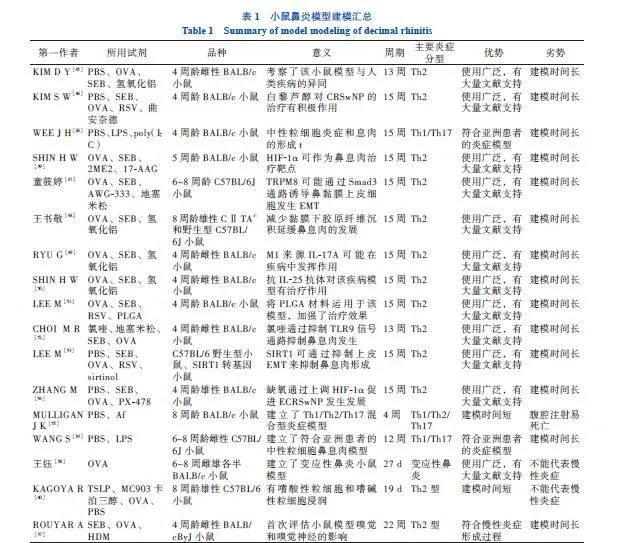
小鼠鼻炎模型建模见表1。
3 小鼠鼻窦炎模型结果检测
3.1 苏木精-伊红染色
HE染色法是石蜡包埋后切片常用的染色方法。苏木精染液为碱性,主要使细胞核内的染色质与胞质内的核酸着紫蓝色,伊红染液为酸性染料,主要使细胞质和细胞外基质中的成分着红色。在HE染色的小鼠头颅切片组织中,可以观察到上皮黏膜形态与分布,从外到内分别为纤毛层、杯状细胞层、上皮细胞层和基底层以及包裹在中心的骨骼组织。在Th2型炎症诱导的慢性鼻窦炎伴息肉中就有嗜酸性粒细胞的浸润,嗜酸性粒细胞的计数也常用于对这类疾病进行分类,若一个高倍视野下的嗜酸性粒细胞个数超过总炎症细胞的10%则为ECRSwNP[5],也是较非ECRSwNP更为严重的一个类型,其临床症状更加严重,治疗后也有更高的复发风险,因此区分ECRSwNP和非ECRSwNP是为了更好地为患者提供有效的治疗和恰当的预后,取病理组织做HE染色则是简便易行的操作流程,也是组织学、病理学与科研中最基本、使用最广泛的技术方法。在HE染色中,嗜酸性粒细胞呈现细胞核紫色分叶状,嗜酸性粒细胞的浸润与机体发挥过敏反应和防御寄生虫的作用,在小鼠鼻息肉模型建立中,HE染色也呈现跟人鼻息肉一样的特征变化。
3.2 过碘酸雪夫染色
过碘酸雪夫染色(periodic acidc shiff,PAS)是糖原染色,通常染糖原时会与酸性黏多糖产生反应呈蓝色,与中性多糖不反应。PAS染色可用于糖原的鉴定和黏液的显示,在研究中常被用来观察杯状细胞的黏液物质,计数杯状细胞的数量[19]。杯状细胞是上皮的屏障细胞,鼻息肉的形成常伴有杯状细胞和黏液细胞的增殖,因此在小鼠鼻窦炎鼻息肉模型中染色杯状细胞可以更直观地展现上皮的变化。
3.3 酶联免疫吸附试验
酶联免疫吸附试验(enzyme-linked immunoso-rbent assay,ELISA)通过抗原或抗体的固相化来量化样品中特定目标分子的含量,ELISA常用于检测包括血清、血浆、细胞培养上清液、尿液、唾液或其他液体样本,ELISA在小鼠鼻窦炎鼻息肉模型中常用于检测鼻腔灌洗液中的炎症因子水平,同时与实验干预组和人类鼻腔灌洗液中炎症因子水平进行对比。使用导管从小鼠气管开口的后方插入,收集鼻腔灌洗液至少1 mL用于ELISA检测,检测指标包括纤维细胞生长因子、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor,TGF-β)、IL-4、IL-5、IL-6、IL-10、IL-13、IL-17等各种炎症因子的水平以及血清总IgE。
3.4 天狼星红染色
嗜酸性粒细胞是炎症细胞之一,在变态反应疾病中发挥作用,嗜酸性粒细胞质中含次级颗粒,这种颗粒中主要含有碱性蛋白,比如嗜酸性粒细胞阳离子、嗜酸性粒细胞衍生神经素、嗜酸性粒细胞过氧化物酶等,这些次级颗粒可以被碱性染料着色。天狼星红染色法可以将嗜酸性粒细胞胞质染成红色,核呈蓝色,相比于HE染色着色更加强烈,对比更加明显,更容易区分组织中其他炎症细胞。因此很多研究者都曾使用天狼星红染色评估嗜酸性粒细胞的浸润,如Rouyar等[37]使用天狼星红染色法对小鼠建模组织进行染色,观察到了明显的红色细胞质的嗜酸性粒细胞浸润。
3.5 免疫荧光与免疫组化
免疫荧光是标记免疫技术中发展最早的一种。根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素,制成荧光抗体,再用这种荧光抗体(或抗原)作为探针检测组织或细胞内的相应抗体(或抗原),从而确定目标蛋白的性质、定位以及定量。通过对石蜡切片进行烤片、脱蜡复水、洗涤、抗原修复、一抗二抗孵育等步骤来制作荧光切片,检测目的蛋白的含量与表达。Ryu等[49]使用小鼠鼻窦部分石蜡切片做了免疫荧光与免疫组化,证实了IL-17A和白细胞分化抗原68 (cluster of differentiation 68,CD68)细胞计数的高表达差异。
3.6 蛋白免疫印迹
蛋白免疫印迹法(western blotting,WB)是电泳分离后的蛋白质从凝胶转移到酸纤维素膜(nitrocellulose membrane,NC)或聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,然后通过特异性抗体检测某特定蛋白的技术,可实现目标蛋白的定量分析。通过提取小鼠鼻黏膜组织蛋白,使用WB检测目的蛋白含量是一种十分有效且能证明观点的实验方法,Kim等[42]提取鼻腔组织蛋白进行WB实验测量目的蛋白的表达差异性,证明白藜芦醇不仅抑制活性氧的产生,还阻止炎症介质的释放。
3.7 实时荧光定量PCR
实时荧光定量PCR(quantitative real time PCR,
qPCR)是利用模板DNA经过变性、退火和延伸3个基本反应过程来检测目的蛋白核酸的表达,可通过对小鼠鼻部组织进行RNA的提取、逆转和扩增来确定靶基因或靶蛋白的表达水平。Kim等[45]从鼻组织中提取总RNA,使用qPCR分析发现CD19、CD138和膜辅蛋白的表达增高。
各检测方法汇总表见表2。
4 结语与展望
本文总结了近几年来CRSwNP的小鼠模型建立方法和研究现状,动物模型是研究疾病发生发展的重要工具,对挖掘慢性鼻窦炎-鼻息肉疾病的形成机制有着重要作用,为针对性治疗提供强有力的理论基础。在慢性鼻窦炎小鼠模型这方面还亟待解决的问题:目前多数文献利用的慢性鼻窦炎伴或不伴鼻息肉造模方法持续时间长达3个月,相对于其他疾病的造模时间成本太高,不利于前期药物的筛选及机制的验证。但由于鼻窦炎是慢性炎症性疾病,如果缩短造模时间,就无法更直观地呈现慢性炎症的病理过程,所以既能呈现慢性炎症又能缩短时间的动物模型研究迫在眉睫。
慢性鼻窦炎是一种多因素异质性疾病,众多科学家在近年来对其进行持续的深入研究,虽然取得了一些研究成果,提供了一部分治疗的靶点,但慢性鼻窦炎小鼠模型在国际上仍然没有金标准,各种造模方法均不能完全模拟人类慢性鼻窦炎病理生理变化过程。但相信随着学术界同仁的不懈努力,动物模型会越来越完善,具有代表性,从而接近人类慢性鼻窦炎疾病的本质。这些模型的发展将有助于我们进一步揭秘慢性鼻窦炎这一疾病的确切病理生理机制,为疾病的精准治疗及管理提供新的思路。
参 考 文 献
[1] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组. 中国慢性鼻窦炎诊断和治疗指南(2018)[J]. 中华耳鼻咽喉头颈外科杂志, 2019, 54(2): 81-100. DOI: 10.3760/cma.j.issn.1673-0860.
2019.02.001.
Subspecialty Group of Rhinology of Editorial Board of Chinese Journal of Otorhinolaryngology Head and Neck Surgery, Subspecialty Group of Rhinology of Society of Otorhinolaryngology Head and Neck Surgery of Chinese Medical Association. Chinese guidelines for diagnosis and treatment of chronic rhinosinusitis (2018)[J]. Chin J Otorhinolaryngol Head Neck Surg, 2019,
54(2): 81-100. DOI: 10.3760/cma.j.issn.1673-0860.2019.02.001.
[2] 叶海波. 慢性鼻-鼻窦炎伴鼻息肉的内在型及精准医疗研究进展[J]. 中国中西医结合耳鼻咽喉科杂志, 2018, 26(6): 475-480. DOI: 10.16542/j.cnki.issn.1007-4856.2018.06.021.
YE H B. Research progress on endotypes and precision medicine in chronic rhinosinusitis with nasal polyps[J]. Chin J Otorhinolaryngol Integr Med, 2018, 26(6): 475-480. DOI: 10.16542/j.cnki.issn.1007-4856.2018.06.021.
[3] VAID S, VAID N. Sinonasal anatomy[J].Neuroimaging Clin N Am, 2022, 32(4): 713-734. DOI:10.1016/j.nic.2022.07.007.
[4] KAKOI H, HIRAIDE F. A histological study of formation and growth of nasal polyps[J]. Acta Oto Laryngol, 1987, 103(1/2): 137-144. DOI: 10.3109/00016488709134709.
[5] FUJIEDA S, IMOTO Y, KATO Y, et al. Eosinophilic chronic rhinosinusitis[J]. Allergol Int, 2019, 68(4): 403-412. DOI:10.1016/j.alit.2019.07.002.
[6] BACHERT C, ZHANG N, HELLINGS P W, et al. Endotype-driven care pathways in patients with chronic rhinosinusitis[J]. J Allergy Clin Immunol, 2018, 141(5): 1543-1551. DOI: 10.1016/j.jaci.2018.03.004.
[7] BACHERT C, AKDIS C A. Phenotypes and emerging endotypes of chronic rhinosinusitis[J]. J Allergy Clin Immunol Pract, 2016, 4(4): 621-628. DOI: 10.1016/j.jaip.2016.05.004.
[8] HOPKINS C. Chronic rhinosinusitis with nasal polyps[J]. N Engl J Med, 2019, 381(1): 55-63. DOI: 10.1056/NEJMcp1800215.
[9] MORSE J C, MILLER C, SENIOR B. Management of chronic rhinosinusitis with nasal polyposis in the era of biologics[J]. J Asthma Allergy, 2021, 14: 873-882. DOI: 10.2147/JAA.S258438.
[10] MENG J, ZHOU P, LIU Y, et al. The development of nasal polyp disease involves early nasal mucosal inflammation and remodelling[J]. PLoS One, 2013, 8(12): e82373. DOI: 10.1371/journal.pone.0082373.
[11] BACHERT C, WAGENMANN M, HAUSER U, et al. IL-5 synthesis is upregulated in human nasal polyp tissue[J]. J Allergy Clin Immunol, 1997, 99(6 Pt 1): 837-842. DOI: 10.1016/s0091-6749(97)80019-x.
[12] BARHAM H P, COOPER S E, ANDERSON C B, et al. Solitary chemosensory cells and bitter taste receptor signaling in human sinonasal mucosa[J]. Int Forum Allergy Rhinol, 2013, 3(6): 450-457. DOI: 10.1002/alr.21149.
[13] LIU J, CHEN Y, SHUAI S, et al. TRPM8 promotes aggressiveness of breast cancer cells by regulating EMT via activating AKT/GSK-3β pathway[J]. Tumour Biol, 2014,
35(9): 8969-8977. DOI: 10.1007/s13277-014-2077-8.
[14] CAO P P, LI H B, WANG B F, et al. Distinct immunopathologic characteristics of various types of chronic rhinosinusitis in adult Chinese[J]. J Allergy Clin Immunol, 2009, 124(3): 478-484, 484.e1-484.e2. DOI: 10.1016/j.jaci.2009.05.017.
[15] ZHANG N, VAN ZELE T, PEREZ-NOVO C, et al. Different types of T-effector cells orchestrate mucosal inflammation in chronic sinus disease[J]. J Allergy Clin Immunol, 2008,
122(5): 961-968. DOI: 10.1016/j.jaci.2008.07.008.
[16] LOU H, MENG Y, PIAO Y, et al. Predictive significance of tissue eosinophilia for nasal polyp recurrence in the Chinese population[J]. Am J Rhinol Allergy, 2015, 29(5): 350-356. DOI: 10.2500/ajra.2015.29.4231.
[17] AMEDEE R G. Prevalence of polyp recurrence after endoscopic sinus surgery for chronic rhinosinusitis with nasal polyposis[J].
Am J Rhinol Allergy, 2017, 31(4): 278. DOI: 10.2500/
194589217821335822.
[18] KIM D H, JEON E J, PARK S N, et al. Effects of a tumor necrosis factor-α antagonist on experimentally induced rhinosinusitis[J]. J Biomed Biotechnol, 2011, 2011: 360457. DOI: 10.1155/2011/360457.
[19] WANG S, ZHANG H, XI Z, et al. Establishment of a mouse model of lipopolysaccharide-induced neutrophilic nasal polyps [J].
Exp Ther Med, 2017, 14(6): 5275-5282. DOI: 10.3892/etm.2017.5208.
[20] BAE J S, KIM J H, KIM E H, et al. The role of IL-17 in a lipopolysaccharide-induced rhinitis model[J]. Allergy Asthma Immunol Res, 2017, 9(2): 169-176. DOI: 10.4168/aair.
2017.9.2.169.
[21] TANG H, PANG S, WANG M, et al. TLR4 activation is required for IL-17-induced multiple tissue inflammation and wasting in mice[J]. J Immunol, 2010, 185(4): 2563-2569. DOI: 10.4049/jimmunol.0903664.
[22] FAN J, MALIK A B. Toll-like receptor-4 (TLR4) signaling augments chemokine-induced neutrophil migration by modulating cell surface expression of chemokine receptors[J]. Nat Med, 2003, 9(3): 315-321. DOI: 10.1038/nm832.
[23] GRINDLER D, THOMAS C, HALL G S, et al. The role of Steno-trophomonas maltophilia in refractory chronic rhinosinusitis[J].
Am J Rhinol Allergy, 2010, 24(3): 200-204. DOI: 10.2500/ajra.2010.24.3466.
[24] CLARKE D L, DAVIS N H E, MAJITHIYA J B, et al. Development of a mouse model mimicking key aspects of a viral asthma exacerbation[J]. Clin Sci, 2014, 126(8): 567-580. DOI: 10.1042/CS20130149.
[25] BAE J S, KIM E H, KIM J H, et al. Mouse model of IL-17-dominant rhinitis using polyinosinic-polycytidylic acid[J]. Allergy Asthma Immunol Res, 2017, 9(6): 540-549. DOI: 10.4168/aair.2017.9.6.540.
[26] WEE J H, KO Y K, KHALMURATOVA R, et al. Effect of lipopolysaccharide and polyinosinic: polycytidylic acid in a murine model of nasal polyp[J]. Sci Rep, 2021, 11(1): 1021. DOI: 10.1038/s41598-020-80483-y.
[27] MARTENS K, SEYS S F, ALPIZAR Y A, et al. Staphylococcus aureus enterotoxin B disrupts nasal epithelial barrier integrity [J].
Clin Exp Allergy, 2021, 51(1): 87-98. DOI: 10.1111/cea.
13760.
[28] DIETZ C J, SUN H, YAO W C, et al. Aspergillus fumigatus induction of IL-33 expression in chronic rhinosinusitis is PAR2-dependent[J]. Laryngoscope, 2019, 129(10): 2230-2235. DOI: 10.1002/lary.28000.
[29] YOON Y H, YEON S H, CHOI M R, et al. Altered mitochondrial functions and morphologies in epithelial cells are associated with pathogenesis of chronic rhinosinusitis with nasal polyps[J]. Allergy Asthma Immunol Res, 2020, 12(4): 653-668. DOI: 10.4168/aair.2020.12.4.653.
[30] KIM D W, KHALMURATOVA R, HUR D G, et al. Staphylococcus aureus enterotoxin B contributes to induction of nasal polypoid lesions in an allergic rhinosinusitis murine model [J].
Am J Rhinol Allergy, 2011, 25(6): e255-e261. DOI: 10.2500/ajra.2011.25.3727.
[31] DIDEHDAR M, KHOSHBAYAN A, VESAL S, et al. An overview of possible pathogenesis mechanisms of Alternaria alternata in chronic rhinosinusitis and nasal polyposis[J].
Microb Pathog, 2021, 155: 104905. DOI: 10.1016/j.micpath.2021.104905.
[32] MATSUWAKI Y, UNO K, OKUSHI T, et al. Total and antigen- (fungi, mites and staphylococcal enterotoxins) specific IgEs in nasal polyps is related to local eosinophilic inflammation[J]. Int Arch Allergy Immunol, 2013, 161(Suppl 2): 147-153. DOI: 10.1159/000350387.
[33] CHENG K J, XU Y Y, ZHOU M L, et al. Role of local allergic inflammation and Staphylococcus aureus enterotoxins in Chinese patients with chronic rhinosinusitis with nasal polyps[J]. J Laryngol Otol, 2017, 131(8): 707-713. DOI: 10.1017/S0022215117001335.
[34] CHENG K J, WANG S Q, XU Y Y. Different roles of Staphylococcus aureus enterotoxin in different subtypes of nasal polyps[J]. Exp Ther Med, 2017, 13(1): 321-326. DOI: 10.3892/etm.2016.3951.
[35] OKANO M, FUJIWARA T, HARUNA T, et al. Role of fungal antigens in eosinophilia-associated cellular responses in nasal polyps: a comparison with enterotoxin[J]. Clin Exp Allergy, 2011, 41(2): 171-178. DOI: 10.1111/j.1365-2222.2010.03584.x.
[36] KHALMURATOVA R, LEE M, PARK J W, et al. Evaluation of neo-osteogenesis in eosinophilic chronic rhinosinusitis using a nasal polyp murine model[J]. Allergy Asthma Immunol Res, 2020, 12(2): 306-321. DOI: 10.4168/aair.2020.12.2.306.
[37] ROUYAR A, CLASSE M, GORSKI R, et al. Type 2/Th2-driven inflammation impairs olfactory sensory neurogenesis in mouse chronic rhinosinusitis model[J]. Allergy, 2019, 74(3): 549-559. DOI: 10.1111/all.13559.
[38] BACHERT C, GEVAERT E. Advances in rhinitis and rhinosinusitis in 2015[J]. J Allergy Clin Immunol, 2016, 138(5):
1277-1283. DOI: 10.1016/j.jaci.2016.09.008.
[39] SHIN H W, CHO K, KIM D W, et al. Hypoxia-inducible factor 1 mediates nasal polypogenesis by inducing epithelial-to-mesenchymal transition[J]. Am J Respir Crit Care Med, 2012, 185(9): 944-954. DOI: 10.1164/rccm.201109-1706OC.
[40] KAGOYA R, KONDO K, KISHIMOTO-URATA M, et al. A murine model of eosinophilic chronic rhinosinusitis using the topical application of a vitamin D3 analog[J]. Allergy, 2021, 76(5): 1432-1442. DOI: 10.1111/all.14627.[PubMed]
[41] TEUFELBERGER A R, BRÖKER B M, KRYSKO D V, et al. Staphylococcus aureus orchestrates type 2 airway diseases[J]. Trends Mol Med, 2019, 25(8): 696-707. DOI: 10.1016/j.molmed.2019.05.003.
[42] KIM Y M, JIN J, CHOI J A, et al. Staphylococcus aureus enterotoxin B-induced endoplasmic reticulum stress response is associated with chronic rhinosinusitis with nasal polyposis[J].
Clin Biochem, 2014, 47(1/2): 96-103. DOI: 10.1016/j.
clinbiochem.2013.10.030.
[43] TOFUKUJI S, KATAYAMA K, NAKANO Y, et al. Allergen-specific sublingual immunotherapy is dose and duration dependent in a murine allergic rhinitis model[J]. J Allergy Clin Immunol, 2018, 142(6): 1977-1979.e9. DOI: 10.1016/j.jaci.2018.08.0
[44] TAKAHASHI Y, KAGAWA Y, IZAWA K, et al. Effect of histamine H4 receptor antagonist on allergic rhinitis in mice[J]. Int Immunopharmacol, 2009, 9(6): 734-738. DOI: 10.1016/j.intimp.2009.02.011.
[45] KIM D Y, LEE S H, CARTER R G, et al. A recently established murine model of nasal polyps demonstrates activation of B cells, as occurs in human nasal polyps[J]. Am J Respir Cell Mol Biol, 2016, 55(2): 170-175. DOI: 10.1165/rcmb.2016-0002RC.
[46] KIM S W, KIM D W, KHALMURATOVA R, et al. Resveratrol prevents development of eosinophilic rhinosinusitis with nasal polyps in a mouse model[J]. Allergy, 2013, 68(7): 862-869. DOI: 10.1111/all.12132.
[47] 童筱婷, 刘佩强, 周慧琴, 等. TRPM8在慢性鼻窦炎伴鼻息肉中的表达及意义[J]. 中华耳鼻咽喉头颈外科杂志, 2021, 56(10):1059-1065. DOI:10.3760/cma.j.cn115330-20210430-00243.
TONG X T, LIU P Q, ZHOU H Q, et al. The expression and significance of TRPM8 among chronic rhinosinusitis with nasal polyps[J]. Chin J Otorhinolaryngol Head Neck Surg, 2021,
56(10): 1059-1065.DOI: 10.3760/cma.j.cn115330-20210430-00243.
[48] 王书敬,李聪颖,张亚明,等.CⅡTA基因沉默小鼠鼻息肉组织中胶原纤维沉积和炎症反应的初步研究[J].河南大学学报(医学版), 2022, 41(4): 272-276. DOI: 10.15991/
j.cnki.41-1361/r.2022.04.005.
WANG S J, LI C Y, ZHANG Y M, et al. A preliminary study on collagen fibril deposition and inflammatory reaction in nasal polyps of CⅡTA gene silencing mice[J]. J Henan Univ(Med Sci), 2022, 41(4): 272-276. DOI: 10.15991/j.cnki.41-1361/r.2022.04.005.
[49] RYU G, BAE J S, KIM J H, et al. Role of IL-17A in chronic rhinosinusitis with nasal polyp[J]. Allergy Asthma Immunol Res, 2020, 12(3): 507-522. DOI: 10.4168/aair.
2020.12.3.507.
[50] SHIN H W, KIM D K, PARK M H, et al. IL-25 as a novel therapeutic t-arget in nasal polyps of patients with chronic rhinosinusitis[J]. J Allergy Clin Immunol, 2015, 135(6): 1476-1485.e7. DOI:10.1016/j.jaci.2015.01.003.
[51] LEE M, PARK C G, HUH B K, et al. Sinonasal delivery of resveratrol via mucoadhesive nanostructured microparticles in a nasal polyp mouse model[J]. Sci Rep, 2017, 7: 40249. DOI: 10.1038/srep40249.
[52] CHOI M R, XU J, LEE S, et al. Chloroquine treatment suppresses mucosal inflammation in a mouse model of eosinophilic chronic rhinosinusitis[J]. Allergy Asthma Immunol Res, 2020, 12(6): 994-1011. DOI: 10.4168/aair.2020.12.6.994.
[53] LEE M, KIM D W, YOON H, et al. Sirtuin 1 attenuates nasal polypogenesis by suppressing epithelial-to-mesenchymal transition[J]. J Allergy Clin Immunol, 2016, 137(1): 87-98.e7. DOI: 10.1016/j.jaci.2015.07.026.
[54] ZHANG M, TANG B, HUANG L, et al. Hypoxia induces the production of epithelial-derived cytokines in eosinophilic chronic rhinosinusitis with nasal polyps[J]. Int Immunopharmacol, 2023, 121: 110559. DOI: 10.1016/j.intimp.2023.110559.
[55] MULLIGAN J K, PATEL K, WILLIAMSON T, et al. C3a receptor antagonism as a novel therapeutic target for chronic rhinosinusitis[J]. Mucosal Immunol, 2018, 11(5): 1375-1385. DOI: 10.1038/s41385-018-0048-x.
[56] 王钰. Toll样受体2和Toll样受体4在小鼠变应性鼻炎中的表达[D]. 沈阳:中国医科大学, 2010.
WANG Y. Expression of Toll-like receptor 2 and Toll-like receptor 4 in murine model of allergic rhinitis[D]. Shenyang: China Medical University, 2010.
(责任编辑:郑巧兰)
