过敏性哮喘患儿螨SCIT不良反应预测模型的构建与验证
2024-11-19孙鑫雨刘长山王雪艳




【摘要】 目的 构建过敏性哮喘患儿接受螨皮下注射免疫治疗(SCIT)出现不良反应的诺莫图预测模型,并加以评估和验证。方法 回顾性分析2016年8月至2023年12月于天津医科大学第二医院儿科接受螨SCIT的过敏性哮喘患儿的病历资料。根据SCIT初始治疗阶段出现不良反应情况将其分为不良反应组和无不良反应组,2组共同组成建模组。通过单因素和多因素Logistic回归分析筛选独立危险因素,构建预测模型,绘制诺莫图,并对模型进行评估和验证。结果 共纳入350例患儿,不良反应组176例,无不良反应组174例。对患儿的基线资料进行单因素Logistic回归分析,结果显示,性别、年龄、近1年哮喘急性发作次数、嗜酸性粒细胞百分比(EOS%)、第一秒用力呼气容积占预计值百分比(FEV1%pred)、总IgE(tIgE)、屋尘螨(Der p)特异性IgE(sIgE)、粉尘螨(Der f)sIgE、其他吸入性过敏原种类数是SCIT不良反应发生的危险因素(均P < 0.1)。将其纳入多因素Logistic回归分析,结果显示,年龄、近1年哮喘急性发作次数、tIgE、Der p sIgE、Der f sIgE、其他吸入性过敏原种类数是独立危险因素(P均< 0.05),基于此结果绘制诺莫图。绘制受试者操作特征曲线进行模型评价,曲线下面积为0.877(灵敏度73.9%,特异度90.8%),且预测概率与实际发生概率一致性较好,内部验证表明该模型具有较好的预测效能。结论 年龄、近1年哮喘急性发作次数、tIgE、Der p sIgE、Der f sIgE、其他吸入性过敏原种类数为儿童螨SCIT不良反应的独立危险因素,基于此绘制的诺莫图具有较好的预测价值。
【关键词】 过敏原免疫治疗;皮下注射免疫治疗;不良反应;过敏性哮喘;儿童;诺莫图;预测模型
Construction and validation of a predictive model for adverse reactions to mite subcutaneous immunotherapy in children with allergic asthma
SUN Xinyu1, LIU Changshan1,2, WANG Xueyan1,2
(1.Department of Pediatrics, the Second Hospital of Tianjin Medical University, Tianjin 300211, China; 2.Pediatric Respiratory and Asthma Research Center, Tianjin Medical University, Tianjin 300211, China)
Corresponding author: WANG Xueyan, E-mail: wxy1008@126.com
【Abstract】 Objective To construct a nomogram prediction model for adverse reactions of mite subcutaneous immunotherapy
(SCIT) in children with allergic asthma, and to evaluate and validate it. Methods Clinical data of children with allergic asthma who were managed by mite SCIT in Department of Pediatrics, the Second Hospital of Tianjin Medical University were retrospectively analyzed. According to the adverse reactions in the initial treatment stage of SCIT, they were divided into adverse reaction group and no adverse reaction group, which together formed the modeling group. Through univariate logistic regression analysis and multivariate logistic regression analysis, independent risk factors were screened out. Then construct the prediction model, draw a nomogram, eventually evaluate and validate the model. Results A total of 350 children were included, including 176 in the adverse reaction group and 174 in the no adverse reaction group. Univariate logistic regression analysis was performed on the baseline data of the children in the modeling group, and the results were as follows. Gender, age, number of asthma exacerbations in the past 1 year, percentage of eosinophils (EOS%), forced expiratory volume in the first second in percent predicted values(FEV1%pred), total IgE(tIgE), dermatopQnLqO3HbKwt/qBon850GUriU6q7TZMwu0PKH6Gs9Amo=hagoides pteronyssinus (Der p) sIgE, dermatophagoides farinae (Der p) sIgE, and the number of other inhaled allergenic species were the risk factors of SCIT-related adverse reactions (all P < 0.1). These were included in the multivariate logistic regression analysis, and the results showed that: age, the number of asthma exacerbations in the past 1 year , tIgE, Der p sIgE, Der f sIgE, and the number of other inhaled allergen species were independent risk factors (all P < 0.05). Based on the results, nomogram was drawn in R language. Model evaluation by receiver operating characteristic curve showed an area under curve of 0.877, a predictive model sensitivity of 73.9%, and a specificity of 90.8%. The predicted probability was consistent with actual probability of occurrence. The model has good prediction performance. Conclusions Age, number of asthma exacerbations in the past 1 year, tIgE, Der p sIgE, Der f sIgE, and the number of other inhaled allergen species were independent risk factors for adverse reactions to mite SCIT in children. The nomogram drawn in this study has good predictive value.
【Key words】 Allergen immunotherapy; Subcutaneous immunotherapy; Adverse reactions; Allergic asthma; Children;
Nomogram; Predictive model过敏原免疫治疗(allergen immunotherapy,AIT)是治疗过敏性疾病的有效方法,与过敏性疾病的常规治疗方法不同,AIT的免疫作用会随着时间的推移持续存在,即再次接触过敏原时不会出现症状,即使停药后也是如此[1-2]。已有证据证实,AIT可以降低新发过敏原致敏的风险,并可预防过敏性鼻炎(allergic rhinitis,AR)进一步发展为哮喘[3]。
迄今为止,学者们已研究出了多种AIT给药方式,包括舌下含服免疫治疗(sublingual immun-otherapy,SLIT)、皮下注射免疫治疗(subcutaneous immunotherapy,SCIT)、口服免疫治疗、支气管免疫治疗、鼻腔免疫治疗、表皮免疫治疗和淋巴结内免疫治疗[4]。SLIT和SCIT是目前较常用的2种给药方式,两者均能给患者带来长期的临床益处,且耐受性良好[5-7]。SLIT给药途径方便、不良反应发生率低,但患者依从性不佳。研究报道中国AR患者SLIT的人均不良反应发生率为8.4%~27.7%,多属于轻微的局部不良反应(local adverse reactions,LRs),可在数日内自行缓解,严重全身反应发生率较低[8]。SCIT的LRs发生率为26%~86%,全身不良反应(systemic adverse reactions,SRs)的发生率为1.9%~5.2%,主要发生在剂量递增阶段[9-10],这使SCIT的应用受到了限制。不少SCIT不良反应风险的研究已揭示其相关危险因素,但不同研究之间的结果不尽相同,且多为单一指标,对于临床的指导作用有限,目前仍缺乏综合的、更高效率的预测SCIT不良反应发生风险的方法[11]。因此,本研究旨在收集SCIT不良反应相关数据建立预测模型,以期为临床评估SCIT的安全性提供指导。
1 对象与方法
1.1 研究对象
选取2016年8月至2023年12月于天津医科大学第二医院儿科接受螨SCIT的过敏性哮喘患儿为研究对象。纳入标准:①年龄≥5岁;②符合儿童支气管哮喘及过敏性哮喘的诊断标准[12];③螨过敏原检测阳性,血清总IgE(total IgE,tIgE)水平> 30.00 kU/L,屋尘螨(dermatophagoides pteronyssinus,Der p)或粉尘螨(dermatophagoides farinae,Der f)皮肤点刺试验(skin prick test,SPT)结果为(++)及以上,或特异性IgE(specific IgE,sIgE)水平≥
0.35 kU/L(1级及以上),且尘螨——Der p和(或)Der f为主要过敏原;④接受螨SCIT治疗且进入螨SCIT维持治疗阶段;⑤病历资料完整;⑥患儿依从性良好,能够配合完成肺通气功能、呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)、SPT等检查。排除标准:①曾接受过生物制剂(如奥马珠单抗、度普利尤单抗)等治疗;②合并肝损害或肾损害,患有严重的心血管疾病、免疫系统疾病、恶性肿瘤及精神障碍者。本研究通过天津医科大学第二医院医学伦理委员会批准(批件号:KY2020K097),患儿监护人均签署知情同意书。
1.2 研究方法
收集患儿的基线临床资料、实验室及辅助检查数据,包括性别、年龄、哮喘病程、近1年哮喘急性发作次数、吸入性糖皮质激素(inhaled corticosteroid,ICS)用量(均换算成布地奈德等效量)、共患病情况、外周血嗜酸性粒细胞百分比(eosinophil-lymphocyte percentage,EOS%)、肺功能、FeNO、SPT、体外过敏原等,记录螨SCIT初始治疗阶段出现不良反应情况。
根据《过敏原皮下免疫治疗不良反应防治专家共识(2023年,重庆)》[10],直径较大的LRs可能增加未来SRs的风险,故本研究将初始治疗阶段任意一次出现直径≥5 cm的LRs和(或)SRs的患儿纳入不良反应组,未出现不良反应和(或)LRs的直径< 5 cm的患儿纳入无不良反应组,两者共同组成建模组。
1.3 统计学方法
采用SPSS 26.0、R 4.3.1软件进行统计分析,构建诺莫图预测模型。采用受试者操作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)和Hosmer-Lemeshow检验
(拟合优度检验)对预测模型进行区分度、校准度检验,使用Bootstrap方法对预测模型进行内部验证。P < 0.05为差异有统计学意义。
1)统计描述及相应的统计学处理
服从正态分布计量资料采用表示,组间比较采用独立样本t检验;非正态分布计量资料采用M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验。计数资料采用n(%)表示,组间比较采用χ 2检验或Fisher确切概率法。定义因变量“结局”无不良反应为“0”,出现不良反应为“1”,定义“性别”男为“0”,女为“1”。
2)单因素及多因素Logistic回归分析
首先在建模组进行单因素Logistic回归分析,为防止有意义的变量被剔除,此处定义P < 0.1为差异有统计学意义。
将单因素分析中有统计学意义的变量纳入多因素Logistic回归分析,对多分类变量进行赋值并设置哑变量。
3)构建诺莫图预测模型
筛选出多因素Logistic回归分析中有统计学意义的独立影响因素,并利用R 4.3.1软件绘制诺莫图,将结果可视化。
4)预测模型的评估与验证
区分度:采用ROC曲线并计算AUC。若AUC >
0.7,认为模型有一定区分度,可接受;若AUC为0.7~0.9,认为模型区分度处于中等水平;若AUC >
0.9,认为模型区分度较高。
校准度:采用Hosmer-Lemeshow拟合优度检验及绘制校准曲线来评估。Hosmer-Lemeshow拟合优度检验所得统计量χ 2值越小,对应P值越大,P > 0.05认为实际结果和预测结果之间没有显著差异,模型校准度较好。
采用Bootstrap法进行内部验证。从原始样本中有放回地抽取多个样本,每个样本大小与原始样本相同,生成多个样本子集,逐一进行模型评估。绘制校准曲线将结果可视化,以曲线和45度参考线之间的距离来表明模型的校准度,若完全重合,提示预测概率和实际概率完全一致。
2 结 果
2.1 一般资料
共纳入350例过敏性哮喘患儿,男214例(61.1%)、女136例(38.9%),年龄(8.2±2.8)岁;不良反应组176例(50.3%),无不良反应组174例(49.7%)。
2.2 螨SCIT不良反应的影响因素分析
对建模组中19个变量进行多重共线性分析,结果显示VIF均< 10。进行单因素Logistic回归分析,变量包括性别、年龄、病程、共患病、近1年哮喘急性发作次数、儿童哮喘控制测试(childhood asthma control test,C-ACT)/ACT、视觉模拟量表(visual analog scale,VAS)评分、EOS%、ICS用量、第1秒用力呼气容积占预计值百分比(forced expiratory volume in the first second in percent predicted values,FEV1%pred)、呼气峰值流量占预计值百分比(large expiratory flow as a percentage in percent predicted values,PEF%pred)、最大呼气中段流量占预计值百分比(maximum mid-expiratory flow as a percentage in percent predicted values,MMEF%pred)、用力呼出50%肺活量时的瞬间流量占预计值的
百分比(forced expiratory flow at 50% of forced vital capacity,FEF50%pred)、用力呼出75%肺活量时的瞬间流量占预计值的百分比(forced expiratory flow at 75% of forced vital capacity,FEF75%pred)、FeNO、tIgE、Der p sIgE、Der f sIgE、其他吸入性过敏原种类数。结果显示,性别、年龄、近1年哮喘急性发作次数、EOS%、FEV1%pred、tIgE、Der p sIgE、Der f sIgE、其他吸入性过敏原种类数共9个变量有统计学意义(P均< 0.1)。见表1。
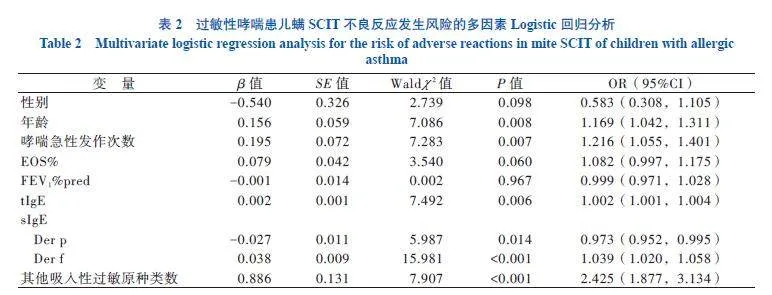
对筛选出的9个变量进行多因素Logistic回归分析,结果显示,年龄(OR = 1.169,95% CI 1.042~1.311,P = 0.008)、近1年哮喘急性发作次数(OR = 1.216,95% CI 1.055~1.401,P = 0.007)、tIgE(OR = 1.002,95% CI 1.001~1.004,P = 0.006)、Der p sIgE(OR = 0.973,95% CI 0.952~0.995,P = 0.014)、Der f sIgE(OR = 1.039,95% CI 1.020~1.058,
P < 0.001)、其他吸入性过敏原种类数(OR = 2.425,95% CI 1.877~3.134,P < 0.001)共6个变量有统计学意义,为螨SCIT出现不良反应的独立影响因素,表明年龄越大、近1年哮喘急性发作次数越多、tIgE水平越高、Der p sIgE水平越低、Der f sIgE水平越高、其他吸入性过敏原种类数越多,接受螨SCIT时不良反应的发生风险越大。见表2。
2.3 构建螨SCIT不良反应的诺莫图预测模型
根据单因素和多因素Logistic回归分析结果,利用年龄、近1年哮喘急性发作次数、tIgE、Der p sIgE、Der f sIgE、其他吸入性过敏原种类数建立预测模型,并绘制诺莫图。见图1。诺莫图由积分线、各预测变量线、总分线及预测概率线段组成,线段长度表示每个预测变量对结局事件的贡献大小,根据各变量值作一垂直线到积分线,得到相应取值并计算总分,在总分线向下作一垂直线到预测概率线,得到对应的发生概率。
2.4 评估并验证预测模型
通过绘制ROC曲线评估预测模型的区分度,结果显示,该模型AUC为0.877,灵敏度为73.9%,特异度为90.8%,表明该模型具有良好的区分度和预测能力。见图2。Hosmer-Lemeshow拟合优度检验中,实际螨SCIT相关不良反应的发生概率与预测中该概率相比,差异无统计学意义(χ 2 =13.779,P = 0.088)。
由于本研究没有外部验证数据集,因此使用内部验证的方法来进行预测模型的稳健性检验,使用Bootstrap抽样方法,重复抽样1 000次,对模型进行内部验证,结果表明实际模型拟合结果与预期模型拟合结果、偏倚校正结果的曲线皆均匀地浮动在对角线附近,模型的稳健性较好。见图3。
3 讨 论
SCIT是目前治疗IgE介导的儿童和成人过敏性疾病的唯一对因治疗方法,能为患者带来短期和长期疗效,改变过敏性疾病的自然进程,并且在停药后仍可持续[13]。已有大量的临床研究评估了SCIT和SLIT在儿童中的疗效和安全性[14]。虽然SCIT一般耐受性良好,但也可能出现LRs和SRs,甚至出现危及生命的严重过敏反应[15]。据报道,SCIT常规注射方案每次注射的SRs发生率为0.1%~0.2%[16-17]。
在SCIT中,大多数不良反应为注射部位的局部反应,如发红、瘙痒或肿胀[18]。局部措施(如降温、局部给予糖皮质激素)或口服抗组胺药有助于缓解这些反应。如果LRs范围扩大,应根据产品特性考虑调整下一剂注射剂量[19]。SRs(如哮喘、血管性水肿、全身性荨麻疹、全身过敏反应)见于约2%的SCIT患者,虽然较为罕见,但由SCIT引起的致命或近乎致命的SRs已有报道[20]。因此,识别可能增加SCIT不良反应发生风险的因素至关重要。
众所周知,不受控制的哮喘可预测SRs,但一些研究结果表明,过敏原类型、敏感性高、注射次数、免疫治疗阶段、疾病类型、季节性接触、既往LRs及给药错误等因素均对SRs有不同程度的影响[11, 13, 21]。加拿大过敏与临床免疫学会发布的《2016 年免疫治疗手册》总结了几个风险因素,包括未控制的哮喘和(或)FEV1< 70%、既往SCIT出现SRs、用新提取物瓶注射的SCIT、同时使用β-受体阻滞剂治疗,以及给药错误,如肌内注射或剂量错误[22]。欧洲过敏与临床免疫学会关于过敏性鼻结膜炎AIT的指南指出,SCIT不良反应的危险因素主要有儿童、伴有哮喘、空腹或过量饮酒、剧烈运动、热水浴、情绪应激等可能加速过敏原吸收的患者自身因素及注射剂量上升等过敏原因素[23]。
尽管对SCIT不良反应发生风险的研究众多,但目前尚无明确的预测方法,并且针对儿童人群的研究并不多[16, 24]。本研究以儿童为研究对象,通过查阅文献,选取与SCIT不良反应相关临床指标进行单因素和多因素Logistic回归分析,结果显示,年龄、近1年哮喘急性发作次数、tIgE、Der p sIgE、Der f sIgE、其他吸入性过敏原种类数为SCIT不良反应发生的独立危险因素。本研究多因素Logistic回归分析显示年龄与螨SCIT不良反应呈正相关,然而Duman等[25]进行的一项研究显示SCIT不良反应(尤其是LRs)在12岁以下患有过敏性哮喘或鼻炎的儿童中更为常见,与本研究结果并不一致,考虑其原因可能受SCIT初始治疗阶段给药频率的影响,且年长儿对不良反应更为敏感,也不排除依从性欠佳的原因,对此需要对患儿及家属加强风险教育、提高依从性。此外,本研究结果显示Der p sIgE与螨SCIT不良反应呈负相关,而Der f sIgE则与其呈正相关,这与理论及既往研究不符[26],不排除样本量较少的原因。此外,本研究同时分析了Der p sIgE和Der f sIgE,而原始数据中Der f sIgE均值大于Der p sIgE,这可能会对Der p sIgE结果分析产生影响,后续需要进一步完善研究设计,对两者进行综合分析。
对SCIT不良反应的风险因素进行分析有助于准确筛选高危患儿,为开发SCIT个体化治疗提供依据。基于此,以患儿的基线临床特征和相关辅助检查为核心指标,本研究建立了螨SCIT相关不良反应的诺莫图预测模型,首次将危险因素可视化,并加以评估和验证,为临床实际应用提供了便捷。该模型能更加精确地预测过敏性哮喘患儿接受螨SCIT后的不良反应发生风险。
本研究的研究对象为尘螨致敏的患儿,有研究显示不同过敏原提取物的不良反应发生率有一定差异[25],因此,在未来开展范围更广的SCIT研究时,排除了制剂自身溶媒等因素的影响后,可对不同制剂的不良反应情况及疗效进行统计分析,这或可为多重过敏患儿选择脱敏类别提供参考。
通过对SCIT不良反应的分析,许多研究者提出了预防措施。美国的一项研究报告显示,2008年至2017年,15%的SRs发生在SCIT皮下注射后的31~60 min,仅0.5%发生在60 min后,这表明给药后的严密观察非常重要[24]。在一项针对中重度过敏性哮喘患儿的回顾性研究中,Har等[27]比较了单用SCIT、SCIT联合奥马珠单抗和单用奥马珠单抗的治疗方案,结果显示,SCIT联合奥马珠单抗治疗的患者出现SRs的比例明显降低。因此,奥马珠单抗与AIT联合治疗可能是避免重症哮喘患者出现SRs的有效方法。美国过敏、哮喘和免疫学会、欧洲过敏与临床免疫学会以及加拿大过敏与临床免疫学会概述了降低过敏风险的策略,包括对有症状的哮喘进行常规筛查、避免给呼吸道感染、发烧或过敏性鼻结膜炎症状严重加重的患者注射、避免在过敏原高峰季节增加和(或)减少剂量、注射前至少1 h以及注射后至少2 h内避免剧烈运动[22, 28-29]。通过分析本研究结果,建议哮喘症状未得到充分控制者需谨慎接受SCIT治疗。
AIT是针对过敏性疾病的一项重要的个体化治疗方法,并仍在不断发展。欧洲建立了一项前瞻性、观察性、多中心、基于网络的AIT登记册[30],旨在记录并解决临床实践中AIT的安全性问题。鉴于此,我国同样需要类似的全国范围的登记方式,利用网络化操作,综合各地区数据,进行符合我国人口特征的大规模且可信的研究,制定未来的建议,及早识别和适当管理可预防的风险因素,减少出现限制AIT使用的不良反应的发生率,从而提高患者的依从性。
本研究存在一定局限性:①大面积局部不良反应被认为与随后出现的SRs有关[31],但本研究仅以有无不良反应为结局指标,未探讨不良反应的进展情况。②综合既往研究结果,SCIT不良反应多发生于注射剂量递增阶段[23],故本研究随访时间为SCIT初始治疗阶段,对于药物浓度未做进一步分级,此外有研究表明SRs多发生于初始治疗阶段中后期及维持治疗阶段[32],但本研究缺乏对维持治疗阶段的探讨。
综上所述,过敏性哮喘患儿年龄越大、近1年哮喘急性发作次数越多、tIgE水平越高、Der p sIgE水平越低、Der f sIgE水平越高、其他吸入性过敏原种类数越多,在接受螨SCIT时不良反应的发生风险越高。基于该风险因素建立的诺莫图预测模型有助于筛选高危患儿,有助于提前采取预防措施,制定SCIT个体化治疗方案。
参 考 文 献
[1] PAVÓN-ROMERO G F, PARRA-VARGAS M I, RAMÍREZ-JIMÉNEZ F, et al. Allergen immunotherapy: current and future trends[J]. Cells, 2022, 11(2): 212. DOI: 10.3390/cells11020212.
[2] 张萍萍, 杨丽芬, 梁英, 等. 儿童变应原免疫治疗的临床应用进展[J]. 新医学, 2022, 53(2): 87-92. DOI: 10.3969/j.issn.0253-9802.2022.02.003.
ZHANG P P, YANG L F, LIANG Y, et al. Research progress on clinical application of allergen immunotherapy in children[J].
J New Med, 2022, 53(2): 87-92. DOI: 10.3969/j.issn.0253-
9802.2022.02.003.
[3] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组. 变应性鼻炎诊断和治疗指南(2015年, 天津)[J]. 中华耳鼻咽喉头颈外科杂志, 2016, 51(1): 6-24. DOI: 10.3760/cma.j.issn.1673-0860.
2016.01.004.
The Editorial Committee of Otorhinolaryngology-Head and Neck Surgery of China, Rhinology Group of the Otorhinolaryngology-Head and Neck Surgery Branch of the Chinese Medical Association.Guidelines for diagnosis and treatment of allergic rhinitis(2015, Tianjin)[J]. Chin J Otorhinolaryngol Head Neck Surg, 2016, 51(1): 6-24. DOI: 10.3760/cma.j.issn.1673-
0860.2016.01.004.
[4] HESSE L, OUDE ELBERINK J N G, VAN OOSTERHOUT A J M, et al. Allergen immunotherapy for allergic airway diseases: use lessons from the past to design a brighter future[J].
Pharmacol Ther, 2022, 237: 108115. DOI: 10.1016/j.pharmthera.
2022.108115.
[5] DURHAM S R, EMMINGER W, KAPP A, et al. SQ-standardized sublingual grass immunotherapy: confirmation of disease modification 2 years after 3 years of treatment in a randomized trial[J]. J Allergy Clin Immunol, 2012, 129(3): 717-725.e5. DOI: 10.1016/j.jaci.2011.12.973.
[6] DIDIER A, WORM M, HORAK F, et al. Sustained 3-year efficacy of pre- and coseasonal 5-grass-pollen sublingual immunotherapy tablets in patients with grass pollen-induced rhinoconjunctivitis[J]. J Allergy Clin Immunol, 2011, 128(3): 559-566. DOI: 10.1016/j.jaci.2011.06.022.
[7] DURHAM S R, EMMINGER W, KAPP A, et al. Long-term clinical efficacy in grass pollen-induced rhinoconjunctivitis after treatment with SQ-standardized grass allergy immunotherapy tablet[J]. J Allergy Clin Immunol, 2010, 125(1): 131-138.e1-7. DOI: 10.1016/j.jaci.2009.10.035.
[8] DE FILIPPO M, VOTTO M, CAMINITI L, et al. Safety of allergen-specific immunotherapy in children[J]. Pediatr Allergy Immunol, 2022, 33 (Suppl 27): 27-30. DOI: 10.1111/pai.
13622.
[9] EPSTEIN T G, LISS G M, MURPHY-BERENDTS K, et al. AAAAI/ACAAI surveillance study of subcutaneous immunotherapy, years 2008-2012: an update on fatal and nonfatal systemic allergic reactions[J]. J Allergy Clin Immunol Pract, 2014, 2(2): 161-167. DOI: 10.1016/j.jaip.2014.01.004.
[10] 杨玉成, 沈暘, 王向东, 等. 过敏原皮下免疫治疗不良反应防治专家共识(2023年, 重庆)[J]. 中华耳鼻咽喉头颈外科杂志, 2023, 58(7): 643-656. DOI: 10.3760/cma.j.cn115330-
20221111-00679.
YANG Y C, SHEN Y, WANG X D, et al. Expert consensus on prevention and treatment of adverse reactions of allergen subcutaneous immunotherapy (2023, Chongqing)[J]. Chin J Otorhinolaryngol Head Neck Surg, 2023, 58(7): 643-656. DOI: 10.3760/cma.j.cn115330-20221111-00679.
[11] DI BONA D, MAGISTÀ S, MASCIOPINTO L, et al. Safety and treatment compliance of subcutaneous immunotherapy: a 30-year retrospective study[J]. Respir Med, 2020, 161: 105843. DOI: 10.1016/j.rmed.2019.105843.
[12] 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南(2016年版)[J]. 中华儿科杂志, 2016, 54(3): 167-181. DOI: 10.3760/cma.j.issn.0578-1310.2016.03.003.
Pediatric Respiratory Group of the Chinese Medical Association, Editorial Committee of Chinese Journal of Pediatrics.Guidelines for diagnosis, prevention and treatment of bronchial asthma in children (2016 edition)[J]. Chin J Pediatr, 2016, 54(3): 167-181. DOI: 10.3760/cma.j.issn.0578-1310.2016.03.003.
[13] MONTSERRAT A L, AKDIS CEZMI A, MUBECCEL A, et al.
EAACI allergen immunotherapy user’s guide[J]. Pediatr Allergy Immunol, 2020, 31 (Suppl 25):1-101.
[14] PAJNO G B, BERNARDINI R, PERONI D, et al. Clinical practice recommendations for allergen-specific immunotherapy in children: the Italian consensus report[J]. Ital J Pediatr, 2017, 43(1): 13. DOI: 10.1186/s13052-016-0315-y.
[15] NELSON H S. Current and future challenges of subcutaneous and sublingual allergy immunotherapy for allergists in the United States[J]. Ann Allergy Asthma Immunol, 2018, 121(3): 278-280. DOI: 10.1016/j.anai.2017.12.013.
[16] CALDERÓN M A, VIDAL C, DEL RÍO P R, et al. European survey on adverse systemic reactions in allergen immunotherapy (EASSI): a real-life clinical assessment[J]. Allergy, 2017,
72(3): 462-472. DOI: 10.1111/all.13066.
[17] EPSTEIN T G, LISS G M, MURPHY-BERENDTS K, et al. Risk factors for fatal and nonfatal reactions to subcutaneous immunotherapy: national surveillance study on allergen immunotherapy(2008-2013)[J]. Ann Allergy Asthma Immunol, 2016, 116(4): 354-359.e2. DOI: 10.1016/j.anai.2016.02.001.
[18] DHAMI S, NURMATOV U, ARASI S, et al. Allergen immunotherapy for allergic rhinoconjunctivitis: a systematic review and meta-analysis[J]. Allergy, 2017, 72(11): 1597-1631. DOI: 10.1111/all.13201.
[19] AGACHE I, LAU S, AKDIS C A, et al. EAACI guidelines on allergen immunotherapy: house dust mite-driven allergic asthma[J]. Allergy, 2019, 74(5): 855-873. DOI: 10.1111/all.13749.
[20] AMIN H S, LISS G M, BERNSTEIN D I. Evaluation of near-fatal reactions to allergen immunotherapy injections[J]. J Allergy Clin Immunol, 2006, 117(1): 169-175. DOI: 10.1016/j.jaci.2005.10.010.
[21] EPSTEIN T G, LISS G M, BERENDTS K M, et al. AAAAI/ACAAI subcutaneous immunotherapy surveillance study(2013-2017): fatalities, infections, delayed reactions, and use of epinephrine autoinjectors[J]. J Allergy Clin Immunol Pract, 2019, 7(6): 1996-2003.e1. DOI: 10.1016/j.jaip.2019.01.058.
[22] AUE A, HO J, ZHU R, et al. Systemic reactions to subcutaneous allergen immunotherapy: real-world cause and effect modelling [J].
Allergy Asthma Clin Immunol, 2021, 17(1): 65. DOI: 10.1186/s13223-021-00566-x.
[23] ROBERTS G, PFAAR O, AKDIS C A, et al. EAACI guidelines on allergen immunotherapy: allergic rhinoconjunctivitis[J]. Allergy, 2018, 73(4): 765-798. DOI: 10.1111/all.13317.
[24] BERNSTEIN D I, EPSTEIN T E G. Safety of allergen immunotherapy in North America from 2008-2017: lessons learned from the ACAAI/AAAAI national surveillance study of adverse reactions to allergen immunotherapy[J]. Allergy Asthma Proc, 2020, 41(2): 108-111. DOI: 10.2500/aap.
2020.41.200001.
[25] DUMAN SENOL H, TOPYILDIZ E, EKICI B, et al. Effectiveness and adverse reactions to subcutaneous immunotherapy in children with allergic rhinitis/asthma[J]. Int J Pediatr Otorhinolaryngol, 2022, 162: 111292. DOI: 10.1016/j.ijporl.2022.111292.
[26] YUENYONGVIWAT A, JINTANAPANYA N, SANGSUPAW-ANICH P, et al. Safety of House Dust Mite Subcutaneous Immunotherapy with a rush and cluster combination protocol in the build-up phase[J]. Asian Pac J Allergy Immunol, 2023. DOI: 10.12932/AP-260922-1465.
[27] HAR D, LEE M J. Systemic reaction rates with omalizumab, subcutaneous immunotherapy, and combination therapy in children with allergic asthma[J]. Allergy Asthma Proc, 2019, 40(1): 35-40. DOI: 10.2500/aap.2019.40.4173.
[28] COX L, NELSON H, LOCKEY R, et al. Allergen immunotherapy: a practice parameter third update[J]. J Allergy Clin Immunol, 2011, 127(1 Suppl): S1-S55. DOI: 10.1016/j.jaci.2010.09.034.
[29] BURKS A W, CALDERON M A, CASALE T, et al. Update on allergy immunotherapy: American Academy of Allergy, Asthma & Immunology/European Academy of Allergy and Clinical Immunology/PRACTALL consensus report[J]. J Allergy Clin Immunol, 2013, 131(5): 1288-1296.e3. DOI: 10.1016/j.jaci.2013.01.049.
[30] ASLLANI J, MITSIAS D, KONSTANTINOU G, et al. Adverse events in children and adolescents undergoing allergen immunotherapy for respiratory allergies-Report from the Allergen Immunotherapy Adverse Events Registry (ADER), a European Academy of Allergy and Clinical Immunology taskforce[J]. Clin Transl Allergy, 2023, 13(6): e12250. DOI: 10.1002/clt2.12250.
[31] ROY S R, SIGMON J R, OLIVIER J, et al. Increased frequency of large local reactions among systemic reactors during subcutaneous allergen immunotherapy[J]. Ann Allergy Asthma Immunol, 2007, 99(1): 82-86. DOI: 10.1016/S1081-1206(10)60626-6.
[32] 曹原, 郅莉莉, 王倩, 等. 变应原特异性免疫治疗致全身不良反应的观察及防控管理[J]. 中国医院药学杂志, 2021, 41(22): 2334-2337. DOI: 10.13286/j.1001-5213.2021.22.11.
CAO Y, ZHI L L, WANG Q, et al. Observations and preventions of systemic adverse reactions caused by allergen-specific immunotherapy[J]. Chin J Hosp Pharm, 2021, 41(22): 2334-2337. DOI: 10.13286/j.1001-5213.2021.22.11.
(责任编辑:洪悦民)
