纤维素降解菌的筛选、鉴定及其秸秆降解效果
2024-11-07司海丽纪立东李晓慧朱英郭永婷秦丽莉李磊刘菊莲尚红莺



摘要:为加速畜禽粪便和农作物秸秆的快速腐熟,筛选高效纤维素降解菌,为研制适宜宁夏本土堆肥发酵的有机物料腐熟剂奠定基础。试验从宁夏不同区域牛羊粪堆肥、沟渠、林土采集样品,通过对样品中纤维素降解菌的富集、分离、纯化,经刚果红染色、纤维素酶活性测定、滤纸条降解及水稻秸秆降解试验,筛选出本土纤维素降解菌并鉴定。结果表明,经过分离筛选得到3株效果最好的菌株,分别命名为X-32、HX-5、G3,纤维素酶活性分别为111.46、74.12和66.23 U/mL。其中,菌株X-32能使滤纸条在60 h内完全降解,通过水稻秸秆降解试验表明发酵21 d时,各个菌株对水稻的降解率均显著高于CK,其中,X-32、HX-5、G3菌株对水稻降解率分别为48.26%、43.01%、23.33%。对2株优势降解菌株X-32、HX-5进行分子生物学鉴定,确定X-32菌株为Paenibacillus polymyxa(多黏类芽孢杆菌),HX-5菌株为Bacillus velezensis(贝莱斯芽孢杆菌),可用于适宜宁夏本土有机物料腐熟剂开发。
关键词:纤维素降解菌;酶活性;秸秆;堆肥
中图分类号:S182 文献标志码:A
文章编号:1002-1302(2024)18-0277-07
收稿日期:2023-07-21
基金项目:宁夏自然科学基金(编号:2022AAC03450);自治区农业科技自主创新专项(编号:NKYJ-22-02);宁夏回族自治区农业高质量发展和生态保护科技创新示范项目(编号:NGSB-2021-11-07)。
作者简介:司海丽(1988—),女,宁夏银川人,硕士,农艺师,主要从事农业微生物筛选与应用方面的研究。E-mail:sihaili_0427@163.com。
通信作者:纪立东,博士,副研究员,主要从事农业废弃物利用与新型肥料研发方面的研究。E-mail:jili521010@163.com。
近年来,宁夏回族自治区畜禽养殖业迅猛发展,宁夏已成为我国重要的优势畜牧业生产基地。2020年,宁夏畜禽存栏总量达2 044.4万头(万只、万羽),折合猪当量1 158.0万头(测算依据《畜禽粪污土地承载力测算技术指南》[1]),与“十二五末”相比,增加了325.3万头。快速增加的畜禽养殖给生态环境带来了严重污染,宁夏畜禽养殖污染物产生量和排放量分别占农业源污染的99.1%和88.3%[2-3]。“十四五”期间,宁夏畜禽养殖产能进一步提升,预计在“十四五”末,宁夏奶牛养殖量要达到110万头。因此,畜禽粪便产生量将持续增加,势必对生态环境安全构成极大威胁。
高温好氧堆肥是畜禽粪便肥料化利用的重要方式。堆肥是在一定条件下,通过微生物的发酵作用,将有机固体废弃物转变成有机肥料的生物化学处理过程[4]。堆肥过程中的物质转化主要是由不稳定的有机物质向稳定的无机物质或有机物质-腐殖质转化的过程。但纤维素作为粪便的主要成分,在畜禽粪便中结构复杂、含量丰富、微生物降解效果受限,严重阻碍堆肥化进程[5],因此如何加速纤维素的降解是提高堆肥效率的关键。微生物作为堆肥过程的工作主体,其代谢活动直接影响物质转化速率,而且微生物对木质纤维素的降解效果也是堆肥充分腐熟的关键[6-7],因此,筛选适宜的纤维素降解菌用于堆肥快速高效发酵十分必要。纤维素降解菌在自然环境中分布广泛,主要有真菌、细菌和假单胞菌、链霉菌等放线菌[8]。真菌具有很强的产纤维素酶的能力[9],而细菌对环境适应性更强,生长较快,能够产生特异性更高的多酶复合物[10]。Liu等从堆肥中筛选到1株纤维素分解真菌Aspergillus fumigatus Z5,最适分解温度为50 ℃,能够分泌完整的纤维素酶系,对玉米秸秆的降解效果比较明显[11]。江高飞等研究了在55~65 ℃和75 ℃条件下依旧能够在高温好氧堆肥中保持高度热稳定性并降解纤维素的短小芽孢杆菌(Bacillus pumilus) B-7和Geobacillus stearo-thermophilusB-11[12];吴翔等从稻草堆肥高温期中分离到1株可在45 ℃下高效降解纤维素的放线菌(Streptomyces sp.)CN9[13]。张必周等筛选出能够在低温条件下高效降解纤维素的复配菌,在15 ℃模拟环境培养下滤纸酶活性(FPA)为32.96 U/mL[14],因此,开展高效纤维素降解菌筛选及应用潜力巨大。
高效纤维素降解菌的筛选已成为有机固体废弃物高效腐解的新途径之一[15]。但由于宁夏畜禽养殖结构及饲料供给的差异,畜禽粪便纤维含量及粪便的理化性状和宁夏区外会有很大区别,而常用的有机物料腐熟剂多是从宁夏区外采购而来,这些菌剂是否适应宁夏的气候特点,能否在堆肥发酵中发挥作用就不得而知。因此,针对宁夏特殊的生态环境,从宁夏本地筛选出适宜本土的高效纤维素降解菌,为开发有机物料腐熟菌剂十分必要。本研究以宁夏不同区域牛羊粪堆肥、沟渠、林土为分离纤维素降解菌的样品,通过对样品中纤维素降解菌的富集、分离、纯化,经刚果红染色、纤维素酶活性测定、滤纸条崩解及水稻秸秆降解试验,筛选出适宜本土生长的纤维素降解菌并鉴定,以期为开发本土高效纤维素降解菌剂的优质菌源提供参考。
1 材料与方法
1.1 试验材料
试验于2022年3月至12月在宁夏农林科学院农业资源与环境研究所微生物实验室开展。
土壤样品:采集宁夏银川市掌政镇日光温室菜园土壤,平罗、永宁、吴忠等地区玉米地土壤、沟渠、树林、农田等富含纤维素较高的土壤样品各约1 kg,用自封袋装好并做好标记后放置4 ℃冰箱备用,样品采集完7 d之内完成纤维素降解菌的分离。
堆肥样品:采集平罗县宝丰镇牛粪堆肥发酵高温期堆肥样品及吴忠市利原村牛羊粪便堆肥发酵高温期堆肥样品各约1 kg,用自封袋装好并做好标记后放置4 ℃冰箱备用,样品采集完7 d之内完成纤维素降解菌的富集。
腐烂秸秆样品:采集平罗县宝丰镇,并置4 ℃冰箱备用,样品采集完7 d之内完成纤维素降解菌的富集。
完好秸秆样品:水稻秸秆采自宁夏银川市永宁县望洪基地。将水稻表面的灰尘清洗干净,晾干,剪成2 cm的小段,121 ℃灭菌30 min备用。
1.2 培养基与试剂
(1)富集培养基:KH2PO4 0.34 g、K2HPO41.20 g、MgSO4·7H2O 0.25 g、NH4NO3 0.60 g、CMC-Na10.00 g、CaCl2·2H2O 0.07 g、MnSO4·H2O 0.025 mg。
(2)CMC-Na筛选培养基:CMC-Na 10 g、酵母膏1 g、琼脂20 g、蒸馏水1 000 mL,pH值为7.0~7.5。
(3)CMC-Na鉴别培养基:CMC-Na 5.5 g、NH4NO3 0.6 g、MgSO4·7H2O 0.2 g、KH2PO40.34 g、酵母提取物0.5 g、NaCl 0.5 g、琼脂20.0 g、蒸馏水1 000 mL,pH值7.2~7.4。
(4)滤纸条崩解培养基:(NH4)2SO4 1.0 g、MgSO4·7H2O 0.5 g、KaHPO4 1.0 g、酵母膏0.1 g、滤纸条(1 cm×6 cm)3条/三角瓶(500 mL)、蒸馏水1 000 mL,pH值为7.0~7.2。
(5)产酶培养基:(NH4)SO4 2.0 g、KH2PO43.0 g、CaCl2 0.5 g、MgSO4 0.5 g、CoCl2 3.0 mg、FeSO4·7H2O 7.5 mg、ZnSO4·7H2O 2.0 mg、MnSO4Wm9N+Z+1kQ0L2tGPuQPYNBr+ivn7JwmeC11kMLcbLfY=·H2O2.5 mg、蒸馏水1 000 mL,pH值自然。
以上培养基均在121 ℃灭菌20 min后使用。
1.3 试验方法
1.3.1 菌株的富集培养
将取回来的土壤、堆肥、腐烂秸秆等样品混匀后分别称取100 g于1 000 mL磷酸缓冲液中,每个样品中滴加吐温-80 4滴,采用玻璃棒充分搅匀后去掉液体中明显的杂质,通过2 000 r/min离心5 min后保留上清液,上清液再通过8 000 r/min离心10 min后保留离心管底部菌体,将菌体用无菌磷酸缓冲液洗下后放置4 ℃冰箱保存备用。分别量取备用菌液10 mL于250 mL富集培养基中,30 ℃ 180 r/min振荡恒温培养7~10 d。
1.3.2 纤维素降解菌初筛
将富集菌液采用无菌水稀释至10-3、10-4倍,各吸取0.1 mL均匀涂布于筛选培养基平板上,置30 ℃倒置培养约7 d,观察并记录菌落生长情况。挑取不同形态菌落,接种斜面培养基培养3 d后于4 ℃低温保存。
1.3.3 纤维素降解菌复筛
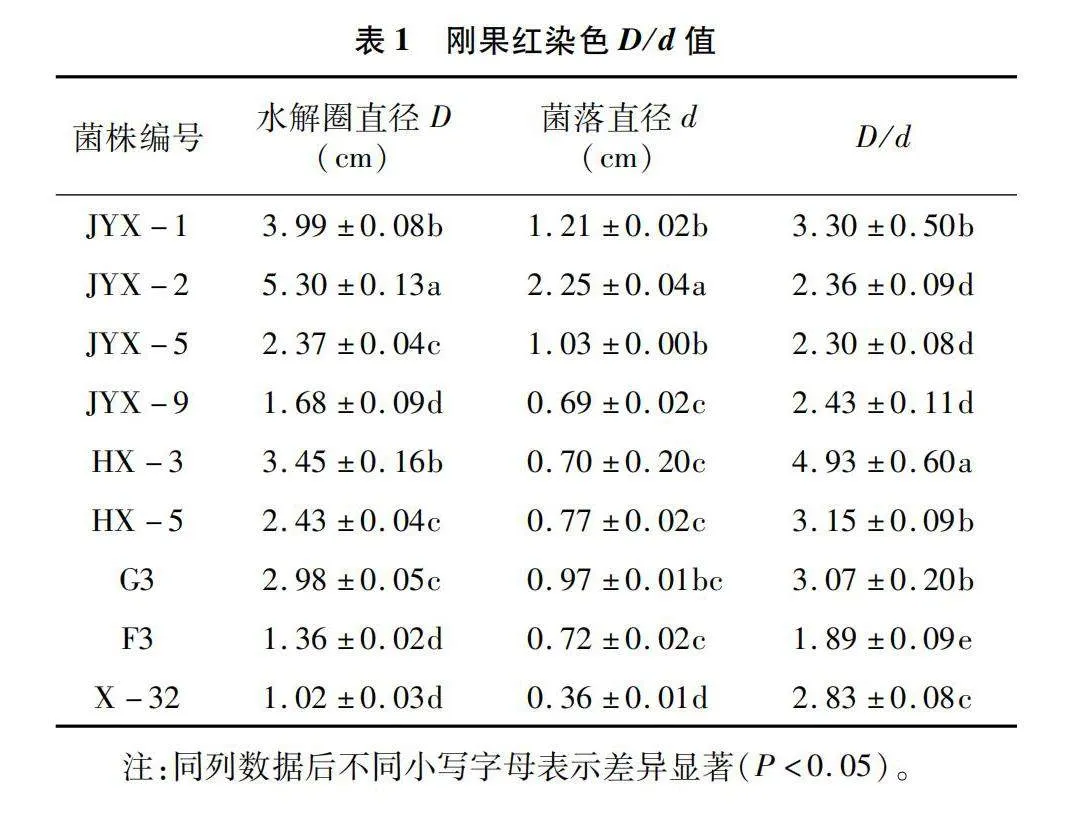
将初筛分离菌株活化后,点种法接种于鉴别培养基上,每株菌进行2个重复,在30 ℃培养箱倒置培养2~3 d,采用0.1%刚果红染色15 min后,再用1 mol/L NaCI溶液进行脱色,通过透明圈Dc值的大小(Dc-水解圈直径(D,cm)/菌落直径(d,cm),初步判断菌株的纤维素降解能力。初选得到的菌株标记保存,用于后期试验。
1.3.4 滤纸条崩解试验
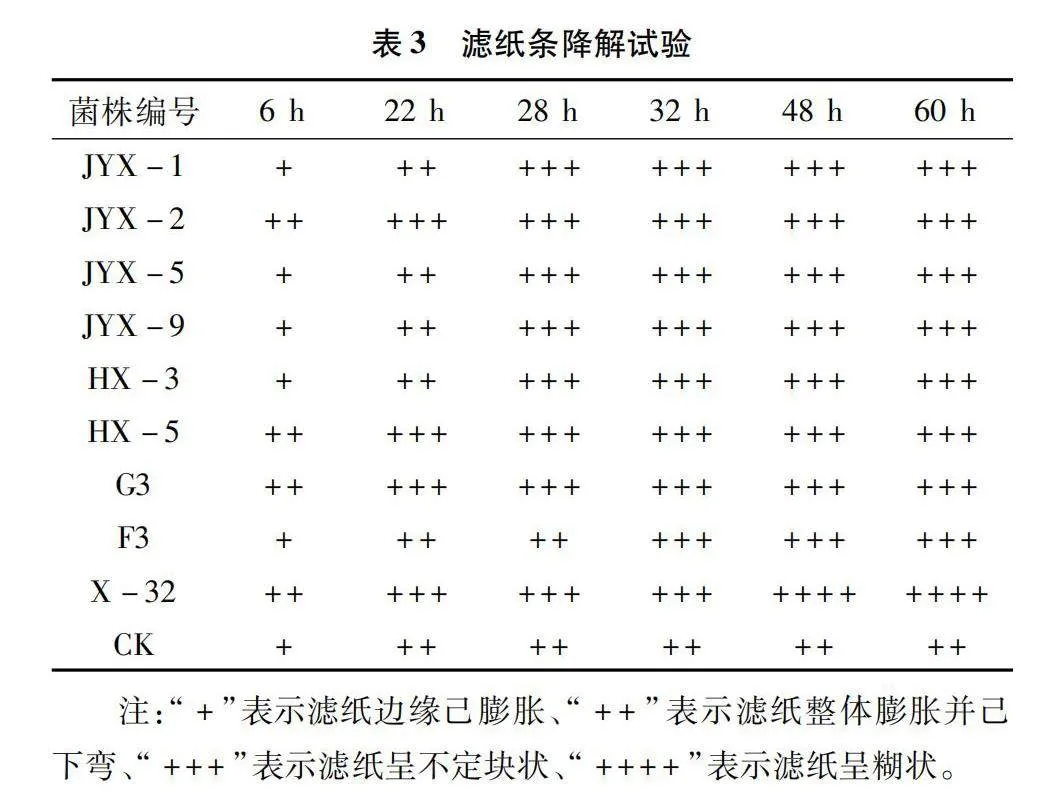
将酶活性试验确定的优势菌株分别接种在牛肉蛋白陈培养基,培养24 h后制备菌悬液。每种菌液分别取1 mL接种于盛有100 mL无菌滤纸条崩解培养基的三角瓶中,并放入3条1 cm×6 cm的无菌waterman #1滤纸条。28 ℃、100 r/min培养,定期观察滤纸条崩解情况。每个菌株3次重复。根据滤纸条崩解程度初步判断菌株降解纤维素能力。“+”表示滤纸边缘己膨胀、“++”表示滤纸整体膨胀并己下弯、“+++”表示滤纸呈不定块状、“++++”表示滤纸呈糊状。
1.3.5 纤维素酶活性测定
粗纤维素酶液的制备:以2%接种量接入滤纸条崩解能力较强菌株的菌悬液于产酶培养基中,28 ℃、180 r/min培养7 d后,4 000 r/min离心10 min,上清液作为粗酶液。每个菌株3次重复。
纤维素酶活性单位定义:在50 ℃条件下,1 mL酶液于60 min内水解相应的底物,产出相当于1 mg葡萄糖的还原糖量,定义为1个酶活性单位,表示为U/mL。
CMC酶活性=Bn×测定前酶液定容体积(mL)/[0.5 mL×时间(h)],式中:B表示从标准曲线中查得的净葡萄糖量(mg);n表示酶液稀释倍数;0.5表示测定时吸取稀释酶液量(mL)。
1.3.6 水稻秸秆降解试验
将滤纸条崩解试验确定的优势菌株悬液分别吸取1 mL接种至水稻秸秆为唯一碳源的培养基中,28 ℃、60 r/min培养7 d后,采用无菌水将不同处理中的秸秆残渣全部清洗出来,然后65 ℃烘干至恒重并称重。
计算秸秆相对降解率(RDE):RDE=(W0-W)/W0×100%;
其中,W0为对照秸秆残渣干重,W为目标菌降解的秸秆残渣干重。相对降解率高表示目标菌株降解水稻秸秆的效果好,每株菌3次重复。
1.3.7 优势菌株鉴定
提取优势菌株DNA,通过PCR扩增得到测序结果,将16S rDNA 基因序列于NCBI网站进行BLAST比对,并找出其同源序列,进行相似性分析。选相性>99.5%的序列在MEGA 11软件基于Neighbor-Joining法构建系统发育树。
2 结果与分析
2.1 纤维素降解菌的初筛及菌落形态
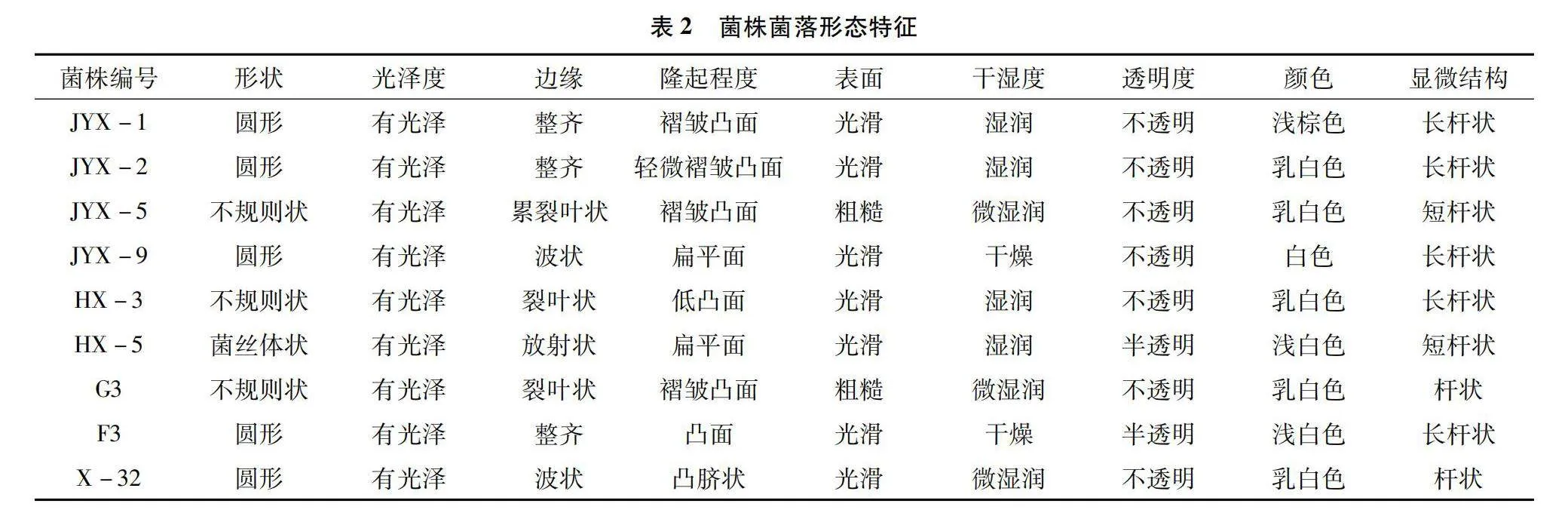
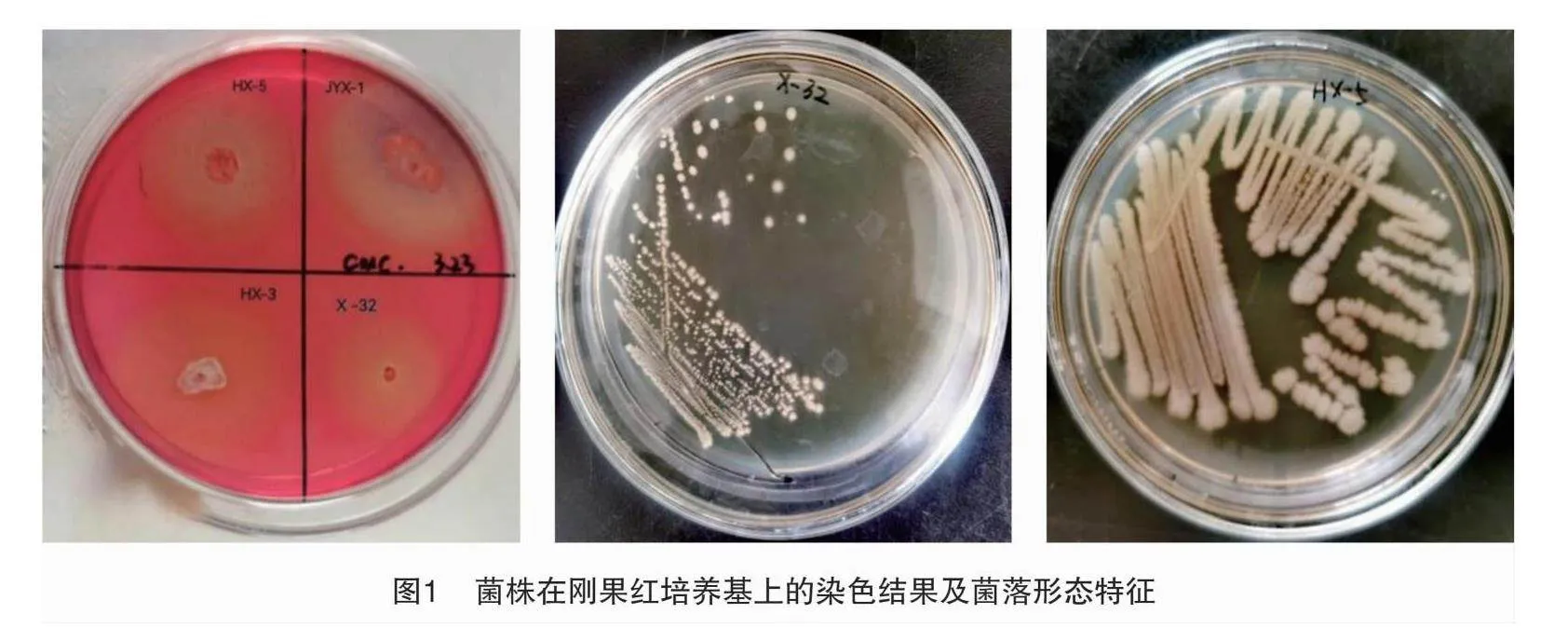
通过样品富集及平板筛选法,由表1、表2可知,筛选出不同形态及不同颜色的纤维素降解细菌共计132株,再经过多次刚果红染色筛选确定9株菌在CMC-Na平板上具有比较稳定且明显的降解圈,且D/d的值在2.5以上的菌株有5株,分别是JYX-1、HX-3、HX-5、G3、X-32(图1)。降解圈直径和菌落直径比(D/d)从大到小依次为菌株HX-3、JYX-1、HX-5、G3、X-32,其中HX-3菌株染色试验D/d值最高,为4.93,其次是JYX-1菌株,D/d值为3.30。D/d越大说明该菌株产生的纤维素酶活性越高,但不能完全表示菌株产纤维素酶的能力和降解纤维素的效果。
2.2 纤维素降解菌株酶活性测定
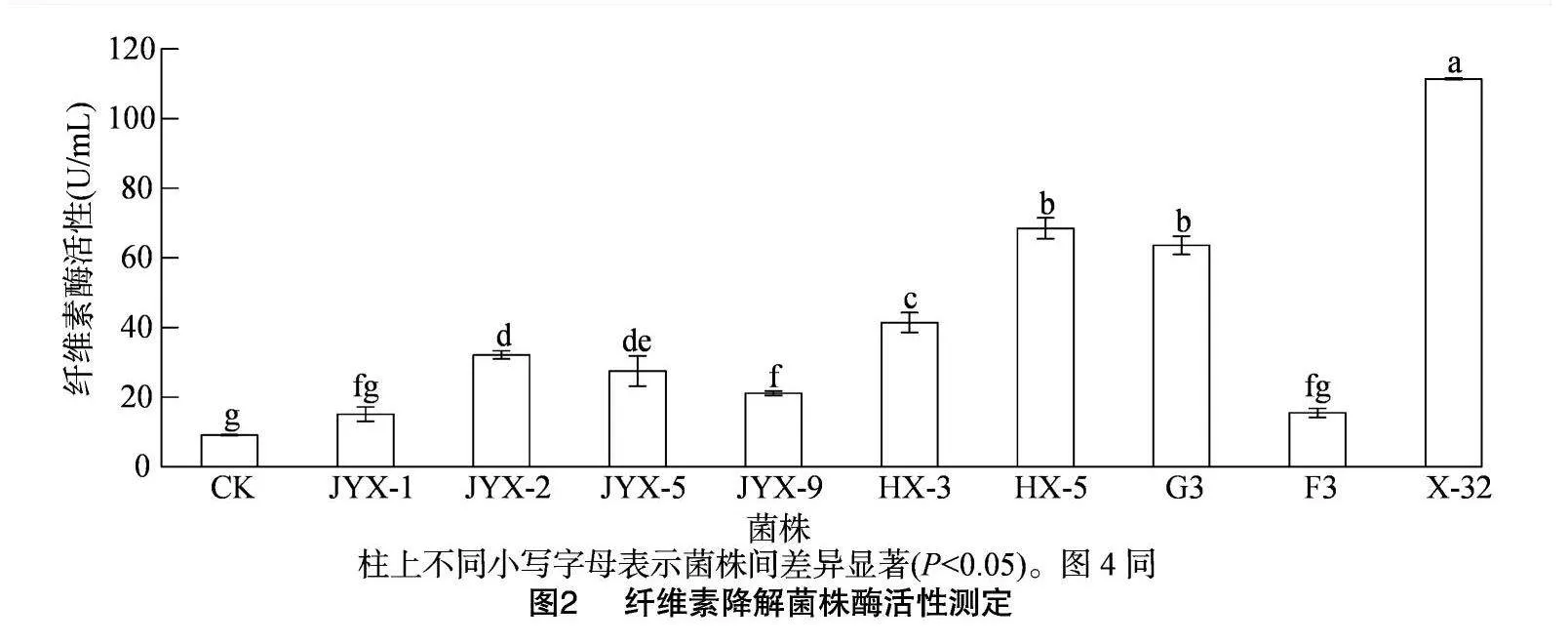
对初筛所得9株菌的纤维素酶活性的检测结果见图2,所检测的9株菌的纤维素酶活性均>CK,其中,纤维素酶活性>50 U/mL的菌株有3株,分别是HX-5、G3、X-32;其中X-32菌株的纤维素酶活性最高,达到111.46 U/mL,显著高于其他菌株,其次为HX-5菌株和G3菌株,纤维素酶活性分别为74.12、66.23 U/mL。
2.3 滤纸条降解试验
将初筛选出具有降解纤维素效果的9株优势细菌进行滤纸条降解试验,由表3可知,在28 h时,除CK和F3菌株处理下滤纸条呈弯曲状,其他菌株处理下滤纸条均为不定状,随着时间推移至32 h时,9株菌处理下的滤纸条均呈现不定块状。但在培养60 h时,由图3可知,X-32菌株在降解速度和效率上均高于其他菌株,滤纸条已经完全分解为糊状,因此,初步判断X-32具有较强的纤维素分解能力。
2.4 水稻秸秆降解试验
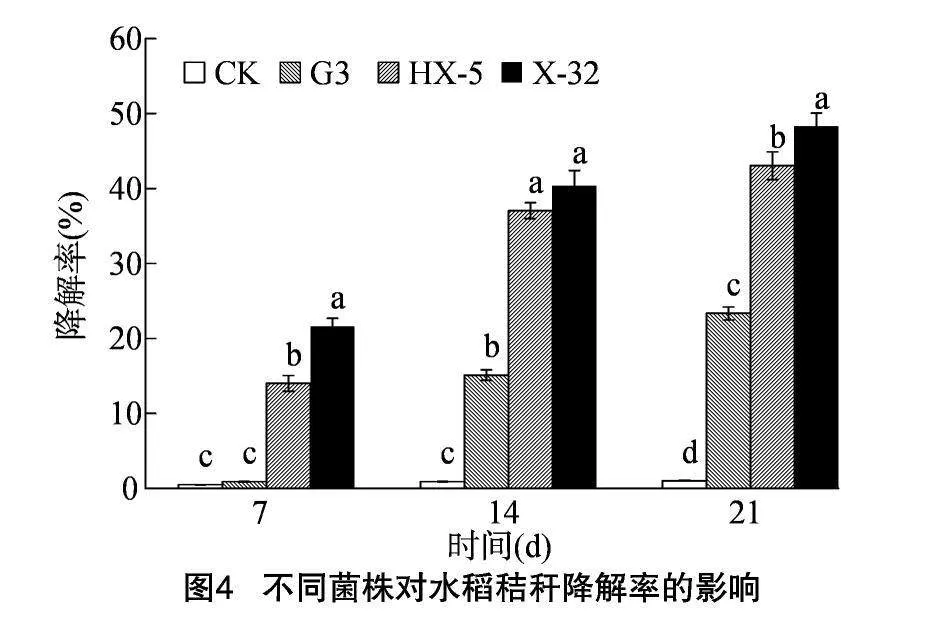
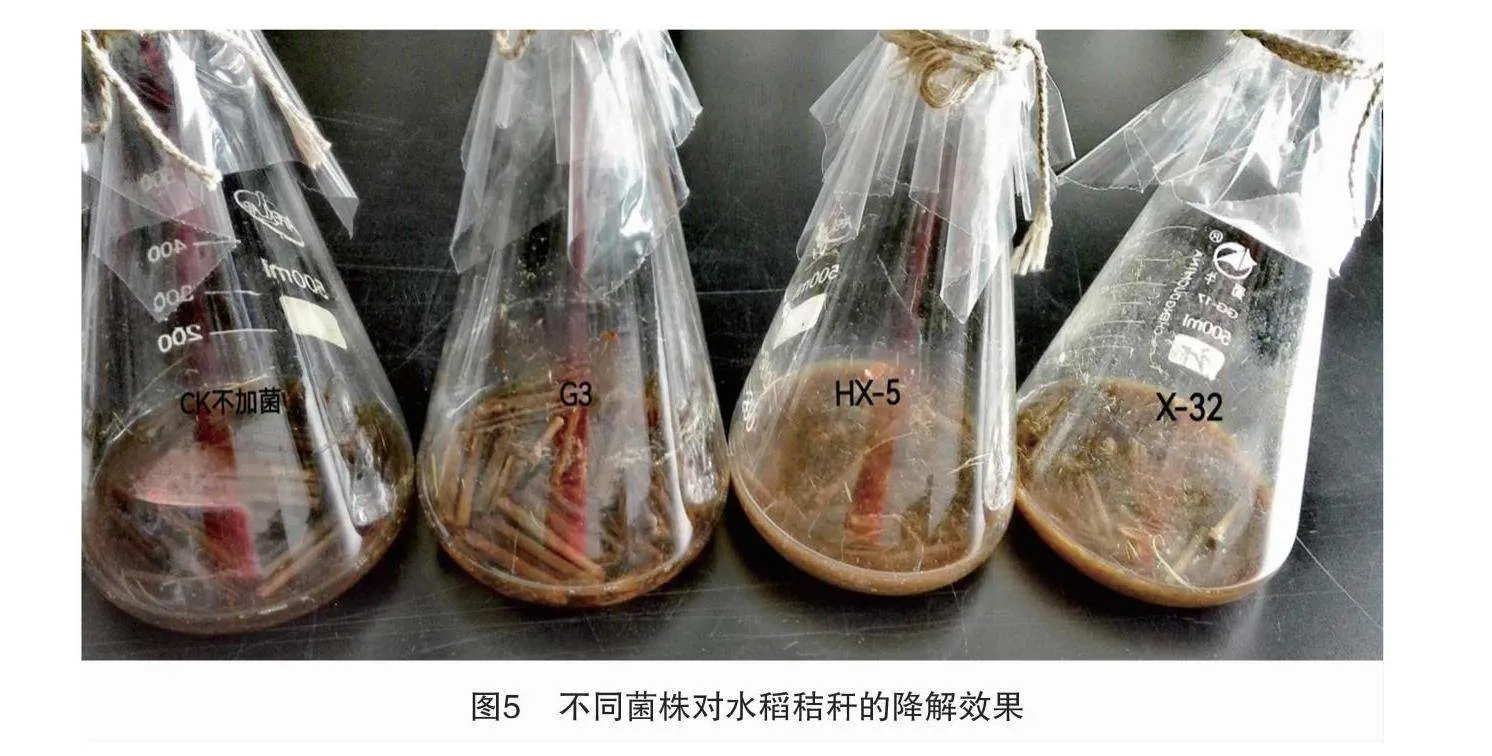
通过纤维素酶活性检测筛选出3株优势菌株,分别为菌株HX-5、G3、X-32,研究优势菌株对水稻秸秆降解试验结果。 由图4可知,不同菌株对水稻秸秆的降解效果有明显差异,降解率均高于CK。在培养7 d时,菌株HX-5和菌株X-32的降解率显著高于CK和G3。待发酵21 d时,各处理均表现出明显差异,且各菌株对水稻的降解率均显著高于CK,其中,X-32>HX-5>G3,降解率分别为48.26%、43.01%、23.33%。不同菌株对水稻秸秆降解效果见图5、图6。
2.5 优势菌株的鉴定
将优势菌株X-32和HX-5送至北京睿博兴科生物技术有限公司测序,所得测序结果在NCBI数据库进行BLAST比对,并找出其同源序列,进行相似性分析。选相似性最高的15个序列在MEGA 11软件基于 Neighbor-Joining 法构建系统发育树,由图7可知,X-32菌株与Paenibacillus polymyxa同源性最高,判定为多黏类芽孢杆菌。HX-5菌株与Bacillus velezensis同源性最高,判定为贝莱斯芽孢杆菌。
3 讨论与结论
本研究从宁夏本地采集堆肥、土壤样品,筛选得到2株高效降解秸秆的细菌,分别为多黏类芽孢杆菌(Paenibacilluspolymyxa)X-32 和贝莱斯芽孢杆菌(Bacillus velezensis)HX-5,其中X-32具有较高的纤维素酶活性,对滤纸条和水稻秸秆有明显的降解效果,HX-5虽然也具有较强的纤维素降解能力,总体效果不及X-32,但是HX-5易培养,菌数较高,且和X-32不拮抗,可作为复合菌剂用于堆肥发酵。多黏类芽孢杆菌和贝莱斯芽孢杆菌均属于芽孢杆菌科的革兰氏阳性细菌,是自然界分布极广的一类细菌,因其具有芽孢,能够抵御外界有害因子,对温度有很强的耐受性,并且适应能力较强[16-17],因此,广泛应用于堆肥中,芽孢杆菌成为目前研究产纤维素酶微生物的一个重要方向[18]。
多黏类芽孢杆菌是一类兼具生物防治和促生长作用的植物根际细菌,1993年由Ash等将其归为类芽孢杆菌属之前又名多黏芽孢杆菌[19],在农业、工业及医药等领域广泛应用,并对人和动植物没有致病性[20-22],但其在纤维素降解或堆肥发酵上的研究很少。程爱芳等对多黏类芽孢杆菌HD-1产纤维素酶活性进行测定发现其最大酶活性为88.3 U/mL[23],本研究测定X-32纤维素酶活性达111.46 U/mL,但发酵条件均需要进一步研究。纤维素作为自然界最广泛的碳源,受到各国政府的高度重视,β-葡萄糖苷酶作为纤维素降解过程中的一个重要酶组分具有十分重要的研究价值,王艳等研究了1株多黏类芽孢杆菌β-葡萄糖苷酶2个亚基bglA和bglB在大肠杆菌C41中共表达后,其酶活性比单一酶组分及混合表达的酶活性提高了4倍[24],这研究结果为多黏类芽孢杆菌对纤维素降解及基因的共表达提供了试验依据。本试验虽然研究了X-32菌株对纤维素酶活性及秸秆的直接降解,但关于β-葡萄糖苷酶的研究还有欠缺,需在今后的试验中继续研究,有望开发一款具有生防、促生的有机物料腐熟剂。
贝莱斯芽孢杆菌2005年被首次报道,是芽孢杆菌属的一个新种[25],能够产生多种次级代谢产物,并且具有潜在的抑菌活性和促进植物生长的作用,在植物病害的生物防治方面被广泛应用[26-27],关于贝莱斯芽孢杆菌对纤维素降解的研究鲜有报道。余梅霞等研究1株FIB-3的贝莱斯芽孢杆菌在培养5 d时滤纸酶活性达最高8.436 U/mL[28],但没有更深一步研究对秸秆降解或堆肥发酵的效果。Bafana等报道B. velezensis AB具有对偶氮染料Direct Red 28(DR28)的脱色能力[29],经研究发现其具有染料解毒活性和偶氮还原酶(60 ku)活性。陈龙等研究一株贝莱斯芽孢杆菌157 CMCase具有产酶量高,耐受pH值范围广的特点[30],可在洗涤剂、饲料添加剂、造纸领域中应用,但该研究没有对纤维素酶活性、滤纸及秸秆降解效果进行研究。本研究中筛选到的贝莱斯芽孢杆菌HX-5纤维素酶活性为74.12 U/mL,对滤纸条和水稻秸秆有明显的降解能力,在发酵21 d时对水稻秸秆的降解率达43.01%,但其代谢途径尚不清楚,今后应需在CMCase酶活性、次级代谢产物上加强研究,为研发功能生物有机肥提供菌源支撑。
从不同土壤样本及粪便发酵样中分离筛选得到3株效果最好的菌株,分别是X-32、HX-5、G3,纤维素酶活性分别为111.46、74.12、66.23 U/mL。
以筛选所得最佳菌株X-32、HX-5、G3为目标菌株开展滤纸条降解试验和水稻秸秆降解试验,菌株X-32在培养60 h可将滤纸条完全崩解,待秸秆发酵21 d时,各个菌株对水稻的降解率均显著高于CK,其中,X-32、HX-5、G3菌株对水稻降解率分别为48.26%、43.01%、23.33%。
对优势菌株X-32、HX-5进行分子生物学鉴定,确定X-32菌株为多黏类芽孢杆菌(Paenibacilluspolymyxa),HX-5菌株为贝莱斯芽孢杆菌(Bacillus velezensis),具有堆肥发酵有机物料腐熟剂的研究潜力。
参考文献:
[1]中华人民共和国农业农村部. 畜禽粪污土地承载力测算技术指南[Z]. 2108.
[2]黄亚捷,廖志宏,崔艳智.“十三五” 与“十四五” 期间宁夏畜禽养殖污染评估[J]. 安徽农业科学,2022,50(23):34-39.
[3]黄亚捷,崔艳智,贾小梅,等. “十四五” 期间宁夏畜禽养殖污染趋势与污染防治对策研究[J]. 中国农学通报,2022,38(32):78-85.
[4]王继莲,李明源,周 茜,等. 堆肥中纤维素降解菌的筛选及复配菌降解性能研究[J]. 核农学报,2023,37(1):180-187.
[5]徐 杰,许修宏,门梦琪,等. 木质纤维素降解菌剂DN-1促进堆肥腐熟度的评估[J]. 中国土壤与肥料,2016(6):146-151.
[6]蔡 瑞,徐春城. 堆肥用微生物及其效果研究进展[J]. 中国土壤与肥料,2019(5):1-7.
[7]朱 屹,李俊良,焦 博,等. 整合宏组学方法研究番茄与玉米秸秆共堆肥生境中的关键微生物及其功能[J]. 福建农业学报,2020,35(7):764-772.
[8]黄青盈,吕嘉昕,何秋愉,等. 纤维素降解菌种的筛选测定及其对秸秆的降解[J]. 复旦学报(自然科学版),2022,61(1):34-42.
[9]Pedraza-Zapata D C,Sánchez-Garibello A M,Quevedo-Hidalgo B,et al. Promising cellulolytic fungi isolates for rice straw degradation[J]. Journal of Microbiology,2017,55(9):711-719.
[10]Xiong X Q,Liao H D,Ma J S,et al. Isolation of a rice endophytic bacterium,Pantoea sp. Sd-1,with ligninolytic activity and characterization of its rice straw degradation ability[J]. Letters in Applied Microbiology,2014,58(2):123-129.
[11]Liu D Y,Zhang R F,Yang X M,et al. Thermostable cellulase production of Aspergillus fumigatus Z5 under solid-state fermentation and its application in degradation of agricultural wastes[J]. International Biodeterioration & Biodegradation,2011,65(5):717-725.
[12]江高飞,暴彦灼,杨天杰,等. 高温秸秆降解菌的筛选及其纤维素酶活性研究[J]. 农业环境科学学报,2020,39(10):2465-2472.
[13]吴 翔,陈 强,徐丽华,等. 一株降解纤维素的高温放线菌的筛选及其产酶条件研究[J]. 农业环境科学学报,2007,26(增刊1):101-104.
[14]张必周,高聚林,于晓芳,等. 玉米秸秆低温降解菌的分离与鉴定及复配菌降解效果研究[J]. 玉米科学,2020,28(6):168-175.
[15]Chen X M,Cheng W T,Li S Z,et al. The “quality” and “quantity” of microbial species drive the degradation of cellulose during composting[J]. Bioresource Technology,2021,320(PtB):124425.
[16]Sahoo K,Sahoo R K,Gaur M,et al. Cellulolytic thermophilic microorganisms in white biotechnology:a review[J]. Folia Microbiologica,2020,65(1):25-43.
[17]Lamb J,Loy T.Seeing red:the use of Congo Red dye to identify cooked and damaged starch grains in archaeological residues[J]. Journal of Archaeological Science,2005,32(10):1433-1440.
66a3fa26606cec12edc4b2ac4ab8a34f6a1532958d03005ce8e8713976221aa4[18]顿宝庆,吴 薇,王旭静,等. 一株高纤维素酶活力纤维素分解菌的分离与鉴定[J]. 中国农业科技导报,2008,10(1):113-117.
[19]Ash C,Priest F G,Collins M D. Molecular identification of rRNA group 3 bacilli (Ash,Farrow,Wallbanks and Collins) using a PCR probe test.Proposal for the creation of a new genus Paenibacillus[J]. Antonie van Leeuwenhoek,1993,64(3/4):253-260.
[20]刘守德,刘华梅,周 莉,等. 多黏类芽孢杆菌的研究进展[J]. 武汉工程大学学报,2022,44(3):237-243.
[21]Ryu C M,Kim J,Choi O,et al. Improvement of biological control capacity of Paenibacillus polymyxa E681 by seed pelleting on sesame[J]. Biological Control,2006,39(3):282-289.
[22]贺 丹,李 鹏,赵 珅,等. 多黏类芽孢杆菌的生防机制研究进展[J]. 江苏农业科学,2023,51(8):1-8.
[23]程爱芳,邓政东,陈 文,等. 多黏类芽孢杆菌HD-1产纤维素酶的条件优化[J]. 食品工业科技,2015,36(10):173-177.
[24]王 艳,马亚茹,万学瑞,等. 多黏类芽孢杆菌β-葡萄糖苷酶bglA、bglB和bgl基因在大肠杆菌中的表达[J]. 草业学报,2017,26(5):189-196.
[25]Ruiz-GarcíaC,Béjar V,Martínez-Checa F,et al. Bacillus velezensis sp. nov.,a surfactant-producing bacterium isolated from the river Vélez in Málaga,southern Spain[J]. International Journal of Systematic and Evolutionary Microbiology,2005,55(1):191-195.
[26]迟惠荣,张亚惠,曾 欣,等. 多花黄精内生贝莱斯芽孢杆菌的分离鉴定及其抗菌与促生作用分析[J]. 植物保护,2019,45(4):122-131.
[27]蔡高磊,张 凡,欧阳友香,等. 贝莱斯芽孢杆菌(Bacillus velezensis)研究进展[J]. 北方园艺,2018(12):162-167.
[28]余梅霞,朱 玉,程 丹,等. 酒糟泥中纤维素降解菌的筛选与鉴定[J]. 阜阳师范大学学报(自然科学版),2021,38(2):58-62.
[29]Bafana A,Chakrabarti T,Devi S S. Azoreductase and dye detoxification activities of Bacillus velezensis strain AB[J]. Applied Microbiology and Biotechnology,2008,77(5):1139-1144.
[30]陈 龙,吴兴利,李立佳,等. 一株高产内切纤维素酶贝莱斯芽孢杆菌的产酶条件优化及酶学性质分析[J]. 中国畜牧兽医,2019,46(5):1353-1361.
