超声影像组学联合模型预测甲状腺乳头状癌同侧颈部中央区淋巴结转移的价值
2024-10-31周煜皓黄丽华文戈
摘要:目的 探讨超声检查联合模型预测甲状腺乳头状癌(PTC)同侧中央区颈部淋巴结转移(CLNM)的价值。方法 "回顾性分析南方医科大学南方医院2021年1~7月137例经病理证实的PTC患者的临床资料及术前甲状腺超声二维影像,根据术后病理结果将患者分为转移组65例,非转移组72例。所有患者均淋巴结行预防性中央区淋巴结清扫,并根据术后病理结果分为转移组和非转移组。在超声影像中手动勾画病变,从处理后的超声图像中导出了纹理特征。然后使用ICC、统计筛选、相关系数筛选以及LASSO方法,最终将LASSO筛选的非0特征作为输入,进行影像特征模型建模。将137例患者的临床有效信息构建与影像特征模型相同的临床特征模型。将影像特征与临床特征相结合,构建联合模型。结果 "在影像特征模型中,ExtraTrees模型表现最佳,训练集和测试集的曲线下面积分别为0.895和0.836。临床特征的最优模型也是ExtraTrees模型,训练集和测试集的曲线下面积分别为0.843和0.701。而联合模型的预测能力最好,训练集和测试集的曲线下面积分别为0.900和0.854。结论 "结合影像特征和临床特征的联合模型对PTC同侧CLNM的预测能力较好,可为临床决策提供一种无创、有效的方法。
关键词:甲状腺乳头状癌;淋巴结转移;影像组学;纹理分析
Value of ultrasonography combined with model in predicting ipsilateral central cervical lymph node metastasis in papillary thyroid carcinoma
ZHOU Yuhao1, HUANG Lihua1,WEN Ge2
1Department of Medical Ultrasonics, Nanfang Hospital Zengcheng Campus, Southern Medical University, Guangzhou 511338, China; 2Imaging Center of Southern Hospital, Southern Medical University, Guangzhou 510515, China
Abstract: Objective To investigate the value of ultrasound combined model in predicting ipsilateral central cervical lymph node metastasis (CLNM) in papillary thyroid carcinoma (PTC). Methods The clinical data and preoperative two-dimensional ultrasound images of 137 patients with pathologically confirmed PTC in Nanfang Hospital of Southern Medical University from January 2021 to July 2021 were retrospectively analyzed, and they were were divided into metastatic group (n=65) and non-metastatic group (n=72) by postoperative pathological results. All patients underwent prophylactic central lymph node dissection. The lesions were delineated manually in the ultrasound images, and the texture features were derived from the processed ultrasound images. Then ICC, statistical screening, correlation coefficient screening and LASSO method were used, and the non-0 features filtered by LASSO were used as input to build the image feature model. 137 patients' clinically effective information was used to construct the same clinical feature model as the image feature model. A combined model was constructed by combining imaging features with clinical features. Results Among the image feature models, the ExtraTrees model has the best performance, and the AUC of the training set and the test set are 0.895 and 0.836 respectively. The optimal model for clinical features is also the ExtraTrees model, with AUC of 0.843 and 0.701 in the training and test sets, respectively. The combined model has the best predictive ability, with AUC of 0.900 and 0.854 for the training set and test set, respectively. Conclusion The combined model combining imaging features and clinical features has a good ability to predict CLNM in the ipsilateral central region of PTC, and it can provide a non-invasive and effective method for clinical decision-making.
Keywords: thyroid papillary carcinoma; lymph node metastasis; imaging omics; texture analysis
近年来,甲状腺癌的发病率呈明显上升趋势[1] 。甲状腺乳头状癌(PTC)是占甲状腺癌的90%以上[2-3] 。颈部中央区淋巴结转移(CLNM)是PTC复发的重要因素,不进行中央区淋巴结清扫或清扫不完整可能会增加复发风险,降低患者的生活质量,或对预后产生不利影响。PTC手术方式多样,各术式各有优劣,各指南和不同学者提出的观点也各不相同,PTC手术的合理选择是外科医师亟待解决的难题[4] 。提高CLNM的诊断水平,对外科手术方式的选择和预后判断具有重要意义[5] 。超声在PTC及其颈部淋巴结转移的诊断上具有非常重要的价值[2-3] 。但超声对检查颈部淋巴结转移的敏感度为63%[7] ,对CLNM的敏感度仅33%。体积小的转移淋巴结难以被超声发现,并且中央区淋巴结周围有气管等组织的遮挡。虽然细针穿刺活检是确认淋巴结转移最准确的方法,但临床不可能对每个区域的淋巴结进行穿刺[8] ,且受超声医师检查方法和技巧、诊断经验等因素的影响,导致部分PTC发生CLNM会出现漏诊。目前对PTC患者CLNM的术前有效评估方法仍然缺乏[9] ,急需探索出新的诊断方法来为外科医生提供更多有价值的信息。
机器学习是一门多学科交叉专业。影像组学可通过机器学习建立预测模型,用于诊断和预测预后和疗效[10] ,弥补传统影像诊断依靠人眼识别征象和经验判断的不足。通过基于超声的影像组学,建立预测模型评估PTC患者CLNM的情况,是解决该问题的新思路。但既往关于超声影像组学预测PTC患者CLNM的研究大多数仅仅基于影像组学模型,没有加入临床特征模型。本研究基于超声影像组学方法对PTC患者的超声二维图像的病灶进行量化提取,为影像特征模型选择了多种不同的机器学习方法,将患者的临床风险因素通过不同的机器学习方法构建临床特征模型,将影像特征模型和临床特征模型采用逻辑回归算法整合,组建联合模型,最终将3种模型用于预测PTC同侧CLNM的发生,旨在提高预测CLNM的准确率,为外科医师进行术式的选择以及个体化的治疗策略提供指导。
1 "资料与方法
1.1 "一般资料
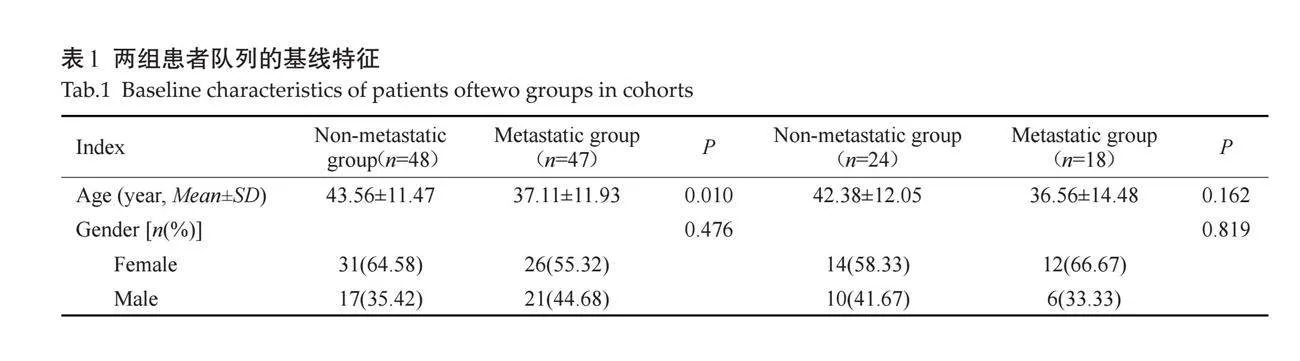
回顾性收集2021年1~7月于南方医科大学南方医院确诊并收治的PTC患者137例,其中男性54例,女性83例,年龄13~68(40.22±12.37)岁。所有患者均淋巴结行预防性中央区淋巴结清扫,并根据术后病理结果分为转移组(n=65)和非转移组(n=72)。本研究获得了南方医科大学伦理委员会的批准(伦理审批编号:NFEC-2024-004)。
纳入标准:术前细针穿刺病理证实为PTC,手术病理明确有无CLNM;术前未进行任何的抗肿瘤治疗;病灶同侧接受中央区淋巴结清扫;PTC为单发结节,或多发结节中病理学检查证实为单发PTC,其余结节为良性。排除标准:超声报告显示有多个结节且术后PTC无法确定为唯一;未进行有效的中央区淋巴结清扫;穿刺未能获取病理结果;术前接受过任何抗癌治疗。
1.2 "仪器与检查方法
患者分别采用西门子Acuson Sequoia、飞利浦Affiniti 70w以及东芝Aplio 500彩色多普勒超声诊断仪,探头频率均为7.5~12.0 MHz。患者取仰卧位,充分暴露颈部,采用横切、纵切以及斜切面对甲状腺病灶进行多切面、多角度扫查。在超声二维影像的基础上,行彩色多普勒超声检查,观察病灶内部及周边血流情况。选取最佳的横切面和纵切面两幅图存取备用。超声影像资料的采集由具有10年以上工作经验的超声医师进行。
1.3 "超声影像组学分析
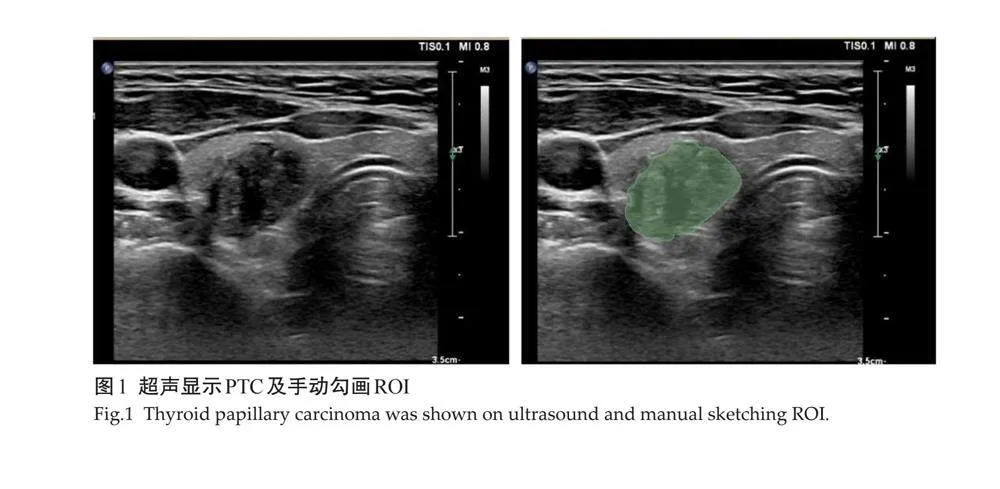
1.3.1 "特征勾画 " 使用3D Slicer5.2.1软件,由2位具有10年以上工作经验的超声医师手动勾画病灶作为感兴趣区(ROI),确保有效病灶区域均在勾画范围内(图1)。
1.3.2 "特征提取 " 超声影像学所有手工制作的特征均从医学图像中使用Python3.7.12中的pyradiomics3.1.0(http://pyradiomics.readthedocs.io)提取。在提取前,超声二维图像经过了重新采样和灰度离散化,符合图像生物标记标准化倡议制定的标准。
利用小波、平方、平方根、梯度、对数、指数、二维局部二值模式、三维局部二值模式(lbp-3D)等方法对处理后的超声二维图像进行纹理特征提取。从每个ROI中提取出了1561个影像学特征,涵盖统计、形状、纹理和空间分布属性等107种特征类型。在每个患者的横切面和纵切面提前整合之后,共得到3122个影像组学特征。这些特征是通过小波滤波生成的,采用了不同方向的稳态小波变换,并包括了峰度图(lbp-3D-k)、lbp-3D-m1和lbp-3D-m2 等子类别。
1.3.3 "特征选择 " 为减少过拟合,同时为提取模型的泛化能力,对提取的影像特征进行筛选、降维。采用组内相关系数(ICC)评估2位研究者手工勾画ROI之间的重复性,具有良好重复性(ICCgt;0.8)的影像学特征被选中,用于是否发生CLNM的比较;对所有影像组学特征进行了t检验和特征筛选,仅保留具有Plt;0.05的特征。因此筛选出了373个影像特征。
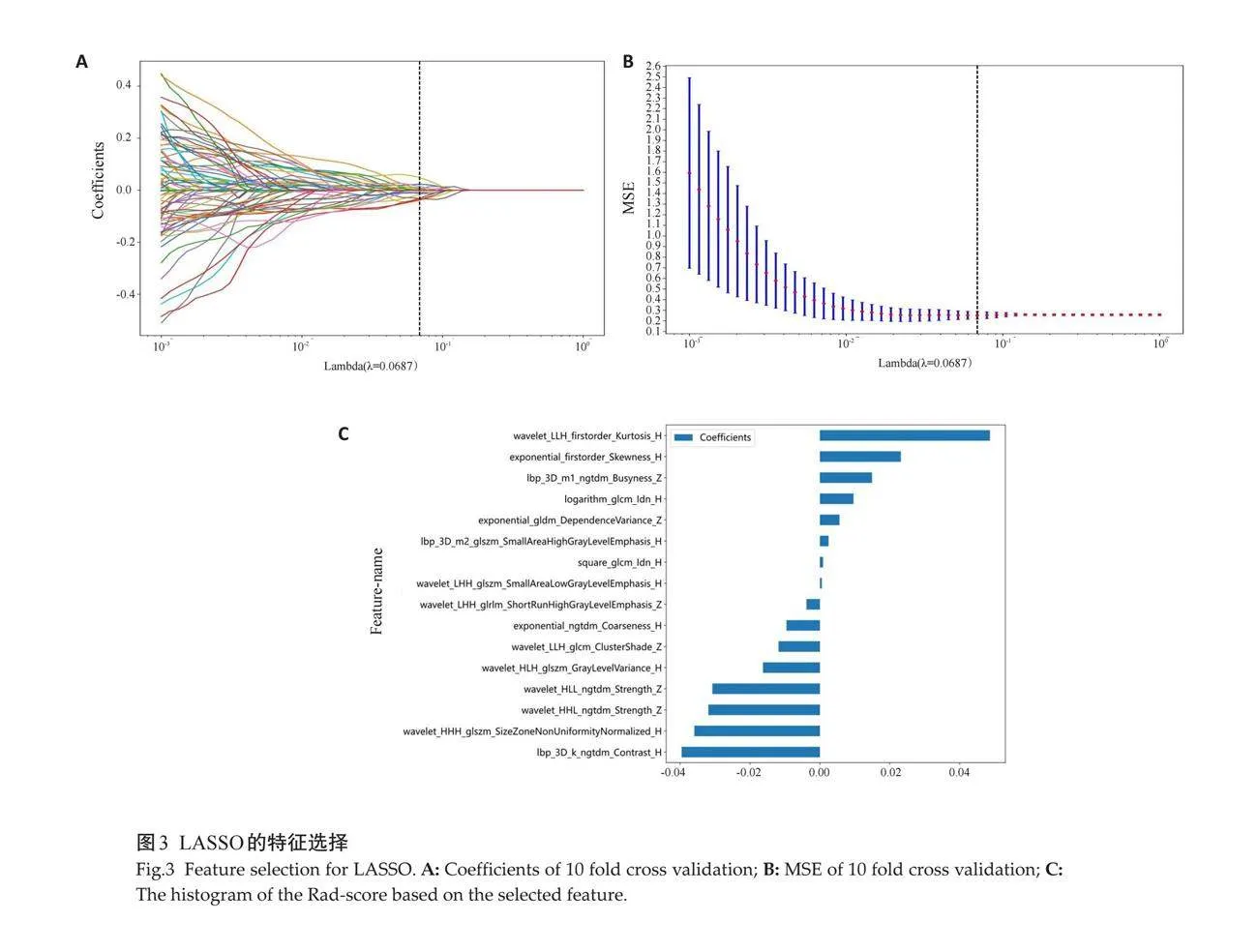
将具有较好可重复性的特征进行Spearman秩相关系数分析。如果任何2个特征之间的相关系数超过了0.9,就保留其中一个。为确保筛选出的每个特征最具有代表性,本研究使用了递归删除策略,删除了最冗余的特征。最终筛选出23个有效影像特征。随后发现数据相对集中,故采用最小绝对值收缩和选择运算子(LASSO)回归模型来构建影像特征模型。选择与颈部CLNM相关度最高、冗余最小的特征,通过使用最小标准方法进行10折交叉验证来确定最佳的正则化权重(λ),选择产生最低交叉验证误差的λ值。
最终,具有非零系数的16个特征被用于模型拟合,并合并成一个影像特征模型。LASSO回归建模使用了Python scikit-learn包。
1.3.4 "模型构建 " 影像特征模型:在LASSO特征筛选之后,对所识别的特征应用了常见的机器学习方法,包括了以下7种模型:线性模型的逻辑回归(LR)、支持向量机(SVM)、随机森林(RF)、极其随机的森林(ET)、XG Boost、Light GBM、多层感知机算法(MLP),以建立影像特征模型,捕捉潜在的风险因素。
临床特征模型:构建临床特征模型的过程与影像特征模型几乎相同。利用年龄和性别作为输入变量,本研究构建了临床特征模型,捕捉了相关的临床指标。
联合模型:将影像特征与临床特征相结合,构建了联合模型。在测试队列中,通过生成ROC曲线来严格评估联合模型的性能。为了比较临床特征模型、影像特征模型和联合模型的性能,本研究采用了Delong检验。还绘制了校准曲线来评估联合模型预测的精度,并使用Hosmer-Lemeshow分析对校准进行了额外评估。此外,采用决策曲线分析(DCA)来量化预测联合模型的临床实用性。
1.4 "统计学分析
采用Python3.7.12进行分析;通过scikit‑learn v1.0.2接口进行机器学习模型的开发。采用Shapiro法评估临床特征的正态性,正态分布的计量资料以均数±标准差表示,组间比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,组间比较采用χ2检验。以Plt;0.05为差异有统计学意义。
2 "结果
2.1 "影像特征模型构建
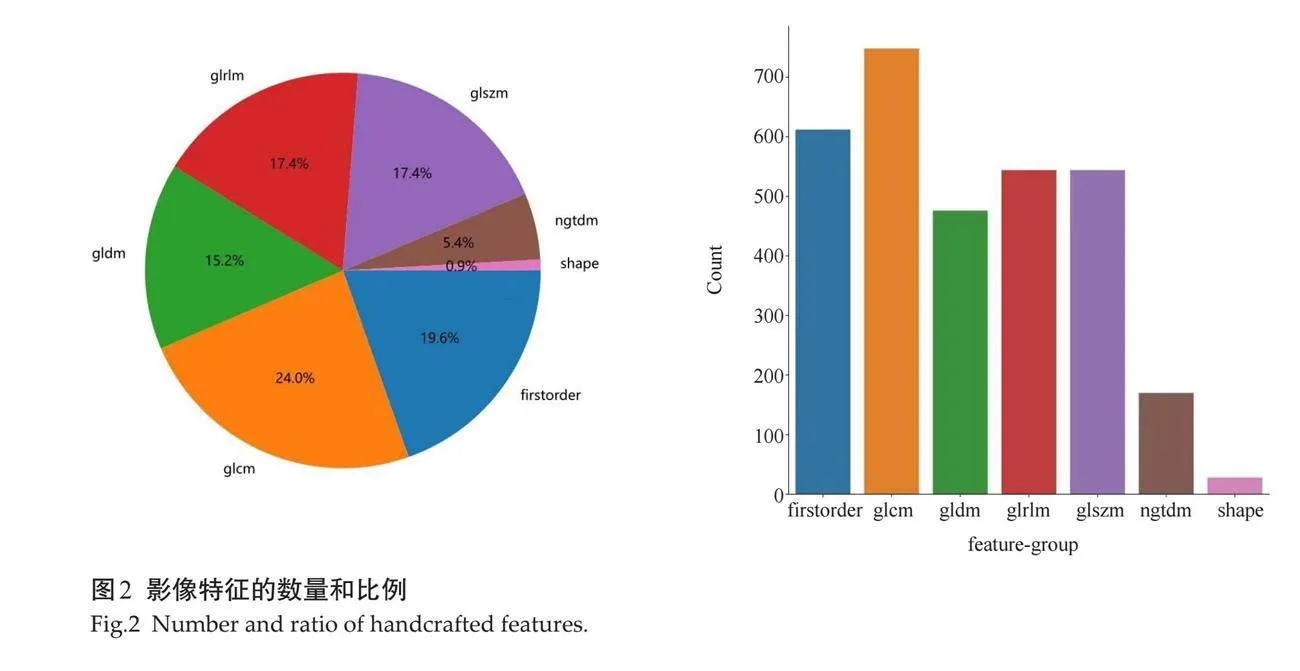
2.1.1 "特征统计概述 " 每位患者的每张横切面和纵切面分别提取了1561个影像特征,包括360个一阶特征、14个形状特征和1组纹理特征,其中纹理特征分为包含了GLCM 374个、GLSZM 272个、NGTDM 85个、GLRLM 272个、GLDM 238个。患者纵切面和横切面的数据被提前整合,最终得到3122个特征(图2)。
2.1.2 "LASSO特征选择 " 来自10折验证的系数的均方误差结果(图3A、B)。保留的16个非零系数、相关性最强的超声影像组学特征和相对应的系数(图3C)。
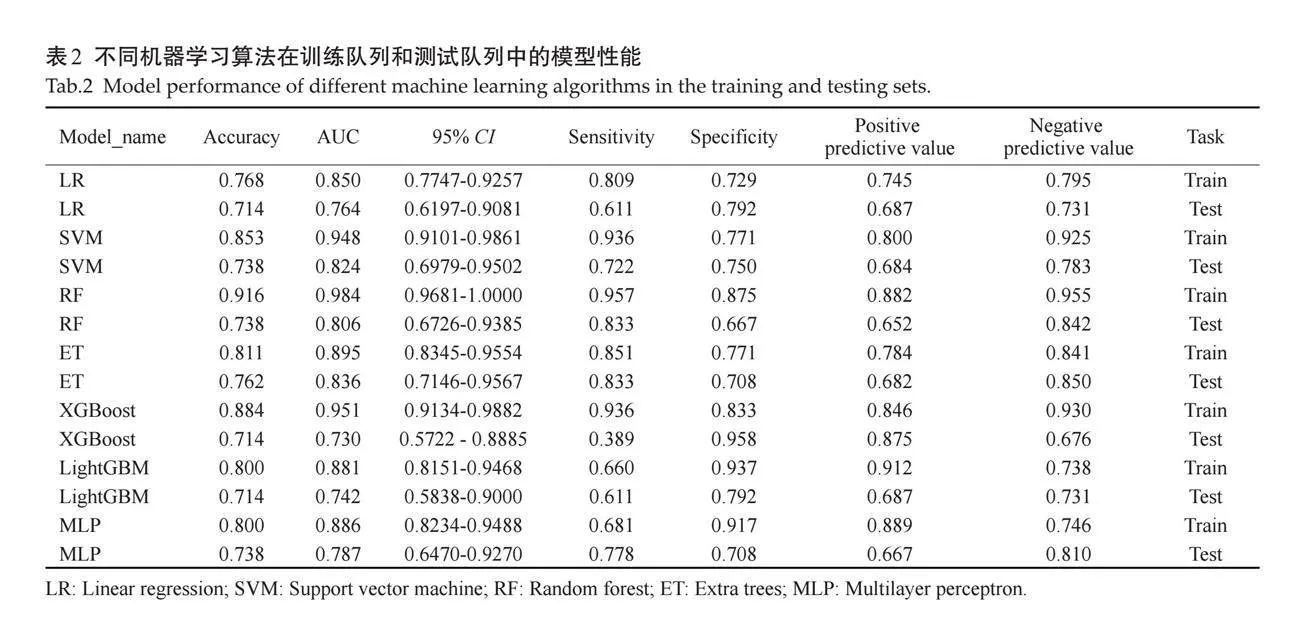
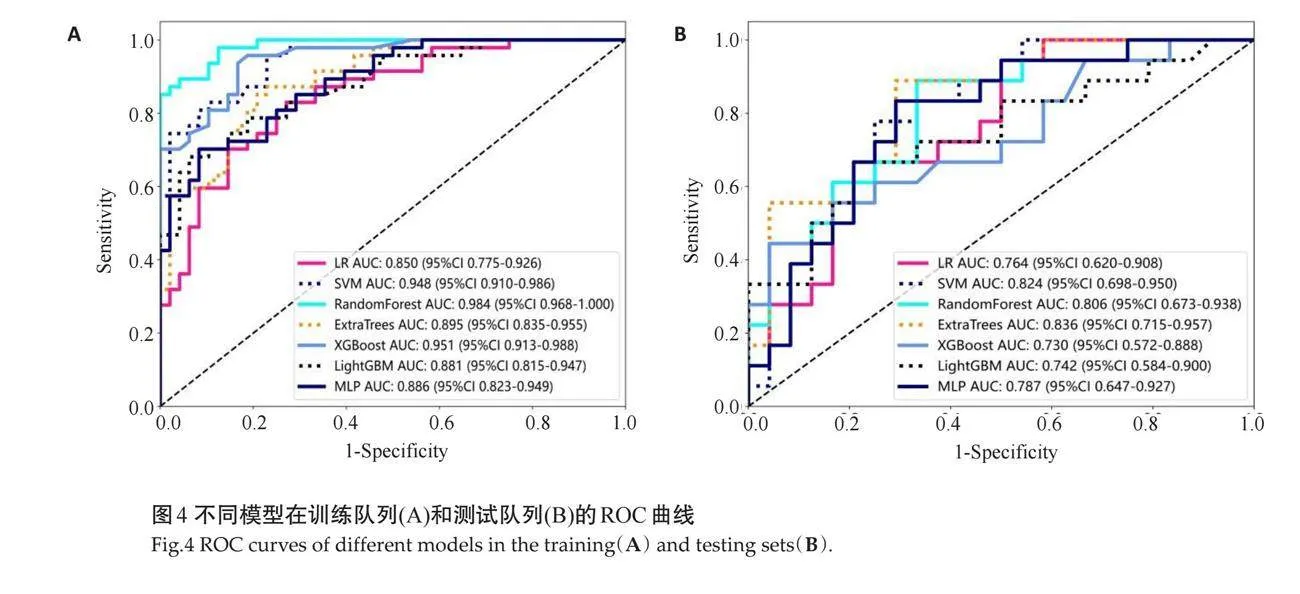
2.1.3 "影像特征模型的评估 " 对所有机器学习算法进行评估,结果显示所有模型的AUC均达到了0.7或更高(表2)。根据模型计算得分,绘制ROC曲线(图4)。
2.2 "临床特征模型构建
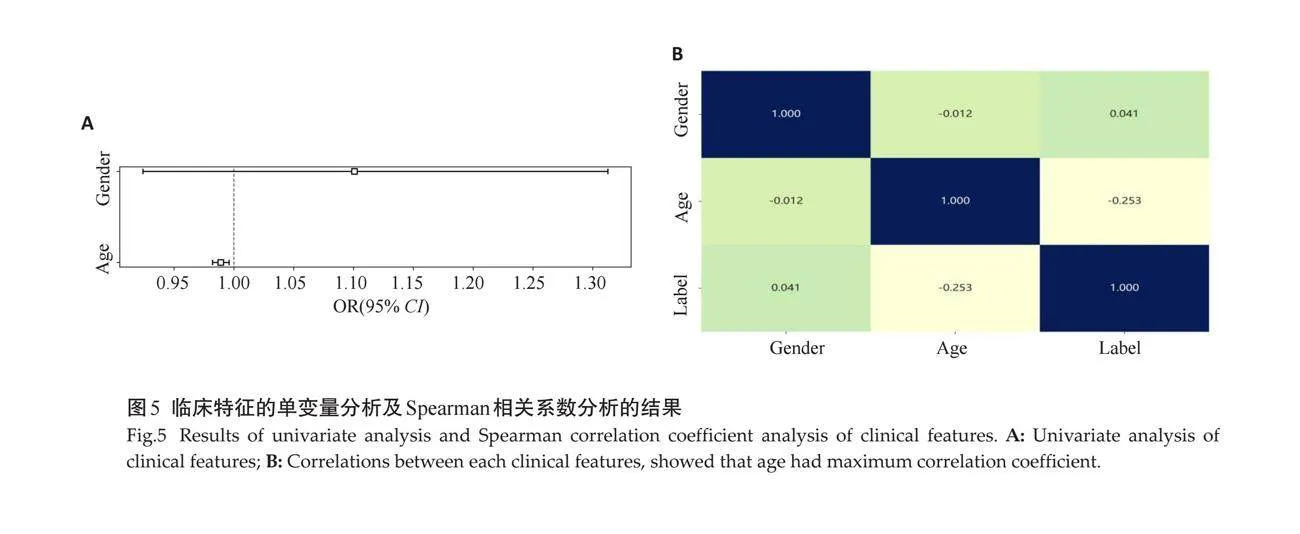
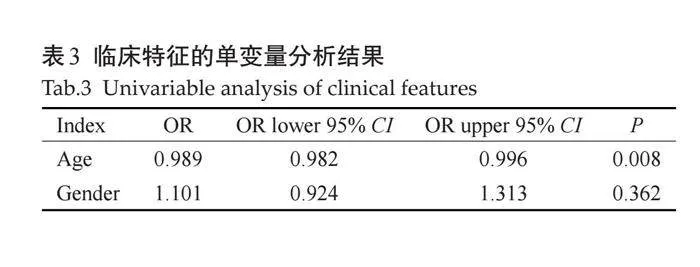
2.2.1 "患者临床数据分析 " 回顾性分析临床参数中包括年龄和性别2个参数,单变量逻辑回归分析结果显示,年龄的P值为0.008(OR: 0.989, 95% CI: 0.982~0.996),性别的P值为0.362(OR: 0.1.101;95%CI: 0.924~1.313,表3、图5A)。年龄是显著的临床特征,将其纳入联合模型的临床特征模型中。
Spearman相关分析结果显示,性别与PTC发生同侧中央区颈部淋巴结转移的相关系数为0.041,二者间无明显相关性;性别与年龄的相关系数为-0.012,二者间无明显的相关性。相对而言,年龄与PTC发生同侧中央区颈部淋巴结转移的相关系数为-0.253(图5B)。
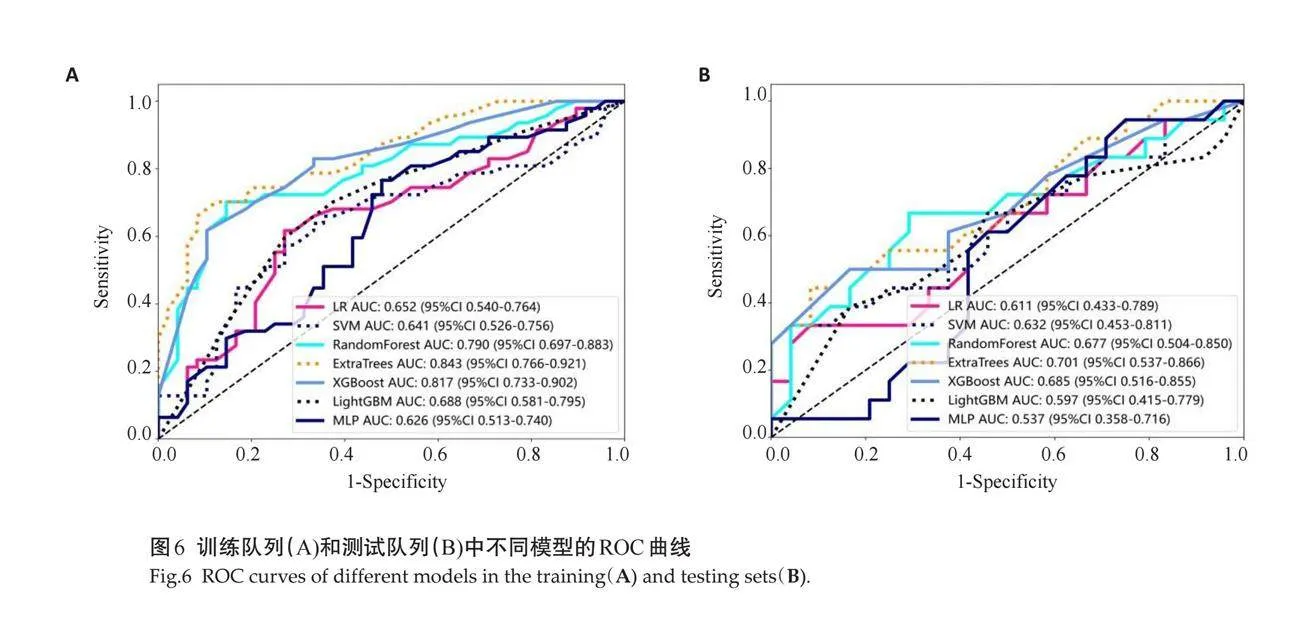
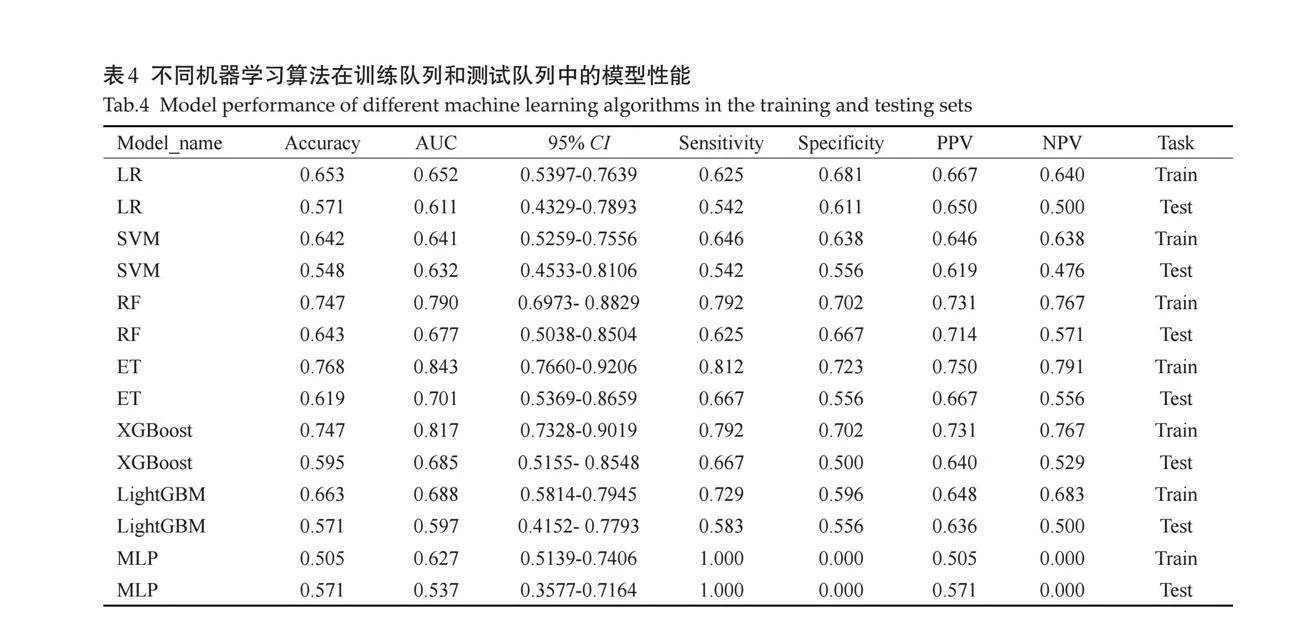
2.2.2 "评估指标 " 用和影像特征模型一致的7种常见机器学习方法(LR、SVM、RF、ET、XG Boost、Light GBM、MLP)进行了临床特征模型评估,绘制ROC曲线,最佳临床模型均为ET模型(表4、图6)。
2.3 "模型比较
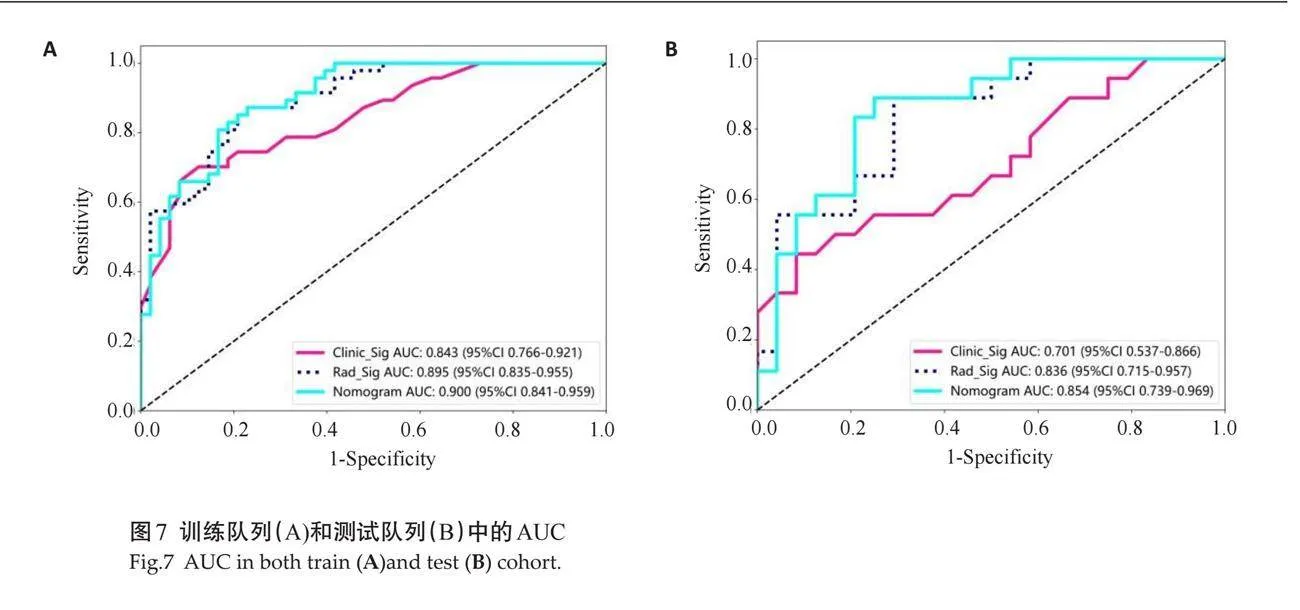
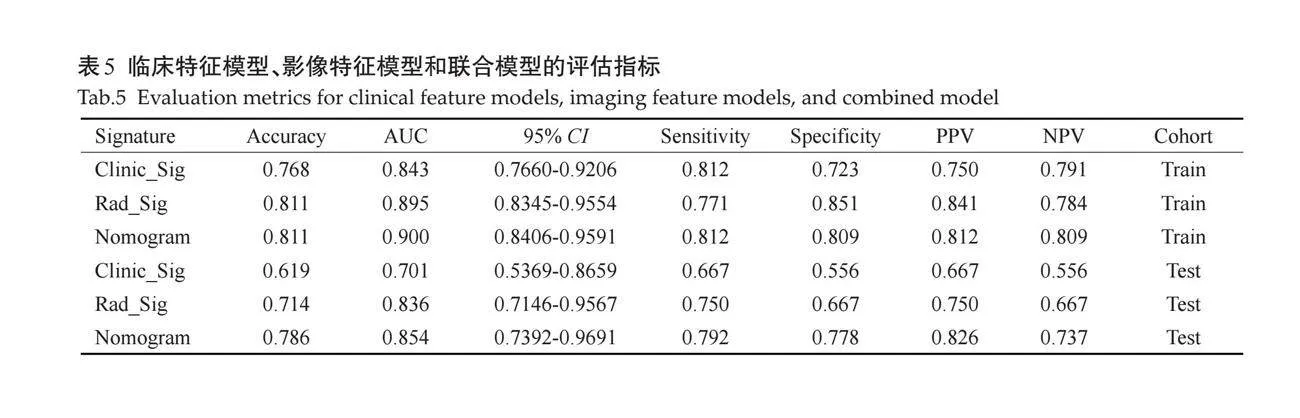
2.3.1 "AUC性能 " 训练队列中,影像特征模型预测的AUC为0.895(95% CI:0.8345~0.9554);临床特征模型预测的AUC为0.843(95% CI:0.7660~0.9206);联合模型预测的AUC为0.900(95% CI:0.8406~0.9591)。测试队列中,影像特征模型预测的AUC为0.836(95% CI:0.7146~0.9565);临床特征模型预测的AUC为0.701(95%CI:0.5369~0.8659);联合模型预测的AUC为0.854(95% CI:0.7392~0.9691,表5、图7)。
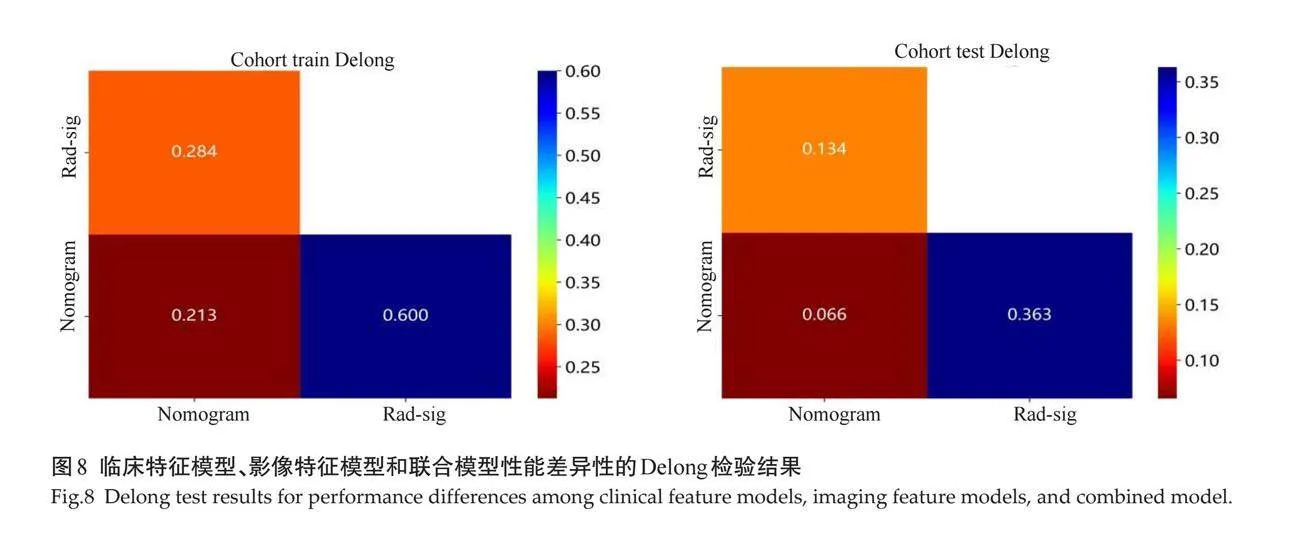
临床特征模型、影像特征模型和联合模型性能差异性的Delong检验结果显示,在训练队列和测试队列中,3种模型的AUC差异均无统计学意义(Pgt;0.05,图8)。
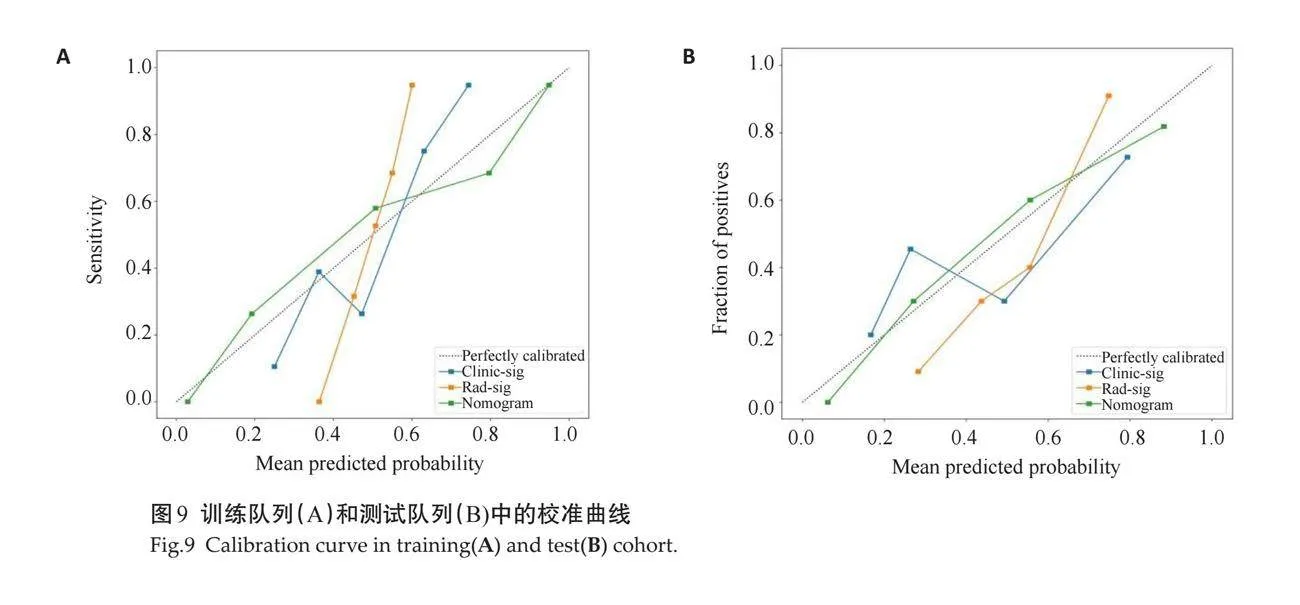
2.3.2 "校准曲线 " 联合模型整合在训练队列和测试队列中的计算校准曲线的量化结果分数分别为0.232和0.338(图9)。
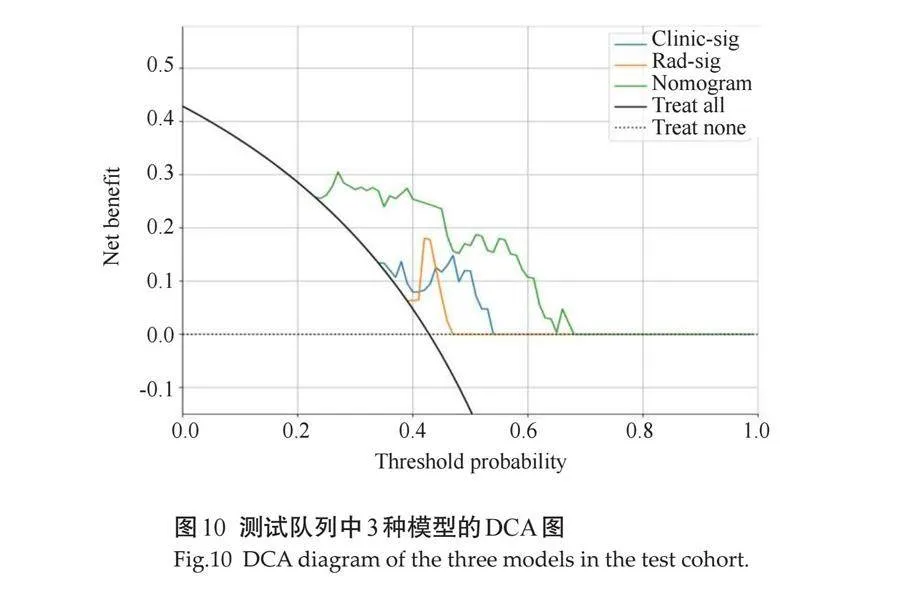
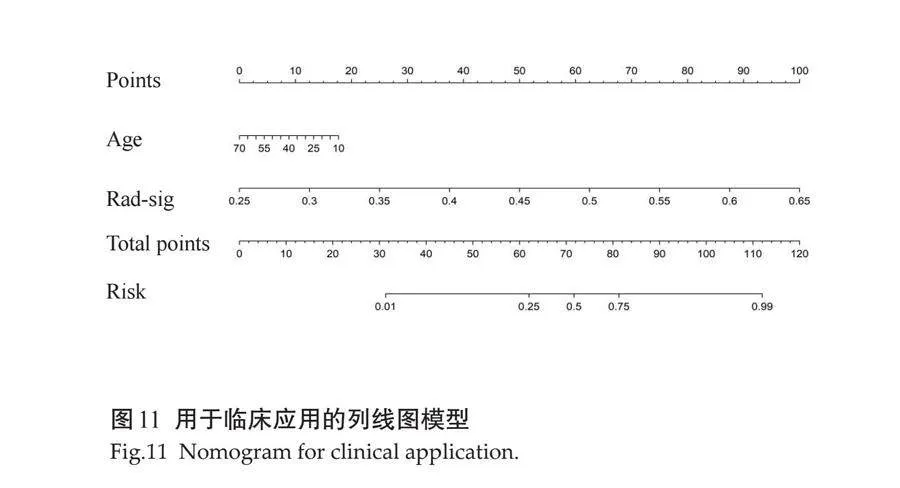
2.3.3 "DCA " 影像特征模型、影临床特征模型和联合模型的DCA结果显示。当风险阈值为0.22~0.64时,联合模型的净收益(即对PTC患者发生CLNM的预测能力)高于影像特征模型和临床特征模型(图10)。将PTC患者影像特征模型筛选出来的纹理特征及临床特征通过逻辑回归算法共同构建联合模型的列线图(图11)。
3 "讨论
临床诊断PTC的首选检查方式是超声检查,伴随着超声引导下甲状腺细针穿刺的广泛应用,PTC的检出率逐年升高。国外已经主张对cN0状态的PTC患者仅需行甲状腺叶切除术,不再进行预防性中央区淋巴结清扫[11-12] ,而我国对于中央区淋巴结的清扫术一直是甲状腺外科领域争议的话题,手术医师如何在术前区分良性增生淋巴结与恶性转移淋巴结是制定具体手术方案的关键环节。
作为诊断PTC的首选方法,超声检查对CLNM的检出率普遍较低。有研究显示,32.4%~84.3%临床淋巴结阴性(cN0)的PTC患者进行甲状腺全切除术和中央区淋巴结清扫术后,最终的病理报告发现颈部中央区转移性淋巴结阳性[13-16] ,PTC患者术前超声检查是否发生了CLNM的假阴性率仍较高。如果能在PTC患者术前将超声影像图像和人工智能计算机辅助诊断,建立有效的CLNM预测模型,减少医生的主观性、降低医生的漏诊率,更加全面地评估和分析PTC及CLNM的准确性,有利于外科手术方案的选择。
既往已有研究通过回顾性分析PTC相关的颈部淋巴结的位置、形态、回声、血流情况以及是否有钙化或液化等多种超声特征,建立预测CLNM的模型,但该模型仅限于超声可检出的淋巴结[17],无法对超声假阴性的潜在转移淋巴结进行判断。本研究旨在通过构建基于超声影像特征组学和/或临床特征的预测模型,并对比了3种模型的诊断效能和临床实用性,以更准确地预测PTC同侧CLNM的发生,期望这一模型能够为外科医生提供更可靠的术前评估工具,从而优化手术方式的选择并改善患者的预后。本研究对提取出来的影像纹理特征使用了ICC、统计筛选、相关系数筛选以及LASSO方法,最终将LASSO筛选的非0特征作为输入,进行影像特征模型建模;随后,为每个患者计算了一个由保留特征的线性组合加权得到的影像学得分。本研究对所有机器学习算法进行了评估,7种影像特征模型在训练队列中,最佳影像特征模型为RF模型;在测试队列中,最好的影像特征模型是ET模型。其中,训练队列和测试队列的RF模型的AUC分别为0.984、0.806,可知RF模型在训练队列和测试队列的不一致性,表现出过拟合的趋势。为了保证影像特征模型的稳定性和可持续性,在训练队列和验证队列中,ET模型的AUC值较高(0.895和0.836),表现该模型对PTC患者CLNM有着良好且稳定的预测作用,明显优于其余6个模型,故本研究最终选择ET模型作为最佳影像特征模型。
与以往临床预测研究类似,考虑到甲状腺炎症是否与PTC的CLNM有相关性存在争议,有较多研究认为两者无明确相关性,所以没有将血清学检查结果纳入模型当中[18-19] 。本研究仅选择性别、年龄纳入CLNM相关危险因素的研究范畴,进而回顾性分析临床参数,分别对这两个参数进行单变量逻辑回归分析和临床特征的Spearman秩相关系数,结果分别为-0.041和-0.253,临床特征的相关系数绝对值越大,意味着此参数的相关性越好,因此年龄具有最大的相关系数;同时在现有数据中,当患者年龄越小,发生CLNM的几率反而更大,这与既往研究[20-22] 结果也是一致的。因此,本研究结果也支持对年轻 CLNM患者行常规中央区淋巴结清扫术。7种临床特征模型在训练和测试队列中,ET模型对PTC患者CLNM具有一定的预测能力,因此最终选择ET模型作为最佳临床特征模型。
在训练队列中,临床特征模型和影像特征模型均得到了满意的表现。本研究进一步分别总结和对比了影像特征模型和临床特征模型的最佳模型(ET)。随后,采用逻辑回归算法将影像特征和临床特征整合到一个联合模型中,从而验证了联合模型优越的性能。结果显示,在影像特征模型的基础上加入临床特征风险因素整合的联合模型在训练队列和测试队列中的AUC、准确性、敏感度均比临床特征模型和影像特征模型有了显著的提高。Delong检验也证实了3种模型具有差异性,联合模型比其他两者优势更显著。联合模型的校准图显示了在预测是否发生了CLNM的训练队列和测试队列中,预测结果与观察结果之间的强烈一致性。为检验本研究的联合模型在训练队列和测试队列中预测患者PTC发生同侧中央区颈部淋巴结转移与临床外科切除术后得到的病理结果的相符程度,本研究进行了Hosmer-Lemeshow测试,以评估临床特征模型、影像特征模型和联合模型的拟合程度,它能直观展示模型觉得预测概率与实际发生转移的一致性,仍是目前评价模型校准度的首选指标。Hosmer-Lemeshow检验显示联合模型在训练队列和测试队列中的计算校准曲线的量化结果分数分别为0.232和0.338,联合模型预测患者PTC同侧CLNM的预测结果与外科手术后病理结果的一致性较好,表示联合模型的预测效果好。常规情况下判断一种诊断方法是否好用,一般是采用ROC曲线法,并计算其AUC。但是ROC仅从该诊断方法的特异度和敏感度考虑,而在临床工作中,特异度、敏感度和准确性不代表一定适合患者的诊疗。为使患者净获益最大,本研究通过绘制DCA进一步量化评估联合模型对不同需求的患者真正的获益,结果显示3种模型的决策曲线均高于两条极端线,说明3种模型均可用于预测PTC患者同侧CLNM,其中联合模型的患者净获益率相对更高,也说明联合模型对比影像特征模型和临床特征模型效能更好。
本研究的局限性在于:联合模型数据较为单一,仅考虑了患者年龄和影像特征组学。既往研究表明,PTC的大小也已经被证实为CLNM的预测因素[23-24] 。PTC同侧叶单发或者是多发也可以成为单变量分析,成为一种独立的模型,最终加入到联合模型中,提高联合模型的预测准确性;本研究为单中心研究,且纳入样本有限。尚待今后行大样本、多中心研究进一步验证;甲状腺峡部的乳头状癌发生中央区淋巴结转移的几率最高[25-26] ,而肿瘤的位置位于甲状腺中部或者下极的时候,中央区淋巴结转移的风险可能会比上极的更高,然而甲状腺上极的肿瘤发生颈侧区部Ⅱ、Ⅲ、Ⅳ区淋巴结转移的概率比中、下极要更高[27-28] ,除了肿瘤的影像组学纹理特征和临床数据,还有基因、肿瘤的位置、肿瘤的大小等等因素可作为预测CLNM的独立因素;超声检查结果一定程度上受限于检查操作者经验,可能存在一定偏倚,未来超声检查规范化的操作、诊断和报告有助于减少这种偏倚;人工手工勾画ROI的肿瘤区域不可避免会存在偏差。后续研究将对此作更深入讨论。
综上,与不使用预测模型(即全部治疗或不治疗方法)的情况相比,联合模型在引导具有预测概率的患者干预方面具有非常显著的优势。采用联合模型进行术前预测是否发生了CLNM具有显著的临床效益,有助于减少医生因传统诊断方式的主观因素引起的漏诊、误诊,提高疾病诊断的准确率,减少对患者不必要的创伤和并发症的发生,为临床外科医生提供更加精准的检查结果,提高患者术后的预后情况和生活质量。
参考文献:
[1] " Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA A Cancer J Clinicians, 2019, 69(1): 7-34.
[2] " "Vaccarella S, Franceschi S, Bray F, et al. Worldwide thyroid-cancer epidemic? the increasing impact of overdiagnosis[J]. N Engl J Med, 2016, 375(7): 614-7.
[3] " Londero SC, Krogdahl A, Bastholt L, et al. Papillary thyroid carcinoma in Denmark, 1996‑2008: outcome and evaluation of established prognostic scoring systems in a prospective national cohort[J]. Thyroid, 2015, 25(1): 78-84.
[4] " "龚 "勇, 许 "军. 甲状腺乳头状癌手术方式选择与争议[J]. 中国现代普通外科进展, 2019, 22(2): 126-9.
[5] " 段天鹏, 尹建军. 甲状腺癌患者的超声及CT影像学表现及诊断价值[J]. 中国CT和MRI杂志, 2017, 15(2): 42-4.
[6] " 袁文利, 王玉梅, 王 "勇, 等. 甲状腺癌的超声影像学诊断与病理学对照研究[J]. 中华普外科手术学杂志: 电子版, 2018, 12(3): 234-7.
[7] " Wu LM, Gu HY, Qu XH, et al. The accuracy of ultrasonography in the preoperative diagnosis of cervical lymph node metastasis in patients with papillary thyroid carcinoma: a meta-analysis[J]. Eur J Radiol, 2012, 81(8): 1798-805.
[8] " Suh CH, Choi YJ, Lee JJ, et al. Comparison of core-needle biopsy and fine‑needle aspiration for evaluating thyroid incidentalomas detected by 18F-fluorodeoxyglucose positron emission tomography/computed tomography: a propensity score analysis[J]. Thyroid, 2017, 27(10): 1258-66.
[9] " Du JC, Yang Q, Sun YX, et al. Risk factors for central lymph node metastasis in patients with papillary thyroid carcinoma: a retrospective study[J]. Front Endocrinol, 2023, 14: 1288527.
[10] Lambin P, Rios-Velazquez E, Leijenaar R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. Eur J Cancer, 2012, 48(4): 441-6.
[11] Lebbink CA, Links TP, Czarniecka A, et al. 2022 European Thyroid Association Guidelines for the management of pediatric thyroid nodules and differentiated thyroid carcinoma[J]. Eur Thyroid J, 2022, 11(6): e220146.
[12] Sugitani I, Ito Y, Miyauchi A, et al. Active surveillance versus immediate surgery: questionnaire survey on the current treatment strategy for adult patients with low‑risk papillary thyroid microcarcinoma in Japan[J]. Thyroid, 2019, 29(11): 1563-71.
[13] Ahn BH, Kim JR, Jeong HC, et al. Predictive factors of central lymph node metastasis in papillary thyroid carcinoma[J]. Ann Surg Treat Res, 2015, 88(2): 63-8.
[14] Chen Q, Wei T, Wang XL, et al. The total number of prelaryngeal and pretracheal lymph node metastases: is it a reliable predictor of contralateral central lymph node metastasis in papillary thyroid carcinoma?[J]. J Surg Res, 2017, 214: 162-7.
[15] Ji YB, Yoo HS, Song CM, et al. Predictive factors and pattern of central lymph node metastasis in unilateral papillary thyroid carcinoma[J]. Auris Nasus Larynx, 2016, 43(1): 79-83.
[16] Yoo HS, Shin MC, Ji YB, et al. Optimal extent of prophylactic central neck dissection for papillary thyroid carcinoma: comparison of unilateral versus bilateral central neck dissection[J]. Asian J Surg, 2018, 41(4): 363-9.
[17] Patel NU, McKinney K, Kreidler SM, et al. Ultrasound-based clinical prediction rule model for detecting papillary thyroid cancer in cervical lymph nodes: a pilot study[J]. J Clin Ultrasound, 2016, 44(3): 143-51.
[18] Wang ZP, Chang QG, Zhang HY, et al. A clinical predictive model of central lymph node metastases in papillary thyroid carcinoma[J]. Front Endocrinol, 2022, 13: 856278.
[19] Luo QW, Gao S, Lv X, et al. A novel tool for predicting the risk of central lymph node metastasis in patients with papillary thyroid microcarcinoma: a retrospective cohort study[J]. BMC Cancer, 2022, 22(1): 606.
[20] Oh HS, Park S, Kim M, et al. Young age and male sex are predictors of large-volume central neck lymph node metastasis in clinical N0 papillary thyroid microcarcinomas[J]. Thyroid, 2017, 27(10): 1285-90.
[21] Ito Y, Miyauchi A, Kihara M, et al. Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation[J]. Thyroid, 2014, 24(1): 27-34.
[22] "田晨曦, 师 "帅, 付言涛. 甲状腺癌喉前淋巴结转移的影响因素及预测意义[J]. 中国实验诊断学, 2021, 25(3): 458-61.
[23] "张晓梅, 康燕飞, 桑 "田, 等. 超声检查指标联合预测甲状腺乳头状癌颈部中央区淋巴结转移的价值研究[J]. 中国全科医学, 2022, 25(3): 305-11.
[24] Medas F, Canu GL, Cappellacci F, et al. Predictive factors of lymph node metastasis in patients with papillary microcarcinoma of the thyroid: retrospective analysis on 293 cases[J]. Front Endocrinol, 2020, 11: 551.
[25] Campennì A, Giovanella L, Siracusa M, et al. Is malignant nodule topography an additional risk factor for metastatic disease in low-risk differentiated thyroid cancer?[J]. Thyroid, 2014, 24(11): 1607-11.
[26] "王文超, 杨 "丽, 张春霞. 伴颈部Ⅵ区淋巴结转移的甲状腺乳头状癌临床分析[J]. 现代肿瘤医学, 2017, 25(1): 45-7.
[27] "吴伟力, 范丽妫, 王瓯晨, 等. 甲状腺上下极淋巴引流与中央区淋巴结相关性研究[J]. 中国现代医生, 2012, 50(14): 129-30, 132.
[28] "边 "学, 徐震纲, 张 "彬, 等. 分化型甲状腺癌的颈淋巴转移规律[J]. 中华耳鼻咽喉头颈外科杂志, 2006, 41(8): 599-602.
(编辑:林 "萍)
