超声检测多部位内脏脂肪与脑卒中的相关性研究
2024-10-31汤敏闫天慧杨倩孙慧张霞


摘要:目的 "应用超声检测多部位内脏脂肪,评估其与缺血性脑卒中(CIS)的关联,识别相关风险因素,为CIS的早期诊断和预防提供新的视角。方法 "连续纳入2022年9月~2023年9月在皖南医学院弋矶山医院神经内科确诊为缺血性脑卒中的患者89例及健康志愿者90例,分别作为卒中组和对照组,采用超声技术测量多个部位内脏脂肪参数并进行组间比较。结果 "两组在中国人内脏脂肪指数、颈动脉内中膜厚度(IMT)、心外膜脂肪组织(EAT)、腹膜前脂肪厚度、右肾后周脂肪厚度、内脏脂肪体积及左右肾脂肪囊厚度等多个内脏脂肪参数的差异均有统计学意义(Plt;0.05),其中EAT的OR值为2.258(1.805~2.834),明显高于其他指标。多因素Logistic回归分析显示,IMT(OR=1.004,P=0.013)、EAT(OR=4.040,Plt;0.001)对CIS的影响有统计学意义;ROC曲线分析显示IMT、EAT的曲线下面积分别为0.708、0.882,有较高的敏感度,确定其临界值分别为1275 μm、17.54 mm。结论 "超声测量多部位内脏脂肪参数与CIS有关,IMT、EAT是CIS的独立影响因素,IMT、EAT值越大患CIS的风险越高,其中EAT的诊断效能更高;当超声检测的EAT超过临界值时,临床可以通过早期指导或干预以降低卒中的发病风险。
关键词:脂肪;内脏脂肪测量;超声检测;缺血性脑卒中
A preliminary study of the correlation between ultrasound detection of multi site visceral fat and cerebral ischemic stroke
TANG Min, YAN Tianhui, YANG Qian, SUN Hui, ZHANG Xia
Department of Ultasound Medicine, The First Affiliated Hospital of Wannan Medical College, Wuhu 241001, China
Abstract: Objective To evaluate the association between visceral fat in multi sites and cerebral ischemic stroke (CIS) by applying ultrasound detection, identify relevant risk factors, and provide a new perspective for the early diagnosis and prevention of CIS. Methods Eighty‑nine patients diagnosed with CIS in the neurology department of Yijishan Hospital, Wannan Medical College as well as 90 healthy volunteers from September 2022 to September 2023 "were included, as stroke group and control group respectively. Ultrasound technology was used to measure visceral fat parameters in multi sites, and compared between groups. Results The differences of Chinese visceral adiposity index, intima-media thickness (IMT), epicardial adipose tissue (EAT), preperitoneal fat thickness, posterior right periphery fat thickness, visceral adipose tissue and left or right renal fat sac thickness between the two groups were statistically significant (Plt;0.05). The OR value of EAT was 2.258 (1.805-2.834), which was significantly higher than other indicators. After adjusting for multiple variables, multivariate Logistic regression analysis showed that IMT (OR=1.004, P=0.013) and EAT (OR=4.040, Plt;0.001) had a statistically significant impact on CIS. ROC curve analysis determined that the AUC values of IMT and EAT were 0.708, 0.882, respectively, which had high sensitivity, and the critical values were 1275 μm and 17.54 mm, respectively. Conclusion Ultrasound measurement of multi sites visceral fat parameters is related to CIS, and IMT and EAT are independent influencing factors of CIS. The higher the IMT and EAT values, the higher the risk of developing CIS, with EAT having higher diagnostic efficacy.
Keywords: fat; visceral fat measurement; ultrasound detection; cerebral ischemic stroke
脑卒中具有高发病率、高致残率、高死亡率、高复发率、高经济负担等特点[1],其中缺血性脑卒中(CIS)约占脑卒中的70%[2]。流行病学调查显示肥胖是脑卒中的重要危险因素,脂肪堆积会增加心脑血管疾病的发病率[3]。一项通过CT测量腹部脂肪的研究显示,内脏脂肪的蓄积与无症状性脑梗死独立相关,而与肥胖一般测量指标如腰围等无关[4]。近年来,人们更加关注脂肪组织分布而非整体肥胖对脑卒中的重要预测价值[5]。有研究证实,较高的皮下脂肪和较低的内脏脂肪与缺血性脑卒中及其治疗后的功能预后程度呈负相关[6],说明脂肪组织的分布可能有助于评估脑卒中的风险和预后。临床上量化内脏脂肪的现有手段主要包括CT和MRI,这两种技术操作复杂、费时、成本高并且具有放射性。虽然目前对于内脏脂肪的测量较少使用超声,但是研究发现超声测量的内脏脂肪指标与CT和MRI 获得的内脏脂肪指标有很强的相关性[7],同时具有重复性良好、无创、简单安全及经济等一系列优点,可见超声测量内脏脂肪更具有优势。既往有研究通过超声测量内脏脂肪并评估超声指标对CIS的预测作用,结果发现只有心外膜脂肪组织对卒中有显著的预测价值[8],但是该研究应用超声测量的内脏脂肪指标较少,且未测量脏器周围脂肪,不能具体地反映人体各部位内脏脂肪与脑卒中的相关性。本研究旨在通过超声检测多部位内脏脂肪,评估各脂肪指标与缺血性脑卒中的相关性,找出CIS的危险因素,以期为脑卒中的早期预防、诊断和治疗提供新的策略和指标。
1 "资料与方法
1.1 "一般资料
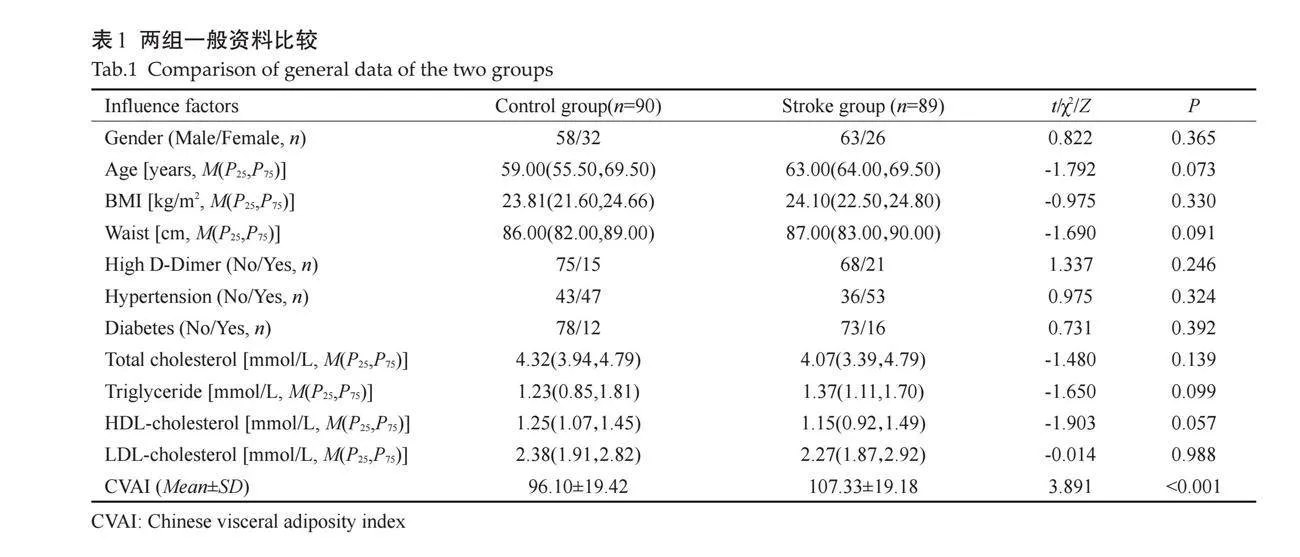
选取2022年9月~2023年9月在皖南医学院弋矶山医院神经内科确诊为CIS的患者89例及健康志愿者90例。CIS患者纳入标准参考符合依据《中国急性缺血性脑卒中诊治指南2018》中的脑卒中诊断标准[9]。纳入标准:年龄gt;18岁;符合上述脑卒中的诊断标准,即起病急,具有局灶性神经功能症状或体征,并经颅脑CT或MRI证实病灶存在;临床检查资料无缺失且愿意参与此次研究。排除标准:心力衰竭或严重的心脏瓣膜缺陷;心源性脑卒中;过去5年内的肿瘤疾病、继发性肥胖原因或既往肥胖干预、体质量意外下降10%;超声成像质量差;BMI≥25 kg/m2或lt;18.5 kg/m2。本研究获得皖南医学院弋矶山医院伦理委员会的审批,伦理审批号:(2019)伦审研第(88)号,受检患者及其家属均已签署知情同意书。两组间性别、年龄、BMI、腰围、一般病史及血脂等生化指标的差异均无统计学意义(Pgt;0.05),中国人内脏脂肪指数(CVAI)的差异有统计学意义(Plt;0.05,表1)。
1.2 "仪器与方法
1.2.1 仪器 " Philips EPIQ7C超声诊断仪,配有线阵、凸阵及扇形探头。
1.2.2 "一般资料获取 " 年龄、性别、体质量、身高、BMI、腰围、高血压和糖尿病史以及血脂。通过完整的一般资料计算受试者的CVAI,计算公式为:
男性CVAI=-267.93+0.68×年龄+0.03×BMI+4.00×腰围+22.00×Log10甘油三酯−16.32×高密度脂蛋白胆固醇;
女性CVAI=-187.32+1.71×年龄+4.23×BMI+1.12×腰围+39.76×Log10甘油三酯−11.66×高密度脂蛋白胆固醇[10]。
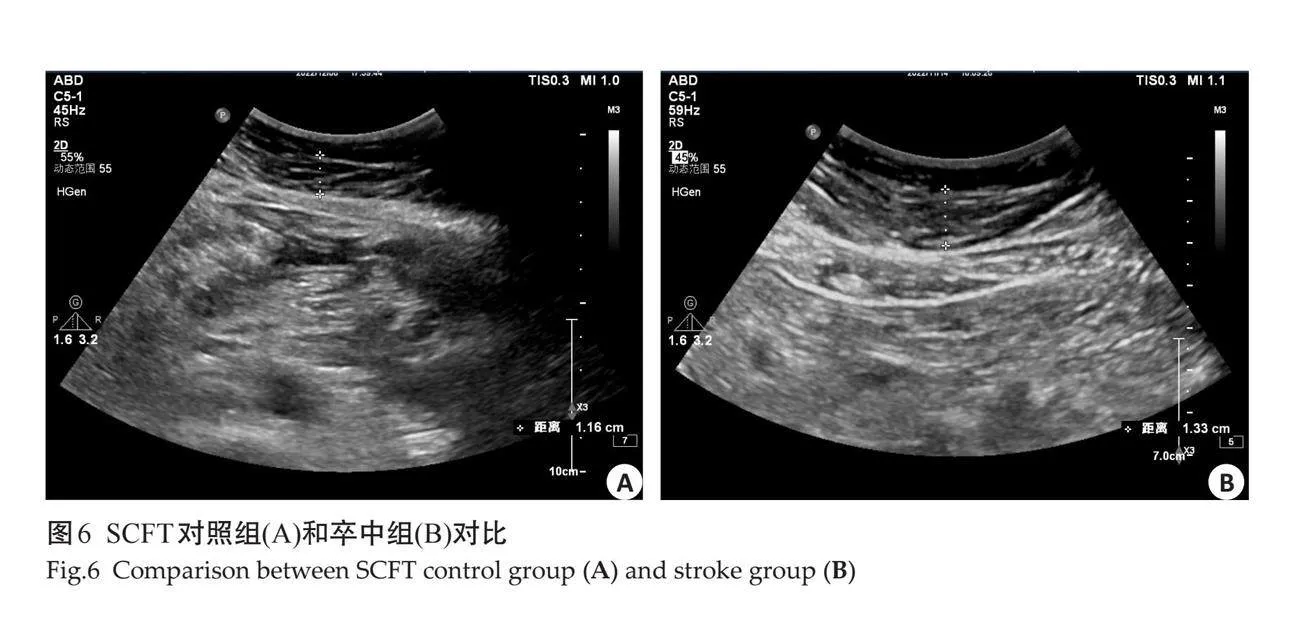
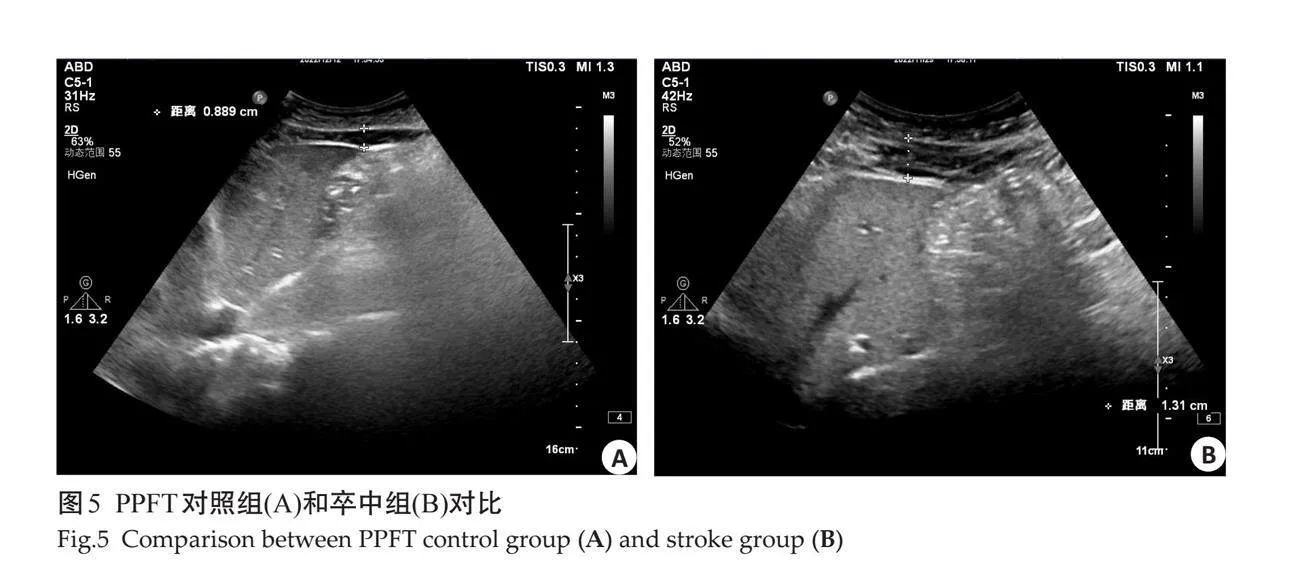
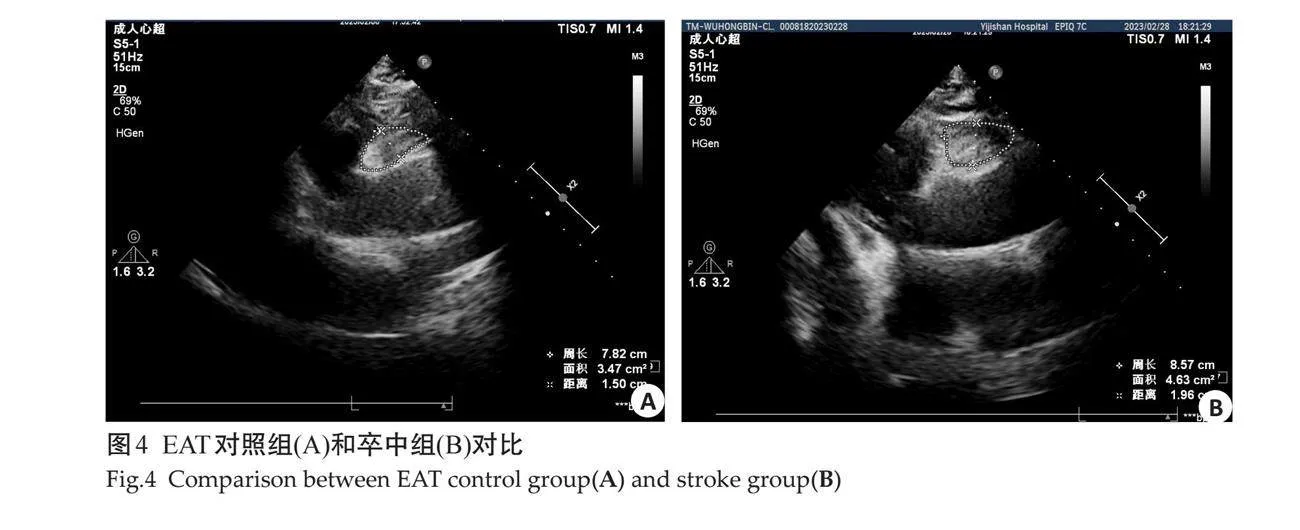
1.2.3 "腹部脂肪测量 " 检查均由1位经验丰富的超声科高年资医师完成,参与者取仰卧位,使用凸阵探头进行检查,为避免呼吸干扰,于呼气末取图,测量时轻压腹壁以避免低估测量指标,进行以下测量:在脐部和剑突之间测量皮下脂肪厚度(SCFT)即腹白线和脂肪-皮肤界面之间的最小脂肪厚度;在右肾后壁的肾周间隙测量右肾后周脂肪厚度(PRPFT)[11],并在左、右肾下极测量脂肪囊最厚的部位,即为左右肾下极脂肪囊厚度。腹膜前脂肪厚度(PPFT)测量腹白线和肝脏上表面之间的最大脂肪厚度;在脐上方1 cm处测量腹直肌的内侧到腹主动脉前壁的厚度即腹部内脏脂肪厚度(VFT)[12];同时还测量了腹直肌内侧到腹主动脉后壁之间的厚度及脾静脉和腹肌内侧之间的距离并联合其它测量值计算内脏脂肪体积(VAT)[13]。然后嘱患者取左侧卧位,使用心脏探头,在胸骨左缘2~3肋间取得胸骨旁左心室长轴切面,并且以主动脉瓣环作为解剖标志,收缩期测量壁层心包与右室游离壁之间的低回声区的最大厚度即心外膜脂肪组织(EAT)[14]。所有患者均进行3次扫查,取均值。
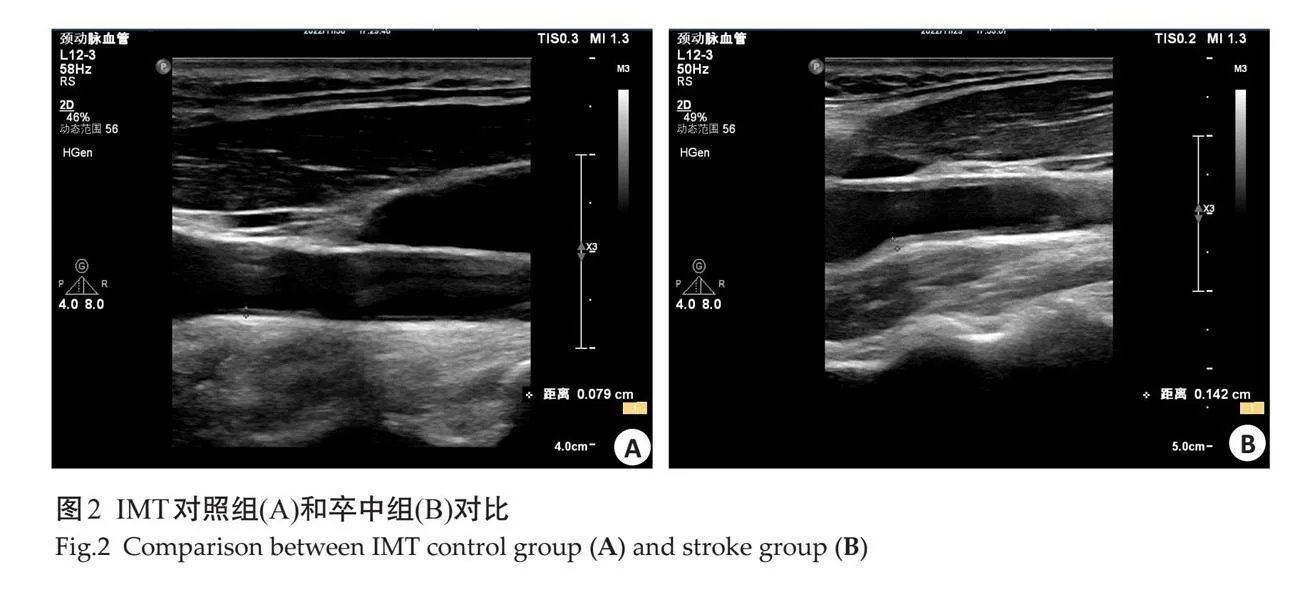
1.2.4 "颈部血管测量 " 颈动脉彩超由同一位医师进行,参与者取仰卧位,头略后仰,使用线性阵列探头进行,在颈总动脉远段(分叉水平下方1.0~1.5 cm),避开斑块位置,测量内膜内缘至中膜外缘的最大垂直距离,即为IMT厚度,双侧颈部血管均进行扫查,若仅有一侧血管IMT增厚,则选取最厚处为参考标准。颈动脉外中膜厚度(EMT)是颈动脉中膜-外膜边界与颈静脉壁-管腔界面之间的距离,以标准化方案手动测量,在窦部近段测最厚的距离[15]。所有患者均进行3次扫查,取均值。
1.3 "统计学分析
采用SPSS25.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,两两比较采用t检验;不符合正态分布的计量资料以中位数及四分位数表示,两两比较采用U检验;计数资料以n(%)表示,组间比较采用χ2检验;对组间有差异的影响因素进行单因素及多因素二元Logistic回归分析。采用ROC曲线确定独立影响因素的最佳截断值;一致性分析采用组内相关性分析进行检验。以Plt;0.05为差异有统计学意义。
2 "结果
2.1 "两组内脏脂肪各指标比较
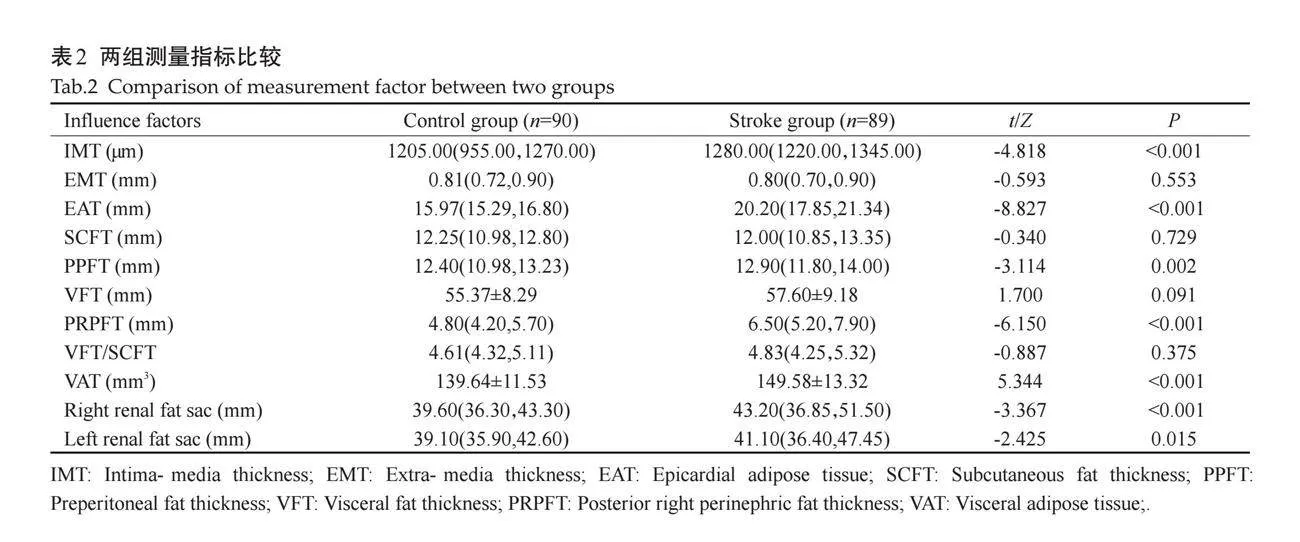
两组IMT、EAT、PPFT、PRPFT、VAT及左、右肾脂肪囊厚度相比,差异有统计学意义(Plt;0.05);两组EMT、SCFT、VFT、VFT/SCFT相比差异无统计学意义(Pgt;0.05,表2)。
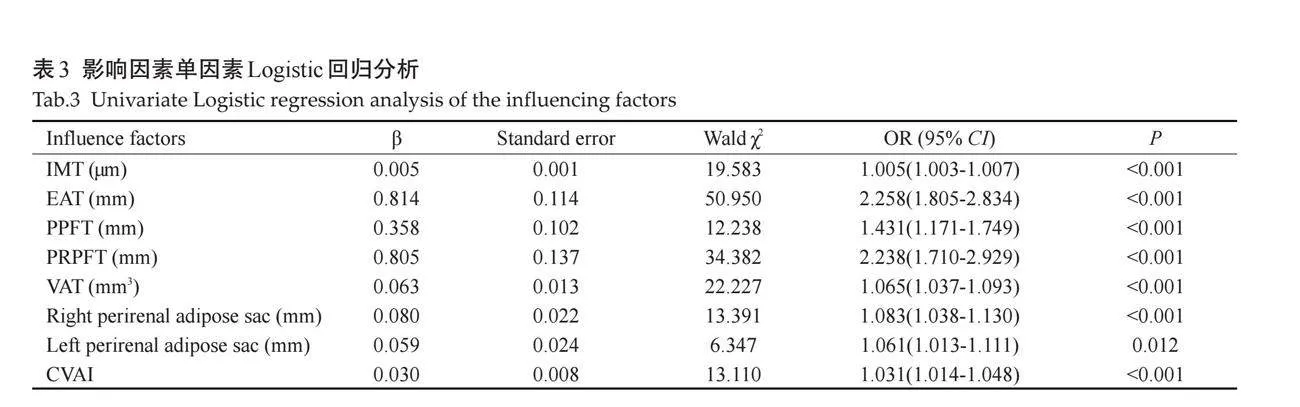
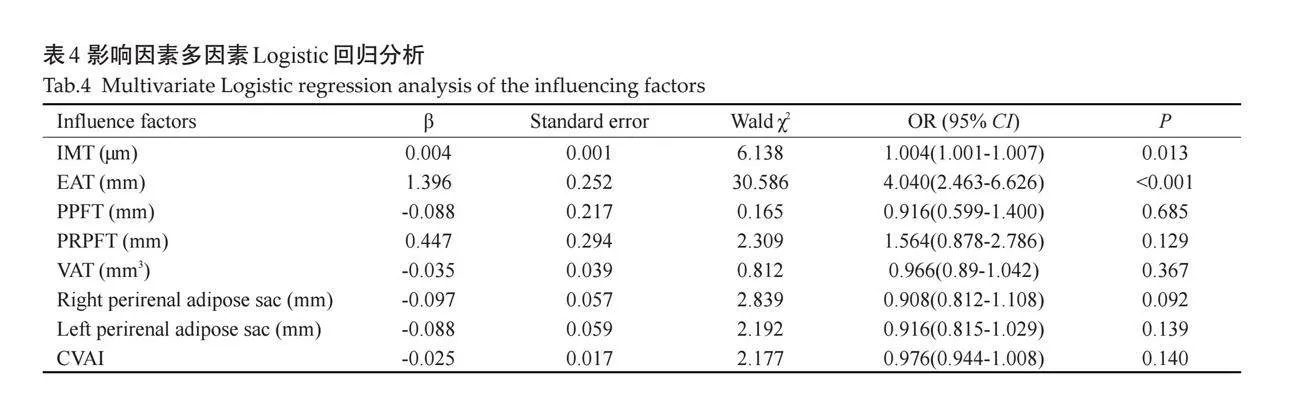
2.2 "单因素及多因素Logistic回归分析
CVAI、IMT、EAT、PPFT、PRPFT及左、右肾脂肪囊值越大患CIS的风险越高,差异有统计学意义(Plt;0.05,表3);调整多变量后再进行分析,结果显示两组间IMT、EAT的差异仍有统计学意义(Plt;0.05,表4)。
2.3 ROC曲线分析
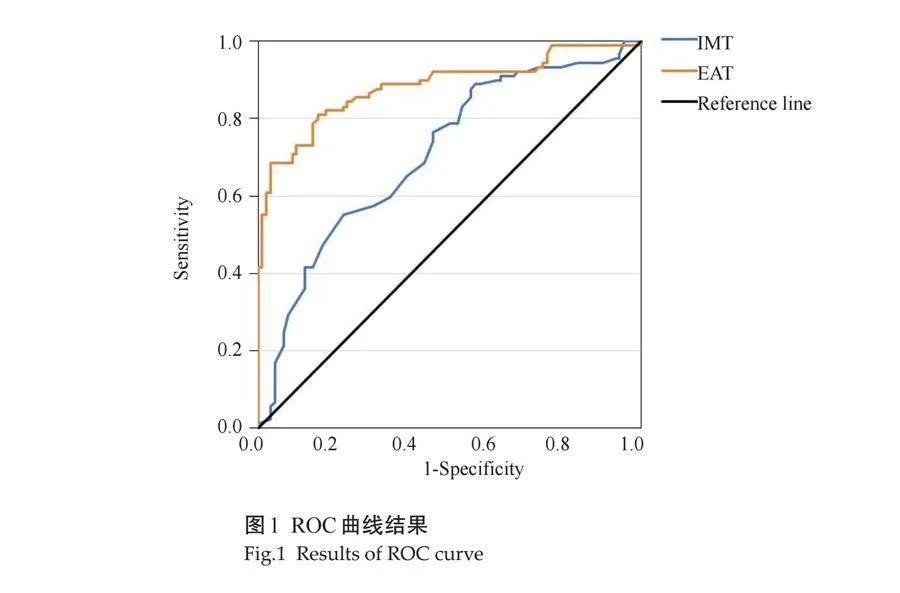
IMT、EAT的AUC值分别为0.708(95%CI: 0.632~0.784)、0.882(95%CI: 0.830~0.933),其中EAT对CIS有较好的诊断价值,计算出其临界值分别为1275 μm、17.54 mm,其敏感度分别为55.1%、77.8%,特异度分别为87.8%、84.4%,约登指数分别为0.329、0.653(图1)。
2.4 "一致性分析
由另一位经验丰富的超声科医师按照同样的测量标准对EAT及IMT进行测量,组内相关性分析结果显示,一致性系数分别为0.874、0.995。
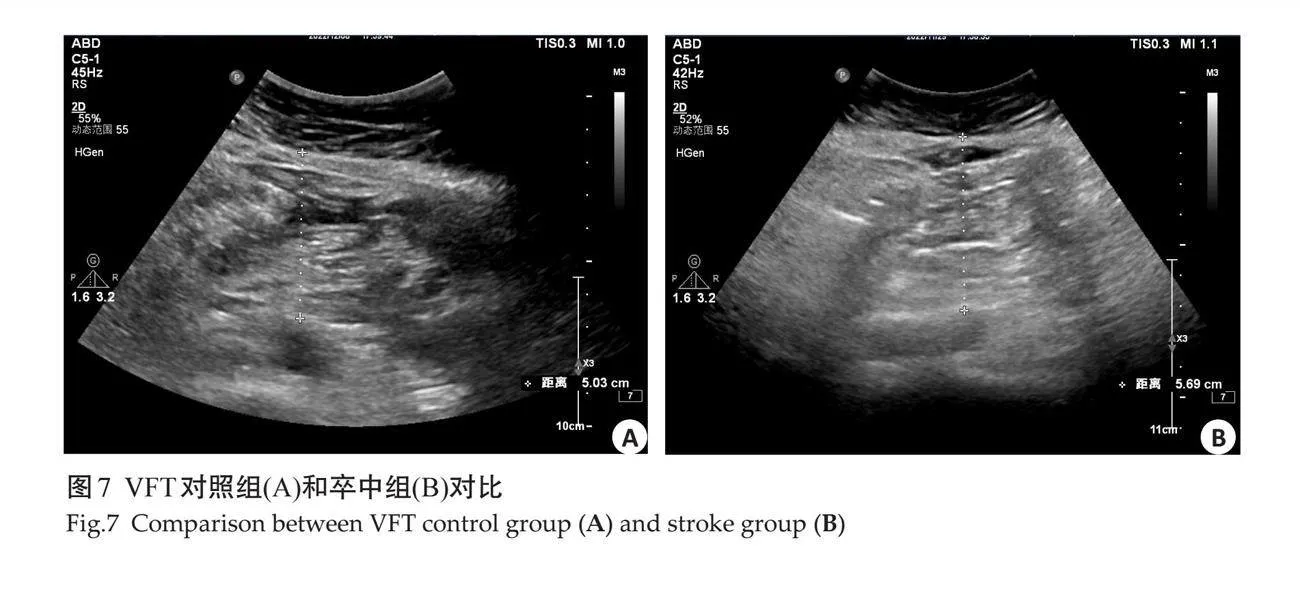
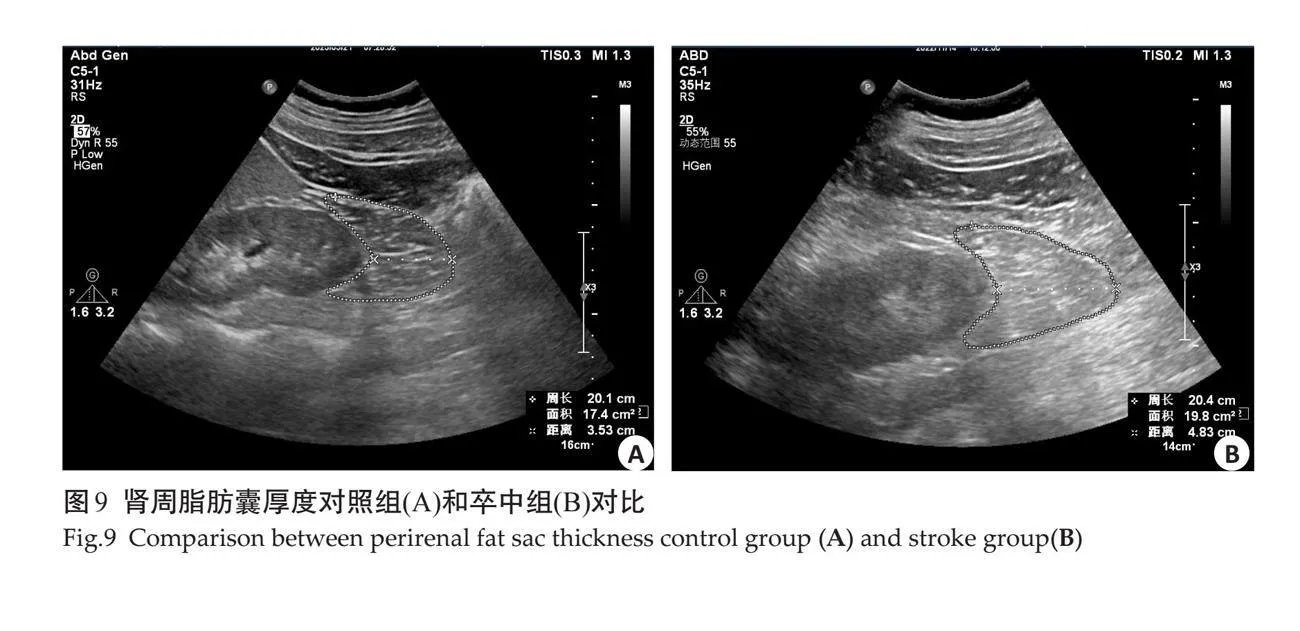
2.5 "典型图例
对照组与卒中组在超声测量指标具有差异性,其中卒中组的颈动脉指标只有IMT(图2)的测量值大于对照组,而EMT在两组之间无明显差异(图3)。卒中组脂肪指标中EAT、PPFT、PRPFT及左右肾周脂肪囊测量值大于对照组,SCFT及VFT在两组之间的测量差异不显著(图4~9)。
3 "讨论
VAT是用于储存过量能量的主要部位,但它也是影响有机体代谢的重要内分泌器官[16],脂肪细胞会分泌局部和全身的促炎细胞因子,导致胰岛素抵抗及代谢紊乱等,进而破坏心脑血管以及器官的正常功能[17]。研究显示,内脏脂肪异常堆积不仅会增加颅内动脉硬化狭窄的风险,而且与中风发病率呈正相关[18-19]。因此,本研究通过超声测量内脏脂肪,从而探讨内脏脂肪与脑卒中的关系。本研究结果显示,两组患者在一般资料方面仅CVAI有差异,而超声测量指标如IMT、EAT、PPFT、PRPFT、VAT及肾周脂肪囊等在两组间均有差异。单因素分析显示,随着IMT、EAT、PPFT、PRPFT、VAT及左右肾周脂肪囊厚度的增大,患CIS的风险增加;将上述指标进行多变量回归分析,结果显示IMT、EAT是CIS的独立危险因素。
EAT是胚胎性的腹部器官,它属于一种内脏脂肪,当EAT异常堆积时产生的促炎性脂肪因子(例如脂联素等)以及游离脂肪酸可以通过旁分泌作用于邻近冠脉或全身血管,引起冠脉及颅内血管动脉粥样硬化的发生;同时,EAT紧贴心肌可产生心房心肌脂肪浸润,从而改变心房电生理特性,引发房颤,这两种病理改变都可能导致脑卒中的发生发展[20-22]。本研究发现EAT是CIS的独立危险因素,并且随着心外膜脂肪的增厚,患者发生卒中的风险会随之增加,这与既往研究[8]一致,其研究认为EAT应作为确认卒中风险的工具应用于临床实践。但是既往研究中IMT与脑卒中没有明显相关性,这与本研究结果不一致。根据本研究结果,除EAT外,IMT也是CIS 的独立危险因素。而IMT也是颈动脉粥样硬化的早期标志,随着IMT的增厚会形成颈动脉粥样硬化斑块,一旦斑块破溃脱落,就容易导致颅内动脉栓塞,直接造成卒中的发生[23]。研究表示早期干预能够有益的影响IMT,预防中风[24]。因此,本研究认为EAT及IMT在未来也可以作为评估CIS发生的风险因素。本研究还采用ROC曲线进一步探究了这两个独立影响因素对CIS的诊断效能,发现EAT诊断效能更高(AUC=0.882),IMT、EAT的最佳截断值分别为1275 μm、17.54 mm。恰当的体育锻炼可减少内脏脂肪的堆积[25],若发现患者心外膜脂肪组织超过其临界值时,可嘱患者进行恰当的体育锻炼,可能会延缓患者患心脑血管疾病时间。
本研究结果显示,随着CVAI、PPFT、PRPFT及VAT的升高,患者中风的风险增加;但在调整了多因素后结果提示其并不是CIS的独立危险因素,与既往类似研究[26]一致。目前,PPFT、PRPFT及VAT的相关研究并不多,有研究认为它们是冠心病的预测因子[25, 27-28],但可能不同样适用于脑卒中。而CVAI作为评估内脏脂肪功能的综合指标,已被证明与颅内动脉粥样硬化相关[29],并且对脑卒中的短期死亡率有预测作用[30],但本研究中并未发现CVAI对卒中有预测作用。分析出现上述结果的原因:首先,可能由于样本量较少影响了结果;其次,可能是由于CVAI及VAT是利用受试者的一般指标计算,而本研究中研究组与对照组在一般指标方面差异不大。对于VFT及SCFT,本研究发现超声测量的腹部皮下脂肪和内脏脂肪与CIS之间不存在显著的联系,这与既往研究[31]结果不一致,既往研究认为VFT/SCFT可以作为预测颈动脉粥样硬化的独立因子,但在本研究中其与CIS没有明显的相关性,可能是种族差异或样本量不足所造成。
本研究也存在一些局限性:首先,纳入的样本量不够多,这可能导致数据结果出现偏倚;其次,MRI和CT是测量腹部脂肪较精准的成像方式,本研究并未用MRI或CT测量来评估超声测量的准确性。后续研究将会加大样本量并联合更精确的测量方法验证超声测量的准确性。
综上所述,本研究通过超声测量内脏脂肪指标发现其与CIS有关,并且EAT、IMT是CIS的独立影响因素,其中EAT具有更高的诊断效能。本研究发现内脏脂肪与CIS有关,而CIS是冠状动脉、大脑动脉和其他动脉粥样硬化形成和演变的窗口,表明内脏脂肪与心脑血管疾病之间存在密切相关。未来会进一步深入研究内脏脂肪与其他心脑血管疾病的关系,为临床早期诊断及干预提供更加可靠的依据及决策支持。
参考文献:
[1] " 王陇德, 彭 "斌, 张鸿祺, 等. 《中国脑卒中防治报告2020》概要[J]. 中国脑血管病杂志, 2022, 19(2): 136-44.
[2] " "Feske SK. Ischemic stroke[J]. Am J Med, 2021, 134(12): 1457-64.
[3] " Potter TBH, Tannous J, Vahidy FS. A contemporary review of epidemiology, risk factors, etiology, and outcomes of premature stroke[J]. Curr Atheroscler Rep, 2022, 24(12): 939-48.
[4] " "Yamashiro K, Tanaka R, Tanaka Y, et al. Visceral fat accumulation is associated with cerebral small vessel disease[J]. Eur J Neurol, 2014, 21(4): 667-73.
[5] " Koenen M, Hill MA, Cohen P, et al. Obesity, adipose tissue and vascular dysfunction[J]. Circ Res, 2021, 128(7): 951-68.
[6] " Kim JH, Choi KH, Kang KW, et al. Impact of visceral adipose tissue on clinical outcomes after acute ischemic stroke[J]. Stroke, 2019, 50(2): 448-54.
[7] " Jung CH, Kim BY, Kim KJ, et al. Contribution of subcutaneous abdominal fat on ultrasonography to carotid atherosclerosis in patients with type 2 diabetes mellitus[J]. Cardiovasc Diabetol, 2014, 13: 67.
[8] " Haberka M, Kubicius A, Starzak M, et al. Adiposity, fat depots and the prediction of stroke[J]. Cardiol J, 2023, 30(5): 810-6.
[9] " 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志, 2015, 48(4): 246-57.
[10] Xia MF, Chen Y, Lin HD, et al. A indicator of visceral adipose dysfunction to evaluate metabolic health in adult Chinese[J]. Sci Rep, 2016, 6: 38214.
[11] Rallidis LS, Baroutsi K, Zolindaki M, et al. Visceral adipose tissue is a better predictor of subclinical carotid atherosclerosis compared with waist circumference[J]. Ultrasound Med Biol, 2014, 40(6): 1083-8.
[12] Roever LS, Resende ES, Diniz ALD, et al. Abdominal obesity and association with atherosclerosis risk factors: the uberlândia heart study[J]. Medicine, 2016, 95(11): e1357.
[13] Hirooka M, Kumagi T, Kurose K, et al. A technique for the measurement of visceral fat by ultrasonography: comparison of measurements by ultrasonography and computed tomography[J]. Intern Med Tokyo Jpn, 2005, 44(8): 794-9.
[14] Parisi V, Petraglia L, Formisano R, et al. Validation of the echocardiographic assessment of epicardial adipose tissue thickness at the Rindfleisch fold for the prediction of coronary artery disease[J]. Nutr Metab Cardiovasc Dis, 2020, 30(1): 99-105.
[15] Haberka M, Gąsior Z. A carotid extra-media thickness, PATIMA combined index and coronary artery disease: comparison with well-established indexes of carotid artery and fat depots[J]. Atherosclerosis, 2015, 243(1): 307-13.
[16] Li CR, Spallanzani RG, Mathis D. Visceral adipose tissue Tregs and the cells that nurture them[J]. Immunol Rev, 2020, 295(1): 114-25.
[17] Kawai T, Autieri MV, Scalia R. Adipose tissue inflammation and metabolic dysfunction in obesity[J]. Am J Physiol Cell Physiol, 2021, 320(3): C375-91.
[18] Cui CC, He CY, Sun QC, et al. Association between visceral adiposity index and incident stroke: data from the China Health and Retirement Longitudinal Study[J]. Nutr Metab Cardiovasc Dis, 2022, 32(5): 1202-9.
[19] Wang FH, Meng LY, Yu TY, et al. Associations of abdominal visceral fat content and plasma adiponectin level with intracranial atherosclerotic stenosis: a cross-sectional study[J]. Front Neurol, 2022, 13: 893401.
[20] Cosansu K, Yilmaz S. Is epicardial fat thickness associated with acute ischemic stroke in patients with atrial fibrillation?[J]. J Stroke Cerebrovasc Dis, 2020, 29(7): 104900.
[21] Holm PH, Hindsø L, Olsen KB, et al. Stereological estimation of myocardial fat and its associations with obesity, epicardial, and visceral adipose tissue[J]. Cells, 2022, 11(19): 3160.
[22] West HW, Siddique M, Williams MC, et al. Deep-learning for epicardial adipose tissue assessment with computed tomography: implications for cardiovascular risk prediction[J]. JACC Cardiovasc Imaging, 2023, 16(6): 800-16.
[23] Jin SQ, Zhang C, Zhang Y, et al. Differential value of intima thickness in ischaemic stroke due to large-artery atherosclerosis and small-vessel occlusion[J]. J Cell Mol Med, 2021, 25(19): 9427-33.
[24] Koeder C, Hahn A, Englert H. Effect of a 6‑month controlled lifestyle intervention on common carotid intima-media thickness[J]. J Nutr Health Aging, 2021, 25(7): 869-77.
[25] Liu KH, Kong APS, Chan JCN, et al. Sonographic measurement of mesenteric fat thickness is a better predictor of aortic stiffness compared with conventional obesity indexes[J]. Ultrasound Med Biol, 2023, 49(2): 599-606.
[26] Liu ZY, Huang Q, Deng B, et al. Elevated Chinese visceral adiposity index increases the risk of stroke in Chinese patients with metabolic syndrome[J]. Front Endocrinol, 2023, 14: 1218905.
[27] Liu BX, Sun W, Kong XQ. Perirenal fat: a unique fat pad and potential target for cardiovascular disease[J]. Angiology, 2019, 70(7): 584-93.
[28] Hazem M, Ezzat M, Elsamman M, et al. Non-invasive prediction of coronary artery disease by multiple abdominal fat and anthropometric indices: revisit[J]. Int J Gen Med, 2021, 14: 387-98.
[29] Zhao WH, Ma XT, Ju JC, et al. Association of visceral adiposity index with asymptomatic intracranial arterial stenosis: a population-based study in Shandong, China[J]. Lipids Health Dis, 2023, 22(1): 64.
[30] Chang YH, Zhang LL, Li YD, et al. Derivation and validation of a new visceral adiposity index for predicting short-term mortality of patients with acute ischemic stroke in a Chinese populationv[J]. Brain Sci, 2023, 13(2): 297.
[31] Hazem M, Elsamman M, Bazeed S, et al. Noninvasive prediction of carotid artery atherosclerosis by multiple abdominal fat indices measured via ultrasonography[J]. Ultrasonography, 2021, 40(3): 366-77.
(编辑:林 "萍)
