高分辨CT影像组学模型鉴别亚厘米肺纯磨玻璃结节腺体前驱病变与微浸润腺癌的价值
2024-10-31徐振宇杨云竣段锐郭莉徐志锋
摘要:目的 "探讨基于高分辨CT影像组学模型鉴别表现为亚厘米肺纯磨玻璃结节的腺体前驱病变和微浸润腺癌(MIA)的价值。方法 "回顾性分析2020年7月~2022年4月经手术病理证实的亚厘米纯磨玻璃结节患者共计68例(75个肺结节),包括6个非典型腺瘤样增生、26个原位癌及43个MIA,根据病理类型分为腺体前驱病变组(非典型腺瘤样增生+原位癌)和微浸润组(MIA),将其分为训练组54例(60个pGGN),验证组14例(15个pGGN)。采集临床资料(年龄、性别)、CT定性参数(边界、毛刺、分叶、支气管异常征、内部血管征、空泡征、胸膜牵拉征)及定量参数(最长径、最短径、平均CT值、最大CT值、最小CT值)。利用ITK-SNAP软件对每个纯磨玻璃结节行手动分割并导入AK软件进行影像特征提取。采取单因素及多因素分析方法筛选出训练组中两亚组之间差异有统计学意义的变量,利用多元Logistic回归的方法构建影像组学模型、临床特征模型及联合模型。通过ROC曲线及计算曲线下面积(AUC)对各模型的预测效能进行比较,使用Delong's检验比较各模型之间的差异。采用校正曲线及决策曲线分析评估联合模型的校准度及临床应用性,采用Hosmer-Lemeshow检验分析联合模型预测值与观测值之间的拟合程度。结果 "联合模型在训练组和验证组中均具有最高的诊断效能(训练组AUC=0.857,95% CI:0.764~0.951,Plt;0.0001;验证组AUC=0.84,95% CI:0.592~1.000,P=0.0071),高于影像组学模型(训练组AUC=0.835,95% CI:0.735~0.935,Plt;0.0001;验证组AUC=0.82,95% CI:0.563~1.000,P=0.0145)和临床特征模型(训练组AUC=0.764,95% CI:0.636~0.864,Plt;0.0001;验证组AUC=0.63,95% CI:0.347~0.913,P=0.3677)。联合模型在训练组和验证组中的预测观察值与实际观察值之间均具有良好的一致性。结论 "基于高分辨CT影像组学和临床特征构建的联合模型有助于术前鉴别表现为亚厘米肺纯磨玻璃结节的腺体前驱病变和MIA,提升肺结节诊治及管理水平。
关键词:影像组学;计算机断层成像技术;磨玻璃结节;腺体前驱病变;微浸润腺癌
Value of high‑resolution CT radiomics model in differentiating glandular precursor lesions and minimally invasive adenocarcinoma presenting as subcentimeter pure ground glass nodules
XU Zhenyu, YANG Yunjun, DUAN Rui, GUO Li, XU Zhifeng
Department of Medical Radiology, Foshan First People's Hospital, Foshan 528000, China
Abstract: Objective To assess the efficacy of a radiomics model rooted in high-resolution CT imaging for the differentiation of precursor glandular lesions and minimally invasive adenocarcinoma (MIA) manifesting as subcentimeter pure ground-glass nodules (pGGN). Methods A total of 68 patients (75 pulmonary nodules) with subcentimeter pGGN confirmed by surgical pathology from July 2020 to April 2022 were retrospectively analyzed, including 6 atypical adenomatous hyperplasia (AAH), 26 adenocarcinoma in situ (AIS) and 43 MIA. According to the pathological type, the patients were divided into precursor glandular lesions group (AAH+AIS) and minimally invasive group (MIA), including 54 cases in the training group (60 pGGN) and 14 cases in the validation group (15 pGGN). Clinical data (age, gender), CT qualitative parameters (margin, spiculation, lobulation, air bronchogram, internal vseesl sign, bubblen, pleural attachment) and quantitative parameters (longest diameter, shortest diameter, average CT value, maximum CT value, minimum CT value) were collected. Manual segmentation of each pGGN was performed using ITK-SNAP software, and image features were extracted using AK software. Statistical analyses included univariate and multivariate methods to identify significant differences between the two subgroups in the training group. We used these analyses to create imaging radiomics models, clinical models, and combined models through multivariate Logistic regression. The prediction efficiency of each model was compared by ROC curve and the area under the curve (AUC), and Delong's test was used to compare whether there were significant differences among the models. The calibration curve and the decision curve analysis were used to evaluate the calibration and clinical application of the combined model, and Hosmer-Lemeshow test was used to analyze the fitting degree between the predicted value and the observed value of the combined model. Results The combined model had highest diagnostic efficiency in both the training group and the text group (AUC=0.857, 95% CI: 0.764‑0.951, Plt;0.0001 in the training group; AUC=0.84, 95% CI: 0.592-1.000, P=0.0071 in the text group), which was higher than the radiomics model (AUC=0.835, 95% CI: 0.735-0.935, Plt;0.0001 in the training group; AUC=0.82, 95%CI :0.563-1.000, P=0.0145 in the text group ) and clinical model (AUC=0.764, 95% CI: 0.636-0.864, Plt;0.0001 in the training group ; AUC=0.63, 95%
CI: 0.347~0.913, P=0.3677 in the text group). Furthermore, the combined model demonstrated a commendable degree of consistency between its predicted values and actual observations in both the training and text group. Conclusion The combined model based on CT radiomics and clinical features is helpful to distinguish precursor glandular lesions and MIA which presenting as subcentimeter pure ground glass nodules before operation, and improve the level of diagnosis, treatment and management of pulmonary nodules.
Keywords: radiomics; computed tomography; ground glass nodules; precursor glandular lesions; minimally invasive adenocarcinoma
肺癌的发病率和死亡率在所有恶性肿瘤中居于首位[1],早诊早治是提高肺癌患者的预后及生存率的关键。2021年最新世界卫生组织(WHO)分类中,将原位腺癌(AIS)剔除肺癌范畴,与不典型腺瘤样增生(AAH)共同列为腺体前驱病变,肺癌亚类包括微浸润性腺癌(MIA)及浸润性腺癌(IAC)[2],这一改变必将伴随着临床诊疗方案的更新。AAH和AIS现临床主要采用管理随访策略,而MIA需及时行外科干预[3];虽然有研究表明AAH和AIS,MIA手术远期疗效相当,然而研究显示MIA的Ki-67水平及表皮生长因子受体突变率均高于AIS[4],表明MIA较AIS具有较高的侵袭性,需实现两者鉴别。如何在结节的随访管理过程中及时发现AIS向MIA转变,实现MIA与腺体前驱病变术前精准鉴别,能为临床手术干预时机选择,手术方案实施、预后的评估等提供极高价值的信息。
既往研究显示高分辨低剂量CT可降低20%的肺癌死亡率[5],是目前最有效的肺癌筛查工具,其中90%以上为早期肺癌,而磨玻璃结节是其主要CT表现模式。病理活检是诊断肺癌类型的金标准,冰冻切片作为术中快速评估肺结节良恶性及组织学类型的有效方法,已成为指导肺结节手术策略的关键[6];但由于肺结节较小且密度较淡常导致取材欠佳,术中冰冻切片与术后石蜡病理对肺结节病理亚型诊断一致率仅约68%[7]。部分学者发现采用传统影像学特征(结节大小、密度,实性占比等参数)有助于MIA与腺体前驱病变(AIS+AAH)鉴别,但这高度依赖判读医生的临床经验,且主观性强[8];另外传统技术鉴别往往局限于体积较大且混杂密度结节,而临床上越来越多的直径lt;10 mm的纯磨玻璃结节(pGGN)被检出,给临床诊断带来了新的挑战。有研究提出直径10 mm可作为临界值来区分腺体前驱病变和浸润性病变[9]。然而,部分≤10 mm的pGGN被证实为MIA或IAC[10],且关于≤10 mm的pGGN管理策略仍存在争议[8]。临床急需一种新颖、经济、高效和准确的无创性技术实现MIA和腺体前驱病变的术前精准诊断。影像组学可高通量地提取并分析影像图像中大量的影像组学特征,在区分肺结节病理亚类,评估浸润程度及预后评估方面具有巨大前景[11]。以往大部分研究[8-10]的研究对象均纳入了IAC病例,但目前仅以表现为亚厘米pGGN的腺体前驱病变和将MIA作为研究对象的研究尚未见报道。本研究旨在探讨联合影像组学和临床特征综合模型对表现为亚厘米pGGN的腺体前驱病变与MIA中的鉴别价值,从而为临床治疗方案的制定及手术干预时机的选择提供参考。
1 "资料与方法
1.1 "一般资料
选择2020年7月~2022年4月经本院手术病理证实的pGGN患者共68例(其中3例为多发结节,共75个病灶)。根据病理类型分为前驱病变组(AAH和AIS,32个病灶)和微浸润组(MIA,43个病灶)。纳入标准:手术切除获得完整病理标本;具备完整的薄层CT图像;肺结节最大径≤10 mm;手术与CT检查的时间间隔小于1月;CT检查前病变未行活检、放疗或化疗。排除标准:肺窗薄层显示病灶有实性成分;病灶合并其他病变,无法正常勾画感兴趣区(ROI),如肺炎、结核、胸腔积液等;图像质量不佳;既往有恶性肿瘤及远处转移病史。本研究经医院伦理委员会审批通过[伦申研(2021)第2号)]。
1.2 "CT检查技术
使用Philips Brilliance iCT 256层螺旋CT及GE Discovery 64排能谱CT进行胸部HRCT扫描。患者取仰卧位并双臂伸直置于头侧,于吸气末屏气后采集容积数据,扫描范围为肺尖至肺底。扫描参数:120 kV,70~120 mAs,层厚5 mm,螺距0.938,准直器宽度64×0.6 mm。扫描完成后,对原始CT图像进行薄层重建:层厚1 mm,层距1 mm,矩阵512×512。肺窗的窗宽为1300 Hu、窗位为-600 Hu。
1.3 "临床及CT参数收集
临床资料包含患者性别和年龄:CT参数包括定性参数(边界、毛刺、分叶、支气管异常征、内部血管征、空泡征、胸膜牵拉征)及定量参数(最长径、最短径、平均CT值、最大CT值、最小CT值)。CT定性参数由医生A(副主任医师,具有10年胸部疾病影像诊断经验)和医生B(主治医师,具有5年胸部疾病影像诊断经验)分别在薄层图像肺窗上对每个pGGN进行独立评估,且2位医生评估过程中均对病理诊断不知情,有分歧时协商讨论达成一致。pGGN的CT定量参数采用联影人工智能软件采集,包括最长径、最短径、平均CT值、最大CT值和最小CT值。
1.4 "影像组学特征的提取、模型构建及评估
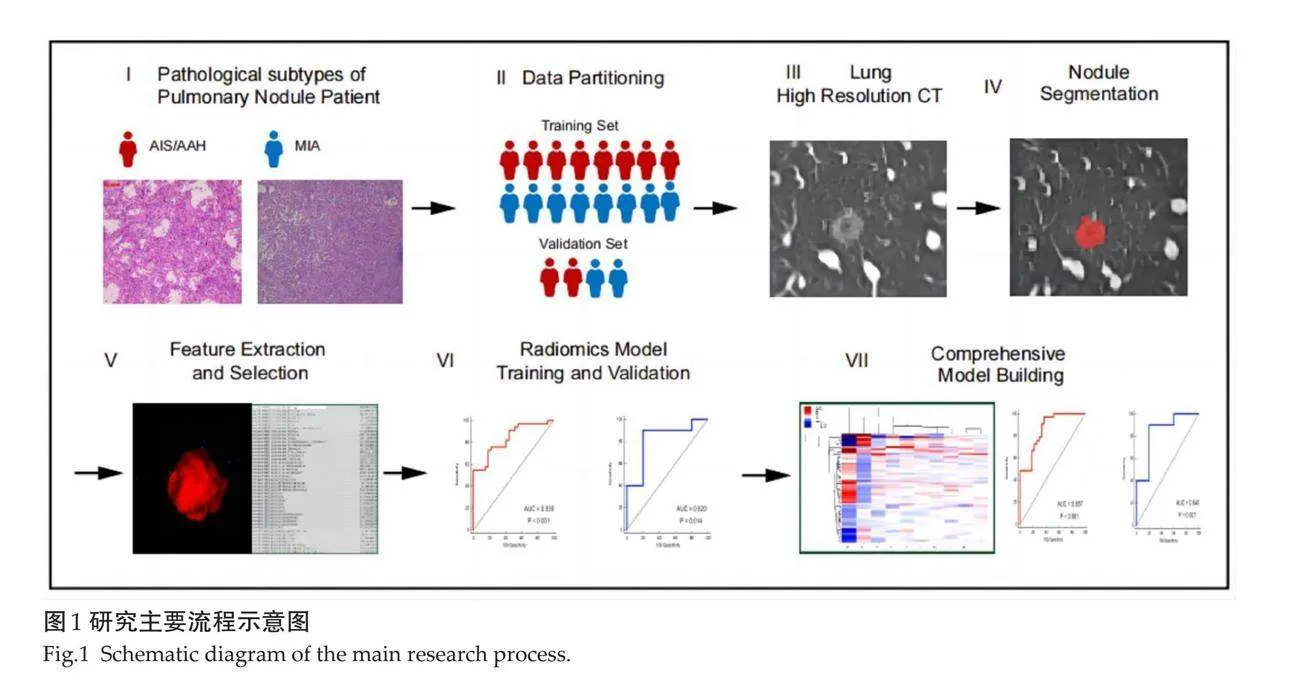
从75个pGGN中随机抽取30个,分别由具有5和10年的CT诊断经验的医师各1位独立利用ITK-SNAP 软件进行ROI分割,1月后将这30个pGGN打乱顺序后由具有5年CT诊断经验的医师再次进行勾画。采用组内相关系数(ICC)对2位诊断医师提取的影像信息进行一致性评估,ICCgt;0.75即认为一致性良好。其余45个pGGN均由具有5年CT诊断经验的医师进行分割,由具有10年CT诊断经验的医师进行审核。具体勾画操作如下:将纳入研究患者薄层CT肺窗图像以DICOM格式导出并导入ITK-SNAP软件,沿结节边缘勾画ROI(避开血管、支气管或空泡区域),利用冠矢状位进行修正,最终合成3D ROI并导出用于后续影像组学特征的提取。将勾画完成的ROI文件导入AK软件(GE healthcare)后进行影像组学特征提取,共提取出1037个影像组学特征。将纳入的病例按照8:2的比例随机分组为训练组和验证组。先通过梯度提升决策树进行影像组学特征的降维处理,然后采用多元Logistic回归进一步筛选影像组学特征,将最终筛选出的特征进行标准化处理后构建影像组学模型。采用多因素 Logistic回归分析从临床资料及CT参数中筛选能鉴别腺体前驱病变(AAH+AIS)和MIA独立预测因子,将这些独立预测因子与影像组学模型结合以构建联合模型。采用ROC曲线评估临床特征模型(包括临床资料和CT参数)、影像组学特征和联合模型在训练组和验证组中的诊断效能。使用校准曲线及决策曲线分析评估联合模型的校准度及临床应用性。使用Hosmer-Lemeshow检验分析联合模型预测值与观测值之间的拟合度。本研究主要流程(图1)。
1.5 "统计学分析
采用SPSS26.0、MedCalc软件及R3.6.3进行统计学分析。计量资料以均数±标准差表示,组间比较采用独立样本t检验或Wilcoxon秩和检验;对分类变量采用卡方检验或Fisher确切概率法,以Plt;0.05为差异有统计学意义。对差异有统计学意义的临床特征指标进行Logistic回归分析,将得到的临床特征独立预测因子用于构建临床特征模型;随后将临床特征模型与影像组学模型纳入多变量回归分析,最后建立联合模型。对训练组和验证组,通过ROC曲线分析和曲线下面积(AUC)评价临床特征模型、影像组学模型和联合模型的诊断效能。对模型采用拟合度检验来校准ROC曲线,采用临床预测模型的决策曲线分析评估其性能。
2 " 结果
2.1 两组一般资料组内比较
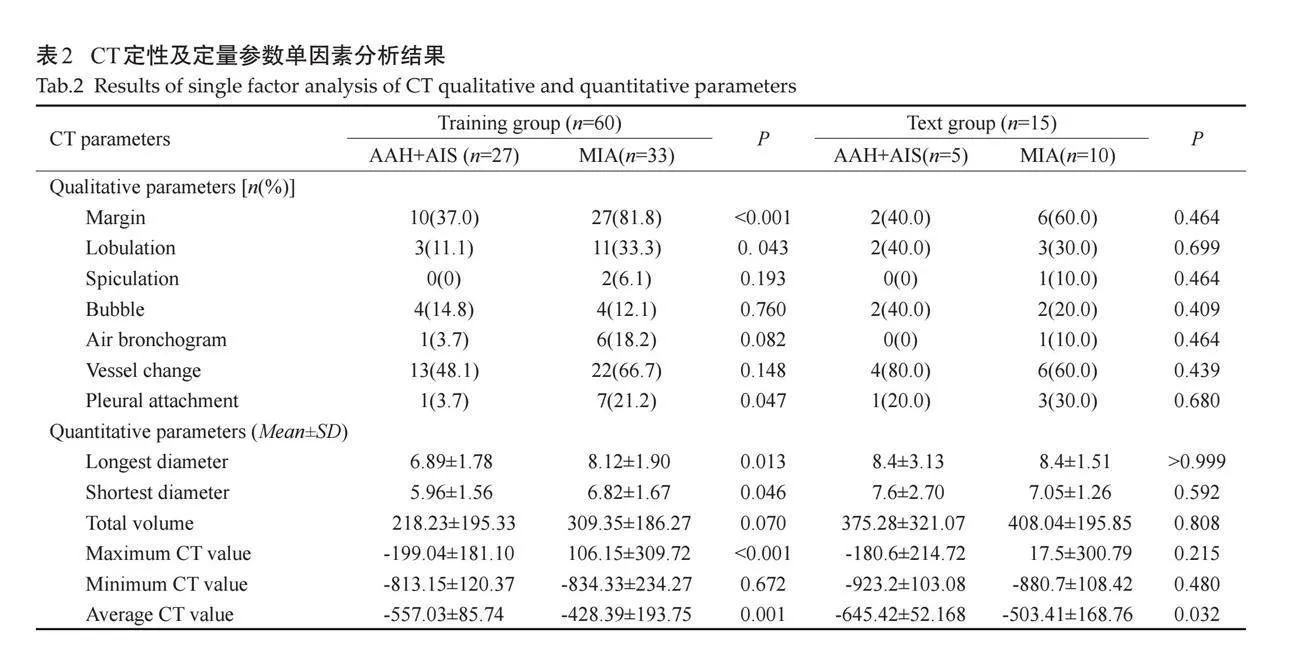
68例pGGN患者,其中训练组54例患者,验证组14例患者,两组年龄及性别差异均无统计学意义(Pgt;0.05,表1)。
2.2 "ICC分析
对由医师提取出的影像组学特征进行可重复性分析:具有5年CT诊断经验的医师2次分割获得的各项影像组学特征比较,ICC为0.8462~0.9717;具有5年和10年CT诊断经验的医师对同一组结节(30个)分别进行分割后获得的各项影像组学特征比较,ICC为0.7619~0.9637,均具有较好的一致性。
2.3 "CT定性、定量参数筛选及临床特征模型构建
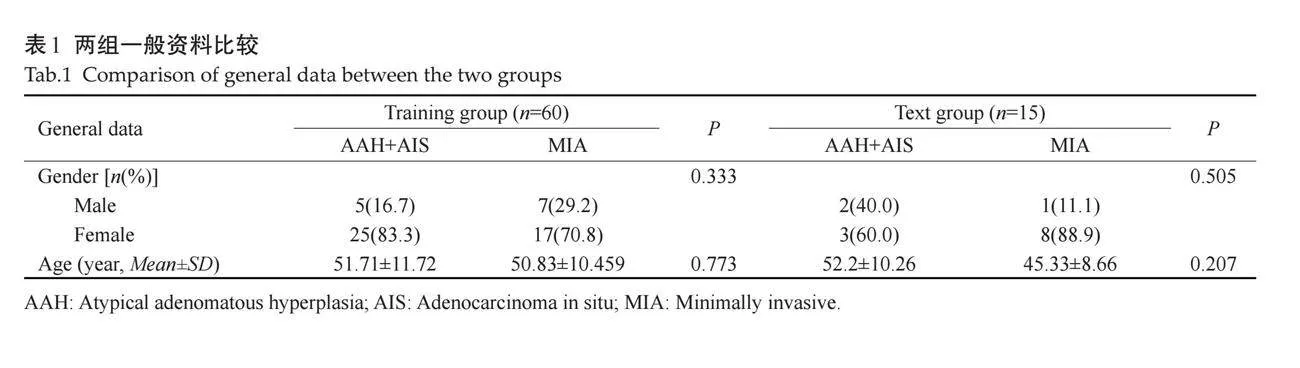
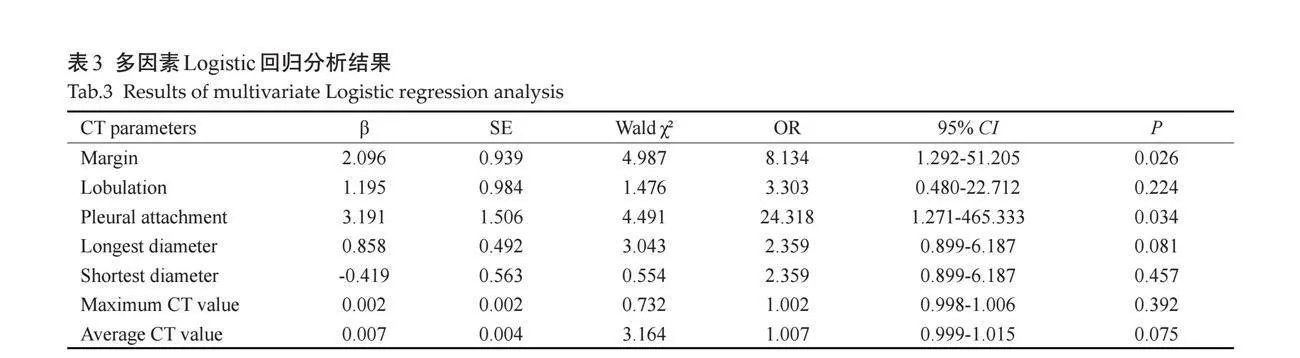
训练组60个pGGN(27个AAH+AIS,33个MIA),验证组15个pGGN(5个AAH+AIS,10个MIA)。单因素分析结果显示训练组的CT参数中边界清晰、分叶征、胸膜牵拉征、最长径、最短径、最大CT值、平均CT值的差异有统计学意义(Plt;0.05),其余CT参数的差异无统计学意义(Pgt;0.05,表2)。
将训练组中边界清晰、分叶征、胸膜牵拉征、最长径、最短径、最大CT值、平均CT值纳入多因素Logistic回归分析(表3),基于独立危险因素[边界清晰(P=0.026)、胸膜牵拉征(P=0.034)]构建临床特征模型。结果表明当亚厘米pGGN具有边界清晰(95%CI:1.292~51.205,OR=8.134)或胸膜牵拉征(95%CI:1.271~465.333,OR=24.318)的征象时更易成为MIA。
2.4 "影像组学特征筛选、组学模型和Nomogram图构建及评估
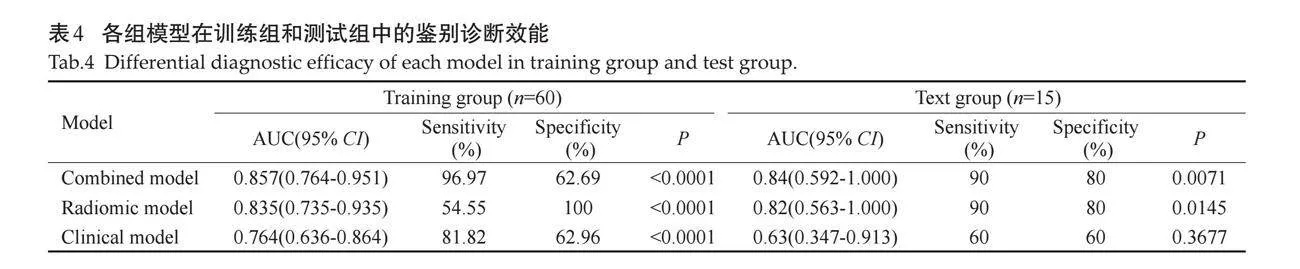
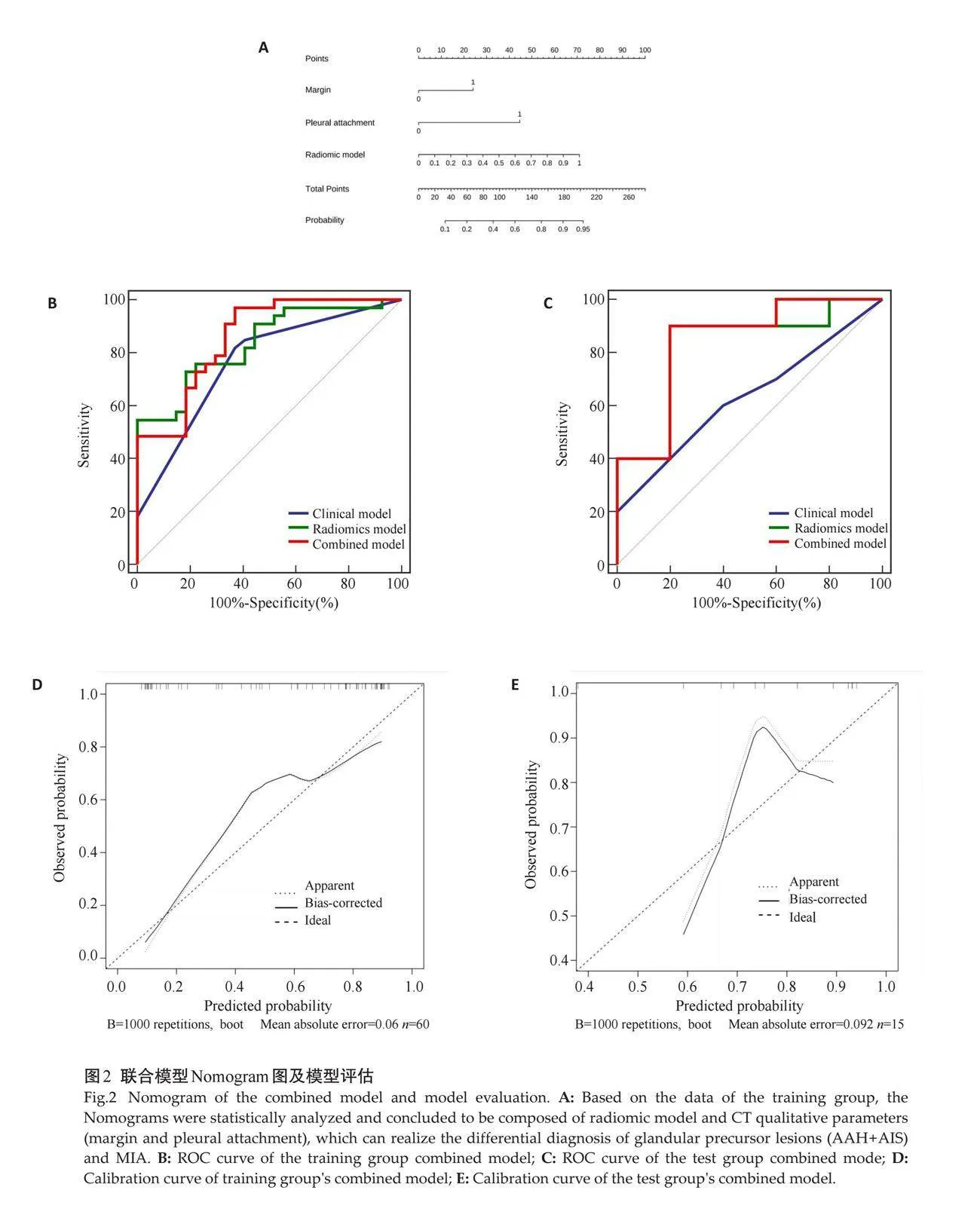
1037个影像组学特征中先通过梯度提升决策树进行降维处理后得到52个影像组学特征,然后进行多元Logistic回归处理,最后筛选出3个影像组学特征:['log-sigma-2-0-mm-3D_firstorder_TotalEnergy']、['wavelet-HHH_glszm_LargeAreaLowGrayLevelEmphasis']、['wavelet-LLH_firstorder_Uniformity']。采用筛选出的3个影像组学特征建立影像组学模型并绘制ROC曲线。各模型在训练组及测试组中均具有良好的鉴别诊断效能,其中联合模型具有最佳诊断效能(训练组AUC=0.857,95%CI:0.764~0.951,Plt;0.0001;验证组AUC=0.84,95% CI:0.592~1.000,P=0.0071),均高于影像组学模型及临床特征模型。具体每个模型的鉴别诊断效能(表4)以及各种模型训练组与验证组的ROC曲线(图2A~B)。
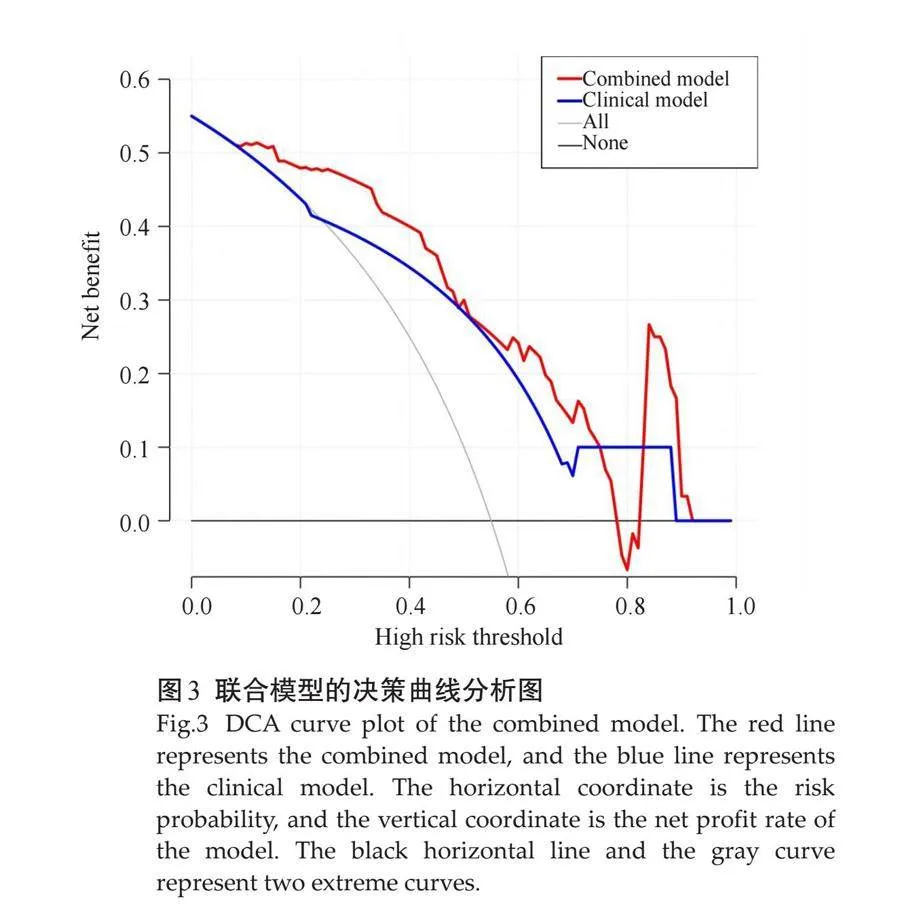
Delong's检验显示训练组中联合模型与临床特征模型间的差异有统计学意义(训练组:Z=2.056,P=0.0398;测试组:Z=1.06,P=0.2894),且与其他模型相比,联合模型具有更好的鉴别效能。训练组和验证组的联合模型的校准曲线显示,联合模型在训练组中的预测观察值与实际观察值之间均具有良好的一致性(图2C~D)。训练组各模型的决策曲线分析结果表明在危险度大于10%时,使用联合模型的鉴别诊断收益优于传统临床特征模型(图3)。联合模型在训练组和测试组间的差异均无统计学意义(P=0.537、0.367),拟合度良好。
3 "讨论
本研究成功构建了基于高分辨CT建立临床特征模型、影像组学模型及联合模型来评估术前鉴别表现为亚厘米pGGN的肺腺体前驱病变(AAH/AIS)与MIA的效能,在国内属于首次研究报道,结果显示联合模型在训练组及测试组中的鉴别效能均为最高,AUC分别0.857和0.84。既往多项研究均表明传统影像学特征具有预测肺结节浸润性的能力:有学者提出不同病理亚型在肿瘤-肺界面等特征差异有统计学意义,侵袭性pGGN的肿瘤-肺界面多清晰[8];有研究指出胸膜牵拉征是重要鉴别征象,推测与pGGN的生长速度与恶性程度相关,生长速度快易引起内部成分收缩而出现胸膜牵拉征[9];有研究提示分叶征有助于鉴别pGGN的浸润性[12];另有研究提示平均CT值是预测pGGN浸润性和浸润程度的独立危险因素[13-14]。本研究通过多因素Logistic回归分析得出边界清晰和胸膜牵拉征为独立危险因素,再次支持了既往研究的结论,同时采用上述危险因素成功构建临床特征模型,但发现其在训练组与测试组的鉴别效能(AUC=0.764、0.63)均低于影像组学模型和联合模型。虽然病理学上MIA的成分较AAH/AIS更丰富、浸润的肿瘤细胞和实体成分更多,但这些病理变化仍不足以在CT图像上产生肉眼可见的改变,因此很难根据传统影像学特征精准区分腺体前驱病变和MIA[15]。单纯依靠肉眼提取的传统影像学特征来准确区分表现为亚厘米pGGN的腺体前驱病变与MIA是难以实现的,本研究结果支持既往研究[16-17]结论。
既往研究对影像组学与传统影像学在pGGN诊断中的价值进行了比较分析,有研究表明影像组学预测模型(AUC=0.936)在识别侵袭性病灶方面优于传统影像学模型[18];有研究发现,对于pGGN的腺体前驱病变与MIA的鉴别,影像组学模型在训练组和测试组织均具有优秀的鉴别效能(AUC=0.884、0.872)[15]。本研究中影像组学模型在训练组和测试组中的诊断效能(AUC=0.835、0.82)均高于临床特征模型;另外,本研究还创新性地融合了影像组学模型和临床特征模型来构建联合模型,在训练组和测试组中均取得了最高的鉴别效能(AUC=0.857、0.84)。有研究中联合模型也取得了最佳的鉴别效能(AUC=0.80、0.831),证实了基于影像组学特征的Nomogram模型所具有的优异临床应用前景[6, 19]。与既往研究[18]不同,本研究依据2021年WHO肺肿瘤最新分类将AAH和AIS归类为腺体前驱病变纳入实验,且剔除了IAC病例,首次基于CT影像组学技术成功构建了高效综合模型,实现了AAH+AIS和MIA的鉴别。本研究分析的肺结节以直径≤10 mmpGGN为首要的纳入条件,由于入选结节小且密度差异小,在一定程度上降低了本研究模型诊断效能,但与既往研究相比[15],根据肺结节的演变过程及最新的WHO肺肿瘤分类,本研究成功构建的诊断模型能够有效地把腺体前驱病变(AAH+AIS)和MIA区分,且诊断效能好(AUCgt;0.85),相对于既往研究的成果而言,更有助于肺癌早期诊疗,提高临床分层管理水平,为临床制定更科学合理诊疗方案,个体化治理提供了有力的证据和手段。
本研究尚存在以下不足:作为一项回顾性研究,不可避免地存在选择偏倚,未来可能需要前瞻性研究来证实本研究的发现;纳入的样本量不足,可能存在数据偏倚,降低了模型诊断效能及稳定性,需要在以后的研究中扩大样本容量;基于单中心研究所构建的模型缺少外部验证组对照,在稳定性、准确性及临床应用价值等方面可能有待考究,未来的研究中会完善多中心对比研究;本研究仅对瘤内组织进行了组学分析,而肿瘤细胞也会作用于瘤周环境[20],且有研究发现结合瘤周成分的影像组学能提高鉴别良恶性结节的效能[21-2],故未来将尝试将瘤周成分的组学特征纳入诊断模型以提高鉴别效能;本研究未纳入含有实性成分的结节,而影像组学模型在不同性质的成分中,获取的信息量存在差异,后续也将纳入含有实性成分的结节以完善结论。
综上所述,本研究基于高分辨CT且联合临床、影像组学特征,成功构建一个Logistic回归联合模型用于鉴别表现为亚厘米pGGN的腺体前驱病变(AAH+AIS)与MIA,通过综合对比分析,发现联合模型具有最佳的鉴别效能且良好的拟合度,有望成为辅助临床实现术前精准诊断、提升管理和诊疗水平的工具。
参考文献:
[1] " Chen WQ, Zheng RS, Zhang SW, et al. Cancer incidence and mortality in China in 2013: an analysis based on urbanization level[J]. Chin J Cancer Res, 2017, 29(1): 1-10.
[2] " World Health Organization (2021). WHO Classification of tumours of the lung[EB/OL]. [2021-06-10]. https://tumourclassification.iarc.who.int.
[3] " She YL, Zhang L, Zhu HY, et al. The predictive value of CT-based radiomics in differentiating indolent from invasive lung adenocarcinoma in patients with pulmonary nodules[J]. Eur Radiol, 2018, 28(12): 5121-8.
[4] Ishida H, Shimizu Y, Sakaguchi H, et al. Distinctive clinicopathological features of adenocarcinoma in situ and minimally invasive adenocarcinoma of the lung: a retrospective study[J]. Lung Cancer, 2019, 129: 16-21.
[5] " National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening[J]. N Engl J Med, 2011, 365(5): 395-409.
[6] " Liu SL, Wang R, Zhang Y, et al. Precise diagnosis of intraoperative frozen section is an effective method to guide resection strategy for peripheral small-sized lung adenocarcinoma[J]. J Clin Oncol, 2016, 34(4): 307-13.
[7] " Yeh YC, Nitadori JI, Kadota K, et al. Using frozen section to identify histological patterns in stage I lung adenocarcinoma of≤3 Cm: accuracy and interobserver agreement[J]. Histopathology, 2015, 66(7): 922-38.
[8] " Wu F, Tian SP, Jin X, et al. CT and histopathologic characteristics of lung adenocarcinoma with pure ground-glass nodules 10 mm or less in diameter[J]. Eur Radiol, 2017, 27(10): 4037-43.
[9] "Lee SM, Park CM, Goo JM, et al. Invasive pulmonary adenocarcinomas versus preinvasive lesions appearing as ground-glass nodules: differentiation by using CT features[J]. Radiology, 2013, 268(1): 265-73.
[10] "Mao HX, Labh K, Han FS, et al. Diagnosis of the invasiveness of lung adenocarcinoma manifesting as ground glass opacities on high-resolution computed tomography[J]. Thorac Cancer, 2016, 7(1): 129-35.
[11] "Jiang YN, Che SY, Ma SC, et al. Radiomic signature based on CT imaging to distinguish invasive adenocarcinoma from minimally invasive adenocarcinoma in pure ground‑glass nodules with pleural contact[J]. Cancer Imaging, 2021, 21(1): 1.
[12] "Meng Y, Liu CL, Cai Q, et al. Contrast analysis of the relationship between the HRCT sign and new pathologic classification in small ground glass nodule-like lung adenocarcinoma[J]. La Radiol Med, 2019, 124(1): 8-13.
[13] "Song L, Xing TT, Zhu ZC, et al. Hybrid clinical-radiomics model for precisely predicting the invasiveness of lung adenocarcinoma manifesting as pure ground-glass nodule[J]. Acad Radiol, 2021, 28(9): e267-77.
[14] "高 "琳, 张 "晶, 顾 "慧, 等. CT特征预测基于2021年肺肿瘤新分类肺纯磨玻璃结节浸润性及浸润程度的价值[J]. 中华放射学杂志, 2022, 56(6): 616-22.
[15] Zhu YQ, Liu CH, Mo Y, et al. Radiomics for differentiating minimally invasive adenocarcinoma from precursor lesions in pure ground-glass opacities on chest computed tomography[J]. Br J Radiol, 2022, 95(1134): 20210768.
[16] "Liu CL, Zhang F, Cai Q, et al. Establishment of a predictive model for surgical resection of ground-glass nodules[J]. J Am Coll Radiol, 2019, 16(4): 435-45.
[17]Xiang WJ, Xing YF, Jiang S, et al. Morphological factors differentiating between early lung adenocarcinomas appearing as pure ground-glass nodules measuring ≤10 mm on thin-section computed tomography[J]. Cancer Imaging, 2014, 14(1): 33.
[18] "Fan L, Fang MJ, Li ZB, et al. Radiomics signature: a biomarker for the preoperative discrimination of lung invasive adenocarcinoma manifesting as a ground-glass nodule[J]. Eur Radiol, 2019, 29(2): 889-97.
[19] Sun YL, Li C, Jin L, et al. Radiomics for lung adenocarcinoma manifesting as pure ground-glass nodules: invasive prediction[J]. Eur Radiol, 2020, 30(7): 3650-9.
[20] "Wu T, Dai Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett, 2017, 387: 61-8.
[21] "Beig N, Khorrami M, Alilou M, et al. Perinodular and intranodular radiomic features on lung CT images distinguish adenocarcinomas from granulomas[J]. Radiology, 2019, 290(3): 783-92.
[22]Nishino M. Perinodular radiomic features to assess nodule microenvironment: does it help to distinguish malignant versus benign lung nodules?[J]. Radiology, 2019, 290(3): 793-5.
(编辑:熊一凡)
