动态对比增强磁共振成像对术前空芯针穿刺活检诊断为乳腺导管原位癌术后病理升级为乳腺浸润性导管癌的评估价值
2024-10-31李汝锐曾辉冯结映赖文佳陈卫国
摘要:目的 "通过分析术前空芯针穿刺活检(CNB)诊断为乳腺导管原位癌(DCIS)术后升级为乳腺浸润性导管癌(IDC)病例的MRI特征,探讨乳腺动态对比增强磁共振成像(DCE-MRI)的评估价值。方法 "回顾性分析2012年1月~2022年12月华南理工大学附属第六医院收治的经超声引导下CNB诊断的乳腺DCIS(含微浸润)患者104例,所有患者均进行乳腺MRI检查,对比分析术后未升级DCIS和术后升级为IDC的大小、形态、边缘及内部强化特征等。结果 "术前CNB诊断为DCIS 104例,手术后仍为DCIS(含微浸润)64例,病理升级为IDC 40例,升级比例(病理学低估)约为38.5%。未升级DCIS组肿块病变18例,非肿块病变46例,升级为IDC组肿块病变19例,非肿块病变21例,两者间差异有统计学意义(Plt;0.05)。DCE-MRI特征方面,病灶表现为非肿块样强化时,未升级DCIS主要表现为段样分布,不均质强化;术后升级为IDC主要表现为区域分布,集簇强化。病灶表现为肿块样强化时,未升级DCIS组边缘清晰,术后升级IDC组多为边缘毛刺状。时间-信号强度曲线分型上,术后未升级DCIS主要为平台型,其次为渐增型,而术后升级为IDC则主要为流出型,其次为平台型,两者间差异有统计学意义(Plt;0.05)。结论 "乳腺MRI成像对于CNB证实的DCIS是否存在手术后病理学升级具有潜在价值,有利于临床制定针对性治疗方案。
关键词:乳腺导管原位癌;病理升级;空芯针穿刺活检;动态增强磁共振
Value of DCE‑MRI in the evaluation of preoperative core needle biopsy diagnosis of ductal carcinoma in situ and postoperative pathology upgrade to invasive ductal carcinoma
LI Rurui1, 2, ZENG Hui1, FENG Jieying2, LAI Wenjia2, CHEN Weiguo1
1Department of Radiology, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China; 2Department of Radiology, Sixth Affiliated Hospital of South China University of Technology, Foshan 528237, China
Abstract: Objective To explore the evaluation value of dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI) in breast cancer by analyzing the MRI features of cases with ductal carcinoma in situ (DCIS) and upgraded to invasive ductal carcinoma (IDC) after surgery diagnosed by preoperative core needle biopsy (CNB). Methods The data of 104 patients with breast DCIS (including microinvasion) diagnosed by CNB admitted to the Sixth Affiliated Hospital of South China University of Technology from January 2012 to December 2022 were retrospectively analyzed. All patients underwent breast DCE-MRI. The DCE-MRI features of postoperative non-upgraded DCIS and postoperative upgraded IDC were compared, including size, morphology, edge, and internal enhancement pattern. Results Among 104 cases with DCIS by CNB before surgery, 64 remained as DCIS postoperatively (including microinvasion) and 40 were postoperatively upgraded to IDC, with an upgrading ratio (pathological underestimation) of approximately 38.5%. In the non-upgraded DCIS group, there were 18 cases of mass lesions and 46 cases of non-mass lesions; in the upgraded IDC group, there were 19 cases of mass lesions and 21 cases of non-mass lesions with statistically significant differences between the two groups (Plt;0.05). In terms of DCE-MRI features, when the lesions appeared as non-mass enhancement, the non-upgraded DCIS mainly showed segmental distribution and heterogeneous enhancement, while the upgraded IDC mainly showed regional distribution and clustered enhancement. When the lesions appeared as mass enhancement, the non-upgraded DCIS group had clear margins, while the the upgraded IDC mostly had spiculated margins. Concerning the time-signal strength curve classification, the non‑upgraded DCIS mainly showed plateau curves followed by persistent enhancing curves, while the the upgraded IDC mainly exhibited outflow curves followed by plateau curves, with statistically significant differences between the two groups (Plt;0.05). Conclusion Breast DCE-MRI has potential value in determining postoperative pathological upgrade of DCIS confirmed by CNB, which is conducive to the formulation of targeted treatment plans in clinical practice.
Keywords: breast cancer; pathological upgrade; empty core needle puncture biopsy; dynamic enhanced magnetic resonance
乳腺导管内原位癌(DCIS)是指各种尚未突破乳腺导管的肿瘤性病变。确诊DCIS的主要方法是超声引导下空芯针穿刺活检(CNB),DCIS低估是指术前CNB未能发现浸润性癌症,只有在手术后获得完整标本的病理检查中才能诊断出来[1] ,其中10%~54%的CNB诊断为DCIS患者最终确诊为乳腺浸润性癌(IDC)[2] 。然而,DCIS和IDC的治疗方法有很大区别,美国癌症联合会指南将DCIS归入乳腺癌早期病变,主张采用保乳切除进行治疗,无须腋窝或前哨淋巴结清扫,IDC的治疗则需进行乳腺根治术+腋窝或前哨淋巴结清扫[3] ,治疗前明确诊断为DCIS或IDC甚为重要。有研究发现肿瘤gt;3 cm、核分级高和人类表皮生长因子受体-2(HER 2)阴性是CNB诊断的单纯DCIS出现病理学低估的危险因素[4] 。研究报道[5] ,乳腺X线摄影的影像组学特征可以对DCIS中的隐匿性浸润病灶进行预测,但影像组学模型AUC并不高。乳腺MRI技术现已广泛应用于乳腺癌术前诊断,但用于评估CNB诊断为DCIS术后是否存在病理学升级的研究甚少,国外研究表明乳腺 MR 成像对于预测活检证实的表现为非肿块样强化的DCIS是否存在隐匿浸润具有潜在价值[6] 。但也有研究认为无法通过MRI图像分析预测DCIS术后情况,结果的差异可能是传统影像学征主要依赖于临床医师对图像的视觉评价,主观性强,缺少组间一致性分析[7-8] 。本研究拟通过探究术前CNB诊断的DCIS,手术切除后病理升级为IDC的DCE-MRI影像表现,总结具有鉴别意义的特征,评价其对术前CNB诊断DCIS术后病理升级为IDC的诊断价值,可以避免不必要的腋窝淋巴结活检,也有利于临床制定针对性治疗方案[9] 。
1 "资料与方法
1.1 "一般资料
收集华南理工大学附属第六医院2012~2022年收治的104例乳腺癌患者。本研究为回顾性研究,经本院伦理委员会审核批准(伦理批件号:LL-2024-02-26-01)。纳入标准:女性;粗针活检诊断为乳腺导管原位癌(含微浸润);腋窝淋巴结临床阴性;术前行MRI检查;接受规范的手术治疗。排除标准:粗针活检诊断为乳腺浸润性癌;手术前没有行MRI检查;既往存在包括乳腺浸润性导管癌的其他的恶性肿瘤。最终纳入104例符合标准的患者,其中DCIS(含微浸润)为64例,最终术后出现病理升级为乳腺浸润性导管癌的40例。
1.2 "仪器与方法
采用西门子3.0T、飞利浦1.5T及3.0T核磁共振扫描仪,检查时患者俯卧于检查床上,双侧乳房自然下垂,放置于乳腺专用线圈内。扫描序列和参数如下:磁共振扫描序列包括:自旋回波 SE T1WI、快速自旋回波 FSE T2WI 轴位平扫、弥散加权成像,以及随后的DCE 轴位。增强扫描采用双筒高压注射器,对比剂为马根维显钆喷酸葡胺,注射流速2.5 mL/s,剂量按0.2 mL/kg,选用型号为20 G的静脉留置针,先扫描蒙片,高压注射器注药后连续扫描6~8期。
1.3 "图像分析
由2位多年从事乳腺MRI诊断工作、具有丰富经验的放射医师在双盲情况下进行独立阅片,若出现结果不一致,由另一位主任医师做出最终诊断。
MRI图像评估:判断为肿块样强化或非肿块样强化。非肿块样强化病灶观察征象:分布情况:局灶分布、线样分布、段样分布、区域分布;内部强化特点:均匀强化、不均质强化、集簇状强化、成簇环状强化。肿块样强化病灶观察征象:病灶形态:圆形、卵圆形及不规则形;病灶边缘:清晰、毛刺状及不规则;病灶内部强化特点:均匀强化、不均质强化、边缘强化。绘制时间-信号强度曲线(TIC),TIC分为3型:I型为渐增型、Ⅱ型为平台型、Ⅲ型为流出型。
1.4 "统计学分析
所有数据资料使用SPSS软件分析。计量资料以均数±标准差表示,组间比较采用t检验;计数资料以n(%)表示,组间比较采用χ2检验或Fisher确切概率法。以Plt;0.05为差异有统计学意义。
2 "结果
2.1 "临床病理特征
2.1.1 "病理学低估 " 纳入术前CNB诊断为DCIS 104例,手术后仍为DCIS(含微浸润)64例,病理升级为IDC 40例,升级比例(病理学低估)约为38.5%。
2.1.2 "形态学 "未升级DCIS组肿块病变18例,非肿块病变46例;术后升级IDC组肿块病变19例,非肿块病变21例,两者差异有统计学意义(Plt;0.05)。另外未升级DCIS组、术后升级IDC组病灶最大径线分别为5.1±0.3 cm、5.3±0.3 cm。
2.2 "CNB诊断为DCIS术后未升级及病理学低估病灶的乳腺DCE-MRI特征
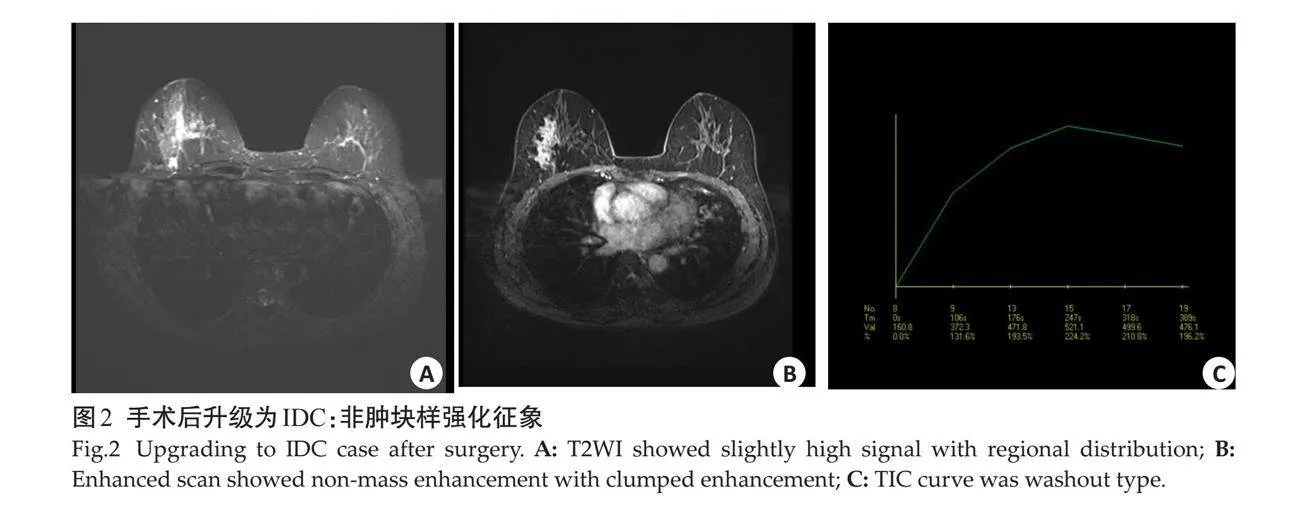
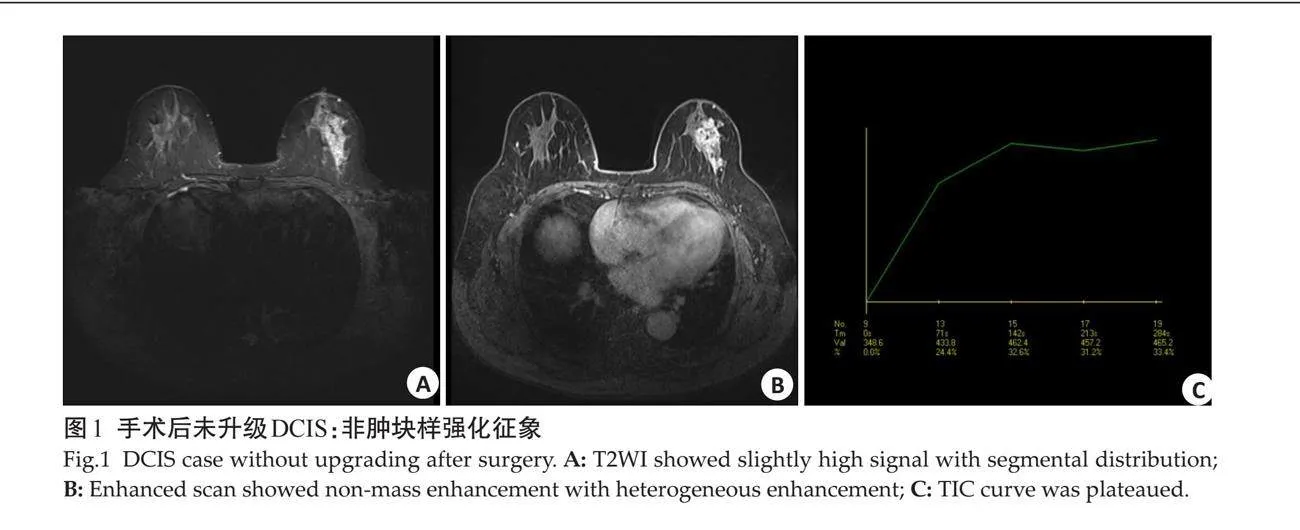
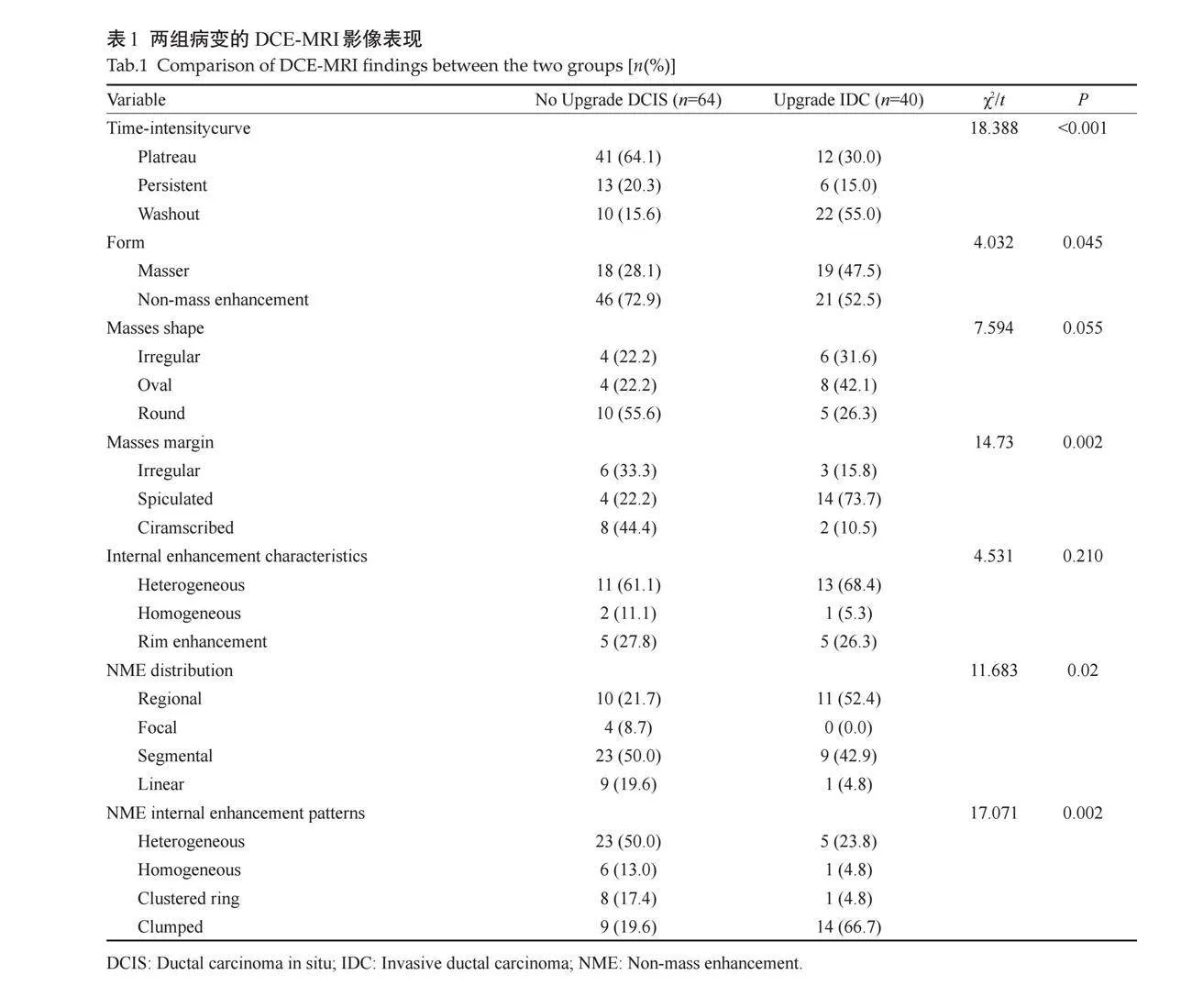
2.2.1 "非肿块样强化征象 " 病灶表现为非肿块样强化时,未升级DCIS组多为段样分布(n=23,50%),不均质强化(n=23,50%,图1)。术后升级IDC组则多为区域分布(n=11,52.4%),集簇状强化(n=14,66.7%,图2);两者在分布及内部强化特点方面差异具有统计学意义(Plt;0.05)。
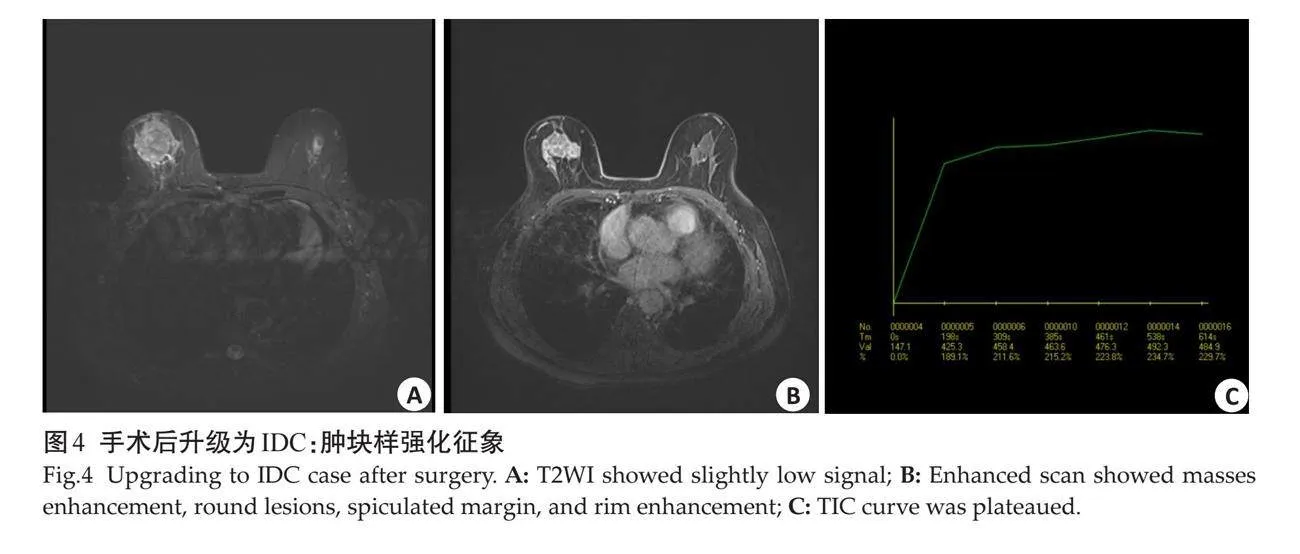
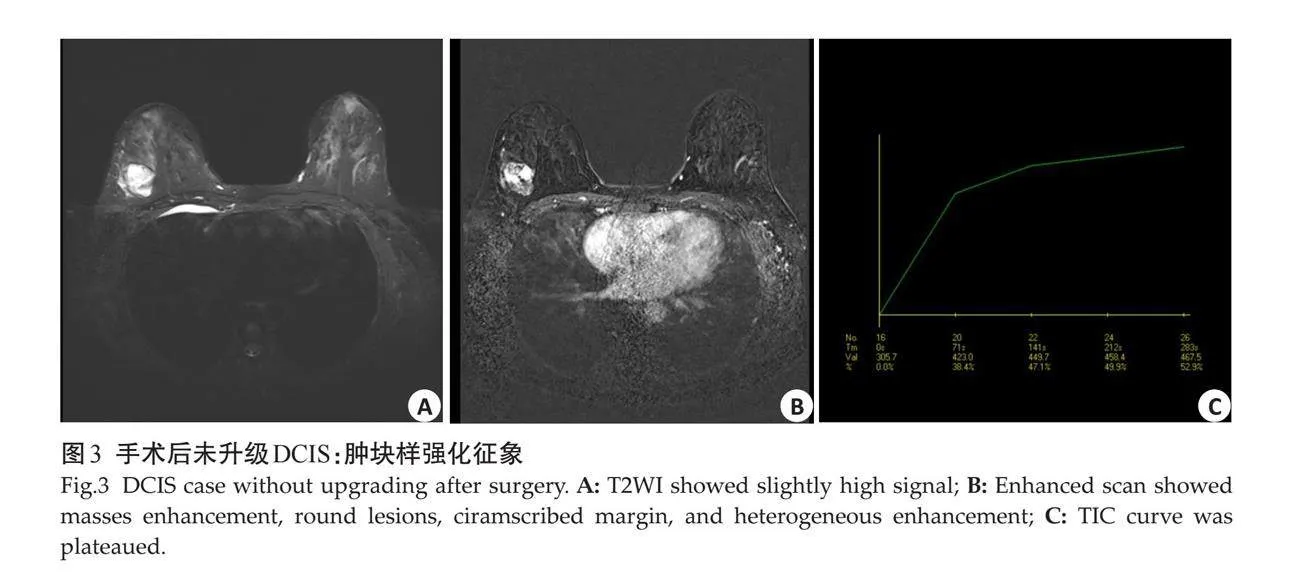
2.2.2 "肿块样强化征象 " 病灶表现为肿块样强化时,未升级DCIS组多表现为圆形(n=10,55.6%),边缘清晰(n=8,44.4%),内部强化特征为不均质强化(n=11,61.1%);术后升级IDC组则边缘多为卵圆形(n=8,42.1%),边缘多为毛刺状(n=14,73.7%),内部强化特征为不均质强化(n=13,68.4%);两者病灶边缘的差异有统计学意义(Plt;0.05),但形态及内部强化特点的差异均无统计学意义(Pgt;0.05,图3~4)。
2.2.3 "TIC曲线 " TIC曲线分型方面,术后未升级DCIS主要为平台型,其次为渐增型,而术后升级为IDC则主要为流出型,其次为平台型,两者差异有统计学意义(Plt;0.05,表1)。
3 "讨论
近年来,随着乳腺癌筛查技术的不断发展,女性自主筛查的意识不断提高,DCIS在新发乳腺癌中所占比例呈逐年升高趋势。目前我国确诊DCIS的主要方法是CNB,但有文献显示,CNB诊断的DCIS中,9%~52%[10] 和10%~38%[11] 的病例术后出现病理学低估,最终诊断升级为浸润性癌。既往研究中,术前DCIS在术后升级为浸润性癌的危险因素包括肿瘤出现症状,可触及,体积大,钼靶可见钙化或致密肿块,超声可见肿物、分级高,核分级高,HER2过表达,Ki-67标记指数高等[12-14] ,但是上述研究的预测因素分散,病例数量不一,部分结果甚至互相矛盾。MRI作为一种无创、无辐射的影像检查技术,其具有较高的空间分辨率,能够清楚地显示病灶形态、边缘轮廓、肿瘤边界,可作为明确经CNB诊断的DCIS是否存在病理学低估的一种主要手段。
本研究为分析DCE-MRI对术前CNB诊断为DCIS术后病理升级为IDC的评估价值,回顾性收集了104例相关乳腺癌患者的病例资料,并对其中64未升级DICS患者与40升级为IDC患者的MRI影像学检查结果进行对比,发现未升级DCIS组非肿块样强化发生率明显高于升级为IDC组,这与病变的病理学状态有关,DCIS未突破基底膜,未对周围有侵犯,故而表现为沿导管分布的非肿块样强化为主,而IDC对周围侵犯程度不同,表现不同,侵犯逐渐加重,则进一步表现为肿块样强化。这与既往研究[15] 结果相符。但仍需对两组数据的具体MRI征象进行进一步更细致的分析。
本研究显示,当病灶表现为非肿块样强化时,术后未升级的DCIS病例与术后升级为IDC的分布与内部强化特征对比有统计学差异。术后未升级的DCIS以段样分布分布为主,内部强化特征以不均质强化为主。术后升级IDC的病理学低估病例中,其以区域分布为主,内部强化特征主要表现为集簇状强化。这与病变的组织病理改变与血供状态有关[16] 。既往有文献报道,纯DCIS趋向于非肿块样强化,常表现为段样、导管样强化[17-18] ,与本研究结果一致。DCIS未突破基底膜,主要沿乳管方向生长,故主要表现为沿乳管走行的线状及段样分布的非肿块样、均匀强化[19-20] 。有研究认为,这种表现可能代表了 DCIS 主要是沿着乳管扩展而不是以向周围扩散为主,是一种更懒惰的生长模式,两者出现不同的表现,这可能与病变的病理发展阶段有关[21] ,因此对于非肿块样强化病灶的DCE-MRI特征可以提示病变所处的病理学阶段。纯DCIS 癌细胞局限于扩张导管内,导致导管明显扩张,而导管的基底膜完整、边界清晰而呈线样(导管)分布,内部强化特征为均匀或不均匀强化。当疾病不断发展,病灶具有向间质侵袭的趋势,可以呈段样分布,内部强化特征为不均匀或簇环状强化;其继续发展,可侵袭邻近结构,范围不断扩大,对周围组织侵犯愈发严重而形成IDC,具有占位效应,呈区域样分布,不断的侵袭邻近结构,内部强化特征可表现为聚簇状强化。
另外,在表现为肿块样强化的病灶中,既往有研究表明IDC多数表现为肿块样强化[22] 。然而在本研究中,术后升级IDC的病例中表现为肿块样强化的比例更高,但两者间的差异无统计学意义,原因首先可能与样本量较小有关;其次,本研究所纳入病例中,术后升级为IDC的病灶范围都比较大,其对周围组织的侵犯范围相对较大,侵犯程度不一,造成以非肿块样强化为主。本研究显示两者仅在病灶边缘的差异具有统计学意义;在形态及内部强化特点方面差异均无统计学意义。在病灶的边缘方面,未升级的DCIS主要表现为边界清晰,而术后升级为IDC的则主要表现为毛刺状,差异有统计学意义,主要反应了病灶不同的病理学特征,DCIS未突破基底膜,表现的边界清晰,而升级为IDC后,对邻近结构的不断侵袭,边缘不清晰,可见毛刺。在内部强化特征方面,两组均表现为不均质强化为主。但有研究发现DCIS患者的病灶以清晰边缘居多,内部也多表现为均匀强化,而IDC患者的病灶以不规则、毛刺状边缘居多,内部多表现为不均匀强化[23] ,这与本研究结果不完全相符。有研究显示,DCIS伴微浸润表现为肿块样强化时,边缘不规则或分叶状,内部强化特征为不均质强化[24] ,部分学者认为边缘强化为呈肿块样强化DCIS伴微浸润病灶的典型表现。我们也将在后续工作中收集纳入更多病例后对分组进行细化后再进行分析、论证。
在TIC方面,未升级DCIS组多为平台型,而术后升级IDC组多为流出型。DCIS的病灶区导管基底膜周围或周围基质内的新生血管存在多少不等的情况[25] ,因此TIC曲线形式多种多样,但DCIS病灶尚未突破乳腺导管,对周围血管浸润有限,主要表现流入型及平台型。而IDC对周围微血管存在大量的侵袭[26] ,故主要表现为流出型。TIC曲线的不同与病灶对邻近血管的侵袭情况有关,与病变所处的病理学状态有关,对于明确CNB诊断的DICS是否出现病理学低估提供诊断价值。
本研究的局限性:所纳入样本量较小,同时没有对纯乳腺导管内乳头状癌及乳腺导管内乳头状癌伴微浸润进行再分组,对于部分征象的分析具有重叠性。未来计划纳入更多符合纳入和排除标准的研究样本,并在分组细化方面进行优化,对乳腺肿瘤的不同阶段的特征表现进一步分析。此外,本研究暂未纳入弥散加权成像、ADC等指标,下一步将优化MRI扫描方案,完善相关数据收集及分析。
综上所述,乳腺MRI成像对于CNB证实的DCIS是否存在手术后病理学升级具有潜在价值,能够获得具有鉴别意义的MRI特征,即非肿块样强化病变中,术后未升级DCIS主要表现为段样分布且不均质强化,TIC曲线主要为平台型;术后升级IDC主要表现为区域样分布且集簇状强化,TIC曲线为流出型;肿块样强化病变中,术后未升级DCIS多表现为边缘清晰,术后升级IDC则多为边缘毛刺状。这些MRI特征可为评估CNB诊断为DICS是否术后出现病理学升级提供诊断依据,有利于临床制定更具针对性的治疗方案。
参考文献:
[1] " Meurs CJC, van Rosmalen J, Menke-Pluijmers MBE, et al. A prediction model for underestimation of invasive breast cancer after a biopsy diagnosis of ductal carcinoma in situ: based on 2892 biopsies and 589 invasive cancers[J]. "Br J Cancer, 2018, 119(9): 1155-62.
[2] " Munck F, Clausen EW, Balslev E, et al. Multicentre study of the risk of invasive cancer and use of sentinel node biopsy in women with a preoperative diagnosis of ductal carcinoma in situ[J]. "Br J Surg, 2019, 107(1): 96-102.
[3] " Hortobagyi GH, Connolly JL, D'Drsi Cl, et al. The AJCC cancerstaging manual (8th ed)[M]. "Springer: American College of Surgeon, 2017: 29-45.
[4] " 曹 "威, 何英剑, 李金锋, 等. 超声引导下空芯针穿刺活检诊断的乳腺导管原位癌病理学低估的危险因素分析[J]. "中国癌症杂志, 2020, 30(3): 217-23.
[5] " Hou R, Grimm LJ, Mazurowski MA, et al. Prediction of upstaging in ductal carcinoma in situ based on mammographic radiomic features[J]. "Radiology, 2022, 303(1): 54-62.
[6] " Goto M, Yuen S, Akazawa K, et al. The role of breast MR imaging in pre-operative determination of invasive disease for ductal carcinoma in situ diagnosed by needle biopsy[J]. "Eur Radiol, 2012, 22(6): 1255-64.
[7] " Greenwood HI, Wilmes LJ, Kelil T, et al. Role of breast MRI in the evaluation and detection of DCIS: opportunities and challenges[J]. "Magnetic Resonance Imaging, 2020, 52(3): 697-709.
[8] " van Bekkum S, ter Braak BPM, Plaisier PW, et al. Preoperative breast MRI in management of patients with needle biopsy-proven ductal carcinoma in situ (DCIS)[J]. "Eur J Surg Oncol, 2020, 46(10): 1854-60.
[9] " Park KW, Kim SW, Han H, et al. Ductal carcinoma in situ: a risk prediction model for the underestimation of invasive breast cancer[J]. "NPJ Breast Cancer, 2022, 8(1): 8.
[10] "van Deurzen CHM, Hobbelink MGG, van Hillegersberg R, et al. Is there an indication for sentinel node biopsy in patients with ductal carcinoma in situ of the breast? A review[J]. "Eur J Cancer, 2007, 43(6): 993-1001.
[11] "Kanbayashi C, Iwata H. Current approach and future perspective for ductal carcinoma in situ of the breast[J]. "Jpn J Clin Oncol, 2017, 47(8): 671-7.
[12] "Brennan ME, Turner RM, Ciatto S, et al. Ductal carcinoma in situ at core-needle biopsy: meta-analysis of underestimation and predictors of invasive breast cancer[J]. "Radiology, 2011, 260(1): 119-28.
[13] "Kondo T, Hayashi N, Ohde S, et al. A model to predict upstaging to invasive carcinoma in patients preoperatively diagnosed with ductal carcinoma in situ of the breast[J]. "J Surg Oncol, 2015, 112(5): 476-80.
[14] "Van Goethem M, Schelfout K, Kersschot E, et al. Comparison of MRI features of different grades of DCIS and invasive carcinoma of the breast[J]. "JBR-BTR, 2005, 88(5): 225-32.
[15] "刘碧华, 郑晓林, 李 "晏, 等. 非肿块强化导管内原位癌与浸润性导管癌的MRI内部特征及分析[J]. "临床放射学杂志, 2019, 38(7): 1198-203.
[16] "Watanabe Y, Anan K, Saimura M, et al. Upstaging to invasive ductal carcinoma after mastectomy for ductal carcinoma in situ: predictive factors and role of sentinel lymph node biopsy[J]. "Breast Cancer, 2018, 25(6): 663-70.
[17] "Nadrljanski M, Maksimović R, Plešinac-Karapandžić V, et al. Positive enhancement integral values in dynamic contrast enhanced magnetic resonance imaging of breast carcinoma: Ductal carcinoma in situ vs. invasive ductal carcinoma[J]. "Eur J Radiol, 2014, 83(8): 1363-7.
[18] "Hussein H, Chung C, Moshonov H, et al. Evaluation of apparent diffusion coefficient to predict grade, microinvasion, and invasion in ductal carcinoma in situ of the breast[J]. "Acad Radiol, 2015, 22(12): 1483-8.
[19] "Chan SW, Chen JH, Agrawal G, et al. Characterization of pure ductal carcinoma in situ on dynamic contrast-enhanced MR imaging: do nonhigh grade and high grade show different imaging features?[J]. "J Oncol, 2010, 2010: 431341.
[20] "许玲辉, 彭卫军, 顾雅佳, 等. 乳腺导管原位癌的MRI表现[J]. "中华放射学杂志, 2011, 45(2): 159-63.
[21] Shehata M, Grimm L, Ballantyne N, et al. Ductal carcinoma in situ: current concepts in biology, imaging, and treatment[J]. "J Breast Imaging, 2019, 1(3): 166-76.
[22] "梅 "昂, 华 佳. 乳腺MRI对导管原位癌及其微浸润的诊断[J]. "实用放射学杂志, 2011, 27(5): 706-9.
[23] "赵 "雪, 朱晓龙, 赵 "茹. MRI对乳腺导管原位癌及浸润性导管癌的鉴别诊断价值[J]. "中国CT和MRI杂志, 2022, 20(8): 105-7.
[24]Hahn SY, Han BK, Ko EY, et al. MR features to suggest microinvasive ductal carcinoma of the breast: can it be differentiated from pure DCIS?[J]. "Acta Radiol, 2013, 54(7): 742-8.
[25] Yamada T, Mori N, Watanabe M, et al. Radiologic-pathologic correlation of ductal carcinoma in situ[J]. "Radiographics, 2010, 30(5): 1183-98.
[26] "吴 "朋, 崔 "蕾, 郭宏兵, 等. DWI及DCE-MRI对乳腺纯导管原位癌、导管原位癌伴微浸润及浸润导管癌的鉴别诊断价值[J]. "放射学实践, 2020, 35(4): 489-96.
(编辑:熊一凡)
