全视野数字化乳腺X线摄影影像组学及深度学习特征预测乳腺癌HER-2状态
2024-10-31何飞黄忠江武沛增郭晓芬王雷
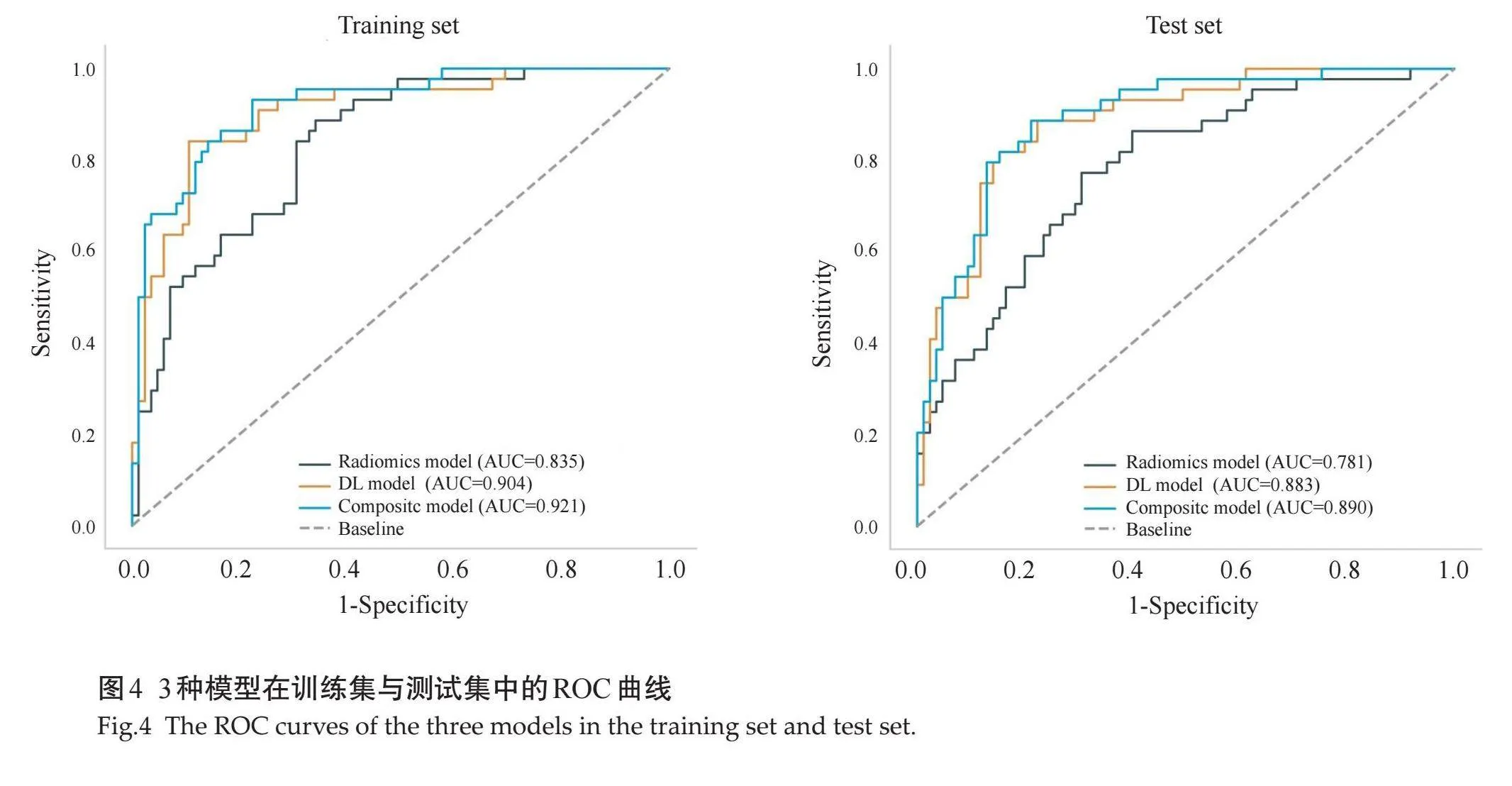

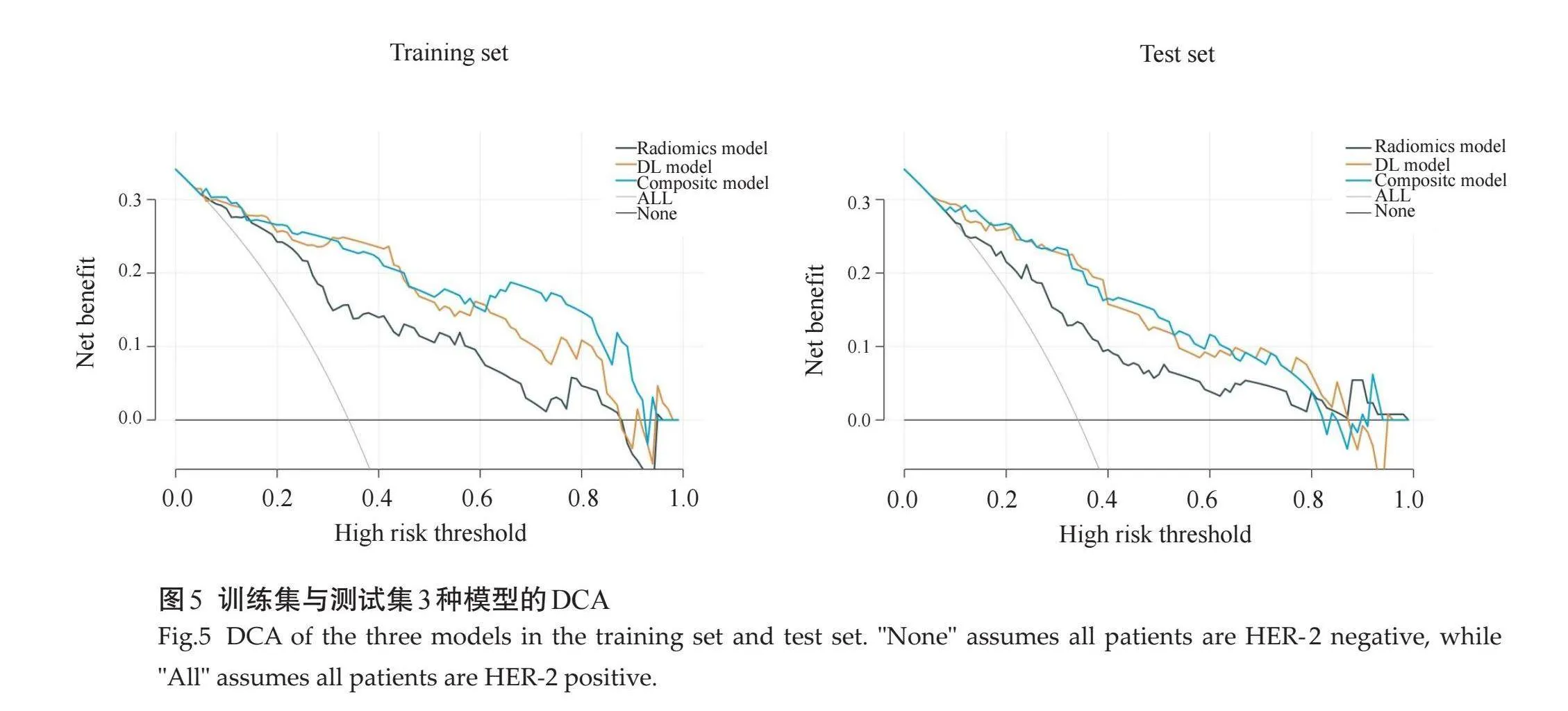
摘要:目的" 通过联合全视野数字化乳腺X线摄影(FFDM)影像组学特征及深度学习特征预测乳腺癌HER-2状态。方法" 回顾性分析山西中医药大学附属医院2018年3月~2023年12月经临床手术或穿刺活检的乳腺癌患者FFDM、临床及病理资料。FFDM图像手工勾画肿瘤感兴趣区并提取组学特征和深度学习特征,分别经过LASSO特征筛选后采用支持向量机算法建立影像组学模型和深度学习模型,通过多因素逻辑回归分析建立综合模型。计算各模型曲线下面积(AUC)评估其预测效能,并通过决策曲线分析评估各模型在实际临床决策中的有效性和实用价值。结果" 影像组学模型在训练集和测试集的AUC分别为0.835(95% CI:0.761~0.898)和0.781(95% CI:0.701~0.857),深度学习模型在训练集和测试集的AUC分别为0.904(95% CI:0.855~0.955)和0.883(95% CI:0.823~0.939),综合模型在在训练集和测试集的AUC分别为0.921(95% CI:0.872~0.967)和0.890(95% CI:0.828~0.942)。决策曲线分析显示3种模型相比于全部认为HRE-2阳性或阴性可获得更好的净收益,其中综合模型在风险阈值下可获得最大净收益。结论" 基于FFDM影像组学特征和深度学习特征的联合应用,可以更有效地预测乳腺癌HER-2状态,显著提高了预测的准确性和可靠性,为乳腺癌的诊断和治疗开辟了新的途径。
关键词:乳腺癌;影像组学;深度学习;HER-2状态
Study on predicting breast cancer HER‑2 status through full‑field digital mammography radiomic" and deep learning features
HE Fei1, HUANG Zhongjiang2, WU Peizeng3, GUO Xiaofen1, WANG Lei1
1Department of Radiology, Affiliated Hospital of Shanxi University of Chinese Medicine, Taiyuan 030024, China; 2Department of Radiology, Shanxi Provincial Hospital of Traditional Chinese Medicine, Taiyuan 030001, China; 3School of Medicine, Xiamen University, Xiamen 361005, China
Abstract: Objective To predict the HER-2 status in breast cancer by integrating full-field digital mammography (FFDM) radiomics features with deep learning features. Methods Retrospective analysis was conducted on of breast cancer patients who underwent clinical surgery or biopsy from March 2018 to December 2023 at the Affiliated Hospital of Shanxi University of Chinese Medicine. Regions of interest within FFDM images were manually delineated to extract radiomics and deep learning features. Following LASSO-based feature selection, support vector machine algorithms were used to construct both a radiomics model and a deep learning model. A composite model was developed using multivariate logistic regression analysis. The predictive performance of each model was evaluated by calculating their AUC values, and their effectiveness and practical value in real clinical decision-making were assessed using decision curve analysis curves. Results The radiomics model exhibited AUC values of 0.835 (95% CI: 0.761-0.898) in the training set and 0.781 (95% CI: 0.701-0.857) in the test set. The deep learning model demonstrated AUC values of 0.904 (95% CI: 0.855-0.955) in the training set and 0.883 (95% CI: 0.823-0.939) in the test set. The composite model achieved AUC values of 0.921 (95% CI: 0.872-0.967) in the training set and 0.890 (95% CI: 0.828-0.942) in the test set. Decision curve analysis indicated that all three models provided a greater net benefit compared to assuming all cases as either HER-2 positive or negative, with the composite model offering the maximum net benefit at various risk thresholds. Conclusion The integration of FFDM radiomics and deep learning features significantly enhances the prediction of HER-2 status in breast cancer, greatly improving both accuracy and reliability. This advancement opens new avenues for the diagnosis and treatment of breast cancer.
Keywords: breast cancer; radiomics; deep learning; HER-2 status
乳腺癌是全球女性最常见的恶性肿瘤,并且是女性因癌症死亡的主要原因之一[1-2]。HER-2状态对乳腺癌治疗至关重要,因其与肿瘤侵袭性和预后紧密相关[3-4]。通过准确评估HER-2状态,可以选择合适的抗HER-2靶向治疗,定制个体化治疗方案,并预测疾病结果。HER-2阳性患者使用如曲妥珠单抗等靶向药物,可显著抑制肿瘤生长并提高生存率[5-6]。目前,HER-2通常通过免疫组织化学(IHC)或荧光原位杂交(FISH)检测,但这些方法由于样本限制可能无法全面反映肿瘤状态[7];此外,活检可能引起并发症如感染、出血,且存在成本高和心理压力等问题。无创性方法不仅能降低患者的痛苦和并发症风险,还能更频繁地检测和动态监测肿瘤的分子变化,帮助医生及时调整治疗方案,提高治疗效果。FFDM是乳腺癌筛查的重要工具,提供高分辨率图像和高成本效益,支持便捷存储与共享,提升图像处理与计算机辅助检测效率[8]。但此技术并不直接用于评估乳腺癌的HER-2状态。影像组学是医学影像领域的人工智能技术,通过从影像中提取大量特征并筛选来构建预测模型,从而提升影像的预测能力[9]。既往研究探讨了基于FFDM影像组学预测乳腺癌HER-2状态,结果在训练集、验证集曲线下面积(AUC)分别仅为0.824、0.775[10]。这一结果揭示了仅依赖影像组学特征进行预测的局限性,整合更复杂的特征可以提升预测精度和泛化能力[11]。近年来,深度学习(DL)中的卷积神经网络(CNN)在计算机视觉领域取得了显著成就,并已应用于肿瘤分级和预后评估等领域。鉴于医疗数据集的限制性,采用预训练的CNN进行迁移学习能有效防止过拟合,已广泛应用于多种实际场景[12-14]。目前,在使用FFDM的DL技术方法中,针对乳腺癌HER-2状态的预测尚未经过充分研究和验证。为了提高预测精度和泛化能力,整合了更复杂的特征,以弥补现有技术的不足,并展示其创新性及潜在的改进价值。本研究通过融合FFDM影像组学特征与DL特征,开发一种创新方法以精确预测乳腺癌HER-2状态。本研究提升诊断准确性并优化治疗策略,以期简化传统诊断流程,提高患者的接受度和治疗效率,推动乳腺癌精准医疗的发展。
1" 资料与方法
1.1" 一般资料
回顾性分析山西中医药大学附属医院2018年3月~2023年12月经临床手术或穿刺活检的乳腺癌患者FFDM、临床及病理资料。纳入标准:每位患者包括2张FFDM图像,分别为头尾位(CC)和内外斜位(MLO);手术或穿刺活检前行FFDM检查;病理证实为原发浸润性导管癌。排除标准:FFDM非肿块性病灶,包括仅表现为恶性钙化、结构扭曲及局部密度增高等;术前有放疗、化疗和中医治疗史;图像质量欠佳,无法提取可靠特征。最终纳入185例患者,为确保子集中的分布与整体数据集一致,通过分层抽样按7:3比例分训练集129例和测试集56例。本研究为回顾性研究豁免患者知情同意,经医院伦理委员会批准(伦理编号:202412271)。
1.2" HER-2状态评定标准
HER-2阳性由IHC(+++)的强阳性结果或FISH检测证实的HER-2基因扩增确定,而HER-2阴性由IHC(-)或(+)显示的低或无HER-2表达,或IHC(++)结合FISH阴性结果共同确定,以确保无基因扩增。
1.3" 图像采集与分割
使用西门子Mammomat Fusion数字乳腺X线机采集CC和MLO图像,参数选用全自动曝光,管电压25~35 kV,高年资医师通过系统软件评估图像质量。将原始DICOM图像导入ITK-SNAP3.8.0软件,由2位15年工作经验的射科医师进行手动勾画感兴趣区(ROI)。
1.4" 特征提取及选择
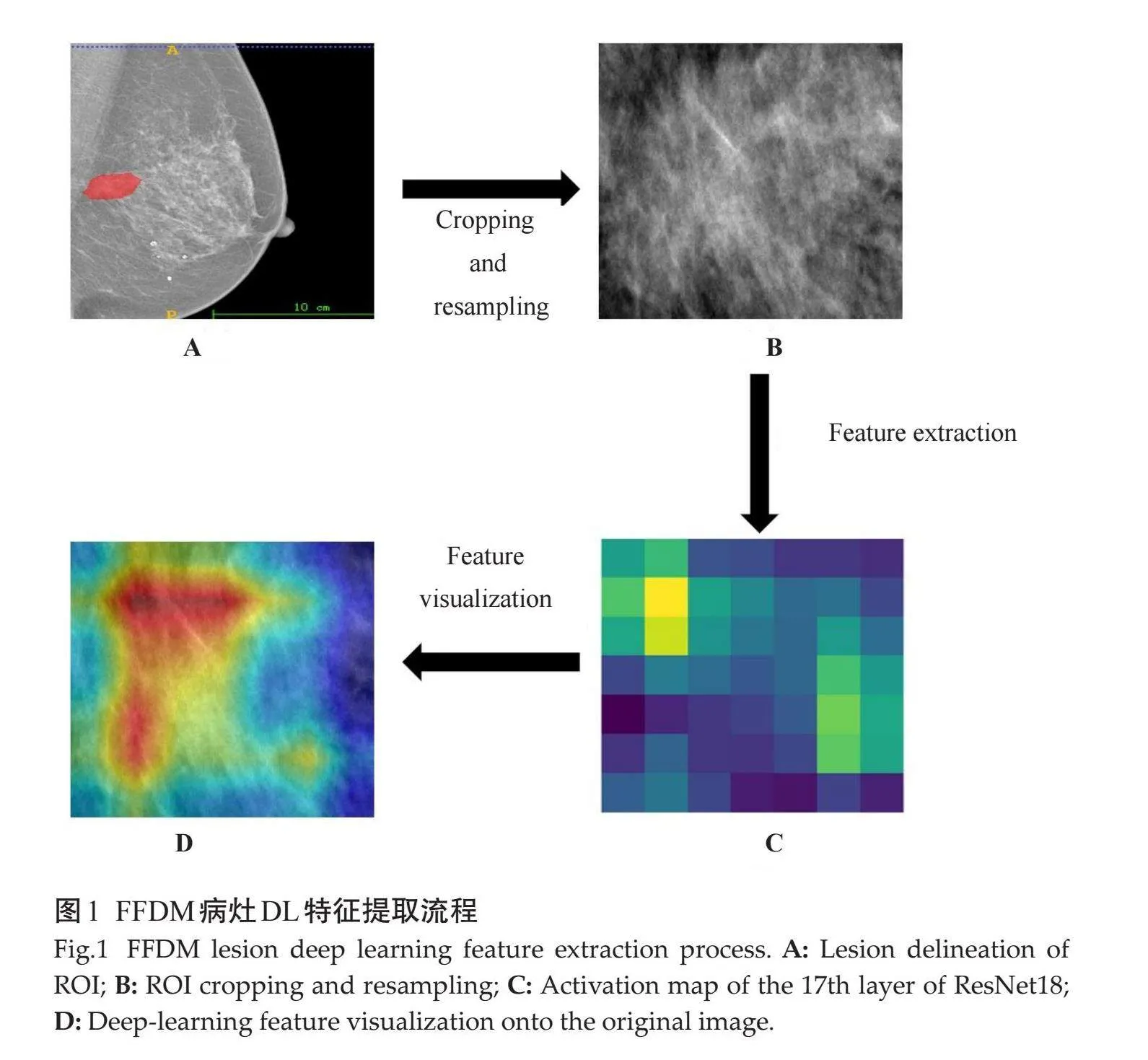
使用开源软件Python3.8.8进行影像组学特征提取,分别从原始图像及小波变换图像上提取包括形状特征、一阶统计特征和高阶统计特征,CC和MLO图像共1774个特征。使用ResNet18模型提取DL特征之前,FFDM图像需要预处理。首先,图像从指定的ROI裁剪成矩形。然后,调整图像大小至标准的224×224像素。最后,对像素值进行归一化处理,设定均值为(0.485, 0.456, 0.406),标准差为(0.229, 0.224, 0.225),以符合使用ImageNet预训练的ResNet18模型的要求[15]。提取自全局平均池化层前的最后一个卷积层的输出,CC和MLO图像共得到1024个DL特征(图1)。为确保特征提取的一致性,本研究随机选取了20例由2位医师分别独立勾画ROI,并使用相同方法提取影像组学和DL特征。通过组内相关系数(ICC)评估了2位医师特征提取的一致性,选取ICCgt;0.75的特征用于进一步分析。先进行Z-score标准化以消除尺度差异,随后利用最小绝对收缩和选择算子(LASSO)进行特征选择。
1.5" 建立预测模型
在训练集中分析患者的术前临床资料和FFDM影像学表现与HER-2状态的相关性。分析变量包括年龄、乳腺密度、肿块位置(左乳、右乳)、肿块最长径、是否含有恶性钙化。通过二元逻辑回归确定是否存在独立预测因子,并构建临床模型。将筛选后的影像组学特征和DL特征分别使用支持向量机分别建立影像组学模型及DL模型。通过多因素逻辑回归分析建立综合模型。计算各模型AUC值评估其预测效能,并通过决策曲线分析(DCA)评估各模型在实际临床决策中的有效性和实用价值。
1.6" 统计学分析
采用GraphPad Prism9.0.2软件进行统计分析,对计量资料行正态性检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验。计数资料以n(%)表示,组间比较采用χ2检验或Fisher精确概率法。采用Python软件进行LASSO特征筛选及建立预测模型。采用R软件绘制ROC曲线、DCA曲线。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 临床资料
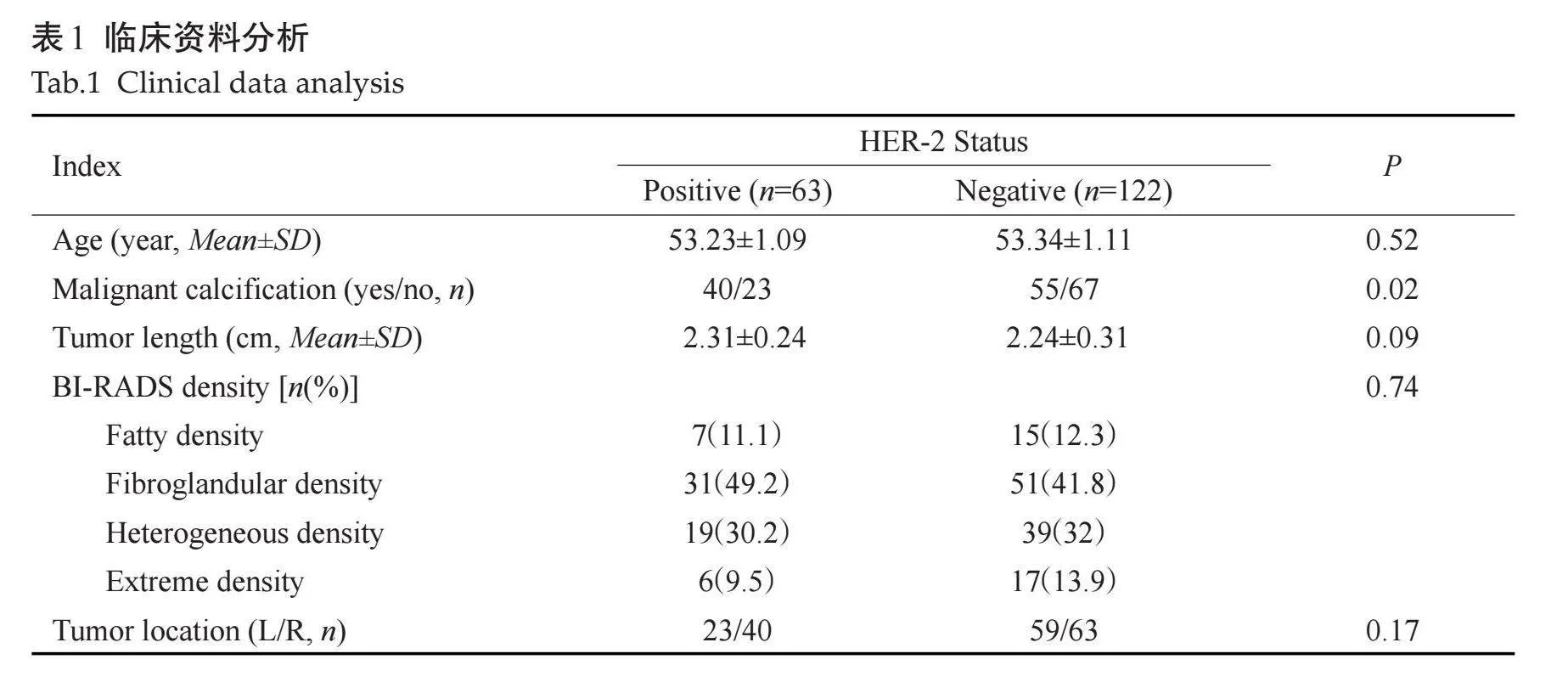
HER-2阳性与阴性乳腺癌患者年龄、乳腺密度、肿块位置、肿块最长径在两组间差异无统计学意义(Pgt;0.05)。恶性钙化在两组间差异有统计学意义(Plt;0.05,表1)。因此将其作为预测因子纳入临床预测模型中。该模型在训练集中的AUC值为0.595(95% CI:0.505~0.680),在测试集中的AUC值为0.586(95% CI:0.447~0.716)。
2.2" 特征筛选结果
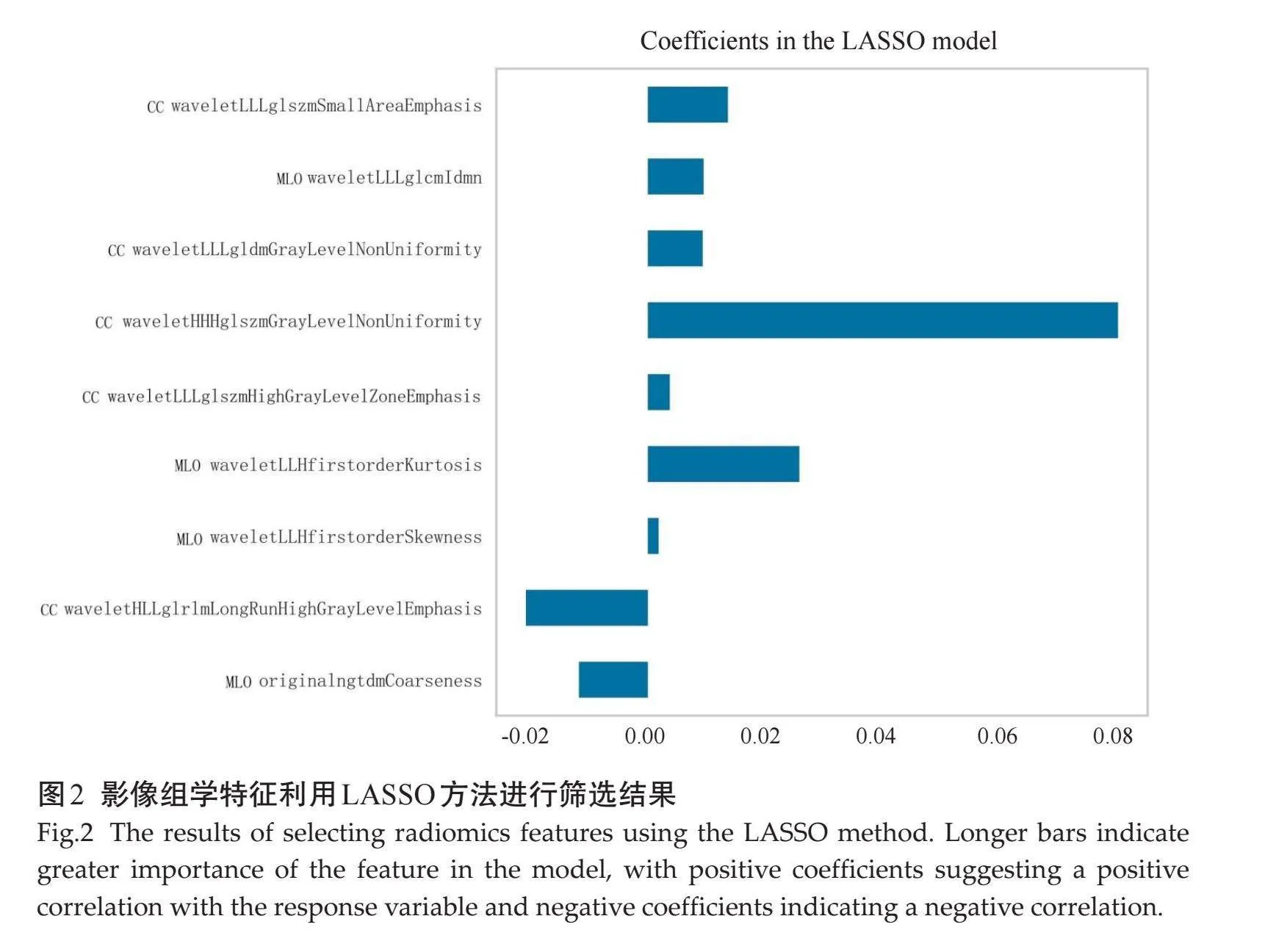
CC和MLO图像共纳入1348个ICCgt;0.75的影像组学特征。LASSO回归分析经过5折交叉验证后,当λ值为0.067时得到9个系数非零最佳影像组学特征(图2)。CC和MLO图像DL特征分别由DF1到DF512依次命名,共纳入876个ICCgt;0.75的DL特征。LASSO回归分析显示,当λ值为0.061时得到7个系数非零最佳DL特征(图3)。
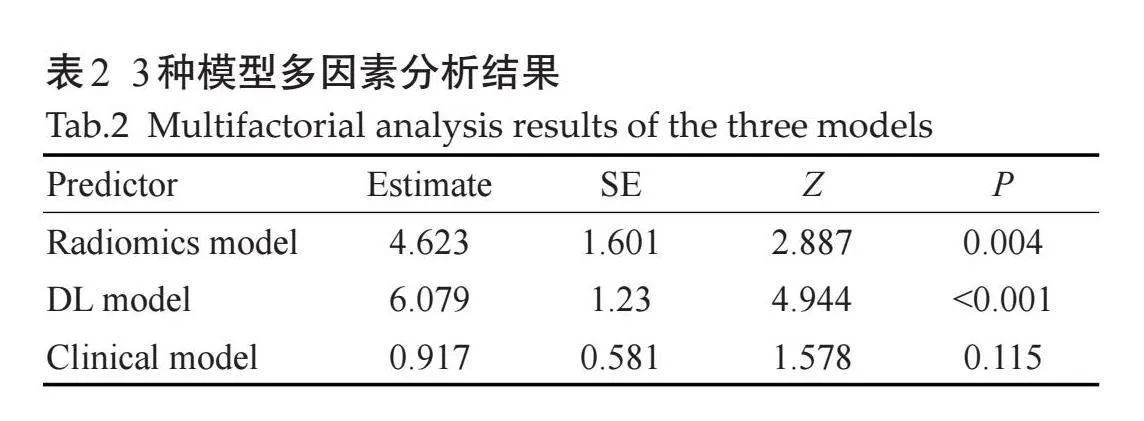
2.3" 预测模型建立与评估
临床模型、影像组学模型和DL模型多因素分析显示,影像组学模型和DL模型均为独立的预测因子(表2)。基于这两种模型构建了一个综合模型,临床模型则未被纳入进一步的研究。影像组学模型在训练集和测试集的AUC分别为0.835(95%CI:0.761~0.898)和0.781(95% CI:0.701~0.857),DL模型在训练集和测试集的AUC分别为0.904(95% CI:0.855~0.955)和0.883(95% CI:0.823~0.939),综合模型在在训练集和测试集的AUC分别为0.921(95%CI:0.872~0.967)和0.890(95% CI:0.828~0.942)(图4)。DCA结果显示,在大多数风险阈值范围内,3种模型相比于全部认为HRE-2阳性或阴性可获得更好的净收益,其中综合模型在风险阈值下可获得最大净收益(图5)。
3" 讨论
乳腺癌的风险因素众多,其中HER-2在乳腺癌分类中起关键作用,其过度表达或基因扩增与癌细胞的快速增长密切相关[16-17]。传统的HER-2状态评估方法依赖于活检样本,受限于样本代表性和技术依赖性。本研究发现FFDM图像中的恶性钙化与HER-2过表达之间存在显著相关性,但模型的效能偏低,与既往研究[18]一致。在本研究中,影像组学模型和DL模型都证明了作为独立预测因子的有效性,分别在训练集和测试集展示了较高的AUC值。具体而言,DL模型在各个数据集上均显示出比影像组学模型更高的预测精度,这表明其更强的数据处理和特征识别能力。通过将影像组学和DL技术融合,构建的综合模型在预测乳腺癌HER-2状态方面表现出较高的准确性和稳定性。这种模型的优势主要源自于它能够综合不同模型的分析力度和范围,提高对复杂影像数据的全面解读能力。综合模型通过融合影像组学的定量特征和DL的层次深远特征,不仅增强了模型对数据内在关联性的捕捉,还优化了决策边界,使之更精准地适应各种数据分布。此外,这种模型通过互补误差的机制,降低了过拟合的风险,并提升了在多变临床环境下的适应性和泛化能力。因此,综合模型不只是在统计指标上超越单一模型,其在实际临床应用中更具有高效表现。该方案不仅能有效补充传统生物标志物检测方法(如IHC和FISH),还为无创诊断技术的未来发展指明了方向。
随着医学影像技术的进步和大数据及人工智能算法的应用,影像组学展现出重要价值并正逐步推向临床应用[19]。过往的研究已经探索了基于FFDM影像组学在乳腺癌HER-2状态预测中的应用。有研究基于多中心FFDM影像组学来预测HER-2状态[10],模型效能与本研究相似。此外,本研究同样发现筛选出的经小波变换的纹理特征与HER-2状态之间存在显著相关性。小波变换用于分解图像数据,可在多尺度上揭示特征,适用于捕捉医学图像中的局部特征和异质性。其多分辨率特性能够有效抑制噪声并增强图像,从而提高影像组学模型的诊断能力,对疾病的早期诊断和病理评估至关重要[20]。纹理分析通过评估图像中的灰度变异性和模式,对理解组织结构和病理状态起着关键作用。在影像组学中,纹理特征不仅揭示了组织的生物学特性,还对疾病分类和预后评估有重要意义[21]。尽管影像组学在临床应用方面展现出潜力,但其对图像细节的反映较为有限,导致模型效能受限。DL通过自动学习庞大数据集中的复杂模式和特征,有望提升影像组学模型的诊断精度和泛化能力[22]。此技术能够深入挖掘图像数据的细微差异,进一步提高特征提取和解析的效率,从而在临床决策支持中发挥更大作用,尤其在复杂病理状态的识别和预后评估方面。目前,DL技术已被用于乳腺癌影像数据的分析,以预测HER-2状态。有研究通过预训练的CNN模型对乳腺超声图像进行分析,能够有效区分HER-2阳性和阴性病例,模型的AUC达到了0.81[23]。有学者建立基于MRI的DL特征来预测HER-2状态,模型在训练集和验证集中的AUC分别为0.868和0.763[24]。尽管目前尚无研究联合影像组学和DL技术来预测乳腺癌的HER-2状态,但已有研究表明,结合FFDM的影像组学与DL特征,可显著提升良恶性病变的识别效果[25]。基于此,本研究旨在探索影像组学与DL技术相结合是否能提高预测乳腺癌HER-2状态的准确性。本研究采用的基于FFDM图像的DL模型在预测乳腺癌HER-2状态方面,相较于先前的基于超声和MRI的DL技术,表现出更高的性能。这一优势可能源自于FFDM图像的更高清晰度、针对性的模型优化,以及使用了更为先进的技术和大规模的高质量数据集。此外,结合影像组学和DL特征的综合模型在乳腺癌HER-2状态的预测上展示了显著的提升,这不仅提高了预测的精确性,也增强了模型的鲁棒性和可靠性,进一步推动了乳腺癌精准医疗的发展。本研究结果凸显了两种技术结合的潜力,不仅克服了单一技术的局限性,还显著提高了模型的预测性能,AUC值的提升突出体现了技术整合的优势。综合模型的应用在不增加患者负担的情况下,提供了更为精准的诊断信息,对于制定个性化治疗计划至关重要。相关研究表明DL技术显著提高了多种癌症类型生物标志物检测的准确性和可靠性[26]。然而,这些技术也存在局限性,例如,DL技术需要大量的训练数据,且模型解释性有限。此外,尽管影像组学在提升诊断精度方面具有潜力,但其复杂性和对高技术的依赖可能阻碍其在资源有限的环境中普及[27-28]。本研究开发的无创诊断技术为乳腺癌治疗提供了一种革新方法,其潜在的广泛应用可能显著改善治疗效果。通过减少对传统活检的依赖,这种方法不仅降低了患者面临的并发症风险,还特别适合资源有限的地区,提供了一种更经济、更可获取的诊断选择。随着技术的进一步验证和优化,这种无创诊断方法预计将在临床实践中带来革命性的改变,优化现有的乳腺癌诊断和治疗流程,提升整体治疗成效,并有助于提高患者的生活质量。尽管面临挑战,医疗政策和法规的支持是关键[29-30]。未来研究应评估这些技术在不同人群和地区的适用性和效果,以推广应用。
本研究存在几项局限性:首先,由于研究数据仅来源于单一中心,因此需要使用外部数据集进行验证以增强结果的普适性;其次,当前研究的数据量相对较小,扩增数据规模有望进一步提升模型的性能;最后,研究中的ROI是由医生手动勾画的,这可能导致特征提取的稳定性受到人为因素的影响。
综上,本研究表明通过结合FFDM影像组学与DL特征,可以显著提高乳腺癌HER-2状态的预测准确性和可靠性。这一综合技术不仅优化了诊断精度,还促进了无创诊断和个性化治疗策略的发展。总体而言,影像组学与DL的结合不仅开辟了乳腺癌诊疗的新途径,也推动了医疗技术的进步,特别是在提高治疗效果和患者生活质量方面展现了显著潜力。
参考文献:
[1]" "Li CL, Song LR, Yin JD. Intratumoral and peritumoral radiomics based on functional parametric maps from breast DCE-MRI for prediction of HER-2 and ki-67 status[J]. J Magn Reson Imaging, 2021, 54(3): 703-14.
[2]" "Cao W, Chen HD, Yu YW, et al. Changing profiles of cancer burden worldwide and in China: a secondary analysis of the global cancer statistics 2020[J]. Chin Med J, 2021, 134(7): 783-91.
[3]" "Smit EF, Felip E, Uprety D, et al. Trastuzumab deruxtecan in patients with metastatic non-small-cell lung cancer (DESTINY-Lung01): primary results of the HER2-overexpressing cohorts from a single-arm, phase 2 trial[J]. Lancet Oncol, 2024, 25(4): 439-54.
[4]" "Ouyang QC, Wang Y, Zhang J, et al. HS-10352 in hormone receptor-positive, HER2-negative advanced breast cancer: a phase 1 dose-escalation trial[J]. Cancer Med, 2023, 12(24): 21849-60.
[5]" "Ibragimova KIE, Geurts SME, Laczkó D, et al. Trastuzumab resistance in patients with HER2-positive advanced breast cancer: results from the SONABRE registry[J]. Clin Breast Cancer, 2024, 24(2): 103-11.
[6]" "岳瑞雪, 胡崇珠, 郝" 鑫, 等. 曲妥珠单抗和帕妥珠单抗联合不同化疗方案新辅助治疗HER-2阳性乳腺癌真实世界疗效及安全性观察[J]. 中国肿瘤临床, 2023, 50(5): 248-54.
[7]" " 周晓蝶, 戚荣鑫, 余" 波, 等. 乳腺淋巴瘤72例临床病理分析[J]. 临床与实验病理学杂志, 2023, 39(8): 925-30.
[8]" "Sheng MH, Ji J, Zhang CY, et al. Optimization of the radiation dose of digital breast tomosynthesis in opportunistic screening by studying the effect of different combinations of FFDM and DBT views[J]. Int J Gen Med, 2021, 14: 1147-54.
[9]" "Gupta S, Nayak K, Pendem S. Impact of slice thickness on reproducibility of CT radiomic features of lung tumors[J]. F1000Res, 2023, 12: 1319.
[10]" 谢玉海, 韩剑剑, 马培旗, 等. 基于多中心数字化乳腺X线摄影影像组学预测乳腺癌人表皮生长因子受体-2过表达[J]. 中国医学影像技术, 2023, 39(3): 365-9.
[11]" 冯" 源, 兰晓莉. 影像组学介绍[J]. 中华核医学与分子影像杂志, 2023, 43(1): 55-60.
[12]" Naser PV, Maurer MC, Fischer M, et al. Deep learning aided preoperative diagnosis of primary central nervous system lymphoma[J]. iScience, 2024, 27(2): 109023.
[13]" Young SI, Zhe W, Taubman D, et al. Transform quantization for CNN compression[J]. IEEE Trans Pattern Anal Mach Intell, 2022, 44(9): 5700-14.
[14]" Wang ZJ, Turko R, Shaikh O, et al. CNN explainer: learning convolutional neural networks with interactive visualization[J]. IEEE Trans Vis Comput Graph, 2021, 27(2): 1396-406.
[15]" 刘" 飞, 陈仁文, 邢凯玲, 等. 基于迁移学习与深度残差网络的滚动轴承快速故障诊断算法[J]. 振动与冲击, 2022, 41(3): 154-64.
[16]" 郭" 晴, 张" 剑. HER2低表达乳腺癌的靶向治疗研究进展[J]. 中国癌症杂志, 2023, 33(2): 181-90.
[17]" Zuo D, Yang LX, Jin Y, et al. Machine learning-based models for the prediction of breast cancer recurrence risk[J]. BMC Med Inform Decis Mak, 2023, 23(1): 276.
[18]Ji Y, Shao ZZ, Liu JJ, et al. The correlation between mammographic densities and molecular pathology in breast cancer[J]. Cancer Biomark, 2018, 22(3): 523-31.
[19]" 张丽菡, 王" 化, 陈永孜, 等. 影像组学在免疫治疗方面的应用现状[J]. 分子影像学杂志, 2024, 47(2): 216-9.
[20] Anita JN, Kumaran S. A deep learning architecture for meningioma brain tumor detection and segmentation[J]. J Cancer Prev, 2022, 27(3): 192-8.
[21]" 陈" 平, 代国坡, 蔡礼彬. 基于CT纹理分析预测食管鳞癌患者Ki-67表达状态的应用价值[J]. 实用放射学杂志, 2024, 40(2): 204-8.
[22]" 朱正群, 巩" 萍, 黄栎有, 等. 联合CT影像组学与深度学习特征建立列线图预测食管鳞癌放疗近期疗效[J]. 放射学实践, 2024, 39(2): 233-8.
[23]" Zhang XY, Li H, Wang CY, et al. Evaluating the accuracy of breast cancer and molecular subtype diagnosis by ultrasound image deep learning model[J]. Front Oncol, 2021, 11: 623506.
[24] Guo Y, Xie XT, Tang WJ, et al. Noninvasive identification of HER2-low-positive status by MRI-based deep learning radiomics predicts the disease-free survival of patients with breast cancer[J]. Eur Radiol, 2024, 34(2): 899-913.
[25] Zhang XY, Liang CX, Zeng D, et al. Pattern classification for breast lesion on FFDM by integration of radiomics and deep features[J]. Comput Med Imaging Graph, 2021, 90: 101922.
[26] Avanzo M, Porzio M, Lorenzon L, et al. Artificial intelligence applications in medical imaging: a review of the medical physics research in Italy[J]. Phys Med, 2021, 83: 221-41.
[27]" Mousavi SM, Beroza GC. Deep-learning seismology[J]. Science, 2022, 377(6607): eabm4470.
[28]" 周志鹏, 赵春雷. PET影像组学临床应用进展[J]. 中国医学影像学杂志, 2023, 31(4): 424-8.
[29]" 刘士远. 加强医学影像数据库建设 推动行业快速发展[J]. 中华放射学杂志, 2022, 56(9): 931-4.
[30]" 胡梦瑶, 袁" 飞. 人工智能临床应用的法律规制[J]. 中华医学杂志, 2023, 103(18): 1363-6.
(编辑:林" 萍)
