基于多参数磁共振的影像组学模型预测前列腺癌Ki67的表达
2024-10-31翟承凤何永胜戚轩杨宏楷杨馨
摘要:目的" 基于多参数磁共振建立影像组学模型预测前列腺癌Ki67的表达。方法" 回顾性分析我院2020年12月1日~2023年6月30日经病理证实、磁共振数据完成的PCa患者176例,按照7:3的比例分配到训练组(n=140)及验证组(n=36)。从PACS工作站中导出患者T2加权成像、T2加权脂肪抑制成像、小视野扩散加权成像、表观扩散系数的DICOM图像,在4个序列图像中勾画出病变区域的三维感兴趣区,并提取其中的影像组学特征,使用Spearman相关系数和LASSO回归对特征进行降维和选择,利用筛选出的组学特征建立影像组学模型。利用绘制ROC曲线并计算曲线下面积(AUC),阐述模型的诊断意义,并通过验证组对诊断效能施行验证。结果" 共提取1834个影像组学特征,最终筛选得到20个组学特征与Ki67表达状态相关。在互相独立创建的8个影像组学模型中,分别为逻辑回归、支持向量机、K-近邻、随机森林、极度随机树、极致梯度提升、轻量级梯度提升机和多层感知机,此中轻量级梯度提升机模型效益最优,训练组的AUC值为0.948(95% CI:0.913~0.982),测试组的AUC值为0.832(95% CI:0.698~0.967)。结论" 基于多参数磁共振构建的影像组学模型可以预测Ki67表达状况,且轻量级梯度提升机模型最好。
关键词:前列腺癌;影像组学;多参数磁共振成像;Ki67;小视野扩散加权成像
Prediction of Ki67 expression in prostate cancer by radiomics models based on multiparameter magnetic resonance imaging
ZHAI Chengfeng1, 2, HE Yongsheng2, QI Xuan2, YANG Hongkai2, YANG Xin1, 2
1The Fifth Clinical Medical College of Anhui Medical University, Ma'anshan Clinical College, Anhui Medical University, Ma'anshan 243000, China; 2 Department of Imaging, Ma'anshan People's Hospital, Ma'anshan 243000, China
Abstract: Objective To establish a radiomics model to predict Ki67 expression of prostate cancer on multiparameter magnetic resonance imaging(mp‑MRI). Methods A total of 176 prostate cancer patients confirmed by postoperative pathology in our hospital from December 1, 2020 to June 30, 2023 with complete magnetic resonance date were rest retrospectively analyzed,and the patients were divided to the training group (n=140) and validation group (n=36) in a 7:3 ratio. The DICOM images of patients T2‑weighted imaging (T2WI), fat‑suppression T2‑weighted imaging (FS‑T2WI), zoomed imaging technique with parallel transmission diffusion weighted imaging (ZOOMit-DWI), the apparent diffusion coefficient (ADC) were exported from the PACS workstation , the three‑dimension volume region of interest of the tumor was manually delineated on the four sequential images, and radiomics features were extracted, and the Spearman correlation analysis and LASSO analysis were used to single out the most valuable radiomic features. The radiomics models were built using the radiomics features The diagnostic value of the model was analyzed by using ROC curve and calculating the AUC, and the diagnostic efficacy was verified in the validation group. Results A total of 1834 radiomics features were extracted from T2WI, FS-T2WI, ZOOMit-DWI, ADC and 20 features were selected ,which were related to Ki67 status. Among the eight radiomics models established for Logistic Regression, Support Vector Machine, K‑Nearest Neighbor, RandomForest, ExtraTrees, eXtreme Gradient Boosting, Light Gradient Boosting Machine, Multilayer Perceptron, The Light Gradient Boosting Machine model was optimal with an AUC of 0.948 (95%CI: 0.913‑0.982) in the training group and an AUC of the test group of 0.832 (95%CI: 0.698‑0.967). Conclusion The radiomics models based on mp‑MRI can noninvasively predict the expression of Ki67 , and the LightGBM model is the best.
Keywords: prostate cancer; radiomics; multiparameter magnetic resonance imaging; Ki67; zoomed imaging technique with parallel transmission diffusion weighted imaging
前列腺癌(PCa)是男性中诊断出的第二大实体器官癌,仅次于肺癌,即使在多模式治疗之后,PCa在很大程度上无法治愈[1-2]。PCa主要诊断工具为前列腺特异性抗原(PSA)、GLEASON评分、以及影像学检查,其中MRI在PCa的检测中起着至关重要的作用[3-4]。多参数磁共振(mp-MRI)提供了比标准MRI扫描更详细的前列腺图像,其最明确的指征是PSA水平升高、活检阴性,以及存在其他结果支持其用于主动监测和非活检患者[4]。Ki67是一种增殖细胞的标志物,可在细胞周期的活跃期检测到,已有研究证明Ki67不仅可以作为鉴别良恶性前列腺病变的指标,甚至可以反应PCa的恶性程度,预测患者的预后情况,随着Ki67表达强度的增加,PCa患者的预后就越差[5-6]。现有Ki67检测方式基本是通过有创病理活检实现,而MRI作为一种无创检查,近两年也有不少研究以MRI为基础,利用影像组学模型预测Ki67表达[7-10]。相比于普通MRI,mp-MRI能提供更详细、更丰富的信息。但是利用mp-MRI预测PCa Ki67表达的价值在国内研究中并未得到具体验证。本研究基于T2加权成像(T2WI)、T2加权脂肪抑制成像(FS-T2WI)、小视野扩散加权成像(ZOOMit-DWI)、表观扩散系数(ADC)4个扫描序列预测Ki67的表达,使用ZOOMit-DWI,相比于传统弥散加权成像能够减少图像失真并改善脂肪饱和度,能更好的表现前列腺病灶[11]。本研究旨在预测PCa患者的预后,为临床医学提供支持。
1" 资料与方法
1.1" 一般资料
回顾性分析马鞍山市人民医院2020年12月1日~2023年6月30日经穿刺活检或手术病理证实的176例PCa患者的临床、影像资料,将患者按7:3的比例随机分配至训练组(n=140)和验证组(n=36),训练组患者年龄为73.6±9.1岁,PSA为60.76±92.12 ng/mL;测试组患者年龄72.2±8.7岁,PSA为70.67±120.66 ng/mL。纳入标准:病理检查证明为PCa;经免疫组化证明表达Ki67;术前于同一MR扫描仪上行前列腺mp-MRI检查;有完整的临床及MRI资料。排除标准:在进行MRI检查前行放疗、化疗或手术治疗;临床及MRI资料丢失、遗漏,MRI图像质量差无法进行病灶勾勒。本研究已通过马鞍山人民医院伦理委员会审查批件,审批号:医学伦申(2021)第006-008号。
1.2" 扫描方法
采用Siemens MANGETO Prisma 3.0T超导型磁共振,检查前嘱受检者呈仰卧位,采用18通道体部线圈进行扫描。扫描包含横断面T2WI和多b值DWI序列,T2WI参数:FOV 200 mm×200 mm,TR 6980 ms,TE 104 mm,层厚3 mm,层数23层。FS-T2WI参数:FOV 200 mm×200 mm,TR 6980 ms,TE 104 mm,层厚3 mm,层数23层。ZOOMit-DWI参数:FOV 220 mm×220 mm,TR 4000 ms,TE 65 ms,层厚3 mm,体素尺寸0.9 mm×0.9 mm×3 mm,层厚3 mm,层数23层,带宽为1750,b值为0、50、100、200、500、1000、1500、2000和2500 s/mm2,ADC使用b=1500 s/mm2的“高b值生成”[12]。
1.3" 图像分析
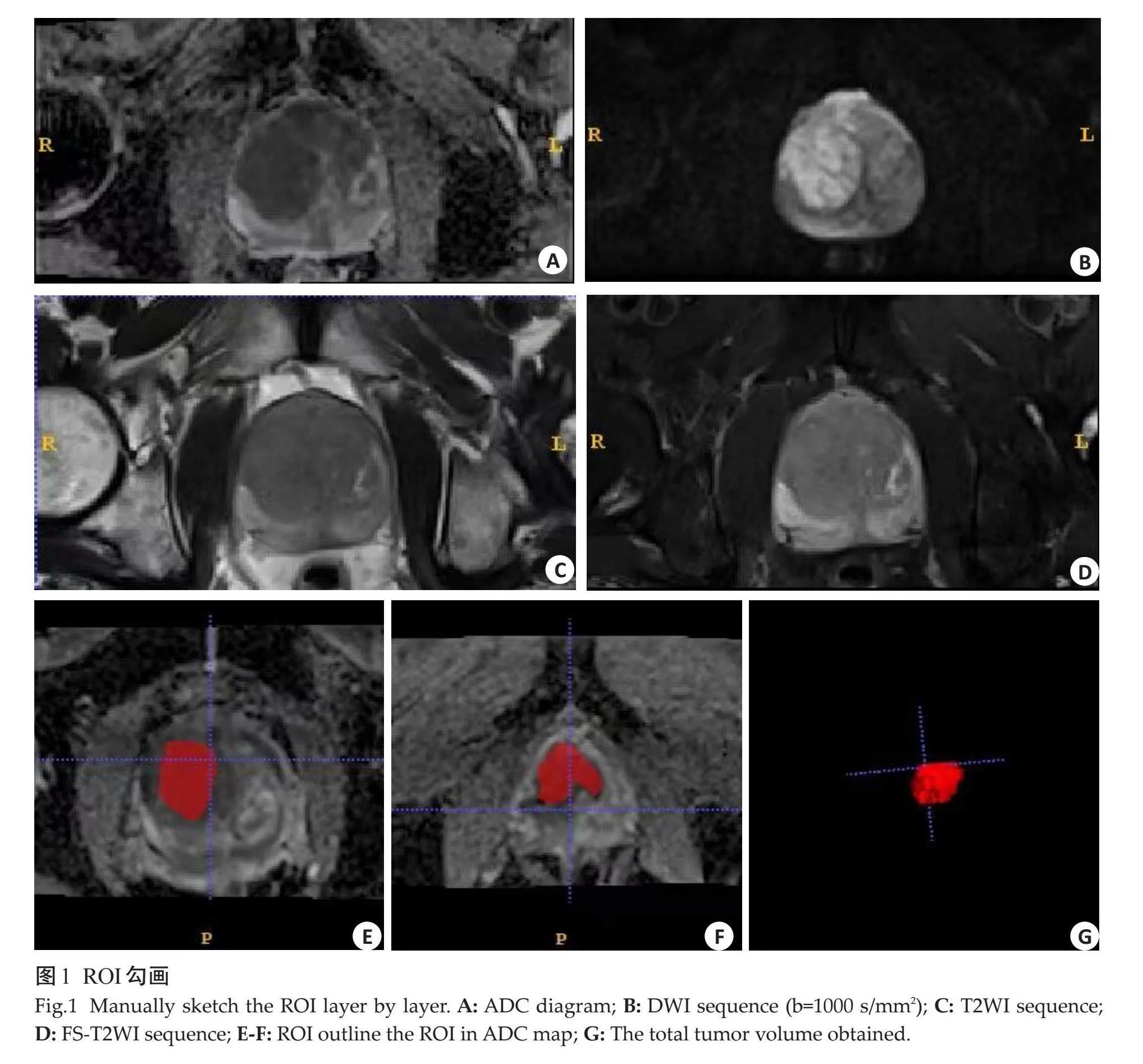
由2位分别具有5年和15年工作经验的放射科医师在双盲情况下进行PCa病灶的分割,先由医师1结合T2WI、FS-T2WI、ZOOMit-DWI图像,在ADC上进行三维感兴趣区的逐层手动勾画,选取肿瘤最大层面,沿病灶边缘手动勾画ROI,尽量避开出血、囊变和坏死等区域(图1),再由医师2进行验证。在双方意见不同的情况下,由另一位具有15年以上工作经验的放射科医师进行定夺。
1.4" 影像组学分析
ROI勾画:通过PACS工作站中导出DICOM图像,后导入处理工作站(Siemens Syngo.via),使用ITK-SNAP软件(http:/www.itksnao.org/pmwiki/pmwiki.php)在ADC图像上进行病灶ROI的勾画。
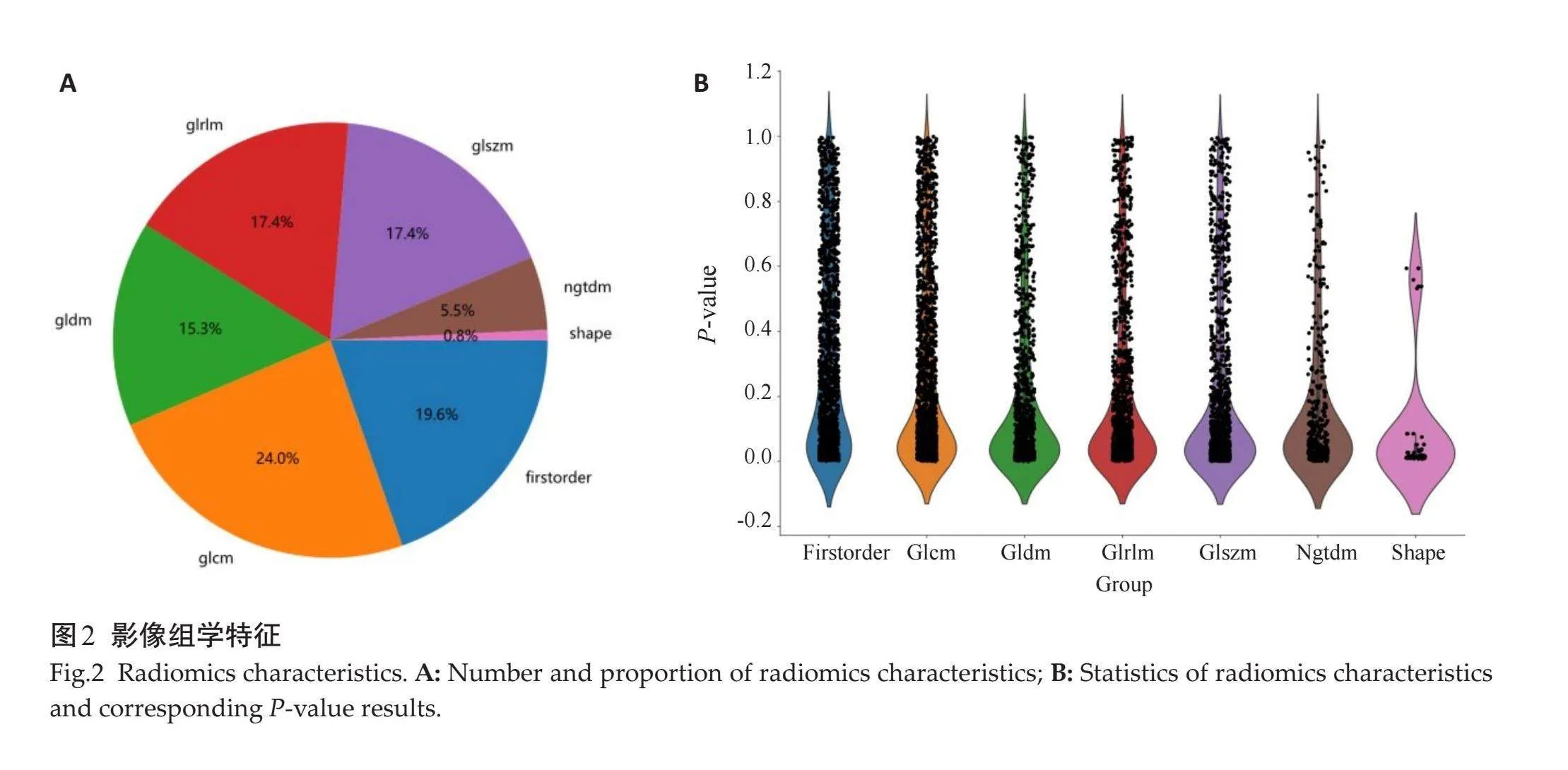
特征提取:所有影像特征都通过PyradiRadiomic(http://pyradiRadiomic.readthedocs.io)。特征可以分为3组:几何图形特征(描述了肿瘤的在三维空间的图形特征);强度特征(描述了肿瘤内体素强度的一级统计分布);纹理特征(描述了模式,或强度的二阶和高阶空间分布)。本文采用几种不同的方法提取纹理特征,包括灰度共现矩阵(GLCM)、灰度运行长度矩阵(GLRLM)、灰度大小区域矩阵(GLSZM)和邻域灰度差分矩阵(NGTDM)方法。
模型筛选和建立:将176例病例按7:3的比例随机分为训练组和验证组,对于可重复性高的特征,使用Spearman相关系数计算特征之间的相关性,保留任意两个特征之间相关系数大于0.9的特征之一。为了最大程度地保留描述特征的能力,采用贪婪递归删除策略进行特征过滤,即每次删除当前集中冗余度最大的特征。最终保留了20个特性,放射性组学特征的P值lt;0.05。并分别创立8个独立的影像组学模型。包括逻辑回归(LR)、支持向量机(SVM)、K-近邻(KNN)、随机森林、极度随机树(ExtraTrees)、极致梯度提升(XGBoost)、轻量级梯度提升机(LightGBM)和多层感知机(MLP),并计算出每个模型在验证组中的绘制ROC曲线。
1.5" Ki67检测
所有患者在MRI检查后3月内接受经超声引导下活检或手术。所有前列腺实质组织样品的Ki67表达。为了确定Ki67的免疫组织化学评价标准,计算3个热点(增殖最强烈的区域)中染色细胞的百分比,并取平均值。当有多个肿瘤时,取最大值。根据病理结果将数据分为2个亚组:Ki67将患者分为高表达组(≥10%)和低表达组(lt;10%)[8]。训练组中Ki67高表达组52例,低表达组88例;验证组中Ki67高表达组14例,低表达组22例。
1.6" 统计学分析
使用R4.2.1软件进行统计分析。计量资料以均数±标准差表示,两组间比较采用独立样本t检验;所有放射性特征进行了Mann-Whitney联合检验统计检验和特征筛选。采用曲线下面积(AUC)分析各模型的诊断效能。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 一般资料与病理资料
训练组中高表达组和低表达组间的年龄差异有统计学意义(P=0.02),验证组中高表达组和低表达组间的年龄差异无统计学意义(Pgt;0.05),训练组和验证组中高表达组和低表达组间的PSA差异均无统计学意义(Pgt;0.05,表1)。
2.2" 影像组学模型
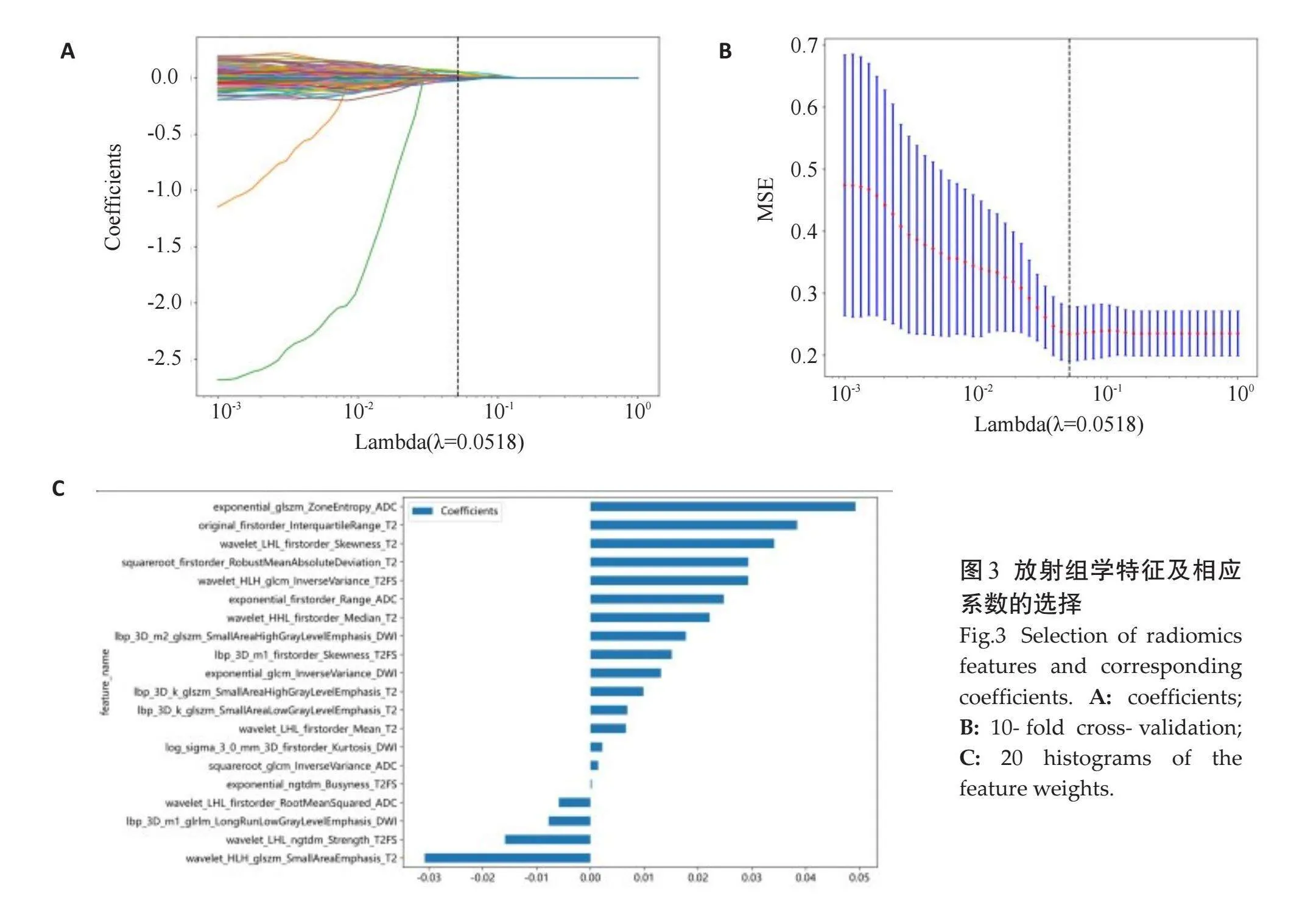
2.2.1" 影像组学特征的选择" "通过PyradiRadiomic从T2WI、FS-T2WI、ZOOMit-DWI、ADC 4个序列中共提取提取1834个特征(ICC≥0.75),共7个类别(图2)。经过LASSO逻辑回归、10倍交叉验证、MSE逐步降维,去除冗余特征,最后筛选出其中coefgt;0的特征共20个(图3)。
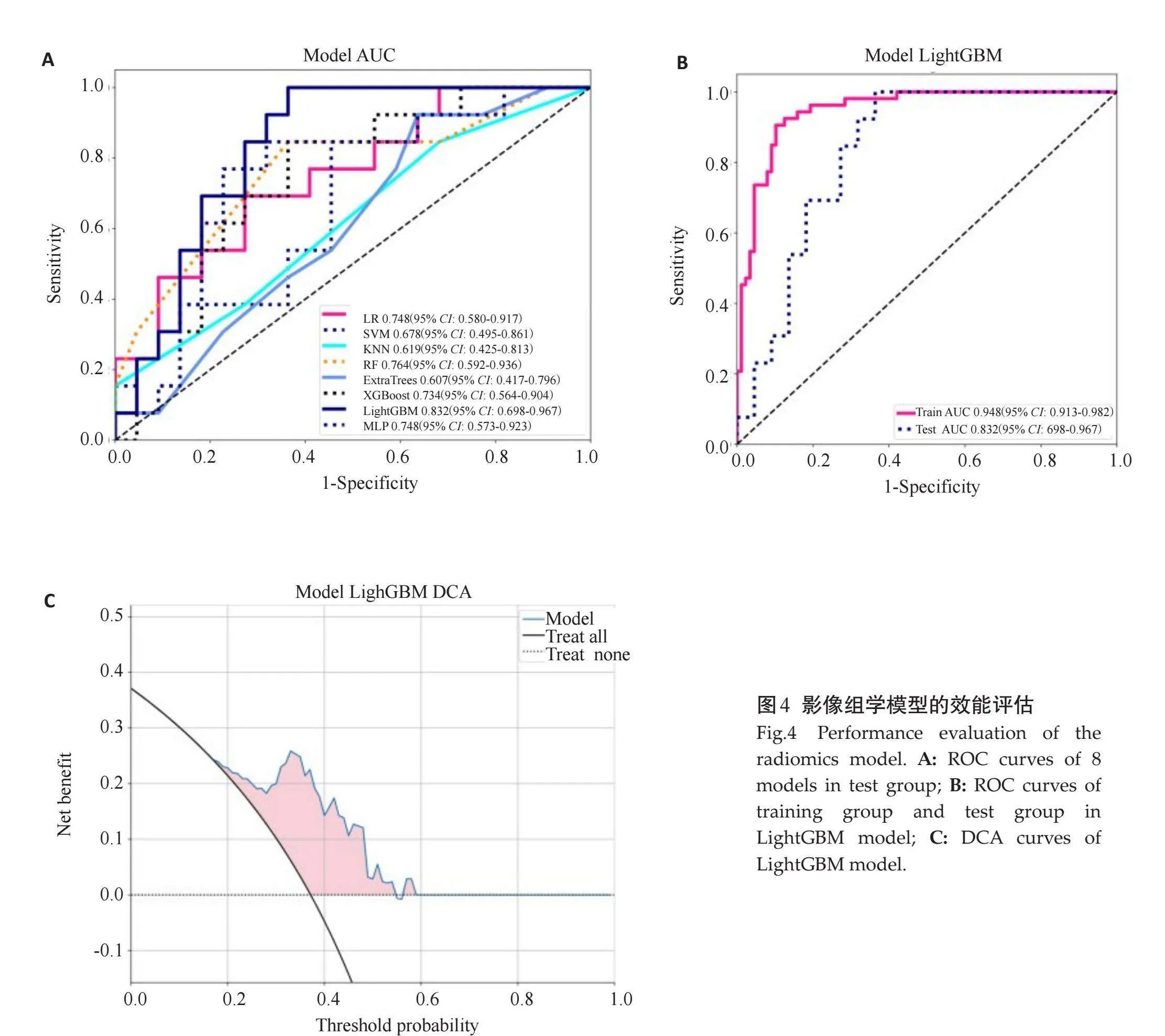
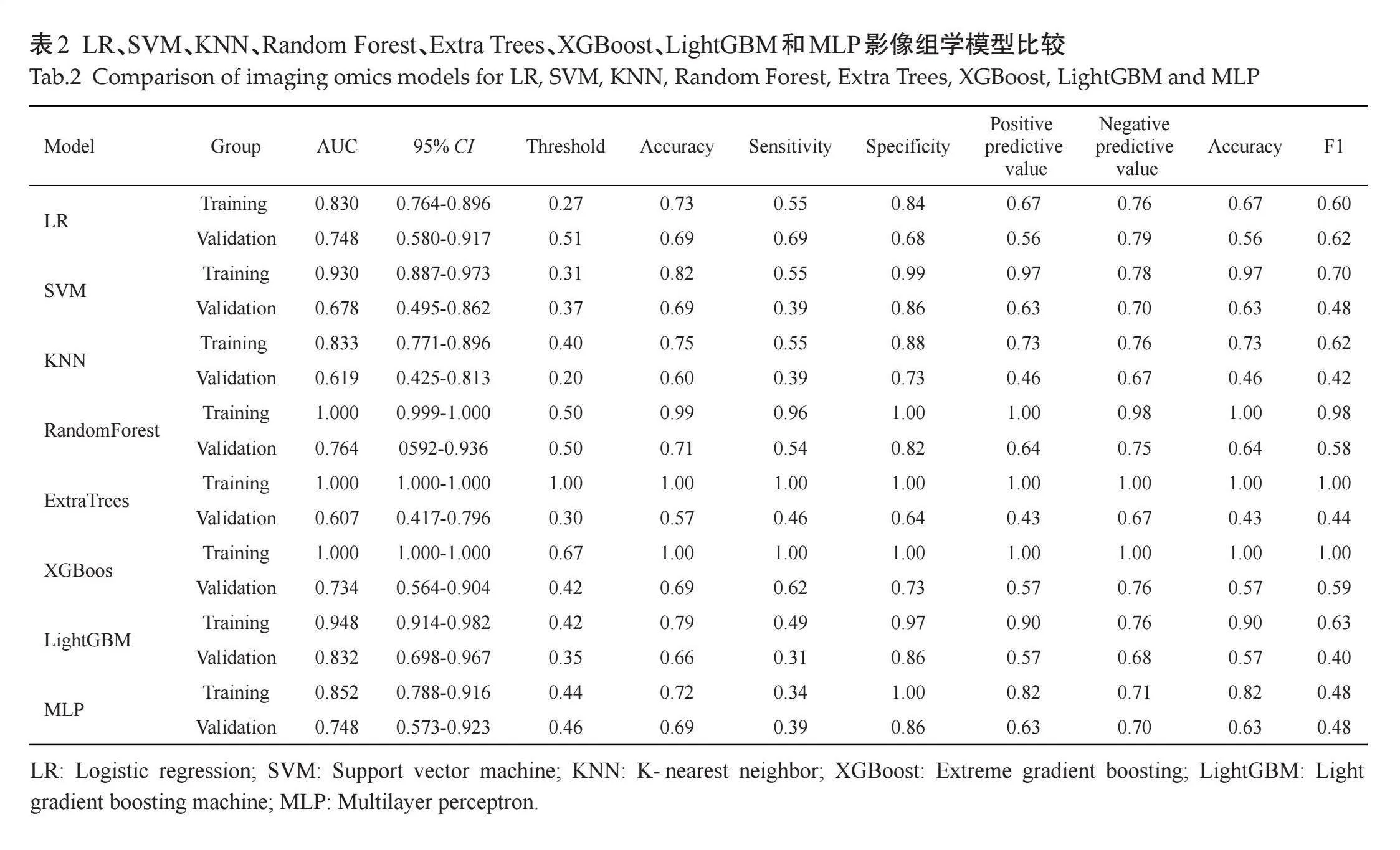
2.2.2" 影像组学模型建立和比较" "本研究8个影像组学模型中,验证组中的AUC值分别为0.748(95%CI:0.580~0.917)、0.678(95% CI:0.495~0.861)、0.619(95%CI:0.425~0.813)、0.764(95%CI:0.592~0.936)、0.607(95%CI:0.417~0.796)、0.734(95% CI:0.564~0.904)、0.832(95%CI:0.698~0.967)、0.748(95%CI:0.573~0.923)(图4)。计算各模型的准确性、敏感度、特异度、阳性预测值、阴性预测值、阈值、F1(表2),结果显示LightGBM模型预测了最佳性能,其中训练组的AUC值为0.948(95% CI:0.913~0.982),验证组的AUC值为0.832(95% CI:0.698~0.967)。
3" 讨论
PCa是男性好发肿瘤之一,尤其好发于欧美国家的中老年患者,发病率常年位居第一[13]。随着生活方式等诸多因素的改变,我国的PCa也呈不断上升的趋势[14]。MRI毋庸置疑是早期检查PCa最好的影像学手段之一。mp-MRI在前列腺的早期诊断与治疗中得到了广泛的应用,可以提供有关生化复发的个体化信息,从而为临床提供更全面的治疗方案[15]。
本研究在扫描序列的选择上选用T2WI和FS-T2WI两个基础序列,因二者在PCa中的诊断价值不同。T2WI侧重于观察PCa包膜与周围脂肪组织的对比度,而FS-T2WI的优势在于能更清晰显示PCa原发及转移病灶[16-18]。本研究最终筛选出的20个影像组学特征中,T2WI与FS-T2WI均具有一定占比,且FS-T2WI在预测PCa Ki67表达中更具意义。因此,基于mp-MRI的放射组学特征在预测肿瘤的治疗和预后更准确[19]。在临床基于mp-MRI使用PCa影像报告和数据系统第2版时,由于每位诊断医师之间的主观差异会导致PCa影像报告和数据系统第2版限制mp-MRI的准确性和预后相关性;而计算机辅助诊断能够避免临床医师的主观差异性,为PCa诊断提供了强大的工具[20-22]。因此通过影像组学可以监测PCa特征,确定肿瘤侵袭性,并监测肿瘤复发[23]。当影像组学模型能够在临床环境中使用时具有临床价值。但既往有关影像组学的研究基本上为回顾性研究,缺乏前瞻性研究[24],且单一的影像组学模型难以避免过拟合的问题,有研究将影像组学和深度学习联合模型,在一定程度上可以避免过拟合问题[25-26]。
Ki67的表达在许多肿瘤中已被证明与预后不良有关,并被广泛用作癌症诊断和治疗预后的预测指标[27]。有研究表明,Ki67是局部PCa复发和进展的独立预测因子,且Ki67高表达与较高Gleason评分相关[5]。Ki67升高与PCa不良预后相关,意味着高表达Ki67的PCa患者的死亡风险更高,另外Ki67可以提供源于Gleason评分的独立预后信息[28]。常规Ki67监测常依赖于穿刺活检后病理结果,但是穿刺的并发症常导致一些副作用。mp-MRI的优势是无创性检查,同时影像组学可以从医学影像中挖掘数字信息并反应肿瘤异质性[29]。本研究建立的LightGBM模型AUC值高达到0.948,意味着在临床工作中可以使用mp-MRI替代系统性穿刺活检预测PCa中Ki67的表达,对预测患者的预后有一定的临床价值。
有研究在基于mp-MRI构建影像组学模型时,基于T2WI+DWI+DCE的模型在预测Ki67表达上具有很强的精确度[10]。本研究未采用DCE而选择ADC,是因为DCE扫描需要注射造影剂,因为个体的特异质反应,可能会导致患者不良反应;且采用DWI和ADC作为功能序列的研究也具有极高的精确度[9]。ZOOMit-DWI显示解剖细节和焦点清晰度优于常规DWI序列,因为ZOOMit-DWI可以有效减少图像的几何变形和伪影,更有利于临床诊断和治疗[30]。ZOOMit-DWI能够更好地显示前列腺小病灶,且体素小,能够提供更加精细的纹理体征[31]。故本研究选用T2WI、FS-T2WI、ZOOMit-DWI、ADC四个序列联合。
本研究对前列腺从T2WI、FS-T2WI、ZOOMit-DWI、ADC序列图像中提取影像特征,将其与肿瘤标记物Ki67的相关性进行研究,结果发现其有一定相关性,研究表明mp-MRI作为一种无创性检查,能够衡量前列腺恶性肿瘤的增值能力与代谢水平,可以为临床提供诊断依据、为预后提供相关支持。
本研究为多中心回顾性研究,构建了基于T2WI、FS-T2WI、ZOOMit-DWI、ADC图像的放射组学模型,用于预测肿瘤表达Ki67。本研究的局限性:本研究的部分Ki67的表达结果来源于超声下穿刺活检,可能存在活检盲区,从而无法确定病理结果的十分准确性,后期可以通过更精确的mp-MRI来指导穿刺,进一步提高穿刺活检的精确性;本研究针对影像组学进行预测,缺少临床相关信息,无法全方面的预测Ki67的表达,后期将积极收集患者的临床信息,再联合影像组学对Ki67表达进行更加准确的预测;此外,ROI为医师手动勾画,难免存在结果误差,后续拟采用更高级的自动勾画系统,提高准确率。
综上,基于mp-MRI序列建立影像组学能够预测PCa患者的Ki67水平的表达,LightGBM影像组学模型具有最有的预测效能,能为临床提供有效的术前参考资料,对PCa患者主动检测有一定的价值。
参考文献:
[1]" " Siegel R, Miller K, Wagle NS, et al. Cancer statistics, 2023[J]. CA A Cancer J Clin, 2023, 73: 17-48.
[2]" " Wang GC, Zhao D, Spring DJ, et al. Genetics and biology of prostate cancer[J]. Genes Dev, 2018, 32(17/18): 1105-40.
[3]" " Sekhoacha M, Riet K, Motloung P, et al. Prostate cancer review: genetics, diagnosis, treatment options, and alternative approaches[J]. Molecules, 2022, 27(17): 5730.
[4]" " Wasim S, Lee SY, Kim J. Complexities of prostate cancer[J]. Int J Mol Sci, 2022, 23(22): 14257.
[5]" " Vlajnic T, Brunner P, Eppenberger-Castori S, et al. High inter- and intratumoral variability of Ki67 labeling index in newly diagnosed prostate cancer with high gleason scores[J]. Pathobiology, 2022, 89(2): 74-80.
[6]" "Yang C, Zhang J, Ding M, et al. Ki67 targeted strategies for cancer therapy[J]. Clin Transl Oncol, 2018, 20(5): 570-5.
[7]" "Qiao XF, Gu XL, Liu YF, et al. MRI radiomics-based machine learning models for Ki67 expression and gleason grade group prediction in prostate cancer[J]. Cancers, 2023, 15(18): 4536.
[8]" "Zhou C, Zhang YF, Guo S, et al. Multiparametric MRI radiomics in prostate cancer for predicting Ki-67 expression and Gleason score: a multicenter retrospective study[J]. Discov Oncol, 2023, 14(1): 133.
[9]" "Deng ST, Ding JF, Wang H, et al. Deep learning-based radiomic nomograms for predicting Ki67 expression in prostate cancer[J]. BMC Cancer, 2023, 23(1): 638.
[10]" Fan XH, Xie N, Chen JW, et al. Multiparametric MRI and machine learning based radiomic models for preoperative prediction of multiple biological characteristics in prostate cancer[J]. Front Oncol, 2022, 12: 839621.
[11]" Xia SD, Gowda P, Silva FD, et al. Comparison between ZOOMit DWI and conventional DWI in the assessment of foot and ankle infection: a prospective study[J]. Eur Radiol, 2024, 34(5): 3483-92.
[12]" 覃小燕, 彭" 鹏. 多参数磁共振成像在前列腺癌主动监测中的应用研究进展[J]. 江苏大学学报: 医学版, 2023, 33(5): 386-90, 443.
[13] Sturgeon KM, Kok DE, Kleckner IR, et al. Updated systematic review of the effects of exercise on understudied health outcomes in cancer survivors[J]. Cancer Med, 2023, 12(24): 22278-92.
[14]" Luan XH, Zhou HX, Chen YM, et al. A preclinical study of an 125I-labeled PSMA ligand for prostate‑cancer puncture[J]. Pharmaceuticals, 2022, 15(10): 1252.
[15] Costa DN. Multiparametric MRI of the prostate: beyond cancer detection and staging[J]. Radiology, 2021, 299(3): 624-5.
[16]" 赖树盛, 郑石磊. 基于磁共振T2WI-FS的影像组学对前列腺癌盆腔淋巴结转移的诊断价值[J]. 中国医科大学学报, 2021, 50(3): 230-4.
[17]" Teică RV, u0218erbănescu MS, Florescu LM, et al. Tumor area highlighting using T2WI, ADC map, and DWI sequence fusion on bpMRI images for better prostate cancer diagnosis[J]. Life, 2023, 13(4): 910.
[18] Kang Z, Xu AH, Wang L. Predictive role of T2WI and ADC-derived texture parameters in differentiating Gleason score 3 + 4 and 4 + 3 prostate cancer[J]. J Xray Sci Technol, 2021, 29(2): 307-15.
[19]" Ramtohul T, Djerroudi L, Lissavalid E, et al. Multiparametric MRI and radiomics for the prediction of HER2-zero, -low, and-positive breast cancers[J]. Radiology, 2023, 308(2): e222646.
[20] Shao LZ, Liu ZY, Liu JG, et al. Patient-level grading prediction of prostate cancer from mp-MRI via GMINet[J]. Comput Biol Med, 2022, 150: 106168.
[21] Ghavami N, Hu YP, Gibson E, et al. Automatic segmentation of prostate MRI using convolutional neural networks: investigating the impact of network architecture on the accuracy of volume measurement and MRI-ultrasound registration[J]. Med Image Anal, 2019, 58: 101558.
[22]" Wang ZW, Lin Y, Cheng KT T, et al. Semi-supervised mp-MRI data synthesis with StitchLayer and auxiliary distance maximization[J]. Med Image Anal, 2020, 59: 101565.
[23]" Midiri F, Vernuccio F, Purpura P, et al. Multiparametric MRI and radiomics in prostate cancer: a review of the current literature[J]. Diagnostics, 2021, 11(10): 1829.
[24]" Zhu XH, Shao LZ, Liu ZY, et al. MRI-derived radiomics models for diagnosis, aggressiveness, and prognosis evaluation in prostate cancer[J]. J Zhejiang Univ Sci B, 2023, 24(8): 663-81.
[25]" Ji XF, Zhang JY, Shi W, et al. Bi-parametric magnetic resonance imaging based radiomics for the identification of benign and malignant prostate lesions: cross-vendor validation[J]. Phys Eng Sci Med, 2021, 44(3): 745-54.
[26]" Li CY, Deng M, Zhong XL, et al. Multi-view radiomics and deep learning modeling for prostate cancer detection based on multi-parametric MRI[J]. Front Oncol, 2023, 13: 1198899.
[27]" Li LT, Jiang G, Chen Q, et al. Ki67 is a promising molecular target in the diagnosis of cancer (review)[J]. Mol Med Rep, 2015, 11(3): 1566-72.
[28]" Hammarsten P, Josefsson A, Thysell E, et al. Immunoreactivity for prostate specific antigen and Ki67 differentiates subgroups of prostate cancer related to outcome[J]. Mod Pathol, 2019, 32(9): 1310-9.
[29] Sobecki M, Mrouj K, Camasses A, et al. The cell proliferation antigen Ki‑67 organises heterochromatin[J]. Elife, 2016, 5: e13722.
[30]" Tang SX, Fu C, Chen HL, et al. Comparison of ZOOMit-DWI sequence and conventional DWI sequence in endometrial cancer[J]. J Cent South Univ Med Sci, 2023, 48(1): 76-83.
[31]" 乔晓梦, 包" 婕, 胡尘翰, 等. 基于小视野扩散加权成像的影像组学模型对临床显著性前列腺癌的诊断价值[J]. 磁共振成像, 2023, 14(8): 79-85.
(编辑:熊一凡)
