基于核磁共振代谢组学特征构建脓毒症患者短期死亡风险的预测模型及效能
2024-10-31张红玉唐永军热依汗古丽·沙塔尔龙小艳
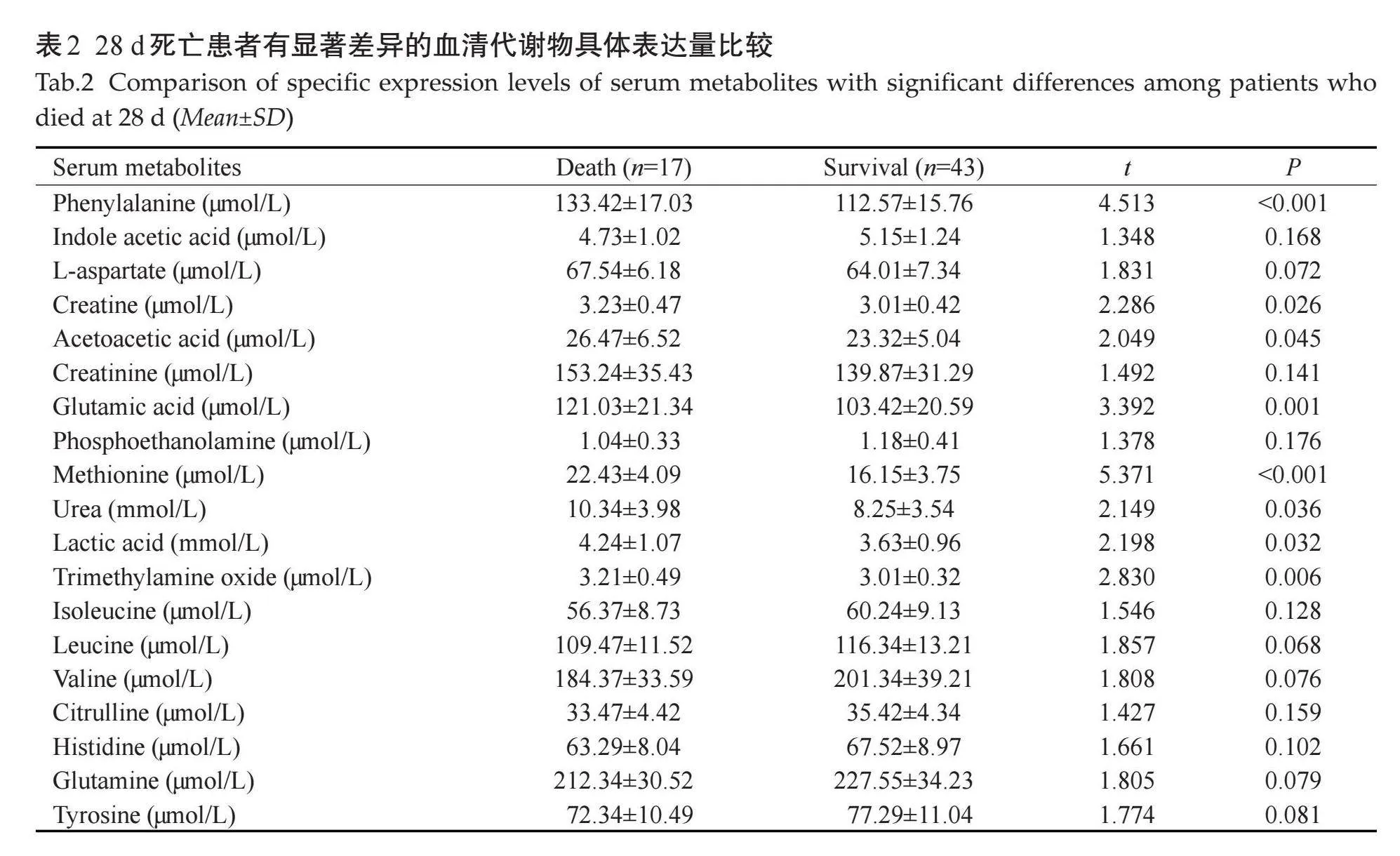
摘要:目的" 探讨基于核磁共振代谢组学特征构建脓毒症患者短期死亡风险的预测模型的效果。方法" 选择2020年1月~2022年12月我院ICU收治的60例脓毒症患者作为训练集。以治疗后28 d时患者存活情况为分组标准,将所有患者分为存活组及死亡组。收集患者一般资料、实验室检查资料,在患者入组时搜集血清样本进行质子核磁共振特异性代谢标志物分析,通过LASSO回归筛选出排名前4的产物构建脓毒症患者短期死亡风险预测模型。最后纳入2023年1~12月于我院ICU治疗的脓毒症患者49例作为测试集对模型的预测效果进行验证。结果" 死亡组患者APACHE II评分高于存活组,差异具有统计学意义(Plt;0.05)。多元统计分析方法显示原始模型的预测能力大于任何1次随机排列Y变量的预测能力,证明模型有效。无监督主成分分析得分散点图共解释了57%的变量(PC1=50%,PC2=7%),脓毒症患者经PCPA造模后血清中内源性代谢物发生了显著变化。OPLS-DA图示模型拟合效果好,不存在特异点,两组的分布区域完全分开。载荷矩阵图显示L-天门冬氨酸、吲哚乙酸、丙氨酸等水平升高,异亮氨酸、亮氨酸等水平下降。提取OPLS-DA模型中VIP值最大的前50个变量进行非参数检验,最后得到34个有统计学意义的变量(Plt;0.05),共有19个与脓毒症死亡最有可能相关的特征代谢物。死亡组患者血清苯丙氨酸、肌酸、乙酰乙酸、谷氨酸、蛋氨酸、尿素、乳酸及氧化三甲胺显著高于存活组(Plt;0.05)。使用LASSO筛选出的4个高相关的代谢产物,并建立的列线图模型脓毒症患者短期死亡风险的C-index分别为0.993(95% CI: 0.931~0.999)。列线图模型预测训练集的脓毒症患者短期死亡风险(AUC=0.993,95% CI: 0.978~1.000,Plt;0.001)具有一定价值;将列线图模型预测测试集的脓毒症患者短期死亡风险(AUC=0.934,95% CI: 0.863~1.000,Plt;0.001)具有一定的使用价值。模型对训练集预测的准确率分别为96.66%,敏感度分别为94.11%,特异度分别为97.60%。模型对验证集预测的准确率分别为90.62%,敏感度分别为88.23%,特异度分别为91.48%。结论" 基于血清核磁共振代谢组学特征构建脓毒症患者短期死亡风险的预测模型对于脓毒症患者28 d死亡风险具有较好的预测价值。
关键词:脓毒症;预后;质子核磁共振;血清代谢组学
Construction of a predictive model of short-term death risk in patients with sepsis based on NMR metabolomics characteristics and its efficacy
ZHANG Hongyu, TANG Yongjun, REYIHANGULI Shataer, LONG Xiaoyan
Department of Intensive Care, The Second Affiliated Hospital of Xinjiang Medical University, Urumqi 830000, China
Abstract: Objective To investigate the effect of building a predictive model of short-term mortality risk in sepsis patients based on NMR metabolomics characteristics. Methods Sixty patients with sepsis admitted to ICU of our hospital from January 2020 to December 2022 were selected as the study objects. All patients were divided into survival group and death group based on the survival status at 28 d after treatment. General data and laboratory examination data of patients were collected. Serum samples were collected for proton nuclear magnetic resonance specific metabolic markers when patients were enrolled. The top 4 products were selected by LASSO regression to construct a short-term death risk prediction model for sepsis patients. Finally, patients with sepsis treated in ICU of our hospital from January 2023 to December 2023 were included to verify the predictive effect of the model. Results APACHE II scores in the death group were higher than those in the survival group, and the difference was statistically significant (Plt;0.05). Multivariate statistical analysis method shows that the prediction ability of the original model is greater than that of any one random arrangement of Y variables, which proves that the model is effective. The scatter plot of unsupervised PCA explained 57% of the variables (PC1=50%, PC2=7%), and the metabolic profile was different between the control group and the model group, with significant changes in serum endogenous metabolites in sepsis patients after PCPA modeling. OPLS-DA graphical model has good fitting effect, there are no special points, and the distribution areas of the two groups are completely separated. As shown in the loading matrix, the levels of L-aspartate, indoleacetic acid and alanine increased, while the levels of isoleucine and leucine decreased. The top 50 variables with the largest VIP value in the OPLS‑DA model were extracted for non-parametric test. Finally, 34 variables with statistical significance were obtained (Plt;0.05), and a total of 19 characteristic metabolites were most likely to be associated with sepsis death. Serum phenylalanine, creatine, acetoacetic acid, glutamic acid, methionine, urea, lactic acid and trimethylamine oxide in death group were significantly higher than those in survival group (Plt;0.05). The C-index of short-term death risk in sepsis patients was 0.993 (95%CI: 0.931-
0.999) in an eriograms of four highly correlated metabolites selected by LASSO. The Nomogram model was of certain value in predicting the short-term mortality risk of sepsis patients (AUC=0.993, 95% CI: 0.978-1.000, Plt;0.001). The short-term mortality risk in model-validated sepsis patients with a Nomogram model (AUC=0.934, 95% CI: 0.863-1.000, Plt;0.001) was useful. The accuracy, sensitivity and specificity of the model to the training set were 96.66%, 94.11% and 97.60%, respectively. The accuracy, sensitivity and specificity of the model to the validation set were 90.62%, 88.23% and 91.48%, respectively. Conclusion The prediction model of short-term death risk in sepsis patients based on serum NMR metabolomic characteristics has a good value in predicting the 28 d death risk of sepsis patients.
Keywords: sepsis; prognosis; proton nuclear magnetic resonance; serum metabolomics
脓毒症常见于严重感染引起的全身炎性反应综合征所诱发的器官代谢障碍,是目前临床上致死率排名靠前的疾病之一[1]。早期积极干预并采用相应的治疗手段可以有效降低脓毒症患者的死亡率,故精准评价脓毒症患者预后有助于及时开展积极有效的治疗措施,也是目前临床研究的热点[2]。目前除外常用的临床检验指标或病情评分运用于评估脓毒症患者病情及预后,但上述指标受限于特异度,导致临床应用效果不理想。基于基因及人体代谢研究技术的进步,对于疾病的精准化评估、诊断及治疗已经成为临床研究中的常用方法,其中代谢组学通过精确评估反应组织及细胞代谢的过程,对脓毒症诱发的器官功能障碍的病理、生理改变过程具有准确的反应[3]。核磁共振光谱学被用于监测代谢组学改变情况,并且针对不同类型的疾病所致的代谢改变具有较好的监测价值[4]。脓毒症患者因炎性反应可以导致人体正常氨基酸代谢紊乱,且可能是导致疾病发展的重要因素,目前尚缺少代谢组学相关指标与患者预后的临床分析[5]。本研究通过核磁共振光谱监测脓毒症患者代谢组学变化情况,并基于上述指标构建脓毒血症患者短期死亡风险的预测模型,旨在为临床评估脓毒症患者预后提供参考。
1" 资料与方法
1.1" 一般资料
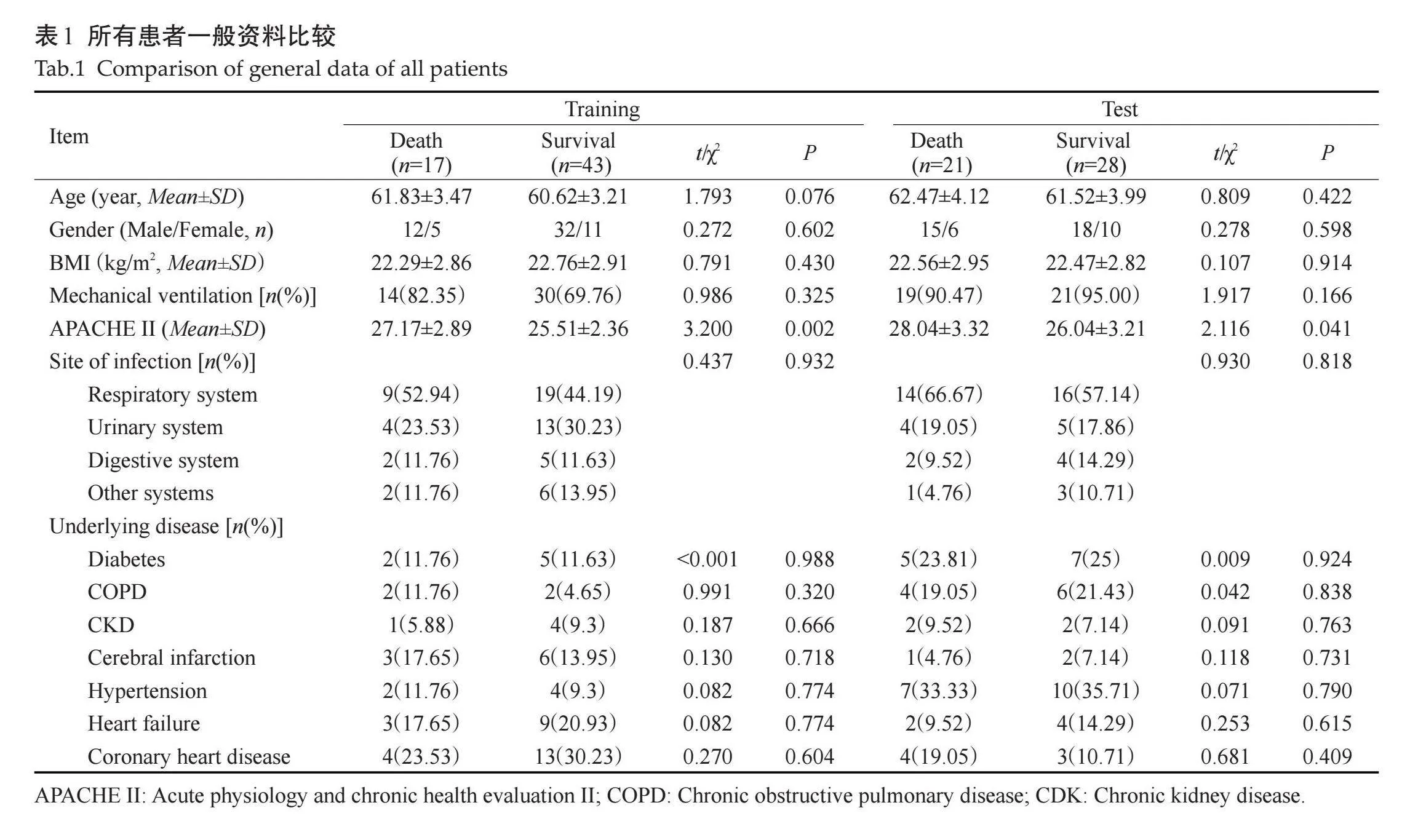
将2020年1月~2022年12月于我院ICU收治的脓毒症患者作为训练集构建预测模型,将2023年1~12月期间于我院ICU收治的脓毒症患者作为测试集验证模型预测效果。纳入标准:符合《中国严重脓毒症/脓毒性休克治疗指南(2014)》[6]对于脓毒症的相关诊断标准;年龄≥18周岁;预计死亡时间≥72 h;临床资料完整。排除标准:合并恶性肿瘤者;合并内分泌、自身免疫系统疾病及血液系统疾病患者;孕妇或哺乳期妇女;中途终止治疗者;严重精神-神经系统疾病不能配合者;临床资料不完整者。共计纳入模型构建对象60例(训练集),模型验证对象49例(验证集)。截止研究结束,模型构建对象的60例患者中28 d死亡17例,最终分组为存活(n=43)及死亡(n=17);模型验证对象49例中28 d死亡21例,最终分组为存活(n=28)和死亡(n=21)。本研究经我院伦理委员会审核批准(审批号:20191107230),患者签署知情同意书。
1.2" 方法
所有患者均以进入ICU病房为观察起点,以治疗28 d为终点,根据患者28 d内存活情况,将患者分为死亡组及存活组,分别比较两组患者一般资料及实验室检查资料。
1.3" 观察指标
1.3.1" 一般资料" "包括年龄、性别、BMI、感染部位、合并基础疾病、急性生理与慢性健康评分(APACHE II)及机械通气比例。
1.3.2" 核磁共振代谢组学检测方法" "所有患者均于入科后抽取空腹肘静脉血5 mL,室温下离心(3000 r/min,10 min)后收集血清置于EP管中,-80 ℃保存。检测时取出血清样本在室温下解冻,取200 μL血清加入400 μL磷酸盐生理盐水缓冲液中,于室温下放置10 min,4 ℃离心(10 000 r/min,10 min),取550 μL上清液移至5 mm核磁管中。将装有血清的核磁管插入测试槽内,放入进样口。应用核磁共振波谱仪(Inova 600型)CPMG脉冲序列[(RD-90°-(τ-180°-τ)n-ACQ)]对质子核磁共振(1H-NMR)谱图进行检测,1H-NMR核磁共振频率为599.95 MHz,采样数据点为32 k,谱宽10 000 Hz,采样延迟2 s,采样时间均为1.64 s,测试温度为25 ℃。当检测到1H-NMR谱后,调整葡萄糖峰及基线保存。所有1H-NMR谱都在同一波谱仪上获得,选取质量较高的1H-NMR谱样品进行二维核磁共振谱测试,包括1H-1H同核相关谱、质子全相关谱和J-分解谱等用于谱图中的各峰的指认。用Topspin软件对各组样本1H-NMR谱进行基线及相位的调整,所有1H-NMR谱均由同一人处理完成。经过核磁共振筛选出代谢产物后,采用氨基酸含量检测试剂盒(高效液相色谱法)对目标氨基酸含量进行检测,试剂盒(上海酶联生物科技有限公司)。
1.4" 统计学分析
所有数据均采用SPSS22.0软件进行统计分析。计量资料以均数±标准差表示,组间比较采用独立样本t检验。计数资料以n(%)表示,组间比较采用χ2检验。采用SIMCA-P+11软件,对所测试的各组数据进行正交偏最小二乘判别分析(OPLS-DA)分析和偏最小二乘方法分析(PLS-DA)。采用主成分分析(PCA)和PLS-DA比较死亡组与对照组间血清代谢物数据。使用Metabo Analyst 5.0软件(https://www.metaboanalyst.ca.)进行代谢物数据分析。通过OPLS-DA 获得代谢物相关系数,并以此确定各组血清差异性代谢成分。应用最小绝对收缩和选择算法(LASSO)回归分析,选择最佳Lambda值,纳入4个预后相关代谢组学特征,构建预后风险评分模型。使用R3.6.1软件根据核磁共振代谢产物构建脓毒症患者短期死亡风险预测模型,通过 ROC 曲线评估预后模型的预测价值。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 一般资料比较
两个分类的死亡组患者APACHE II评分高于存活组,差异有统计学意义(Plt;0.05);两组患者其他项目的差异无统计学意义(Pgt;0.05,表1)。
2.2" 模型构建患者1H-NMR特异性代谢标志物多元统计分析
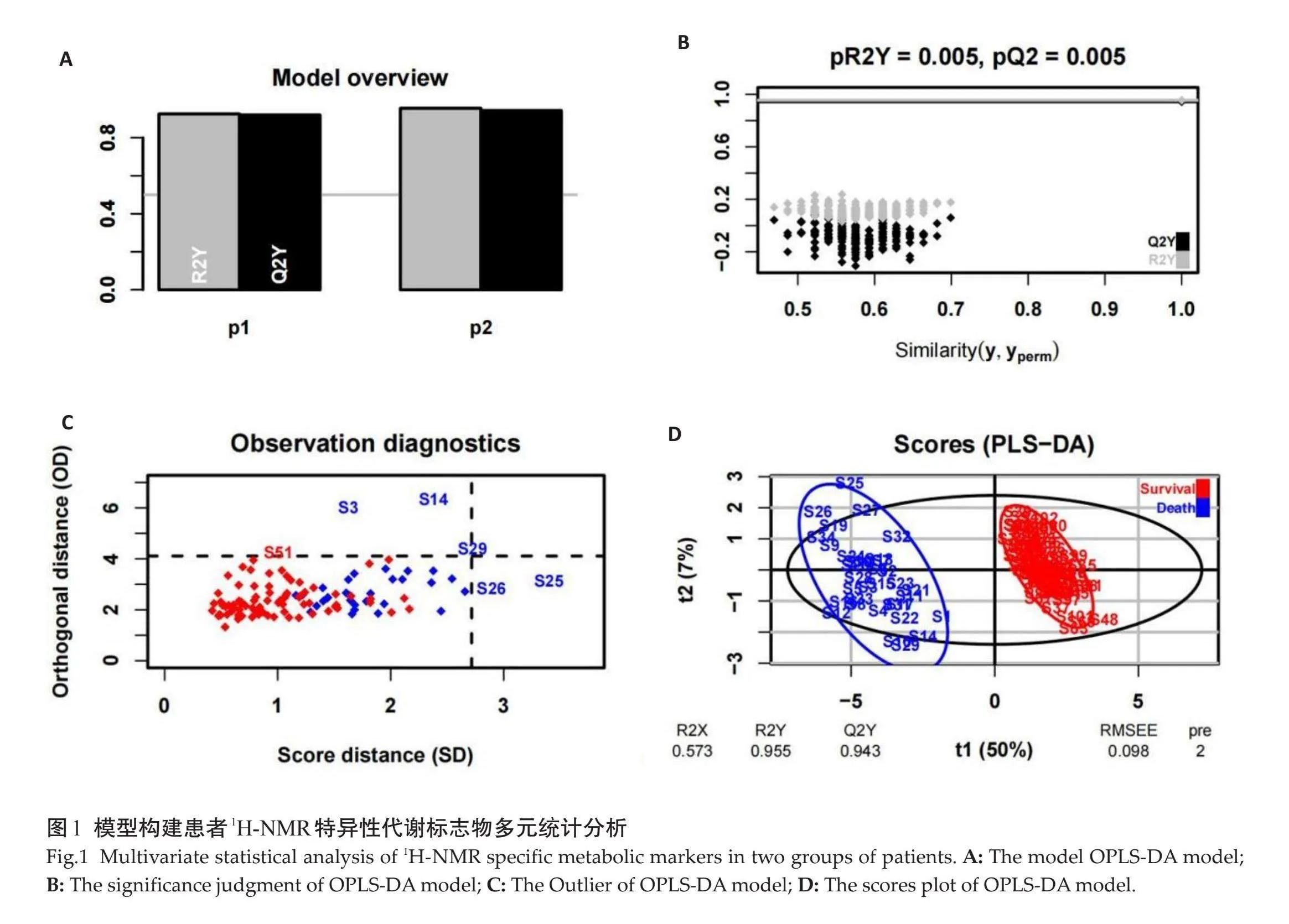
模型验证排列实验(n=120)中下端任何1次随机排列产生的R2、Q2均小于上端(R2Y=0.005,Q2=0.005),即原始模型的预测能力大于任何1次随机排列Y变量的预测能力,证明模型有效。采用无监督的主成分分析,得分散点图共解释了57%的变量(PC1=50%,PC2=7%),脓毒症患者经PCPA造模后血清中内源性代谢物发生了显著变化(图1)。
2.3" 模型构建患者特异性代谢标志物分析
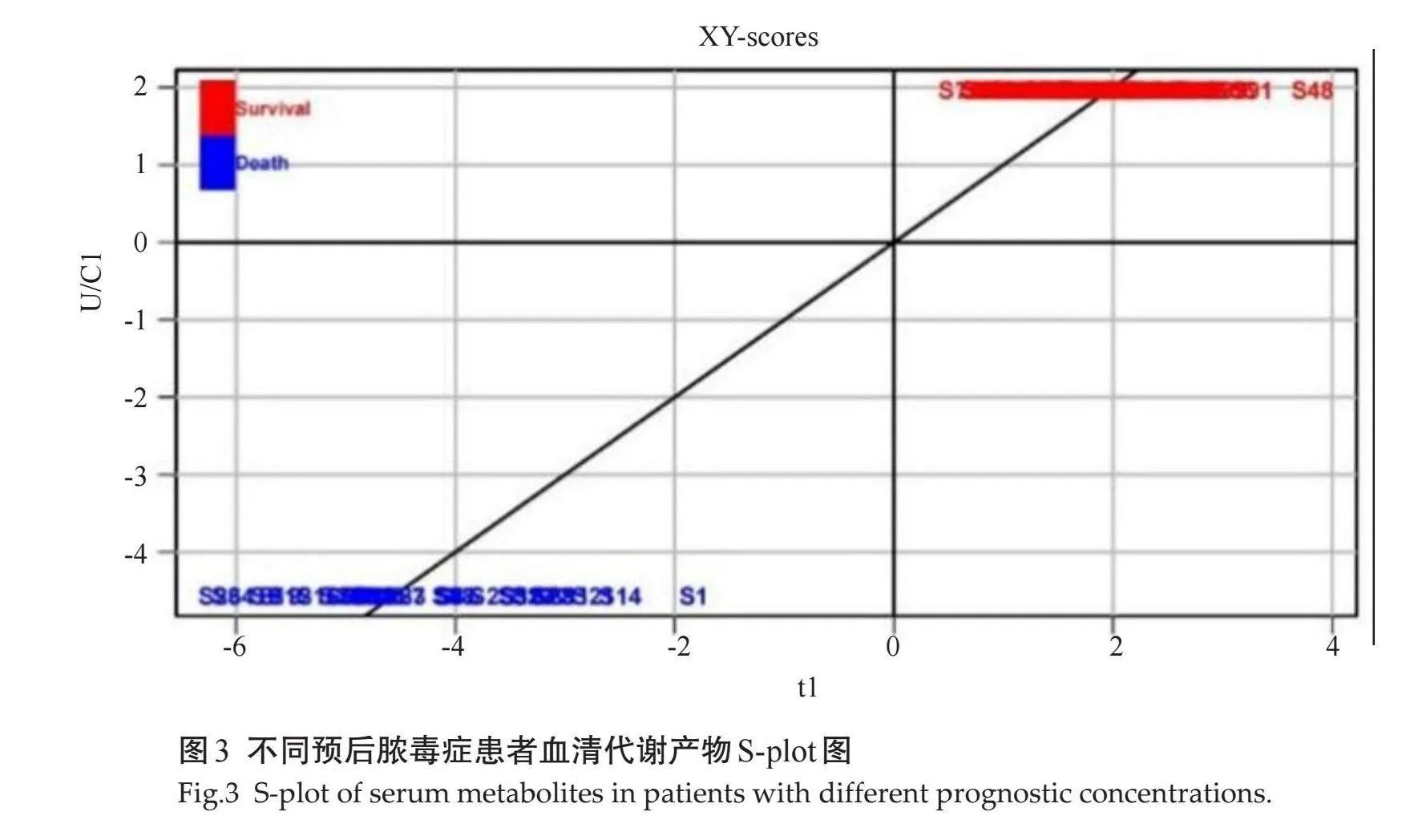
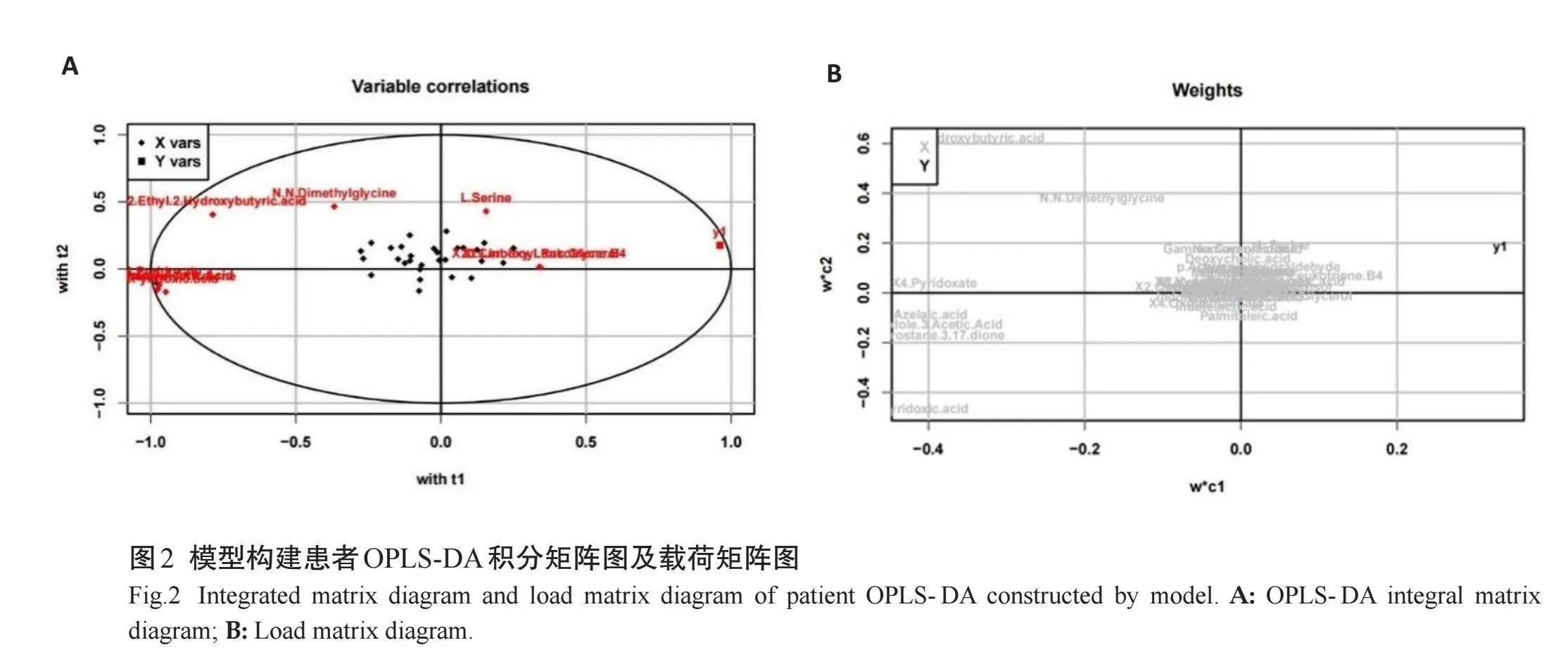
采用OPLS-DA法对两组样本建模 ,以“死亡”为因变量(y),积分值为自变量(X),将y值设定为0/1的矩阵(存活患者设为0,死亡患者设为1),模型参数R2Y=0.005,Q2=0.005。模型拟合效果好,两组的分布区域完全分开。对应的载荷矩阵图显示,L-天门冬氨酸、吲哚乙酸、丙氨酸等水平升高,异亮氨酸、亮氨酸等水平下降(图2)。
2.4" 脓毒症患者生物标志物的寻找
提取OPLS-DA模型中VIP值最大的前50个变量(VIP值gt;1.49)进行非参数检验,得到34个有统计学意义的变量(Plt;0.05)。综合OPLS-DA 载荷矩阵图、VIP值、非参数分析结果,选择相关性排名前19个特征代谢物。比较两组患者代谢产物具体情况,结果显示:模型构建组死亡组患者血清苯丙氨酸、肌酸、乙酰乙酸、谷氨酸、蛋氨酸、尿素、乳酸及氧化三甲胺显著高于存活组(Plt;0.05,表2,图2~3)。
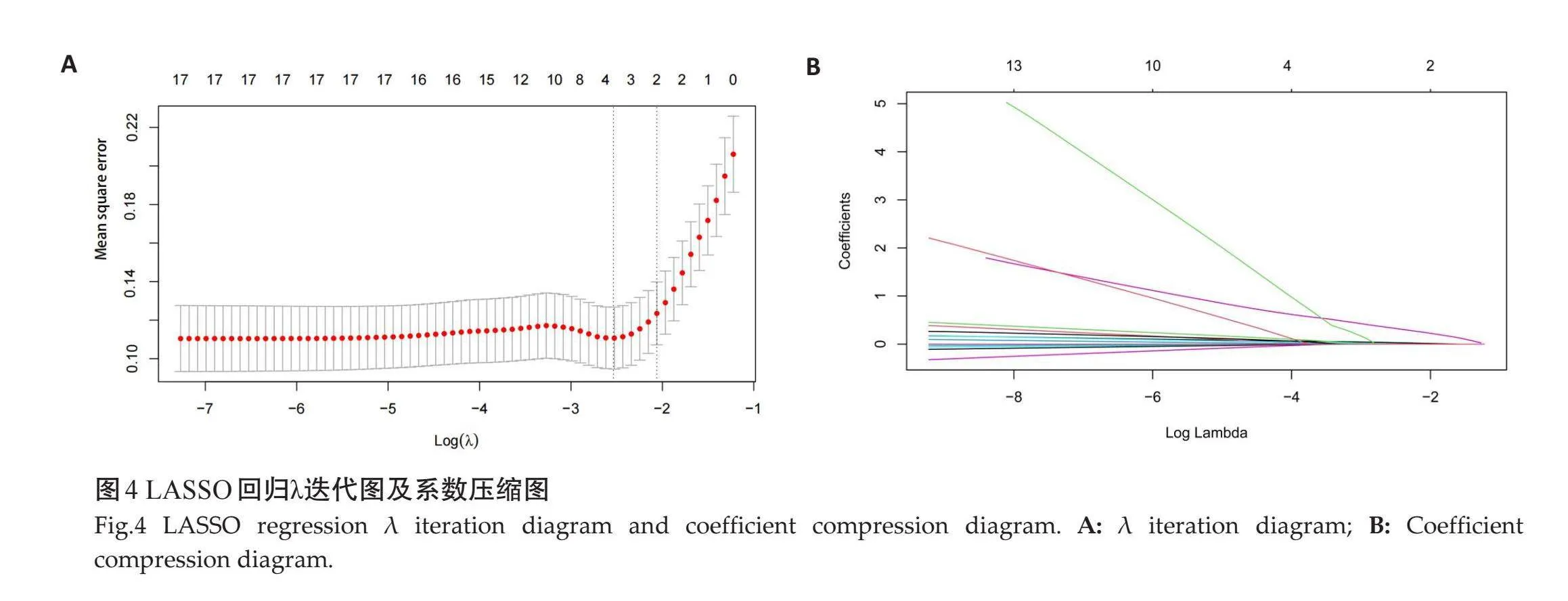
2.5" LASSO回归筛选代谢产物
应用LASSO回归对差异有统计学意义的19个血清代谢产物进行筛选,最终筛选出的4个代谢产物:苯丙氨酸、谷氨酸、蛋氨酸及氧化三甲胺,LASSO回归的回归迭代图和系数压缩图(图4)。
2.6" 基于核磁共振代谢产物构建的脓毒症患者短期死亡风险模型效果分析
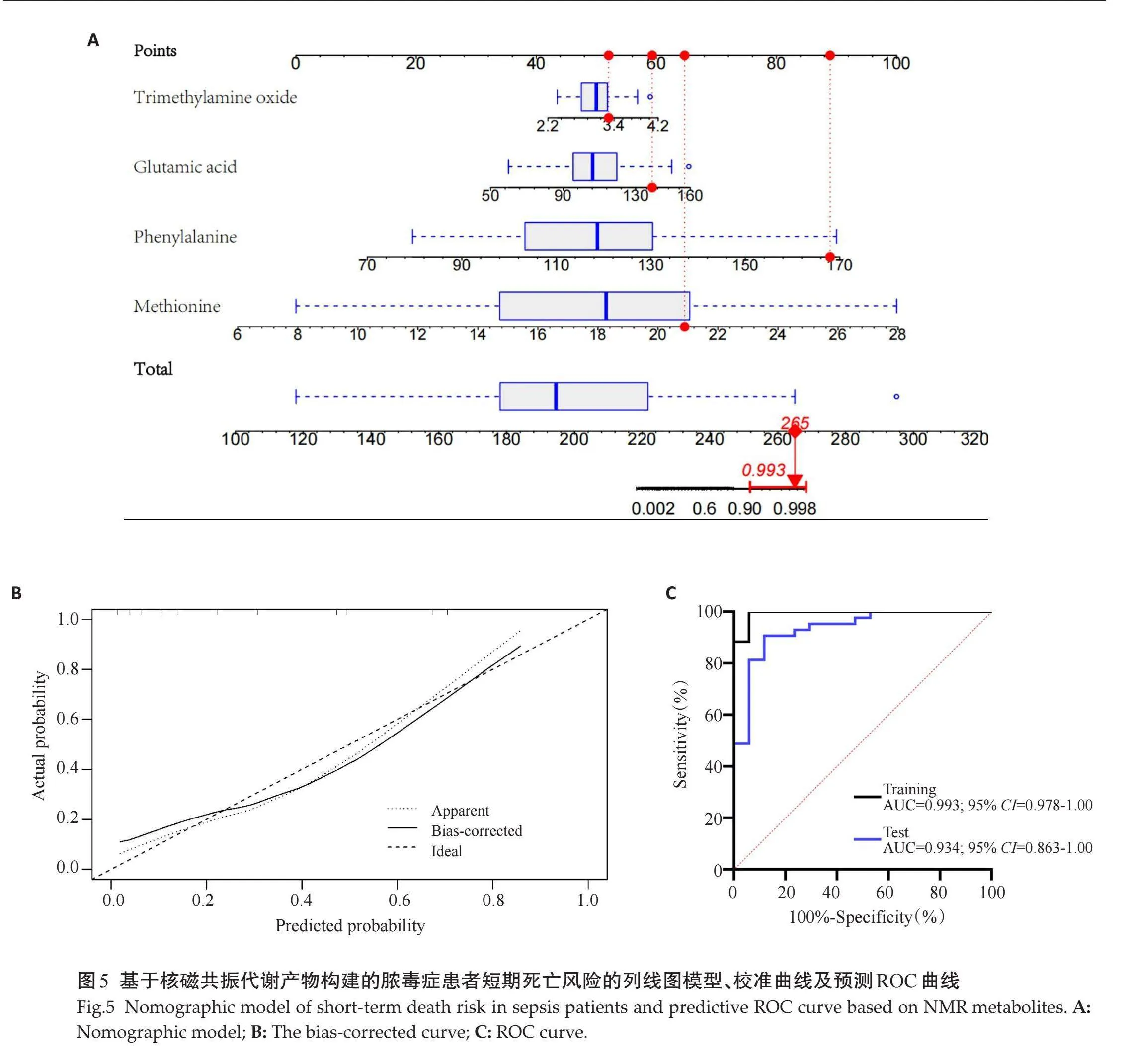
将LASSO筛选出的4个代谢产物建立列线图预测模型预测脓毒症患者短期死亡风险,列线图模型脓毒症患者短期死亡风险的C-index为0.993(95% CI: 0.931~0.999)(图5A)。校准曲线显示在训练集中列线图模型的预测概率与实际概率均具有良好的一致性(图5B)。ROC曲线分析结果显示:列线图模型预测训练集和验证集患者的短期死亡风险均具有的一定价值(AUC=0.993、0.934,95%CI:0.978~1.000、0.863~1.000,Plt;0.001)。模型对训练集预测准确率分别为96.66%,敏感度分别为94.11%,特异度分别为97.60%。模型对验证集预测准确率分别为90.62%,敏感度分别为88.23%,特异度分别为91.48%(图5C)。
3" 讨论
既往研究指出,PCT、乳酸及白蛋白等实验室检查指标以及APACHE II、GSC、MEDS等综合评价指标对于脓毒症患者预后具有一定的预测价值,但仍无法解决脓毒症患者死亡风险居高不下的情况[7-8]。虽然医疗水平有限是导致脓毒症患者死亡的重要原因,但深入了解脓毒症患者预后的危险因素能为降低死亡风险提供有意义的参考意见[9-10]。
代谢组学是对生物样品中各小分子代谢物进行系统鉴定和定量分析,通过检测代谢途径末端的内源性分子化合物,反映身体状态变化情况,从而提供一种识别潜在生物标志物的新型检测方法,为继基因组学、转录组学之后迅速发展的新型检测手段,目前,代谢组学已被广泛应用于研究脓毒症的病理机制和生物标志物[11-12]。1H-NMR因其具有采集时间短、样本保存容易及可高度重复性等原因而备受重视[13]。通过1H-NMR对患者血标本进行检测,共分析出19个差异产物。其中上调的标志物中吲哚乙酸已经被证实与脓毒症死亡风险有一定关系[14],肌酸、肌酐、尿素氮及乳酸与脓毒症之间的关系也得到了相应的证实[15-17]。下调的氨基酸中,除氧化三甲胺外,其余氨基酸均为人体代谢及营养所需的重要组成部分[18-21],而脓毒症患者出现营养不良的风险较高,故上述氨基酸因营养不良导致以上几个氨基酸的含量显著下降。
后续在1H-NMR结果的基础上,本研究通过筛选的19个差异产物进行LASSO回归后共筛选出4个相关系数较高的产物。有研究指出,苯丙氨酸属于芳香族氨基酸,其可以与支链氨基酸竞争,穿透血脑屏障后导致假神经递质的形成,从而抑制神经系统的正常功能[22]。也有研究指出,苯丙氨酸在脓毒症所致的急性肾损伤时也会有浓度升高的情况[23]。以上分析说明苯丙氨酸高浓度状态说明脓毒症可能已经导致神经系统及肾损伤的发生,故其浓度升高说明患者损伤更重,预后相对较差,本研究中患者苯丙氨酸浓度显著升高,与既往研究结果类似。谷氨酸是体内氮代谢的基本氨基酸,其也具有参与神经内信息传递的递质作用[24]。有研究指出,谷氨酸浓度过高会导致神经系统活动过于频繁,从而导致神经系统损伤加剧[25]。也有研究指出,活化的中性粒细胞会发生谷氨酸自分泌的情况,会导致局部氧自由基大量生成,从而导致炎性反应加剧的情况[26]。本研究显示,1H-NMR指出谷氨酸上调与脓毒症28 d死亡相关,通过测量也得出了相同的结果,说明此项指标与脓毒症预后相关性较高。蛋氨酸又称甲硫氨酸,是体内多个代谢的重要基础,其代谢产物有S-腺苷甲硫氨酸以及S-腺苷同型半胱氨酸,其中前者可以作为反甲基化反应的甲基供体,而后者则是同型半胱氨酸的前体,二者均与肾功能具有显著的相关性[27-28]。本研究显示,蛋氨酸表达升高是影响脓毒症28 d死亡的重要因素,这与上述既往研究结果类似。同时蛋氨酸可以通过促进PRMT2的表达从而增加 TLR4/IRF3 信号通路活化进而加剧IFN-β的产生,而IFN-β已经被证实是引起脓毒症休克的关键因素[29-30]。氧化三甲胺是由肠道菌群代谢过程中产生的重要因素,研究显示其含量升高与血栓形成风险呈正相关[31],同时也意味着肠道屏障功能受损[32]。故氧化三甲胺含量升高与脓毒症患者28 d死亡风险正相关,本研究结果与之类似。可以认为脓毒症随着病情的加重,肠道以及凝血功能障碍逐渐加重,导致氧化三甲胺明显升高,后续会因为肠道屏障及凝血功能障碍发更严重的炎症风暴或DIC的发生,导致患者死亡[33]。基于上述4个指标建立的列线图模型对于本次研究中的脓毒症患者28 d死亡风险的预测效果也较好,准确率、敏感度及特异度均超过90%。最后将模型应用于验证患者,虽然准确率、敏感度及特异度均不同程度下降,但仍在90%左右,说明本次构建的模型具有较好的临床应用价值。
本研究通过1H-NMR对患者血标本进行检测,具有差异的产物数量多于高效液相色谱法,同时测试集患者的准确率、敏感度及特异度均有一定下降。出现上述情况的原因可能有以下几点:检测方式的差异;样本量较小导致偏倚;检测标本不够全面。故为进一步解决上述问题,后续会进一步扩大样本量,同时选择更加丰富的标本种类进一步了解脓毒症对于人体代谢的影响,从而建立更加可靠及完善的模型。
综上,基于血清核磁共振代谢组学特征构建脓毒症患者短期死亡风险的预测模型对于脓毒症患者28 d死亡风险具有较好的预测价值,可以作为下一步研究的方向进行探索。
参考文献:
[1]" "Torres LK, Pickkers P, van der Poll T. Sepsis-induced immunosuppression[J]. Annu Rev Physiol, 2022, 84: 157-81.
[2]" "Wang S, Ruan WQ, Yu Z, et al. Validity of presepsin for the diagnosis and prognosis of sepsis in elderly patients admitted to the Intensive Care Unit[J]. Minerva Anestesiol, 2020, 86(11): 1170-9.
[3]" "Wishart DS. Metabolomics for investigating physiological and pathophysiological processes[J]. Physiol Rev, 2019, 99(4): 1819-75.
[4]" "Rinschen MM, Ivanisevic J, Giera M, et al. Identification of bioactive metabolites using activity metabolomics[J]. Nat Rev Mol Cell Biol, 2019, 20(6): 353-67.
[5]" Chen Q, Liang X, Wu TZ, et al. Integrative analysis of metabolomics and proteomics reveals amino acid metabolism disorder in sepsis[J]. J Transl Med, 2022, 20(1): 123.
[6]" "中华医学会重症医学分会. 中国严重脓毒症/脓毒性休克治疗指南(2014)[J]. 中华内科杂志, 2015, 54(6): 557-81.
[7]" "Paudel R, Dogra P, Montgomery-Yates AA, et al. Procalcitonin: a promising tool or just another overhyped test?[J]. Int J Med Sci, 2020, 17(3): 332-7.
[8]" "Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-18.
[9]" "Póvoa P, Coelho L, Dal-Pizzol F, et al. How to use biomarkers of infection or sepsis at the bedside: guide to clinicians[J]. Intensive Care Med, 2023, 49(2): 142-53.
[10] Lee J, Banerjee D. Metabolomics and the microbiome as biomarkers in sepsis[J]. Crit Care Clin, 2020, 36(1): 105-13.
[11] Pinu FR, Beale DJ, Paten AM, et al. Systems biology and multi-omics integration: viewpoints from the metabolomics research community[J]. Metabolites, 2019, 9(4): 76.
[12] She H, Tan L, Wang Y, et al. Integrative single-cell RNA sequencing and metabolomics decipher the imbalanced lipid-metabolism in maladaptive immune responses during sepsis[J]. Front Immunol, 2023, 14: 1181697.
[13] She H, Tan L, Zhou YQ, et al. The landscape of featured metabolism-related genes and imbalanced immune cell subsets in sepsis[J]. Front Genet, 2022, 13: 821275.
[14] Ding XF, Tong R, Song H, et al. Identification of metabolomics-based prognostic prediction models for ICU septic patients[J]. Int Immunopharmacol, 2022, 108: 108841.
[15] Ho TL, Tang CH, Chang SL, et al. HMGB1 promotes in vitro and in vivo skeletal muscle atrophy through an IL-18-dependent mechanism[J]. Cells, 2022, 11(23): 3936.
[16] Balkrishna A, Sinha S, Kumar A, et al. Sepsis-mediated renal dysfunction: Pathophysiology, biomarkers and role of phytoconstituents in its management[J]. Biomedecine Pharmacother, 2023, 165: 115183.
[17] Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Crit Care Med, 2021, 49(11): e1063-143.
[18] Gervasi M, Sisti D, Amatori S, et al. Effects of a commercially available branched-chain amino acid-alanine-carbohydrate-based sports supplement on perceived exertion and performance in high intensity endurance cycling tests[J]. J Int Soc Sports Nutr, 2020, 17(1): 6.
[19] Bonvini A, Coqueiro AY, Tirapegui J, et al. Immunomodulatory role of branched-chain amino acids[J]. Nutr Rev, 2018, 76(11): 840-56.
[20] Reisinger AC, Posch F, Hackl G, et al. Branched-chain amino acids can predict mortality in ICU sepsis patients[J]. Nutrients, 2021, 13(9): 3106.
[21]Cummings NE, Williams EM, Kasza I, et al. Restoration of metabolic health by decreased consumption of branched‑chain amino acids[J]. J Physiol, 2018, 596(4): 623-45.
[22] She H, Du YL, Du YX, et al. Metabolomics and machine learning approaches for diagnostic and prognostic biomarkers screening in sepsis[J]. BMC Anesthesiol, 2023, 23(1): 367.
[23] Ping F, Guo Y, Cao YM, et al. Metabolomics analysis of the renal cortex in rats with acute kidney injury induced by sepsis[J]. Front Mol Biosci, 2019, 6: 152.
[24] Xie ZX, Xu M, Xie J, et al. Inhibition of ferroptosis attenuates glutamate excitotoxicity and nuclear autophagy in a CLP septic mouse model[J]. Shock, 2022, 57(5): 694-702.
[25] Mantuano E, Azmoon P, Brifault C, et al. Tissue-type plasminogen activator regulates macrophage activation and innate immunity[J]. Blood, 2017, 130(11): 1364-74.
[26] Del Arroyo AG, Hadjihambi A, Sanchez J, et al. NMDA receptor modulation of glutamate release in activated neutrophils[J]. EBioMedicine, 2019, 47: 457-69.
[27] Wexler O, Gough MS, Morgan MAM, et al. Methionine metabolites in patients with sepsis[J]. J Intensive Care Med, 2018, 33(1): 37-47.
[28] Kuley R, Duvvuri B, Wallin JJ, et al. Mitochondrial N-formyl methionine peptides contribute to exaggerated neutrophil activation in patients with COVID‑19[J]. Virulence, 2023, 14(1): 2218077.
[29] Wang JP, Hua HM, Wang FL, et al. Arginine methylation by PRMT2 promotes IFN-β production through TLR4/IRF3 signaling pathway[J]. Mol Immunol, 2021, 139: 202-10.
[30] Manry J, Bastard P, Gervais A, et al. The risk of COVID-19 death is much greater and age dependent with type I IFN autoantibodies[J]. Proc Natl Acad Sci U S A, 2022, 119(21): e2200413119.
[31] Qi JQ, You T, Li J, et al. Circulating trimethylamine N-oxide and the risk of cardiovascular diseases: a systematic review and meta-analysis of 11 prospective cohort studies[J]. J Cell Mol Med, 2018, 22(1): 185-94.
[32] Zhang YX, Wang Y, Ke BB, et al. TMAO: how gut microbiota contributes to heart failure[J]. Transl Res, 2021, 228: 109-25.
[33] Lichota A, Gwozdzinski K, Szewczyk EM. Microbial modulation of coagulation disorders in venous thromboembolism[J]. J Inflamm Res, 2020, 13: 387-400.
(编辑:林" 萍)
