超声引导复合式冷热消融系统治疗Hepa1-6瘤鼠的疗效及免疫效应
2024-10-31陈少华吕国荣许紫薇李伯义


摘要:目的" 探讨超声引导复合式冷热消融系统治疗Hepa1-6瘤鼠的疗效及免疫效应。方法" 选取健康C57BL/6J小鼠建立肝癌Hepa1-6小鼠移植瘤模型。将40只Hepa1-6荷瘤小鼠随机分为4组:空白对照组、假手术组、外科手术组及复合式冷热消融治疗组,10只/组。分别于治疗前及治疗后1、2、3、4周,采用超声评估各治疗组荷瘤小鼠皮下肿瘤体积变化,采用血流式细胞术检测检查各组小鼠外周血CD4+、CD8+T淋巴细胞数百分比。于治疗2周后随机处死各治疗组小鼠各3只,并对治疗后病灶行HE染色病理检查及免疫组化检测组织CD4+、CD8+细胞光密度值。结果" 空白对照组及假手术组各时间点的肿瘤组织逐渐增大,但两者差异无统计学意义(Pgt;0.05);与空白对照组及假手术组相比,复合式冷热消融组肿瘤体积在治疗后各时间点肿瘤逐渐缩小,差异有统计学意义(Plt;0.05)。复合式冷热消融治疗组术后与术前比较,术后各时间点血清CD4+T、CD8+T细胞水平均升高,明显高于空白对照组、假手术组、外科手术组(Plt;0.05)。冷冻治疗组血清CD4+T、CD8+T细胞水平在治疗后3周出现峰值,随后出现下降。与对照组及假手术组相比,冷冻治疗组在治疗后2周肿瘤组织CD4+、CD8+细胞明显增多,差异有统计学意义(Plt;0.05)。结论" 超声引导复合式冷热消融系统治疗Hepa1-6瘤鼠具有很好的治疗疗效,同时还能够激活免疫系统,增强机体的抗肿瘤免疫效应。
关键词:超声引导;复合式冷热消融系统;Hepa1-6瘤鼠;疗效;免疫效应
Experimental study on the therapeutic effect and immune response of Ultrasound-Guided Co-Ablation System in the treatment of Hepa1-6 tumor-bearing mice
CHEN Shaohua, LÜ Guorong, XU Ziwei, LI Boyi
Department of Ultrasound Medicine, The Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China
Abstract: Objective To evaluate the therapeutic efficacy and immunological impact of an ultrasound-guided combined cryoablation and thermal ablation system (Co-Ablation System) in the management of Hepa1-6 tumor-bearing mice. Methods A hepatoma mouse model was established using healthy C57BL/6J mice inoculated with Hepa1-6 tumor cells. Forty tumor-bearing mice were randomly assigned to four groups: a blank control group, a sham operation group, a surgical operation group, and a Co-Ablation System group, with ten mice per group. Utilizing ultrasound, tumor volume alterations were assessed pre-treatment and at 1, 2, 3, and 4 weeks post-treatment. Flow cytometry was employed to quantify the percentages of CD4+ and CD8+ T lymphocytes in peripheral blood samples. Additionally, three mice from each group were euthanized two weeks post-treatment for histological analysis via HE staining and immunohistochemistry to determine the optical density of CD4+ and CD8+ cells. Results The tumor tissues in both the blank control group and the sham operation group exhibited gradual growth at each time point, with no statistically significant difference observed between the two groups (Pgt;0.05). In contrast, the tumor volume in the Co-Ablation System group progressively decreased post-treatment, showcasing a statistically significant difference compared to the blank control and sham operation groups (Plt;0.05). Notably, the serum levels of CD4+T and CD8+T cells in the Co-Ablation System group were markedly elevated compared to the blank control, sham operation, and surgical operation groups at all post-operative time points (Plt;0.05). These levels peaked three weeks after treatment in the Co-Ablation System group, subsequently declining. Additionally, a significant increase in CD4 and CD8 positive cells within tumor tissue was observed in the Co-Ablation System group two weeks post-treatment, as compared to the blank control and sham operation groups, with the difference being statistically significant (Plt;0.05).Conclusion The utilization of the Ultrasound-guided Co-Ablation System has proven to be highly effective in treating Hepa1-6 tumor mice, not only reducing tumor burden but also activating the immune system and potentiating the body's anti-tumor immune response.
Keywords: ultrasound guidance; Co-Ablation System; Hepa1-6 tumor-bearing mice; therapeutic effect; immune response
原发性肝癌是全球肿瘤相关死亡第2位的恶性肿瘤[1-2] 。手术治疗或肝移植曾是唯一可以治愈的手段,然而肝癌的手术切除率仅20%~30%[3-4] 。除了手术和肝移植之外,消融技术是最有希望达到肝脏恶性肿瘤根治目的治疗方法[5] 。冷冻消融是一种目前临床上常用的消融治疗方式,被广泛应用于多种实体肿瘤的治疗[6-9] 。复合式冷热消融系统作为我国自主研发的一种先进肿瘤微创医疗设备,采用以深低温冷冻与高强度加热相结合的复合式模式治疗肿瘤[10] 。虽然复合式冷热消融系统近几年已广泛应用于肺癌、肝癌等实体肿瘤的治疗,并且临床疗效和安全性也得到了验证[10-12] ,但是目前关于复合式冷热消融系统的疗效及免疫效应的基础研究仍未见报道。本研究通过探讨超声引导复合式冷热消融系统治疗肝癌动物模型的疗效及免疫效应,旨在为复合式冷热消融系统的临床应用提供参考。
1" 材料与方法
1.1" Hepa1-6瘤鼠动物模型的建立[13]
选取健康SPF级近交C57BL/6纯系小鼠,雄性,体质量20~30 g。小鼠适应性饲养3 d后用于种瘤。取对数生长期的Hepa1-6细胞,消化后用PBS稀释成1×107 mL/L的细胞悬液,接种于小鼠右大腿皮下,每只接种体积为0.2 mL。当超声检查接种小鼠皮下结节最大直径达10~20 mm时即造模完成。本研究动物实验经福建医科大学附属第二医院伦理委员会批准,审批号:[2020]福医附二伦理审字(506)号。
1.2" "研究方法
1.2.1" 仪器与设备" "冷冻消融设备采用复合式冷热消融系统(北京海杰亚医疗器械有限公司),以液氮为冷媒,最低冷冻温度可达-196 ℃,应用无水乙醇为热媒,可在冷冻结束后加热消融针至80 ℃。本次实验使用全部冷冻刀头直径均为2.0 mm。影像学引导设备采用GE E9彩色多普勒诊断仪,探头为线阵探头,频率5~10 MHz。
1.2.2" 治疗方法与步骤" "选取40只种植Hepa1-6肝癌细胞的荷瘤小鼠随机分为空白对照组、假手术组、手术切除组和复合式冷热消融治疗组,10只/组。肿瘤生长过程中,定时观察小鼠皮下肝癌肿瘤的成瘤及生长情况,使用彩超检查测量并记录肿瘤的长径值(a)、宽径值(b)及高径值(c),根据各个径向测量值计算肿瘤体积即V=a×b×c/2。
空白对照组:荷瘤小鼠未做任何特殊处理。
假手术组:荷瘤小鼠腹腔注射2%的戊巴比妥钠1 mg/kg麻醉后,固定备皮后,于肿瘤处行常规消毒、铺巾,沿肿瘤长轴切开皮肤,分离肿瘤,直视下将直径2.0 mm的复合式冷热消融系统冷冻探针刺入肿瘤组织内中央。未启动复合式冷热消融系统设备,常规消毒,缝合皮肤,注意保暖,术后正常饲喂。
外科手术组:于荷瘤小鼠腹腔注射2%的戊巴比妥钠1 mg/kg麻醉后。仰卧固定于操作台上。背部处沿肿瘤长轴切开皮肤,分离和完整切除肿瘤,彻底止血,缝合皮肤切口,术后正常饲喂。
复合式冷热消融治疗组:于荷瘤小鼠腹腔注射2%的戊巴比妥钠1 mg/kg麻醉后,仰卧固定于操作台上。背部皮肤处常规消毒、铺巾,在瘤旁切一小口,使用复合式冷热消融系统配备2 mm探针在超声引导下经皮沿肿瘤长轴植入(图1),针尖抵达肿瘤对侧边缘,首先导入冷媒氮气,探针治疗区在50 s内迅速使局部温度降至-196 ℃以下,持续5 min,关闭氮气并导入热媒无水乙醇,使探针的温度迅速恢复至80 ℃,一个冷热循环治疗过程结束。两个循环后拔出探针,常规消毒,缝合皮肤,注意保暖,术后正常饲喂。
1.3" 观察指标
1.3.1" 疗效" "消融后1、2、3、4周应用超声评估进行评估,分别测量肿瘤的长径值(a)、宽径值(b)及高径值(c),按V=a×b×c/2计算肿瘤体积并记录。
1.3.2" 免疫功能" "分别于消融前1 d及消融后1、2、3、4周抽取各组小鼠外周静脉血置于抗凝管,以流式细胞仪(Beckman Couter)检测CD4+、CD8+T淋巴细胞百分比。
1.3.3" 病理检查及组织免疫组化检查" "治疗后2周后随机选取各治疗组小鼠各3只,采用经皮往小鼠心脏注入1~2 mL空气方法处死实验动物,沿瘤体边缘切开皮肤,手术治疗组未见肿瘤组织,其余各治疗组均完整挖出治疗后肿瘤,标本石蜡包埋行6 μm连续切片,常规HE染色观察肿瘤坏死情况,同时行组织免疫组化检测组织CD4+、CD8+细胞光密度。
1.4" 统计学分析
应用SPSS21.0软件进行统计学分析。所有计量资料均以均数±标准差表示,组间比较采用单因素方差分析,多重比较采用LSD方法;方差不齐时采用Welch检验校正。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 术后病理
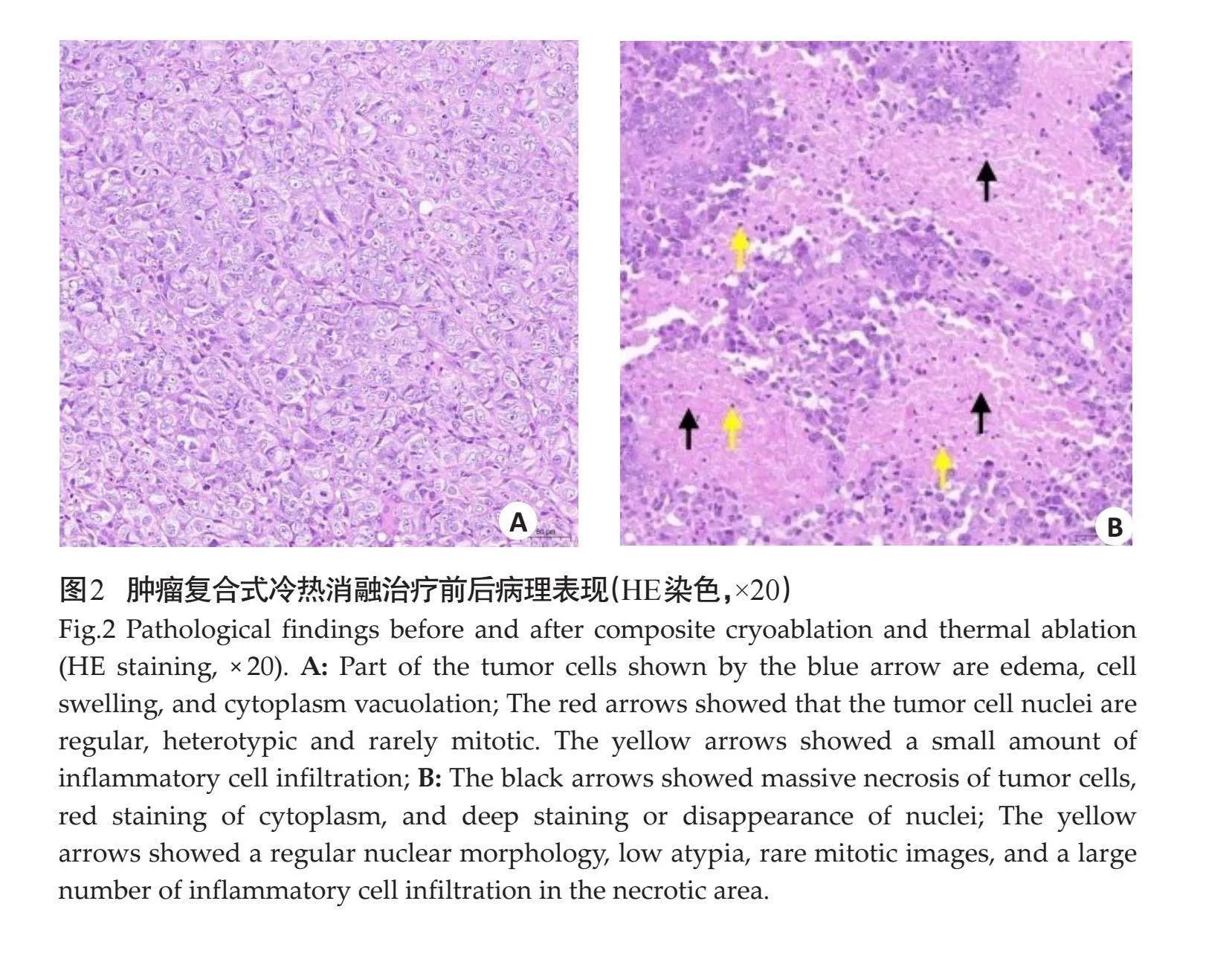
治疗前:视野内部分肿瘤细胞水肿,细胞肿胀,胞质呈空泡化;细胞核形态较规则,异型性较低,核分裂象少见;组织可见少量炎症细胞浸润(图2A)。
复合式冷热消融治疗后:视野内大面积肿瘤细胞坏死,胞浆红染,胞核固缩深染或者消失;细胞核形态较规则,异型性较低,核分裂象罕见,坏死区可见大量炎症细胞浸润(图2B)。
2.2" 疗效评估
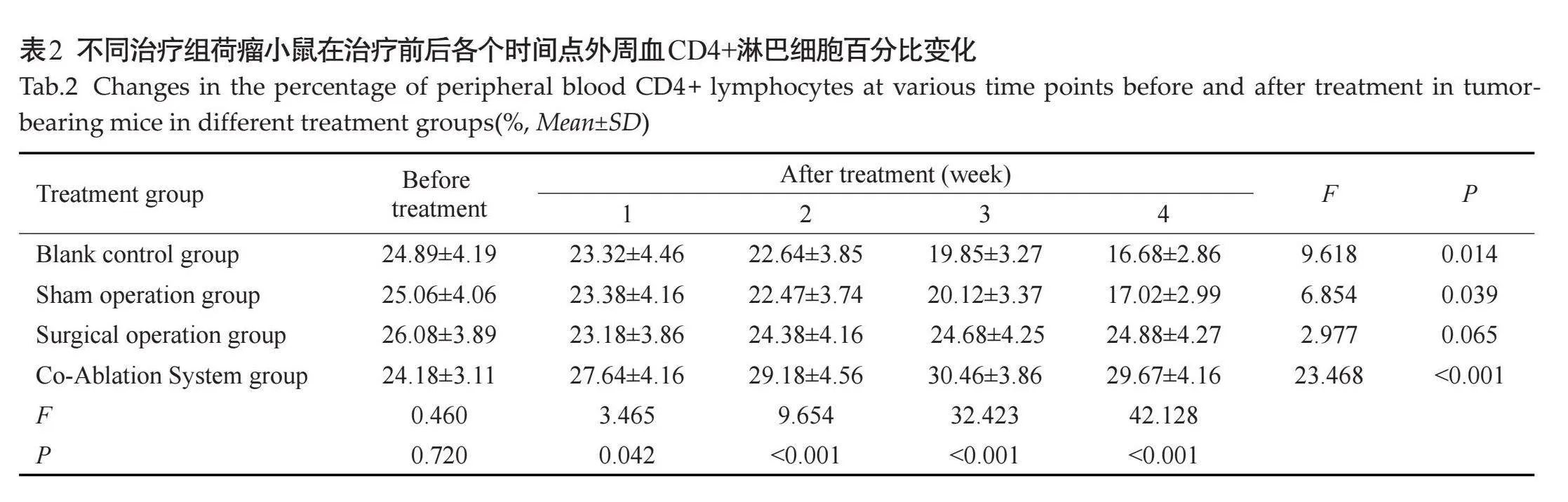
空白对照组、假手术组、外科手术组及复合式冷热消融治疗组治疗前肿瘤大小差异无统计学意义(Pgt;0.05),空白对照组及假手术组的肿瘤组织逐渐增大,术后第4周空白对照组肿瘤体积达到2.747±0.176 cm3,假手术组达到2.847±0.213 cm3,两组各时间点肿瘤大小差异无统计学意义(Pgt;0.05);外科手术组在切除后2周内未发现新生肿瘤,在治疗后3周出现新生肿瘤,第4周明显增大。复合式冷热消融组肿瘤体积在冷冻治疗后肿瘤逐渐缩小,术后第4周缩小至0.0427±0.081 cm3,各时间点与空白对照组及假手术组相比,差异有统计学意义(Plt;0.05,表1)。
2.3" 免疫效应
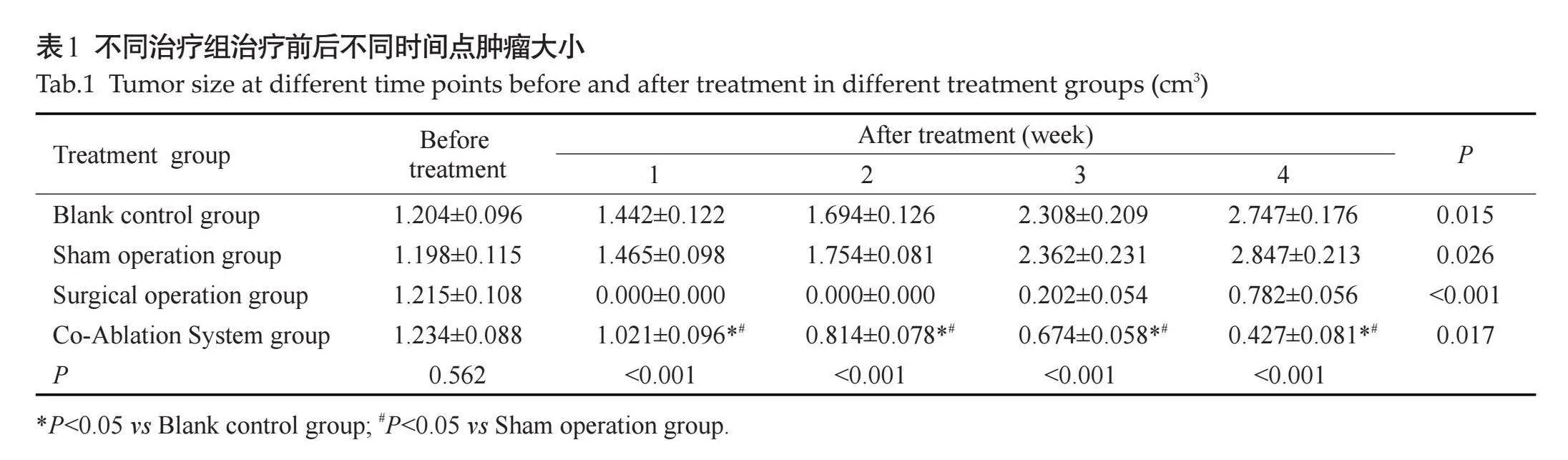
2.3.1" 不同治疗组不同治疗时间点外周血清CD4+T、CD8+T细胞水平变化" "术前空白对照组、假手术组、外科手术组、复合式冷热消融治疗组间比较,血清CD4+T、CD8+T细胞水平差异无统计学意义(Pgt;0.05)。空白对照组及假手术组随着时间推移,血清CD4+T、CD8+T细胞水平呈逐渐下降,各时间点之间的差异有统计学意义(Plt;0.05)。手术切除组术后与术前比较,术后各时间点血清CD4+T、CD8+T细胞水平差异无统计学意义(Pgt;0.05)。复合式冷热消融治疗组术后与术前比较,术后各时间点血清CD4+T、CD8+T细胞水平均明显升高,均高于空白对照组、假手术组、外科手术组。复合式冷热消融治疗组组血清CD4+T、CD8+T细胞水平在治疗后3周出现峰值,随后出现下降(表2~3)。
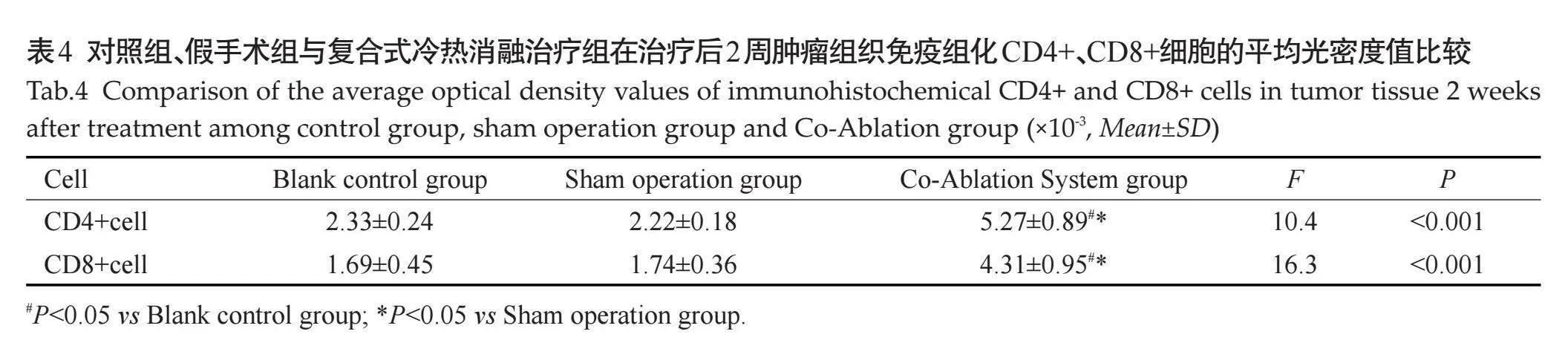
2.3.2" 肿瘤组织免疫组化CD4+、CD8+细胞水平" 与对照组及假手术组相比,复合式冷热消融治疗组在治疗后2周肿瘤组织CD4、CD8阳性细胞增多,差异有统计学意义(Plt;0.05,表4)。
3" 讨论
冷冻消融术是运用广泛的肿瘤微创手段,局部消瘤作用确切、不良反应小、安全性高[14] 。氩氦刀是目前临床上最常用的冷冻消融设备,它以氩气为冷媒,氦气为热媒,冷冻温度140~180 ℃,复温温度约30 ℃[15] 。我国自主研发的复合式冷热消融系统采用液氮为冷媒,易获取,最低冷冻温度可达-196 ℃,单针消融范围更大;应用无水乙醇为热媒,可在冷冻结束后加热消融针至80 ℃,更快速溶解冰球,同时可消融穿刺针道、减少出血、预防肿瘤针道种植转移,安全性更高[11] 。另外,氩氦刀所采用的氩气和氦气价格昂贵,而复合式冷热消融系统采用的氮气及无水乙醇成本低廉,这有助于该技术的推广应用。目前关于复合式冷热消融系统治疗疗效及免疫效应的基础研究仍较为缺乏。本研究通过对复合式冷热消融系统在治疗Hepa1-6肝癌荷瘤小鼠动物模型的疗效及相关免疫效应的研究,对于指导临床诊疗具有重要意义。
相对于传统氩氦刀冷冻系统,复合式冷热消融系统具有更低的消融温度(-196℃),由于冷冻消融致肿瘤细胞死亡的温度为-40℃以下,冷冻温度越低,所产生冰球范围越大,消融范围越大,杀灭肿瘤细胞就更彻底[16] 。另外,与氩氦刀冷冻系统相比,该消融系统具有更高的复温温度(80℃),一方面可提高复温的效率,减少手术时间及低温并发症,同时较高的复温温度可以有效发挥针道止血作用[17] 。尽管有研究表明缓慢解冻比快速冷冻是更重要的细胞死亡机制[18] ,但较高的复温温度可直接热消融灭活肿瘤细胞,从而达到治疗肿瘤的效果。本实验研究中复合式冷热消融治疗组Hepa1-6荷瘤小鼠在治疗后第4周皮下肿瘤体积从1.234±0.088 cm3缩小至0.0427±0.081 cm3,表明复合式冷热消融系统其冷热复合消融机制在治疗Hepa1-6荷瘤小鼠皮下肿瘤具有很好的疗效。
与手术、放疗、热消融相比,冷消融能够最大程度地保留瘤灶抗原活性,从而更有效地激发抗肿瘤免疫反应,这对于晚期癌症的治疗极其重要[14] 。但是,有研究表明不同肿瘤对于冷冻治疗的免疫应答不完全相同,这可能与肿瘤异质性有很大关系[19-20] 。有研究认为[21] ,与射频消融或微波消融相比,肝脏肿瘤冷冻消融的意义有限,因此研究相对较少。而且目前的研究结果对于冷冻消融治疗肝脏肿瘤的免疫效应仍存在争议[22-24] 。本研究结果显示在采用复合式冷热消融后荷瘤小鼠的外周血及组织内CD4+、CD8+T淋巴细胞比例均升高,表明复合式冷热消融后小鼠免疫效能有明显提升,进一步证实高低温多模态消融技术具有很强的机体免疫反应诱导能力。究其原因:首先,高低温多模态治疗后增强T效应细胞(CD4+和 CD8+T)活化[25] ;其次,该方法可增加细胞毒T细胞浸润,诱导免疫细胞进入肿瘤碎片[26] ;再者,其可诱导急性IL-6在启动级联先天性和适应性抗肿瘤免疫应答中起重要作用,导致CD4+T细胞分化[27] 。有研究表明,组织坏死与凋亡面积的比例是决定免疫状态的关键因素[28] ,坏死诱导免疫增强,凋亡导致免疫抑制,坏死、凋亡之间的平衡是调控免疫效应的关键因素,高冷冻速率导致细胞以坏死为主,从而激活免疫反应,而低冷冻速率则导致细胞以凋亡为主,从而出现免疫抑制[14] 。相较于氩氦刀冷冻消融系统,本研究采用的复合式冷热消融系统具有更低的消融温度,更高的冷冻速率,有助于细胞组织坏死的产生,进而增强免疫反应[29-30] 。
本研究结果显示,对照组及假手术组荷瘤小鼠外周血清CD4+、CD8+T细胞比例随着时间推移呈下降趋势,表明肿瘤对于荷瘤小鼠具有免疫抑制作用,这与既往研究[31]一致。另外,复合式冷热消融后荷瘤小鼠外周血清CD4+及CD8+T细胞比例在治疗3周后出现了下降,这说明消融治疗可以启动荷瘤小鼠的免疫反应但并不会使免疫水平一直升高,而具体原因仍有待进一步研究。虽然本研究通过实验证实新型复合式冷热消融系统具有良好的治疗肿瘤疗效及免疫效应,但是仍存在一些不足:本研究缺乏传统氩氦刀治疗组作为对照,无法通过客观对比两者在疗效及免疫效应方面的区别;本研究仅从常规超声监测肿瘤体积变化作为治疗疗效评估,缺乏造影手术评估肿瘤活性及其灭活范围情况;本研究样本量较小、研究时间较短,需要进一步扩大样本量和延长研究时间,以进一步验证研究结果。
综上,本研究表明超声引导复合式冷热消融系统治疗Hepa1-6瘤鼠具有较好的治疗疗效,同时,还能够激活免疫系统,增强机体的抗肿瘤能力。这为复合式冷热消融系统在临床上的应用提供了科学依据,为肝肿瘤患者的治疗提供了新的选择。
参考文献:
[1]" Tang A, Hallouch O, Chernyak V, et al. Epidemiology of hepatocellular carcinoma: target population for surveillance and diagnosis[J]. Abdom Radiol, 2018, 43(1): 13-25.
[2]" " 郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28.
[3]" "Piñero F, Dirchwolf M, Pessôa MG. Biomarkers in hepatocellular carcinoma: diagnosis, prognosis and treatment response assessment[J]. Cells, 2020, 9(6): 1370.
[4]" "Kulik L, El-Serag HB. Epidemiology and management of hepatocellular carcinoma[J]. Gastroenterology, 2019, 156(2): 477-91.e1.
[5]" "McDermott S, Gervais DA. Radiofrequency ablation of liver tumors[J]. Semin Intervent Radiol, 2013, 30(1): 49-55.
[6]" "李虎子, 段振东, 赵" 成, 等. TACE联合冷冻消融治疗不可切除肝癌临床疗效的meta分析[J]. 介入放射学杂志, 2021, 30(8): 804-13.
[7]" " 刘" 川, 雷丽程, 朱" 丽, 等. 影像引导经皮冷冻消融术治疗肿瘤应用进展[J]. 中国介入影像与治疗学, 2018, 15(3): 175-8.
[8]" "Yang WW, Wu Q, Li J. Survival analysis of patients with recurrent or metastatic soft tissue sarcoma who were treated by cryoablation: a real-world retrospective study[J]. J Can Res Ther, 2021, 17(7): 1736.
[9]" "Filippiadis DK, Velonakis G, Kelekis A, et al. The role of percutaneous ablation in the management of colorectal cancer liver metastatic disease[J]. Diagnostics, 2021, 11(2): 308.
[10]" 关海涛, 范则杨, 王" 健, 等. CT引导下经皮复合式冷冻消融治疗肺恶性肿瘤的有效性及安全性[J]. 中国介入影像与治疗学, 2023, 20(1): 36-9.
[11]" 高" 嵩, 朱" 旭, 邹英华, 等. 冷热多模态消融治疗肝脏恶性肿瘤操作规范专家共识[J]. 中国介入影像与治疗学, 2021, 18(1): 23-7.
[12]" 关海涛, 李甜甜, 范则杨, 等. CT引导下经皮冷热交替复合式冷冻消融治疗肝脏恶性肿瘤近期效果及其安全性[J]. 中国介入影像与治疗学, 2023, 20(4): 198-201.
[13]" 周忠信, 吕明德, 殷晓煜, 等. C57BL/6j小鼠接种Hepa1-6细胞诱导皮下肝癌模型的建立[J]. 广东医学, 2007, 28(2): 178-80.
[14]" 段" 桦, 王" 丹, 连岩岩, 等. 冷冻消融免疫效应的研究进展[J]. 中国肿瘤临床, 2020, 47(18): 949-54.
[15]" 智雅婧, 郑" 媞, 那顺孟和. 氩氦刀冷冻消融靶向治疗中晚期恶性肿瘤的应用进展[J]. 当代医学, 2021, 27(15): 191-4.
[16]" 魏颖恬, 肖越勇. 影像学引导肺癌冷冻消融治疗专家共识2018版[J]. 中国介入影像与治疗学, 2018, 15(5): 259-63.
[17]" 史瑶平, 孟志强, 翟" 博. 复合式冷热消融系统治疗原发性肝癌中国专家共识(2023)[J]. 临床肝胆病杂志, 2023, 39(12): 2793-7.
[18] Baust JG, Snyder KK, Santucci KL, et al. Cryoablation: physical and molecular basis with putative immunological consequences[J]. Int J Hyperthermia, 2019, 36(sup1): 10-6.
[19] Zhang YS, Niu LZ, Zhan K, et al. Percutaneous imaging-guided cryoablation for lung cancer[J]. J Thorac Dis, 2016, 8(Suppl 9): S705-9.
[20]" Baust JG, Bischof JC, Jiang-Hughes S, et al. Re-purposing cryoablation: a combinatorial ‘therapy’ for the destruction of tissue[J]. Prostate Cancer Prostatic Dis, 2015, 18(2): 87-95.
[21]" 宋" 光, 王" 健, 姚绍鑫. 非小细胞肺癌患者CT引导下氩氦刀冷冻消融治疗前后外周血细胞因子和免疫功能的变化及意义[J]. 中国实验诊断学, 2016, 20(4): 564-6.
[22]Yakkala C, Denys A, Kandalaft L, et al. Cryoablation and immunotherapy of cancer[J]. Curr Opin Biotechnol, 2020, 65: 60-4.
[23] Osada S, Imai H, Tomita H, et al. Serum cytokine levels in response to hepatic cryoablation[J]. J Surg Oncol, 2007, 95(6): 491-8.
[24]" 李前进, 刘兴贵. 肝癌晚期患者氩氦刀治疗手术前后外周血T、NK细胞表达差异相关研究[J]. 贵州医药, 2015, 39(8): 706-7.
[25] Zhu J, Zhang Y, Zhang AL, et al. Cryo‑thermal therapy elicits potent anti‑tumor immunity by inducing extracellular Hsp70-dependent MDSC differentiation[J]. Sci Rep, 2016, 6: 27136.
[26]" Dong JX, Liu P, Zhang AL, et al. Immunological response induced by alternated cooling and heating of breast tumor[J]. Annu Int Conf IEEE Eng Med Biol Soc, 2007, 2007: 1491-4.
[27]" Liu K, He K, Xue T, et al. The cryo-thermal therapy-induced IL-6-rich acute pro-inflammatory response promoted DCs phenotypic maturation as the prerequisite to CD4+ T cell differentiation[J]. Int J Hyperthermia, 2018, 34(3): 261-72.
[28]" Sabel MS, Su G, Griffith KA, et al. Rate of freeze alters the immunologic response after cryoablation of breast cancer[J]. Ann Surg Oncol, 2010, 17(4): 1187-93.
[29] Sabel MS. Cryo-immunology: a review of the literature and proposed mechanisms for stimulatory versus suppressive immune responses[J]. Cryobiology, 2009, 58(1): 1-11.
[30]" Sidana A. Cancer immunotherapy using tumor cryoablation[J]. Immunotherapy, 2014, 6(1): 85-93.
[31]" 刘建军. 肝癌患者术后疼痛对细胞免疫功能及早期预后的影响[D]." 广州: 南方医科大学, 2017: 1-66.
(编辑:熊一凡)
