基于可视化临床影像模型预测冠状动脉易损斑块的价值
2024-10-30叶辉映张榕刘子蔚胡秋根


摘要:目的" 探讨基于临床影像征象和影像组学联合模型对冠状动脉易损斑块发生的预测价值,并通过Shapley算法对模型进行可视化分析。方法" 回顾性收集2016~2020年南方医科大学顺德医院确诊冠心病并且行2次CCTA检查的患者383例,提取相应区域的影像组学特征。使用多步联合方法筛选出各区域最佳特征后进行联合建模。通过Logistic回归方法筛选重要临床影像征象,最后构建可解释的XGBoost临床影像模型。利用Shapley算法对模型分别进行可视化和特征贡献度解释。结果" 相比单区域影像组学模型,多区域影像组学模型展现出更高的预测性能(AUC=0.701)。结合重要临床影像征象的联合模型性能进一步提高(AUC=0.885)。利用Shapley分析算法对特征重要性进行解析,前6个组学特征对模型结果预测具有贡献度,Shapley热图算法实现了易损斑块发生的预测推演可视化过程。结论" 临床影像组学联合模型对冠状动脉易损斑块的预测具有较高的准确性和泛化性。可解释机器学习算法的可视化保障了模型的实用性,为临床制定针对性治疗方案提供了一种无创工具。
关键词:冠状动脉疾病;易损斑块;影像组学;机器学习;无创评估模型
Value of using visual clinical imaging models to predict vulnerable coronary artery plaques
YE Huiying, ZHANG Rong, LIU Ziwei, HU Qiugen
Department of Radiology, Shunde Hospital, Southern Medical University (The First People's Hostital of Shunde), Foshan 528308, China
Abstract: Objective To explore the predictive value of a combined model based on clinical imaging features and radiomics for the occurrence of vulnerable coronary artery plaques, and visualize the model through Shapley algorithm for further analysis. Methods A retrospective study was conducted on 383 patients diagnosed with coronary heart disease and who underwent two CCTA examinations at Shunde Hospital of Southern Medical University from 2016 to 2020. Radiomics features were extracted from the corresponding regions of interest. A multi-step combined method was used to select the best features from each region for joint modeling. Logistic regression was employed to select important clinical imaging features, and an interpretable XGBoost clinical imaging model was constructed. The Shapley algorithm was utilized to visualize the model and interpret the feature contributions. Results Compared with single-region radiomics models, multi-region radiomics models demonstrated higher predictive performance (AUC=0.701). Combining important clinical imaging features with the joint model improved the performance even further (AUC=0.885). By analyzing the feature importance using the Shapley analysis algorithm, it was found that the first six radiomics features contributed significantly to the model's predictive results. The Shapley heatmap algorithm visualized the prediction process of vulnerable plaque occurrence. Conclusion The clinical radiomics combined model shows high accuracy and generalizability in predicting vulnerable coronary artery plaques. The visualization of interpretable machine learning algorithms ensures the practicality of the model, providing a non-invasive tool for the development of targeted treatment plans in clinical practice.
Keywords: coronary artery disease; vulnerable plaques; radiomics; machine learning; non-invasive evaluation model
急性冠脉综合征(ACS)是一种严重的心血管疾病。易损斑块是冠状动脉内一种具有特定结构和特征的病变,其易发生破裂或溃疡,并引发急性心脏事件的风险较高[1, 2]。易损斑块的破裂或溃疡化可能导致血小板聚集、血栓形成,进而阻塞冠状动脉,这包括炎症反应增加、纤维帽破裂、斑块溃疡形成等,进而促使斑块破裂或溃疡,释放内部炎症介质、凝血因子等物质进入血管腔。以上因素共同作用,增加了急性心脏事件(如心肌缺血、心肌梗塞)的发生风险。研究证明,单纯依据冠状动脉狭窄的程度进行风险评估是不充分的,即使狭窄的程度较轻,具有易损斑块的人群亦有较高的心血管事件风险[3]。及早识别和评估易损斑块,明确相关危险因素,并进行适当的治疗和干预,对预防心血管不良事件的发生具有重要意义。
易损斑块的影像学特征包括低密度斑块、正性重构、点状钙化和餐巾环征。研究报道,针对这4个影像征象的识别,对预防ACS事件的发生具有重要意义[4, 5]。影像组学作为高通量提取影像学特征,能够更深度的挖掘疾病的与影像的关系[6],从而辅佐临床诊断。有研究指出,与2位独立的冠状动脉计算机断层扫描血管造影(CCTA)图像解读者相比,由冠状动脉斑块影像组学特征构建的机器学习模型可以更准确地判断心肌梗死的存在;此外,斑块影像组学在识别以血管内超声作为金标准的易损斑块时,同样展出较高性能。然而,影像组学机器学习的“黑箱子”模式影响医生对其结果的信任,且预测模型的内在决策机制和推演过程尚不清晰,这限制了模型的推广应用。Shapley算法作为一种来自博弈论的局部解释方法,该方法使用基于包含特定特征的所有可能特征子集组合的预测模型,量化每个特征对预测模型的贡献度,从而演示每个案例的决策过程[7-9]。目前,国内通过利用Shapley可视化斑块影像组学机器学习的文章未见报道。本研究通过机器学习算法,挖掘与易损斑块密切相关的影像组学特征,并联合临床特征,基于Shapley算法构建可视化、可解释、无创的易损斑块评估体系,旨在为临床对冠心病患者进行个体化风险管理提供一种无创工具。
1" 资料与方法
1.1" 一般资料
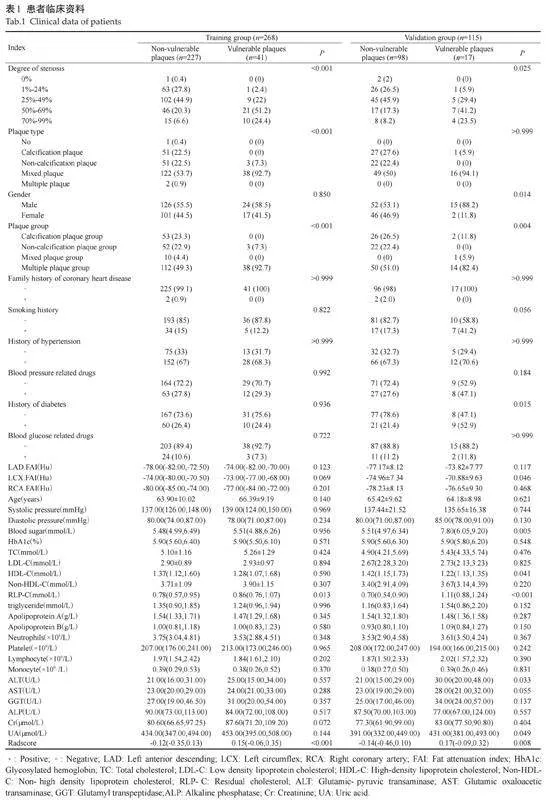
选择南方医科大学顺德医院2016年1月~2020年12月行2次CCTA检查的383例冠心病患者,男性217例,女性166例,年龄64.56±9.73岁。纳入标准:经2次CCTA检查,且患者首次CCTA检查时未发生易损斑块;病变主要分布于三支主要冠脉;临床资料完善、患者CCTA 图像符合诊断要求的患者。排除标准:近期发生急性心肌梗死、心源性休克、严重心力衰竭的患者;伴严重的肝肾功能不全或者血小板功能不全的患者;既往行冠状动脉旁路移植的患者;临床资料不全、CCTA 图像质量不符合诊断要求的患者。本研究获得南方医科大学顺德医院医学伦理委员会批准(审批号:202100134),回顾性研究免除患者知情同意书。
1.2" 图像采集
所有患者均采用西门子SOMATOM Definition Flash双源CT扫描设备进行扫描。所有患者在扫描前2~3 min舌下含服0.5 mg硝酸甘油以扩张冠状动脉,同时对患者进行呼吸训练。患者取仰卧位,采用回顾性或前瞻性心电门控技术扫描,扫描范围从主动脉弓至心尖部,包完整个心脏。扫描参数:管电压120 kV,智能管电流,准直器宽度128×0.6 mm,层厚3 mm,重建层厚0.75 mm,层间距0.5 mm,旋转时间0.53 s/r。利用双筒高压注射器经患者外周静脉团注30~50 mL非离子型对比剂碘普罗胺(含碘370 mg/mL,德国拜耳先灵医药公司),注射流率4.0 mL/s。采用人工智能触发扫描系统确定延迟时间,兴趣区选取在升主动脉,注射对比剂后当CT值达到80 Hu即触发扫描。
1.3" 图像分析及影像组学特征提取
对所有患者均采用第1次CCTA检查的图像进行分析。使用西门子Syngo.viaVB10后处理工作站对所有患者的图像进行重建处理及分析。通过横截面、最大密度投影、多平面重建和曲面重建4种模式对病变段进行分析。
根据指南,易损斑块阳性被定义为至少存在2种高危斑块特征,这些特征包括低密度斑块、正性重构、点状钙化和餐巾环征[10]。
采用多平面重建与曲面重建,结合原始横断面图像分析狭窄程度、冠状动脉周围脂肪衰减系数(FAI)。狭窄程度测量规则:冠状动脉狭窄程度分级标准:无狭窄(0)、轻微狭窄(1%~24%)、轻度狭窄(25%~49%)、中度狭窄(50%~69%)、重度狭窄(70%~99%)、完全闭塞(100%)。FAI定义为取血管近端0~40 mm的冠状动脉周围FAI的平均值。测量方法:冠周脂肪组织定义为离冠状动脉外壁径向距离等于节段直径的一层脂肪组织,其测量长度与冠脉病变长度相一致,左主干部位因长度和脂肪分布变异较大而未进行冠周FAI测量。在冠状动脉多曲面重建图上,勾画出致动脉狭窄的犯罪斑块范围,并在斑块旁勾画冠周脂肪组织。脂肪的CT值设定为-190~-30 Hu,当CT阈值和测量范围参数定义完毕后,后台在图像上自动分割测算。当2位高年资放射科诊断医师测量数据存在差异时,对测量方法和测量位置进行协商。
靶区勾画和特征提取:由1位工作经验10年的放射科诊断医生对这383例患者的CCTA图像进行评估,选择适合勾画的最佳期相的图像导入开源软件3DSlicer中,第一步确定病变整体边界,采用手动勾画的方法从横断位开始勾画,并从三维重建的冠状位、矢状位逐层进行靶区勾画矫正,确保3个方向上的兴趣区(ROI)不超过病灶范围;由另一位工作经验5年的放射诊断医生对目标靶区进行勾画,用于后面影像组学特征的一致性评估,对靶区图像进行标准化和1:1:1的重采样,binwidth值取25。采用3DSlicer的内嵌的PyRadiomics模块对靶区进行影像组学提取,包括直方图(一阶统计特征)、形状特征(三维和形状)、灰度区域大小矩阵、灰度共生矩阵、灰度依赖矩阵等灰度特征、Wavelet滤波特征和高斯滤波转换特征。采用组内相关系数(ICC)评估组学特征一致性,ICCgt;0.75被认为一致性较好。
1.4" 影像组学特征筛选及模型构建
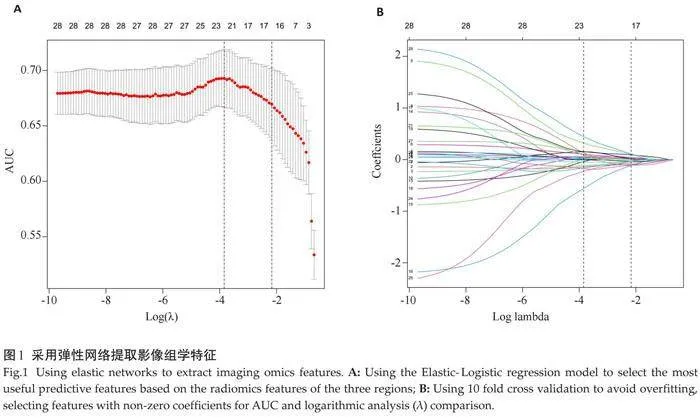
按照7:3的比例随机分为训练组和内部验证组。为了避免模型拟合过度和提高模型的泛化性,我们对提取的影像组学特征进行了由粗到细的特征筛选。单因素分析:采用秩和检验筛选显著特征,以Plt;0.05为显著特征;相关性分析:进行Spearman相关性分析,以降低特征之间冗余度,删除相关性大于0.8的特征;弹性网络回归分析:为防止模型出现过度拟合现象,采用弹性网络-Logistic模型对重要建模特征进行筛选。随后建立弹性网络-Logistic模型对三区域影像组学特征进行联合分析,最终筛选出17个特征。
1.5" 临床影像模型构建
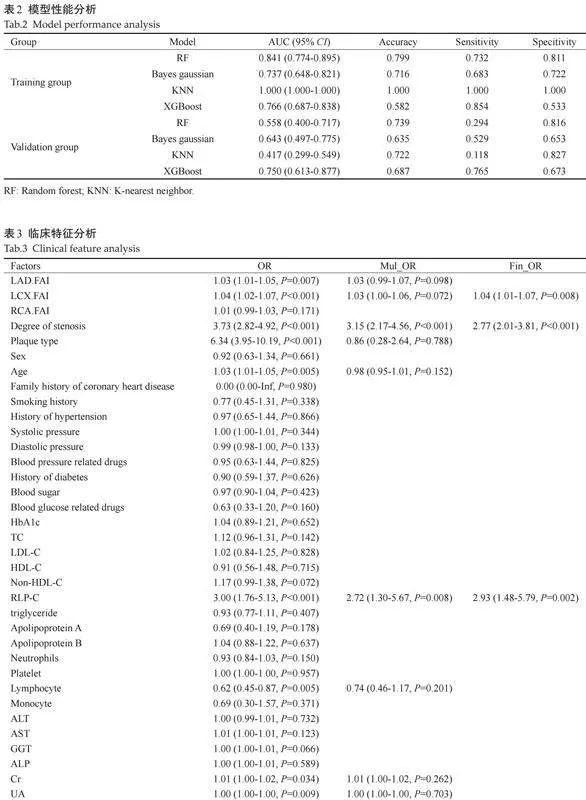
对临床因素和影像征象进行单因素Logistic回归分析筛选Plt;0.05的显著因素,随后进行多因素Logistic分析确定冠状动脉易损斑块的形成相关的重要危险因素并完成临床模型的构建。采用XGBoost、随机森林(RF)、Bayes gaussian、K邻近分类算法(KNN)等机器学习算法构建临床影像联合模型,通过调节算法内树的数量、深度、学习率等参数进行模型训练,分别得到各自算法的最优模型,通过评估模型的ROC曲线下面积(AUC)、准确度、敏感度、特异度,得到最优算法下的最优模型。
1.6" 通过Shapley对预测模型进行可解释性分析
使用SHAP方法对模型进行后处理,以提供预测易损斑块发生背后的推理,并解释每个特征对模型性能的影响。通过 Shapley 值产生了一个从上到下的特征顺序,重要性递减,然后基于验证集计算特征对预测的影响的分布,并使用 SHAP 汇总曲线图进行显示。
1.7" 统计学分析
采用R4.13和Python Anaconda进行统计学分析。采用Shapiro-Wilk检验计量资料是否满足正态分布,若计量资料满足正态分布以均数±标准差表示,组间比较采用独立样本t检验;非正态分布的数据以中位数和四分位数表示,组间比较采用Mann-Whitney U检验;计数资料以n(%)表示,组间比较采用χ²检验或Fisher精确检验。分别进行组间相关系数分析、单因素分析、相关性分析、Elastic-Logistic回归分析、ROC曲线分析。采用AUC来评估临床模型、XGBoost模型及联合模型的效能,采用约登指数计算模型的准确度、敏感度及特异度。在Python Anaconda中使用pycaret、sklearn包完成XGBoost、RF、Bayes gaussian、KNN机器学习模型构建以及Shapley模型可解释性分析。以Plt;0.05为差异有统计学意义。
2" "结果
2.1" 临床资料
383例冠心病患者中,268例被随机分配到训练集,115例被随机分配到验证集,患者临床资料(表1)。
2.2" 影像组学特征选择筛选及模型构建
从CCTA图像上提取279个影像组学特征,其中RCA、LCX、LAD各区域特征数均为93个。经特征筛选分析,各区域分别保留了6、11、11个组学特征。在单区域模型中,LAD区域模型表现出了最好的预测效能,AUC=0.675。联合三区域影像组学特征建立弹性网络-Logistic模型,再次通过10次交叉验证计算出最大AUC所对应的Lambda值(-2. 168)实现特征的筛选(图1),最终筛选出17个影像特征。基于这17个特征构建1种多区域影像组学模型,表现出了更高的模型性能,AUC=0.701。
采用XGBoost、RF、Bayes、KNN等多种机器学习算法对弹性网络得到的影像组学特征进行建模分析,采用网格搜索法+十折交叉验证方法进行模型参数优化,得到另外4种多区域影像组学模型。模型性能分析显示,在训练集和验证集中,XGBoost模型对易损斑块的形成具有更强的预测效能,AUC分别为0.766和0.750(表2)。
单因素加多因素分析显示,LCX冠状动脉周围FAI、病变血管狭窄程度和残余胆固醇水平为易损斑块形成的重要危险因素(表3)。
2.3" 临床影像组学模型的建立及性能评估
对重要的临床影像征象进行XGBoost机器学习建模分析,得到临床影像组学联合模型。通过模型性能分析发现,在训练集和验证集中,相比于影像组学模型,联合模型对易损斑块的形成具有更强的预测效能,AUC分别为0.885和0.804(表4、图2)。
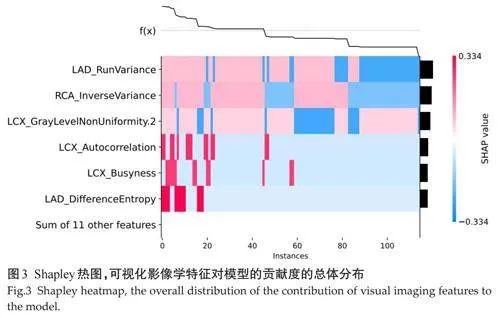
2.4" 针对影像组学模型解释和可视化
XGBoost算法只纳入了6个特征,这6个特征分别是LAD_RunVariance、LAD_DifferenceEntropy、LCX_
Autocorrelation、LCX_Busyness、LCX_GrayLevelNon
Uniformity.2、RCA_InverseVariance,其中LAD_RunVariance对于易损斑块的评估是最为重要的,RCA _InverseVariance次之(图3)。Shapley蜜蜂图描述了LAD_RunVariance、LAD_DifferenceEntropy、LCX_Au
-tocorrelation、LCX_Busyness、LCX_GrayLevelNonUniformity.2、RCA _InverseVariance等6个因素对易损斑块发生预测的贡献情况(图4)。
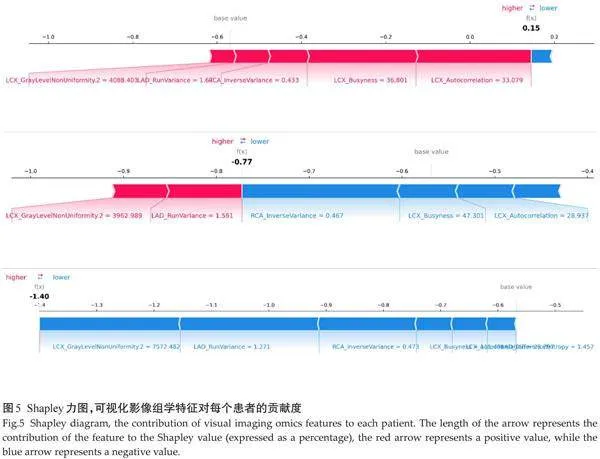
2.5" 影像组学模型模型应用案例分析
3例冠心病患者的Shapley力图显示:患者1:64/M,LCX_GrayLevelNonUniformity. 2为4088.403, LAD_
RunVariance为1.67,RCA _InverseVariance为0.433,LCX_Busyness为36.801,LCX_Autocorrelation为33.079,预测结果为容易发生易损斑块,与实际一致。患者2:63/F,LCX_GrayLevelNonUniformity.2为7572.482,LAD_RunVariance为1.271,RCA _InverseVariance为0.473,LCX_Busyness为111.491,LCX_Autocorrelation为1.457,模型预测为不容易发生易损斑块,与实际一致。患者3:61/M,LCX_GrayLevelNonUniformity.2为3962.989,LAD_RunVariance为1.561,RCA_InverseVariance为0.467,LCX_Busyness为47.301,LCX_Autocorrelation为28.937,预测结果为不容易发生易损斑块,与实际一致(图5)。
3" 讨论
ACS是一组由冠状动脉供血急剧不足引起的心肌缺血,包括不稳定性心绞痛、非ST段抬高型心肌梗死和ST段抬高型心肌梗死等,以上这些情况通常由冠状动脉斑块破裂或溃疡导致血栓形成而引起。有研究认为对于冠心病患者冠脉斑块的检测,其特征和性质在临床诊断和预后评估中至关重要[11]。及时准确地诊断易损斑块,评估斑块的稳定性和易损性,对于预防急性冠脉事件的发生具有重要意义[12]。目前,数字减影血管造影作为诊断冠心病的“金标准”,但仍存在一定局限性,例如无法评估斑块的性质、负荷情况以及区分钙化斑块、混合斑块等[13],同时存在一定的检查和麻醉风险[14]。冠状动脉CT血管造影目前是诊断疑似冠心病的首选[15],其操作简便、时间和空间分辨率高,可有效评估冠心病患者冠脉斑块的稳定性[16]。本研究联合冠状动脉斑块CCTA影像组学特征和传统临床影像征象因素,开发了一种可解释的易损斑块预测模型。Shapley热图算法将模型的推演过程进行了可视化,有助于直观了解模型分析过程;另外,Shapley分析算法被用来实现了各特征对易损斑块发生的预测贡献情况可视化,这为临床提供了一种准确、便捷的易损斑块评估手段。
本研究经过临床多因素分析,鉴别出残余胆固醇水平、LCX冠状动脉周围FAI和病变血管狭窄程度为临床重要危险因素。有研究显示,高残余胆固醇水平与心血管疾病发生风险增加之间存在着明确的关联[17]。较高的残余胆固醇水平意味着存在更多的胆固醇积聚在血管壁中,这增加了心肌梗死和缺血性心脏病发作的概率。残余胆固醇是指非高密度脂蛋白胆固醇的一种类型,它会在体内富集并促进冠状动脉粥样硬化的形成和发展,本研究与既往研究[18]相似,表明当残余胆固醇水平升高时,会导致冠状动脉壁内脂质积聚增加,并进一步促进斑块的形成。这些斑块通常以脂质核心为主,周围是具有高炎症状态的薄纤维帽,容易破裂形成血栓。此外,炎症在ACS的发展过程中也发挥着重要作用。当冠状动脉内的炎症进展时,会引发病变区域的薄纤维帽破裂,导致血栓形成,从而导致严重的心血管事件。研究发现,对比非罪犯病变及稳定CAD患者中最狭窄的病变,ACS患者中罪犯病变的FAI值明显增高[19]。本研究也得出相似结论,LCX-FAI为预测易损斑块的独立危险因素,是一个反映动脉粥样斑块易损性的指标,其值越高则代表着动脉粥样斑块易损性越高。此外,本研究发现病变血管狭窄程度作为评估冠状动脉斑块易损性的独立危险因素,这与既往研究一致[20-22]。
本研究对不同区域的斑块影像组学模型进行了对比分析,发现在单区域模型中,建模训练组AUC分别为AUCLAD=0.675,AUCLCX=0.667,AUCRCA=0.633,表明LAD区域影像组学特征预测效能最佳。而在多区域联合建模过程中,模型纳入了8个LAD、5个LCX及4个RCA特征,将多区域影像组学特征联合构建的多区域组学模型性能得到了改进,AUC=0.701。多区域联合模型比单区域模型更有优势,多模态影像组学建模是非常有优势的。在此基础上,利用多种机器学习算法完成临床影像联合机器学习模型的构建,发现XGBoost模型表现较好,模型性能得到了进一步地提高(AUC=0.885、0.804)。然而,尽管影像组学算法可以分析大量的冠脉成像数据,从中识别和评估易损斑块[23-25],但这些模型的复杂性和不确定性都会导致其结果缺乏可信度和可靠性。
通过Shapley图形对模型进行解释及可视化,展示每个特征对模型的影响,可以更清晰地理解模型决策背后的原因,并找出影响模型准确性的因素。这种技术的应用已经得到了初步的验证[26, 27]。为了直观理解易损斑块预测模型的推演过程,本研究绘制了Shapley热图来实现模型的可视化。相比Nomogram,Shapley热图更为直观地显示出各特征对斑块稳定性的影响程度。本研究显示,LAD_RunVariance、LAD_DifferenceEntropy、LCX_Autocorrelation、LCX_Busyness、LCX_GrayLevelNonUniformity.2、RCA _InverseVariance被算法纳入Shapley热图,其中某个特征对模型有正向贡献,所以该特征与易损斑块高度相关,但是仍然需要进一步的研究。此外,本研究还利用Shapley可解释技术分析了不同特征对不同患者斑块稳定性进展的预测贡献度。
本研究通过Shapley蜜蜂图分析发现,在训练集和内部验证集中,二者趋势高度一致。其中,特征数值越大,颜色越接近红色;反之,越接近蓝色。如LAD_RunVariance的特征数值越大,Shapley值也越大,对预测易损斑块的发生是正向影响。由结果可知LAD_RunVariance、LCX_Autocorrelation对易损斑块的发生有正向影响,LAD_DifferenceEntropy、LCX_Busyness、LCX_GrayLevelNonUniformity.2、RCA_InverseVariance的影响是负向影响。Shapley力图实现了患者特征的个性化解释及可视化,临床医生不仅可以了解每个特征对个体患者的影响程度,还可以更深入地探索特征之间的相互作用[28]。总而言之,这种模型的可解释性和可视化能力对于临床医生来说至关重要。它不仅提供了对预测斑块稳定性的直观理解,还揭示了预测中所使用的关键特征和其对结果的影响程度。通过这种解释性的方法,将增强临床医生对模型的信心,推动影像组学在实际应用中的推广。
本研究存在一定的局限性,一方面,本研究为单中心、回顾性研究,患者病例数较少,病例筛选存在选择偏倚,未对模型进行外部验证,需要进一步扩大样本进行前瞻性研究;另一方面,未对患者随访进一步明确心血管事件的发生,缺乏更多对预后判断的影像学证据。今后应增大样本量在多中心开展研究,进一步验证模型的性能。
综上所述,本研究通过构建临床影像组学模型,采用Shapley热图、Shapley解释和可视化模型,可用于评估冠状动脉斑块易损性,具有较好的预测效能,可解释机器学习算法可以帮助临床医生提高对易损斑块治疗及管理,可作为临床对冠心病患者进行个体化风险管理的一种无创工具。
参考文献:
[1]" "Bhatt DL, Lopes RD, Harrington RA. Diagnosis and treatment of acute coronary syndromes: a review[J]. JAMA, 2022, 327(7): 662-75.
[2]" "Stefanadis C, Antoniou CK, Tsiachris D, et al. Coronary atherosclerotic vulnerable plaque: current perspectives[J]. J Am Heart Assoc, 2017, 6(3): e005543.
[3]" "Narula J, Nakano M, Virmani R, et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques[J]. J Am Coll Cardiol, 2013, 61(10): 1041-51.
[4]" "Ferencik M, Mayrhofer T, Bittner DO, et al. Use of high-risk coronary atherosclerotic plaque detection for risk stratification of patients with stable chest pain: a secondary analysis of the PROMISE randomized clinical trial[J]. JAMA Cardiol, 2018, 3(2): 144-52.
[5]" "Williams MC, Moss AJ, Dweck M, et al. Coronary artery plaque characteristics associated with adverse outcomes in the SCOT-HEART study[J]. J Am Coll Cardiol, 2019, 73(3): 291-301.
[6]" "Lambin P, Rios‑Velazquez E, Leijenaar R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. Eur J Cancer, 2012, 48(4): 441-6.
[7]" "Giraud P, Giraud P, Nicolas E, et al. Interpretable machine learning model for locoregional relapse prediction in oropharyngeal cancers[J]. Cancers, 2020, 13(1): 57.
[8]" "Li R, Shinde A, Liu A, et al. Machine learning-based interpretation and visualization of nonlinear interactions in prostate cancer survival[J]. JCO Clin Cancer Inform, 2020, 4: 637-46.
[9]" "Rodríguez-Pérez R, Bajorath J. Interpretation of compound activity predictions from complex machine learning models using local approximations and shapley values[J]. J Med Chem, 2020, 63(16): 8761-77.
[10]" Cury RC, Abbara S, Achenbach S, et al. CAD-RADSTM Coronary Artery Disease-Reporting and Data System. An expert consensus document of the Society of Cardiovascular Computed Tomography (SCCT), the American College of Radiology (ACR) and the North American Society for Cardiovascular Imaging (NASCI). Endorsed by the American College of Cardiology[J]. J Cardiovasc Comput Tomogr, 2016, 10(4): 269-81.
[11]" 乔红艳, 许棚棚, 卢佳庆, 等. 基于冠状动脉CT血管成像的斑块定量分析及血流储备分数预测斑块进展的研究[J]. 中华放射学杂志, 2020, 54(10): 934-40.
[12]Williams MC, Hunter A, Shah ASV, et al. Use of coronary computed tomographic angiography to guide management of patients with coronary disease[J]. J Am Coll Cardiol, 2016, 67(15): 1759-68.
[13]Elagha A, Khaled W, Gamal S, et al. Coronary computed tomography versus coronary angiography for preoperative coronary assessment before valve surgery[J]. Egypt Heart J, 2021, 73(1): 63.
[14]" 王箬芃, 顾" 慧, 高" 艳, 等. 基于冠状动脉CT血管成像斑块定量分析探究甘油三酯葡萄糖指数与斑块负荷及斑块易损特征的相关性[J]. 中华放射学杂志, 2021, 55(11): 1153-60.
[15] Schmermund A, Eckert J, Schmidt M, et al. Coronary computed tomography angiography: a method coming of age[J]. Clin Res Cardiol, 2018, 107(S2): 40-8.
[16]" 伍丽君, 许志强, 兰" 斌. CT冠脉成像、超声心动图对冠心病患者左心室功能、冠脉斑块稳定性的评估价值[J]. 中国CT和MRI杂志, 2022, 20(9): 81-3.
[17] Prati F, Investigators OBOC, Romagnoli E, et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study[J]. Eur Heart J, 2020, 41(3): 383-91.
[18] 闫海浩, 张飞飞, 党" 懿. 残余胆固醇与急性冠脉综合征患者易损斑块特征的相关性研究[J]. 中国全科医学, 2023, 26(26): 3303-7, 3313.
[19] Goeller M, Achenbach S, Cadet S, et al. Pericoronary adipose tissue computed tomography attenuation and high-risk plaque characteristics in acute coronary syndrome compared with stable coronary artery disease[J]. JAMA Cardiol, 2018, 3(9): 858-63.
[20]" 曹红岩, 蔡晓航, 孙国臣. CCTA及CT-FFR评估冠脉病变特异性缺血的价值观察[J]. 中国CT和MRI杂志, 2023, 21(5): 52-4.
[21] Lee JM, Choi G, Koo BK, et al. Identification of high-risk plaques destined to cause acute coronary syndrome using coronary computed tomographic angiography and computational fluid dynamics[J]. JACC Cardiovasc Imaging, 2019, 12(6): 1032-43.
[22] Serruys PW, Hara H, Garg S, et al. Coronary computed tomographic angiography for complete assessment of coronary artery disease: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2021, 78(7): 713-36.
[23] Chen Q, Pan T, Yin XD, et al. CT texture analysis of vulnerable plaques on optical coherence tomography[J]. Eur J Radiol, 2021, 136: 109551.
[24] Lin A, Kolossváry M, Cadet S, et al. Radiomics-based precision phenotyping identifies unstable coronary plaques from computed tomography angiography[J]. JACC Cardiovasc Imaging, 2022, 15(5): 859-71.
[25] Chen Q, Pan T, Wang YN, et al. A coronary CT angiography radiomics model to identify vulnerable plaque and predict cardiovascular events[J]. Radiology, 2023, 307(2): e221693.
[26] Manikis GC, Ioannidis GS, Siakallis L, et al. Multicenter DSC-MRI-based radiomics predict IDH mutation in gliomas[J]. Cancers, 2021, 13(16): 3965.
[27] Wang YX, Lang JW, Zuo JZ, et al. The radiomic-clinical model using the SHAP method for assessing the treatment response of whole‑brain radiotherapy: a multicentric study[J]. Eur Radiol, 2022, 32(12): 8737-47.
[28] Zhang J, Jin JB, Ai Y, et al. Computer tomography radiomics-based nomogram in the survival prediction for brain metastases from non-small cell lung cancer underwent whole brain radiotherapy[J]." Front Oncol, 2021, 10: 610691.
(编辑:孙昌朋)
基金项目:广东省中医药局科研项目(20241312);佛山市科技计划项目(2220001005383); 南方医科大学顺德医院科研启动计划项目(SPSP2021021)
作者简介:叶辉映,在读硕士研究生,住院医师,E-mail: 1239488878@qq.com
通信作者:胡秋根,硕士生导师,主任医师,E-mail: hu6009@163.com
