粉煤灰酸法生产氧化铝过程中气体氧化剂氧化Fe2+的动力学研究
2024-10-30松丽涛高桂梅王宏宾曹坤钞晓光戴崟






摘要:对粉煤灰酸法生产氧化铝浸出液进行化学成分分析,结果显示:浸出液中铝、铁为主要元素,以氯化铝计的铝质量浓度为263.5 g/L,以FeO计的总铁质量浓度为4.4 g/L,Fe2+质量浓度为2.17 g/L。开展了空气、富氧气体、臭氧气体氧化Fe2+的氧化反应动力学研究,得到了3种气体氧化剂氧化Fe2+的动力学方程,对比了3种气体氧化剂的氧化速率,发现臭氧气体氧化速率是富氧气体的1.7倍,是空气的1.9倍。
关键词:粉煤灰;亚铁离子;气体氧化剂;臭氧;富氧;动力学
中图分类号:TD98文章编号:1001-1277(2024)10-0091-05
文献标志码:Adoi:10.11792/hj20241015
引言
目前,适合工业生产的Fe2+氧化剂主要分为固体氧化剂和液体氧化剂。粉煤灰酸法生产氧化铝过程中的Fe2+氧化剂,通常采用高价态的氯化物固体氧化剂,但此种氧化剂在使用过程中存在诸多安全问题。首先,高价态氯化物受高热易分解并产生有毒气体,危害操作人员健康;其次,高价态氯化物作为危险化学药品,对存储、运输、装卸等要求较高;此外,高价态氯化物易向已有体系中引入杂质离子,为后续处理带来负担[1-5]。因此,需要寻找一种安全、经济的Fe2+氧化剂。
臭氧的标准电势在酸性浸出液中为2.07 V,在碱性浸出液中为1.25 V,其氧化的物理化学过程简单,被广泛应用于水处理和水净化领域,是目前水处理中常用的氧化剂[6-9]。近年来,臭氧氧化技术逐渐应用于湿法冶金中[10],RODRIGUEZ-RODRIGUEZ等[11]研究了臭氧对黄铁矿的酸浸作用,证实了黄铁矿中的Fe2+会被臭氧氧化成Fe3+。
本文主要开展空气、富氧气体、臭氧气体3种气体氧化剂对粉煤灰酸法生产氧化铝浸出液中Fe2+氧化效果研究,以期找到粉煤灰酸法生产氧化铝浸出液中Fe2+的最佳气体氧化剂。
1试验部分
1.1试验仪器
臭氧发生器、氧化反应器、流量计、浓度表、恒温水浴锅、循环蠕动泵、烧杯、锥形瓶、氧气罐等。
1.2试验方法
粉煤灰酸法生产氧化铝浸出液中Fe2+氧化装置如图1所示。取2.5 L粉煤灰酸法生产氧化铝浸出液于氧气反应器中,外部恒温水浴锅循环温度80 ℃,由氧气反应器底部通入气体氧化剂,气体流速为1 L/min,进气量为4 g/h。从通气开始计时,取不同时刻浸出液检测Fe2+含量。Fe2+采用重铬酸钾滴定法测定,粉煤灰酸法生产氧化铝浸出液的化学成分采用电感耦合等离子体发射光谱仪(ICP-OES)测定。
2结果与讨论
2.1粉煤灰酸法生产氧化铝浸出液化学成分分析
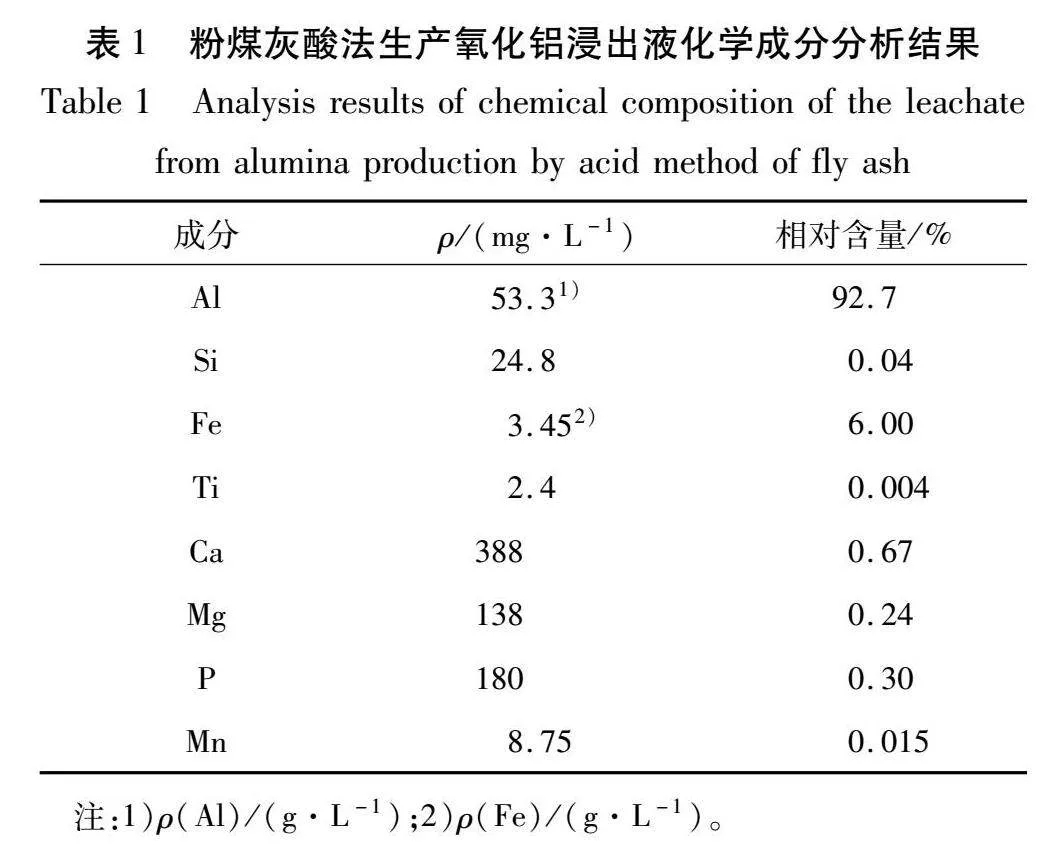
对粉煤灰酸法生产氧化铝浸出液进行化学成分分析,结果如表1所示。
由表1可知:粉煤灰酸法生产氧化铝浸出液中,铝质量浓度以氯化铝计,铁质量浓度以FeO计,氯化铝质量浓度为263.5 g/L,总铁质量浓度为4.4 g/L。铁元素包括Fe2+及Fe3+,经过滴定试验检测,Fe2+质量浓度为2.17 g/L,占总铁的49 %。
2.2气体氧化反应动力学研究
分别选取空气、富氧气体、臭氧气体3种气体氧化剂对Fe2+进行氧化研究。其中,富氧气体中氧气浓度大于99 %,臭氧气体中臭氧浓度约10 %。
2.2.1空气氧化剂动力学
选取空气作为气体氧化剂氧化Fe2+,利用空气中的氧气参与氧化反应,氧气浓度约为21 %。该氧化反应在酸性条件下反应方程式为:
4Fe2++O2+4H+4Fe3++2H2O。
试验过程使用气泵将气体打入氧化反应器中,通过流量计调节气体流量,从通气开始计时,试验结果如表2所示。
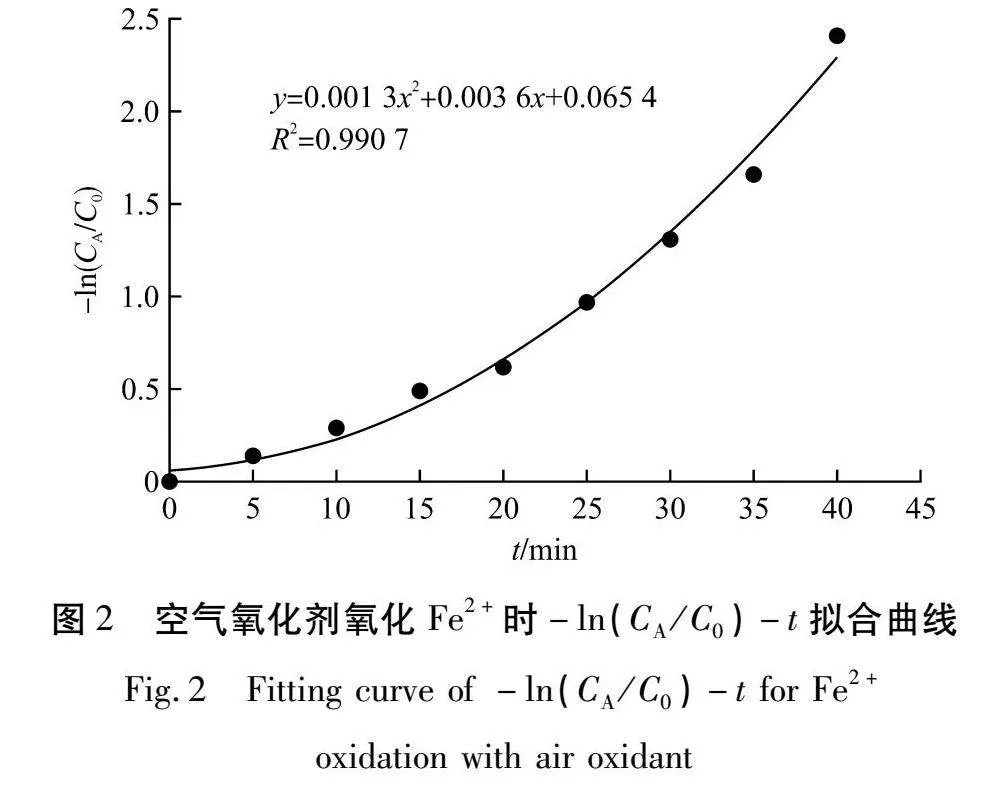
由表2可知:当反应时间达到45 min时,粉煤灰酸法生产氧化铝浸出液中的Fe2+全部被转化成Fe3+,此时气体投加量为1 200 mg/L。根据反应动力学方程,假设n=1,即反应为一级反应时,计算-ln(CA/C0)与反应时间(t)的拟合关系,结果如图2所示。
由图2可知:-ln(CA/C0)与t的关系为多项式,不呈线性关系,所以该反应不是一级反应。
当n≠1时,(CA/C0)1-n=1+(n-1)Cn-10kt,根据上述试验结果计算CA/C0与t的拟合关系,结果如图3所示。
由图3可知:CA/C0与t呈线性关系,拟合后R2=0.995,线性拟合效果较好。CA/C0与t呈线性关系,说明该反应属于零级反应,零级反应通用反应动力学方程为:CA= C0-kt。
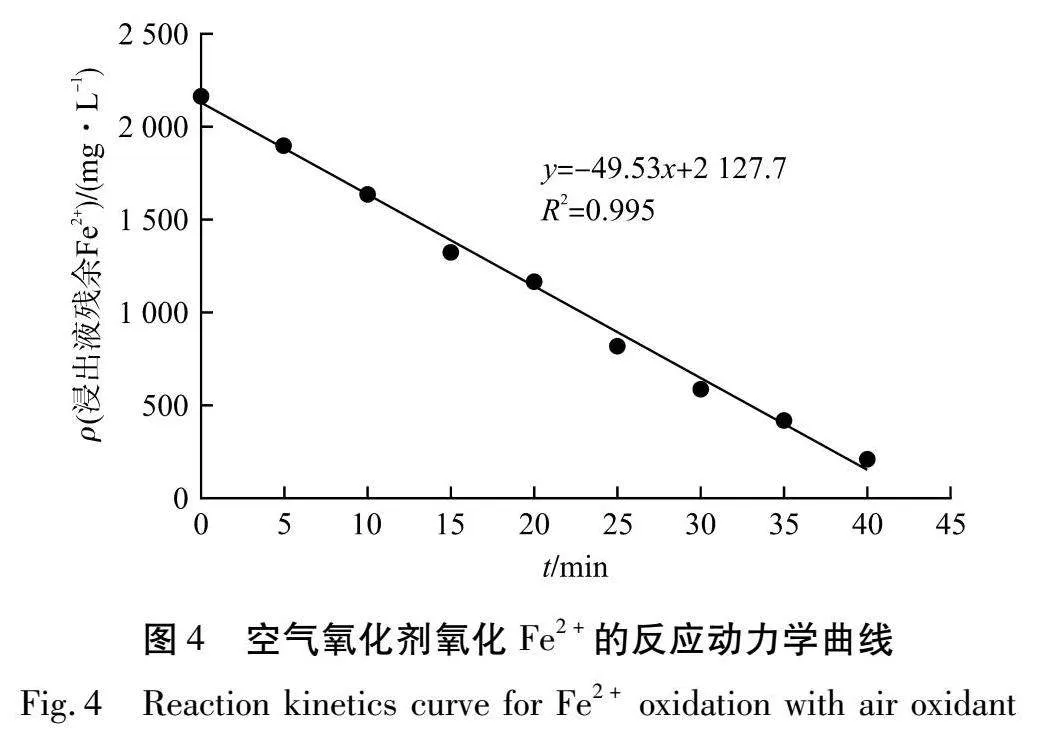
CA与t的反应动力学曲线如图4所示。
由图4可知:将CA与t进行线性拟合,拟合后R2=0.995,线性拟合效果好。拟合方程式为:y=-49.53x+2 127.7。浸出液中Fe2+的化学反应速率常数为49.53 mg/(L·min),速率常数为负,代表随着反应时间的增加,浸出液中Fe2+质量浓度减少,故浸出液中Fe2+的反应动力学方程应为:CA=2 170-49.53t。
2.2.2富氧气体氧化剂动力学
酸性条件下,富氧气体氧化剂氧化Fe2+的反应方程式如下:
4Fe2++O2+4H+4Fe3++2H2O。
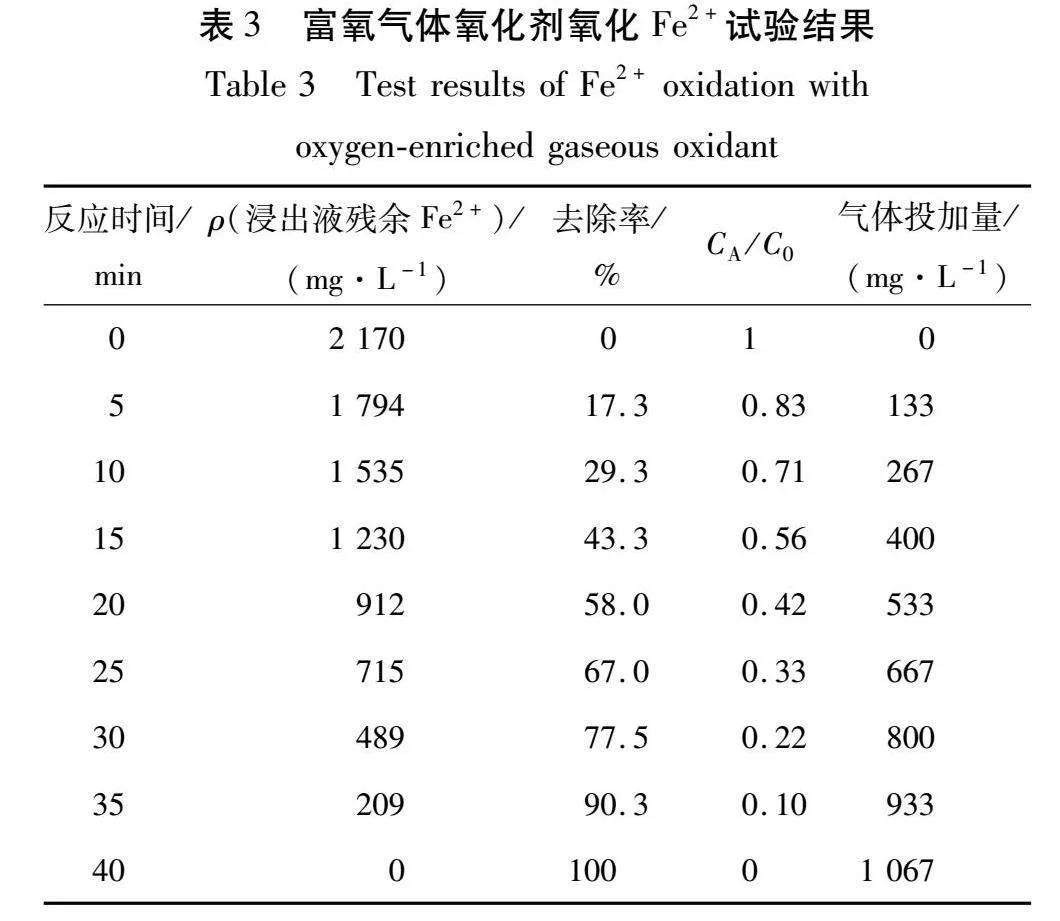
从氧气瓶中取氧气进行氧化反应,氧气由氧气管通过减压阀直接鼓入氧化反应器中,富氧气体中氧气浓度大于99 %,试验结果如表3所示。
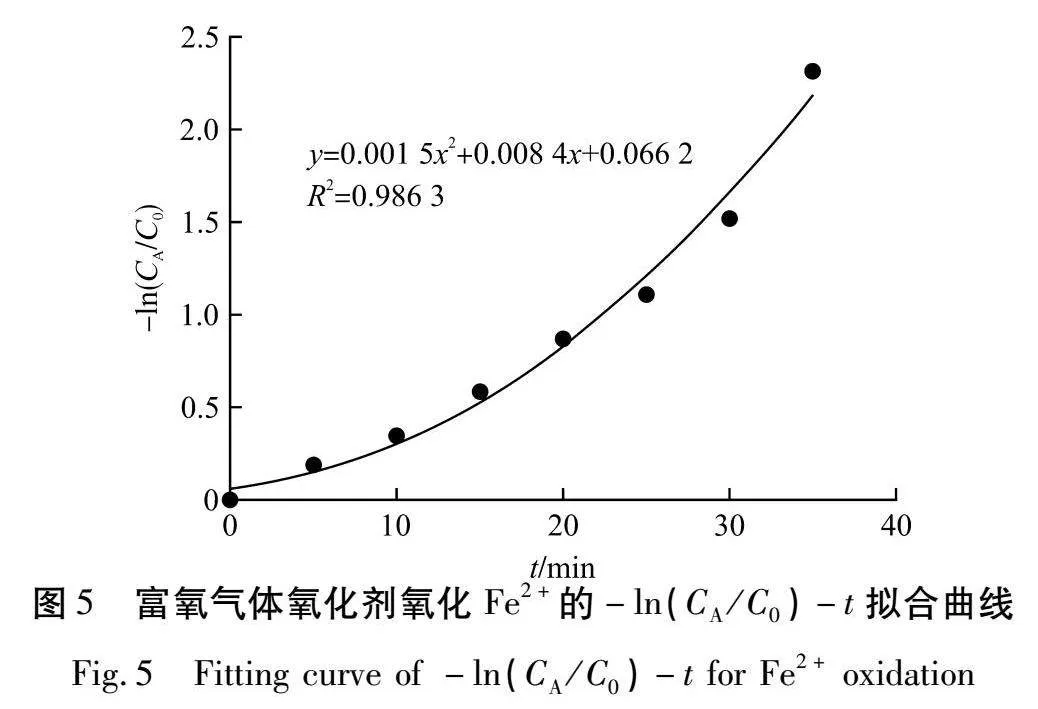
由表3可知:当反应时间达到40 min时,浸出液中Fe2+全部被转化成Fe3+,此时气体投加量为1 067 mg/L。根据反应动力学方程,假设n=1,即反应为一级反应时,计算-ln(CA/C0)与t的拟合关系,结果如图5所示。
由图5可知:n=1时,-ln(CA/C0)与t不呈线性关系,所以该反应不是一级反应。
当n≠1时,(CA/C0)1-n=1+(n-1)Cn-10kt,根据上述试验结果计算CA/C0与t的拟合关系,结果如图6所示。
由图6可知:CA/C0与t呈线性关系,拟合后R2=0.994 2,线性拟合效果较好。CA/C0与t呈线性关系,说明该反应属于零级反应,零级反应通用反应动力学方程为:CA= C0-kt。
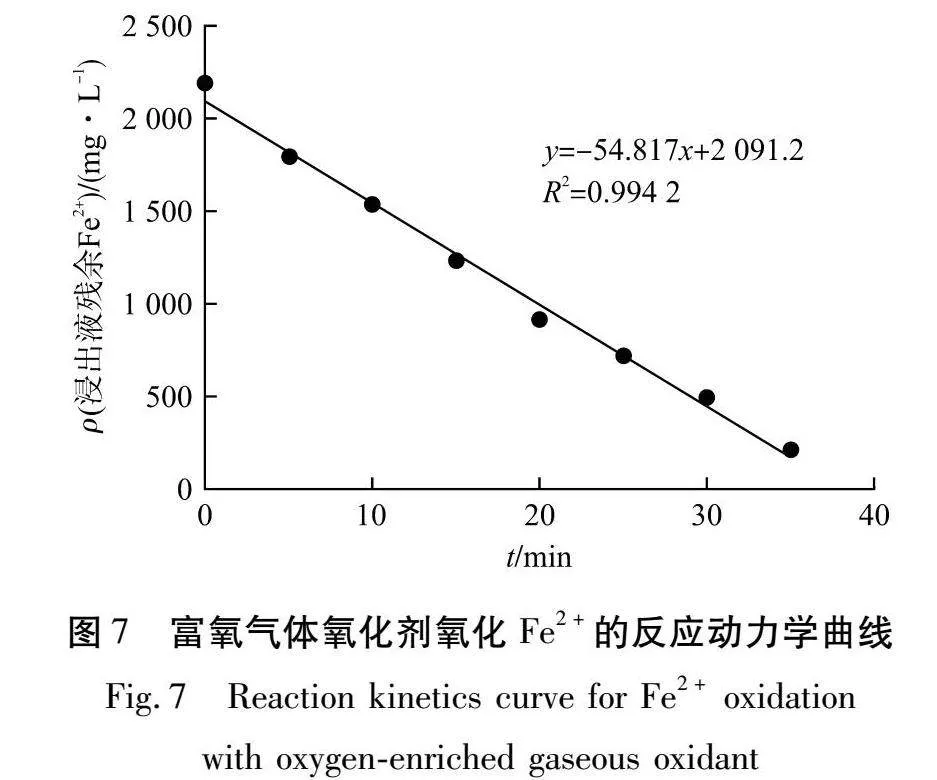
富氧气体氧化剂氧化Fe2+的反应动力学曲线如图7所示。
由图7可知:将CA与t进行线性拟合,拟合后R2=0.994 2,线性拟合效果好。拟合方程式为:y=-54.817x+2 091.2。Fe2+的化学反应速率常数为54.817 mg/(L·min),故浸出液中Fe2+的反应动力学方程为:CA=2 170-54.817t。
2.2.3臭氧气体氧化剂动力学
臭氧气体氧化剂臭氧浓度为10 %。臭氧气体的氧化机理与富氧气体有很大不同,虽然没有定论,但一般认为主要是由O3分子在水中分解产生氧化能力更强的单原子氧(O)与羟基自由基(·OH)等中间产物发生氧化反应[12]。臭氧气体水中发生的反应方程式如下:
O3 O+O2 ,
O+H2 O2HO·,
O3 +OH-·O-2 +HO2 ·,
O3 +OH-HO - 2 +O2 ,
HO - 2 +O3 ·HO2 +·O-3 。
臭氧气体与Fe2+反应总方程式如下:
2Fe2++O3+2H+2Fe3++O2+H2O。
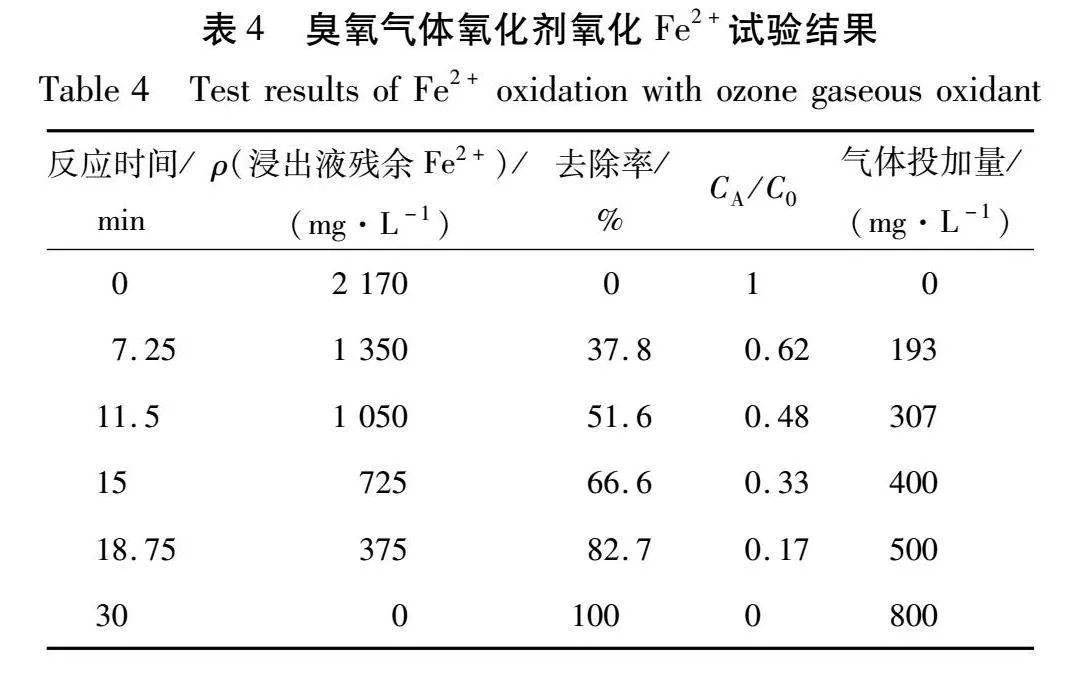
臭氧气体氧化剂氧化Fe2+试验结果如表4所示。
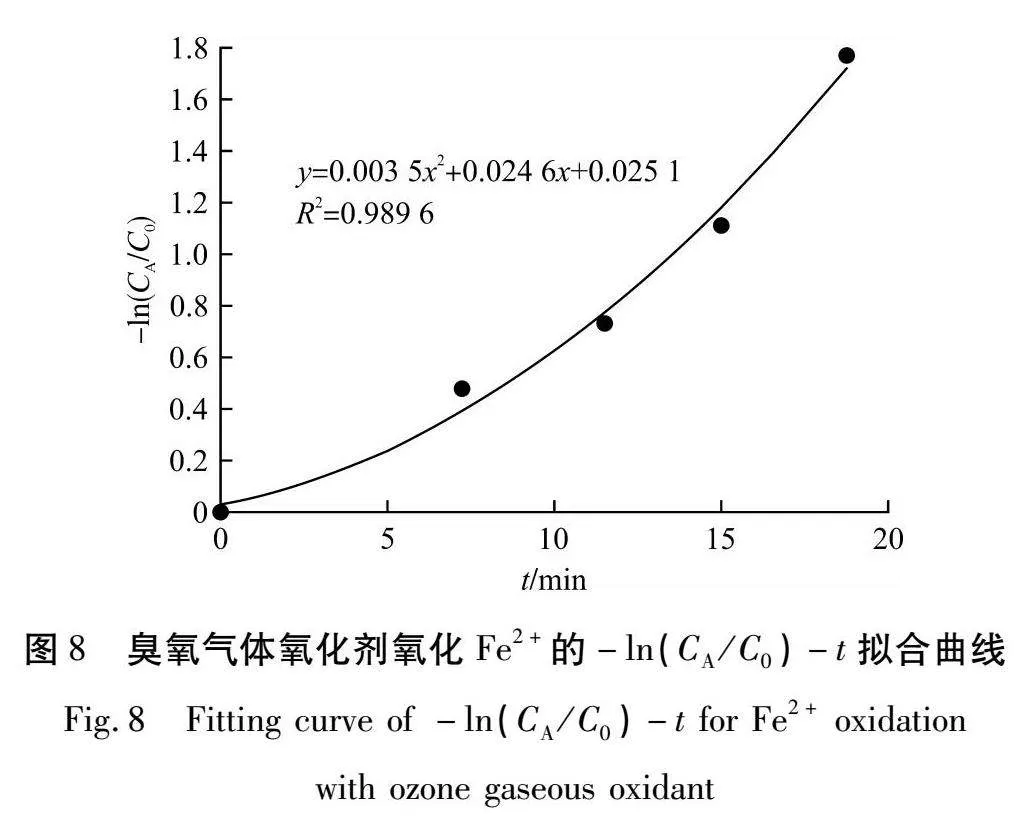
由表4可知:当反应时间达到30 min时,浸出液中的Fe2+全部被转化成Fe3+,此时臭氧气体投加量为800 mg/L。根据反应动力学方程,假设n=1,即反应为一级反应时,计算-ln(CA/C0)与t的拟合关系,结果如图8所示。
由图8可知:-ln(CA/C0)与t的关系为多项式,不呈线性关系,所以该反应不是一级反应。
当n≠1时,(CA/C0)1-n=1+(n-1)Cn-10kt,根据上述试验结果计算CA/C0与t的拟合关系,结果如图9所示。
由图9可知:CA/C0与t呈线性关系,拟合后R2=0.992 1,线性拟合效果较好。CA/C0与t呈线性关系,说明该反应属于零级反应。
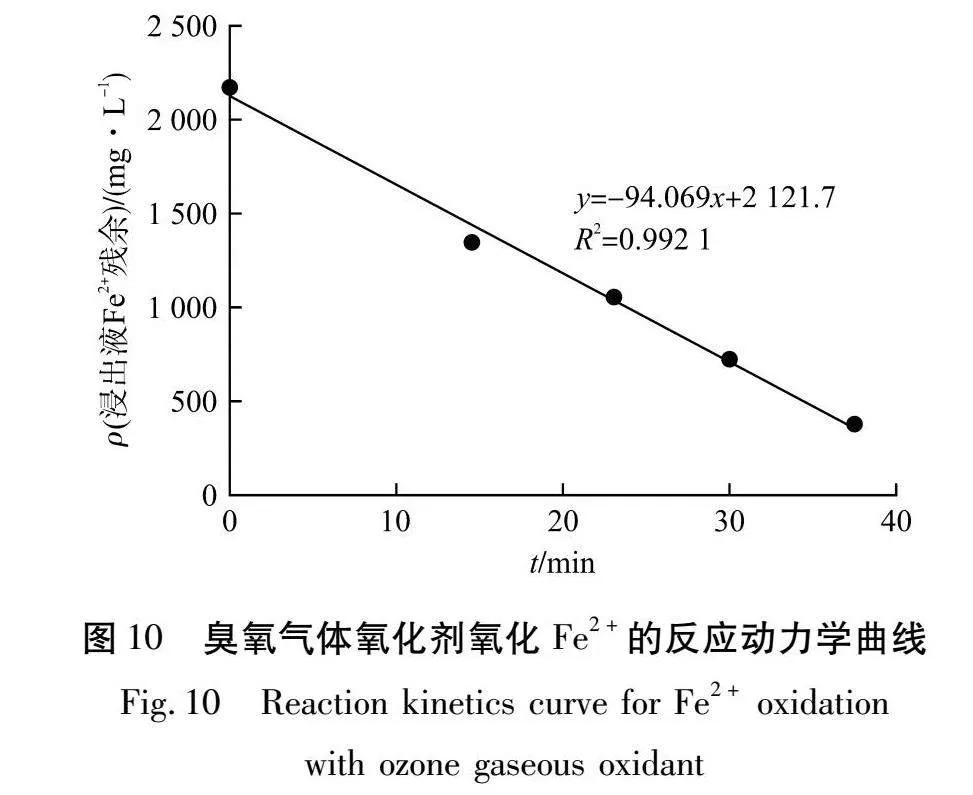
臭氧气体氧化剂氧化Fe2+的反应动力学曲线如图10所示。
由图10可知:将CA与t进行线性拟合,拟合后R2=0.992 1,线性拟合效果好。拟合方程式为:y=-94.069x+2 121.7,浸出液中Fe2+的化学反应速率常数为94.069 mg/(L·min),故浸出液中亚铁离子的反应动力学方程为:CA=2 170-94.069t。
2.2.4气体氧化剂动力学研究对比
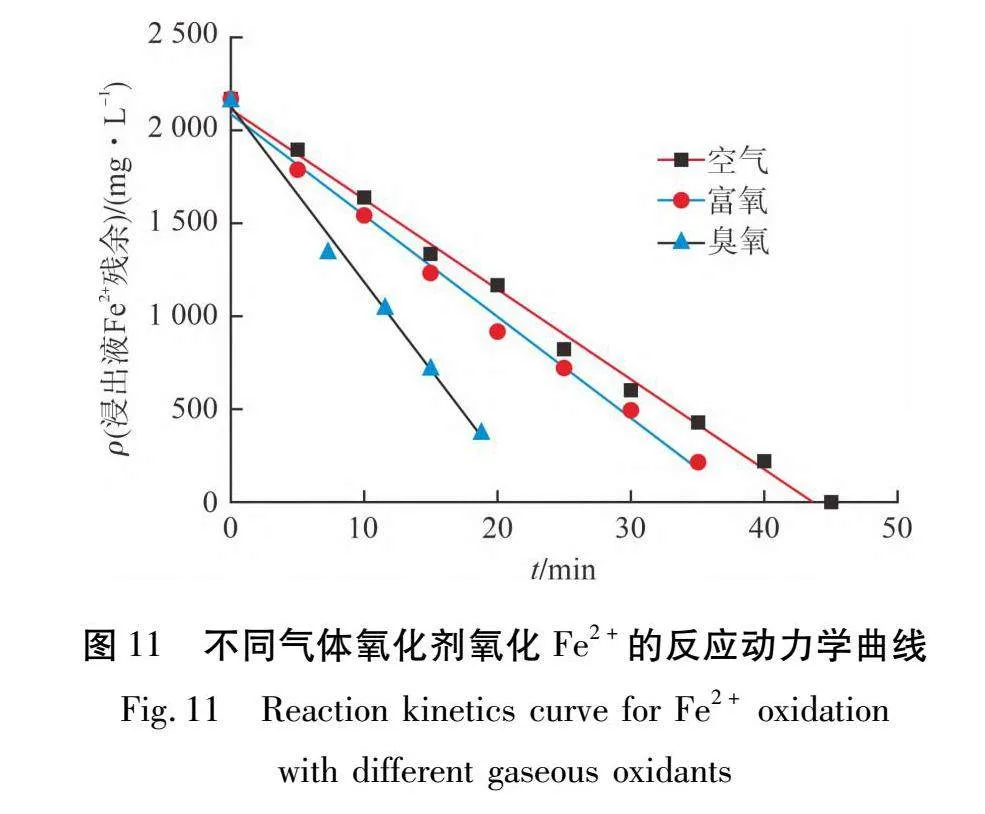
将空气、富氧气体和臭氧气体3种氧化剂进行对比分析,结果如图11所示。
由图11可知:臭氧气体氧化剂氧化Fe2+反应动力学曲线斜率远大于空气氧化剂和富氧气体氧化剂,根据动力学方程可知:臭氧气体氧化剂在反应时间22.5 min时,可将粉煤灰酸法生产氧化铝浸出液中的Fe2+全部转化成Fe3+,而空气氧化剂需要的反应时间为43 min,富氧气体氧化剂需要的反应时间为38 min,可明显看出臭氧气体氧化剂的氧化能力要远高于空气氧化剂和富氧气体氧化剂。
臭氧气体氧化的反应速率常数为94.096 mg/(L·min),富氧气体氧化的反应速率常数为54.817 mg/(L·min),空气氧化的反应速率常数为49.53 mg/(L·min),说明臭氧气体对粉煤灰浸出液中的Fe2+氧化效率和速率均大于富氧气体和空气,臭氧气体氧化速率为富氧气体的1.7倍,为空气的1.9倍。
3结论
1)粉煤灰酸法生产氧化铝浸出液的化学成分分析结果表明,浸出液中以氯化铝计的铝质量浓度为263.5 g/L,以FeO计的总铁质量浓度为4.4 g/L,Fe2+质量浓度为2.17 g/L。
2)空气、富氧气体、臭氧气体3种气体氧化剂对Fe2+的氧化反应动力学研究结果表明,臭氧气体氧化速率为富氧气体的1.7倍,为空气的1.9倍。虽然臭氧气体对Fe2+的氧化性能较好,但其难以保存和生产成本较高的特性制约了其大规模应用。
3)优化改造传统臭氧气体氧化工艺或将臭氧气体氧化工艺与其他技术联合使用将成为臭氧气体氧化Fe2+的未来研究方向。
[参 考 文 献]
[1]代晓博.锌电解阳极泥氧化亚铁离子的工艺研究[J/OL].有色金属科学与工程,1-9[2024-07-06].http:∥kns.cnki.net/kcms/detail/36.1311.TF.20231122.1238.004.html.
[2]RICE R G.Ozone in the United States of America—State-of-the-art[J].Ozone:Science & Engineering,1999,21(2):99-118.
[3]李周平.亚铁离子氧化性实验的改进[J].化学教育(中英文),2022,43(19):99-101.
[4]欧阳石保,张清华,付雄聪,等.用氧化—沉淀法从废电池浸出液中去除铁[J].湿法冶金,2021,40(6):506-509.
[5]王亚茹,吕页清,王少娜,等.微气泡强化磷酸介质中Fe2+高效氧化研究[J].过程工程学报,2021,21(8):887-894.
[6]于梦琦,党康飞,李顺义.PAM对热镀锌助镀液中铁离子去除效果研究[J].广州化工,2018,46(19):78-80.
[7]LOWNDES R.State of the art for ozone U.K.experience[J].Ozone:Science & Engineering,1999,21(2):201-205.
[8]汪毅,赵冬霞,封莉,等.活性炭催化臭氧氧化深度处理工艺对酵母发酵废水中有机物的去除特性分析[J].环境工程学报,2017,11(11):5 820-5 827.
[9]ZHANG J L,YU H T,QUAN X,et al.Ceramic menbrane separation coupled with catalytic ozonation for tertiary treatment o/wy3E9DD0BdUqWlt1CsWMQ==f dyestuff wastewater in a pilot-scale study[J].Chemical Engineering Journal,2016,301:19-26.
[10]张晓慧.催化臭氧氧化法处理有机废水的研究[D].天津:天津大学,2006.
[11]RODRIGUEZ-RODRIGUEZ C,NAVA-ALONSO F,URIBE-SALAS A.Pyrite oxidation with ozone:Stoichiometry and kinetics[J].Canadian Metallurgical Quarterly,2018,57(3):294-303.
[12]张佳乐,王天,张利波,等.臭氧氧化技术在lPBEndJvGS3jdyLM/nbVEQ==有色金属湿法冶金中的应用进展[J].矿冶,2020,6(29):68-75.
Kinetic study on the oxidation of Fe2+ by gaseous oxidants in the process
of producing alumina from fly ash using acid method
Song Litao,Gao Guimei,Wang Hongbin,Cao Kun,Chao Xiaoguang,Dai Yin
(Shenhua Zhunneng Resource Comprehensive Development Co.,Ltd.)
Abstract:A chemical composition analysis of the leachate in the process of producing alumina from fly ash using the acid method was conducted.Aluminum and iron were found to be the main elements in the leachate,with an aluminum concentration of 263.5 g/L (calculated as aluminum chloride) and a total iron concentration of 4.4 g/L (calculated as FeO),where the Fe2+ concentration was 2.17 g/L (calculated as FeO).A kinetic study on the oxidation of ferrous ions by air,oxygen-enriched gas,and ozone was carried out.Kinetic equations for the oxidation of ferrous ions by these 3 gaseous oxidants were obtained,and the oxidation rates were compared.The oxidation rate by ozone was found to be 1.7 times that of oxygen-enriched gas and 1.9 times that of air.
Keywords:fly ash;ferrous ion;gaseous oxidant;ozone;oxygen-enriched;kinetics
