贝莱斯芽孢杆菌SY01诱导苹果树抗性基因表达及其脂肽类抑菌物质分析
2024-10-29李紫英沙帅帅唐御忻谢盼李竞雄王兰


关键词:贝莱斯芽孢杆菌;苹果树腐烂病菌;抗性基因;抑菌活性成分
贝莱斯芽孢杆菌(Bacillusvelezensis)是革兰氏阳性菌,广泛分布于自然界的水体、土壤、空气、植物根系、植株表面和动物肠道等[1-3]。近年来,国内外有关贝莱斯芽孢杆菌的研究主要集中在其拮抗病原菌、促进植物生长[4,5]、诱导系统抗性、积累防御酶[6]及其抑菌活性物质[7,8]等方面。作为一种新型生防细菌,贝莱斯芽孢杆菌对腐烂病[9]、炭疽病[10]、白粉病[11]等均能发挥生物防治作用,其菌株FZB42、83和QST713已经实现商品化[12,13]。在植物与病原菌互作过程中,芽孢杆菌能诱导植物与抗病相关的防卫基因的表达,使寄主表现出抗病性。研究发现植物病程相关蛋白(PRs)合成基因PR-1、PR-2、PR4等基因调控PR蛋白表达的NPR1基因、植物保卫素合成基因PDF等,这些基因合成的抗病物质可以阻止病原菌的进一步侵入以及病害的传播[14]。例如植物根际促生菌(plantgrowthpromotingrhizobacteria,PGPR)能够通过提高这些防卫基因表达量诱导植物产生抗性,增强植物免疫,是各种PGPR用来保护植物抵御广泛的病原体的重要机制之一[15]。芽孢杆菌除了能诱导植物产生系统抗性外,还能通过直接分泌水解酶和次生代谢产物来抑制病原菌[16]。本研究采用的贝莱斯芽孢杆菌SY01菌株,由塔里木大学绿色防控实验室从环塔里木盆地周边健康的苹果树皮组织分离获得,已被证明具有广泛的抗真菌活性,其发酵滤液对苹果树腐烂病菌也具有较强的抑制作用[17],但其对苹果树抗性基因的诱导表达和主要抑菌活性成分还有待于进一步研究。
本研究以贝莱斯芽孢杆菌SY01为试材,采用荧光定量PCR检测贝莱斯芽孢杆菌SY01对苹果树关键抗性基因表达量变化的影响,并对菌株SY01抗菌脂肽粗提物进行稳定性测定;采用脂肽类抑菌成分合成基因的扩增比对和UPLCTripleTOF-MS/MS相结合,分析菌株SY01的抑菌活性成分,为揭示其诱导苹果树抗性基因表达,明确该菌株的脂肽类抑菌物质成分提供理论依据。
1 材料与方法
1.1 供试菌株
贝莱斯芽孢杆菌(Bacillusvelezensis)SY01和苹果树腐烂病菌(Valsamailvar.pyri)SW5均由塔里木大学绿色防控实验室提供。
1.2 贝莱斯芽孢杆菌发酵产物的制备
将活化后的贝莱斯芽孢杆菌SY01挑取单菌落接种于盛有50mLLB液体培养基的三角瓶中,36℃、200rpm培养24h得到种子液。按3%的接种量将种子液接种于优化后的发酵培养基(9.8g/L蔗糖、10g/L黄豆粉、7.3g/LNaCl)为发酵液。发酵液经离心喷雾干燥后获得固体发酵产物,于研钵中研磨至粉末状备用。
1.3 苹果枝条抗性相关基因表达量的RT-PCR检测
为了检测贝莱斯芽孢杆菌SY01对苹果树关键抗性基因表达量的变化,选用MdEF-1a为内参基因,采用实时荧光定量PCR扩增植物抗病相关基因MdPDF1、MdNPR1、MdPR1、MdPR2、MdPR4(引物序列信息见表1),检测它们在苹果枝条中的表达水平[14]。
选取1-2年生粗细相近的健康苹果枝条裁剪至15cm长,置于浓度1%次氯酸钠中浸泡15min,无菌水冲洗3遍,晾干后石蜡两端封口。使用5mm打孔器在枝条中间部位打孔进行接种试验,将枝条水平置于铺有润湿滤纸的托盘上,每处理重复5次。试验共设置3个处理,C1:接种在PDA培养基上培养3d的苹果树腐烂病菌SW5;C2:接种贝莱斯芽孢杆菌SY01无菌发酵滤液100μL,30min后重复接种1次;C3:清水对照。分别在接种后0h、24h、48h、72h、96h从发病(接种)部位开始往上2cm采集样品,液氮速冻,-80℃冰箱保存。
使用多糖多酚植物RNA提取试剂盒提取树皮总RNA,1.5%的琼脂糖凝胶检测RNA质量,合格后使用FastKingcDNA合成试剂盒对RNA进行反转录,合成第一链cDNA。以反转录得到的cDNA产物3倍稀释后作为模板,选MdEF1-α为内参基因,按照扩增程序对5个基因的表达水平进行测定,PCR反应体系为:SYBRqPCRMix10μL,PrimerF/R各0.8μL,cDNA1μL,ddH2O7.4μL,总体积为20μL。反应程序:95℃预变性5min;95℃变性15s,60℃退火20s,72℃延伸20s,共40个循环。每反应3个重复,由RT-PCR仪生成Ct值及其标准误。反应结束后分析融解曲线和荧光Ct值的变化曲线,参照相对定量的2-ΔΔCt法计算不同处理、时间点样品目标基因对内参的相对表达量。
1.4 不同有机溶剂萃取的抗菌脂肽粗提物对苹果树腐烂病菌抑菌作用测定
采用生长速率法测定不同有机溶剂萃取后的抗菌脂肽粗提物对苹果树腐烂病菌的抑制作用。以甲醇、二氯甲烷和乙酸乙酯为萃取溶剂,称取30g发酵产物于250mL锥形瓶中,分别加入250mL不同有机溶剂进行萃取,置于超声波清洗机中超声5min以加速产物溶解,4℃静置过夜,4000rpm离心10min,取上清液于旋转蒸发仪将有机溶剂蒸干,定量0.01MPBS缓冲液(pH=7.2-7.4)溶解,0.22μm滤膜过滤备用,即为菌株SY01抗菌脂肽粗提物[7]。以只接种苹果树腐烂病菌菌饼为空白对照,每处理3次重复,28℃培养,待对照皿内腐烂病菌菌丝长满后,用十字交叉法测量处理组菌丝直径,计算抑菌率。
1.5 菌株SY01抗菌脂肽粗提物生物学特性研究
采用生长速率法测定不同处理条件下贝莱斯芽孢杆菌抗菌脂肽粗提物的稳定性。温度:将抗菌脂肽粗提物分别置于不同温度(-20℃、20℃、40℃、60℃、80℃、100℃)下水浴加热30min,待各处理液恢复至室温,以未经温度处理的抗菌脂肽粗提物为对照,无菌水为空白对照,测定其抑菌率。自然光和紫外线:将抗菌脂肽粗提物分别置于自然光和紫外灯下,分别照射1h、3h、5h、7h、9h,以未经自然光或紫外线灯照射处理的抗菌脂肽粗提物为对照,无菌水为空白对照,测定其抑菌率。酸碱度:将抗菌脂肽粗提物用1mol/LHCl溶液或1mol/LNaOH溶液调节pH分别至1、3、5、7、9、11,4℃静置12h后,缓慢调回各处理pH至原始数值pH=7.2,以未处理的抗菌脂肽粗提物为对照,无菌水为空白对照,测定抗菌脂肽粗提物的抑菌率。
1.6 菌株SY01抑菌活性物质的初步分析
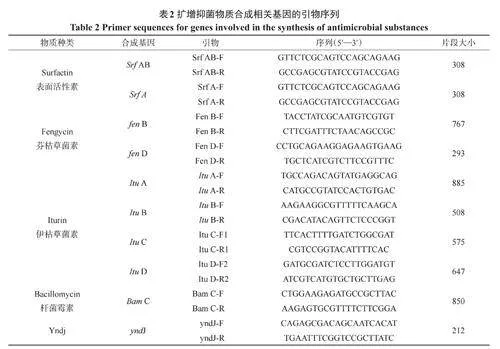
1.6.1 菌株SY01脂肽类抑菌物质合成基因的扩增和比对 取出斜面保藏的菌株SY01,三区划线法接种于LB培养基平板上,30℃过夜培养,挑取单菌落于LB培养基中,36℃,200rpm振荡培养,取菌液1mL,10000rpm离心5min,弃上清液,用细菌DNA提取试剂盒提取菌株SY01的DNA,-20℃保存备用。
使用表2中的10对引物分别对贝莱斯芽孢杆菌SY01进行PCR扩增。反应体系(20μL):1μLDNA模板,正反引物各1μL,10μLSYBRPremixExTag,ddH2O7μL。扩增条件:95℃5min;95℃10s,60℃30s,72℃20s,共40个循环;95℃15s,60℃60s,95℃15s。
1.6.2 脂肽类粗提物的初步分析 采用UPLCTripleTOF-MS/MS鉴定甲醇有机萃取液的成分[18]。分离色谱柱型号为C18色谱柱。色谱分离条件:柱温40℃,流速0.3mL·min-1,进样量4μL。质谱条件:采用电喷雾离子化(ESI+)源;雾电压(IS)5kV;喷雾气(GS1)50psi;辅助加热气(GS2)50psi;辅助加热气温度350℃;TOFMS扫描质合比范围:m/z200-400;采集模式:飞行时间全扫描质谱和二级质谱(TOFMSIDAMS-MS)模式;TOFMS触发二级扫描范围:m/z500-2000;去簇电压(DP)100V;MS-MS碰撞能量(CE)Rollingcollisionenergy。
1.7 数据处理与分析
采用Origin2022制图,SPSS27.0进行差异显著性分析。
2 结果与分析
2.1 总RNA检测
将提取的总RNA进行质量与含量的检测,其RNA浓度均较高,并且A260/280值均在1.8-2.1之间,将浓度、纯度合格的RNA使用1.5%琼脂糖凝胶进行检测,电泳图结果显示28s和18s条带清晰完整(图1),可用于后续试验。
2.2 苹果抗性相关基因的荧光定量PCR分析
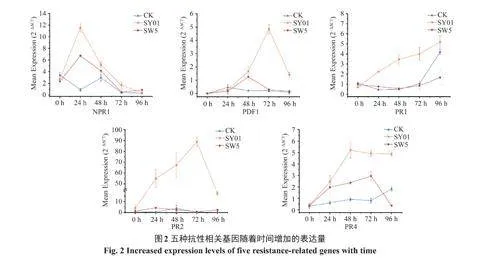
如图2所示,5种苹果树抗性相关基因表达量在贝莱斯芽孢杆菌SY01和苹果树腐烂病菌SW5的诱导下,除MdPR1基因外,其余4种抗性基因均呈现先上升后下降的趋势,且SY01的诱导表达量大于SW5。不同抗性基因诱导表达的峰值时间存在差异,MdNPR1、MdPDF1、MdPR2、MdPR4分别在24、72、72和48h达到峰值,而MdPR1在0-96h呈现持续上调的趋势。
2.3 抗菌脂肽粗提物对苹果树腐烂病菌的抑制效果
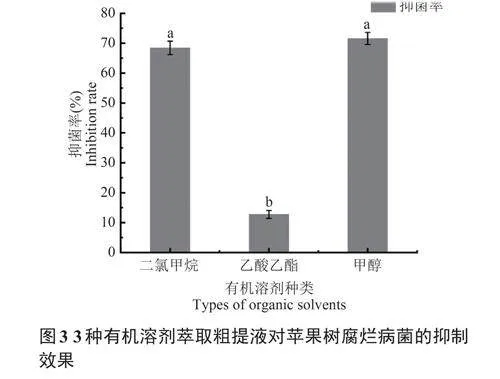
由图3可知,3种有机溶剂萃取菌株SY01发
酵产物后的抗菌脂肽粗提物均对苹果树腐烂病菌具有一定抑菌效果,其中以甲醇为有机溶剂的抗菌脂肽粗提物抑菌效果最好,抑菌率达到72.16%,其次为二氯甲烷,二者无显著性差异,乙酸乙酯的抑制效果最差,与其它处理存在显著性差异(Plt;0.05)。
2.4 菌株SY01萃取液中抑菌活性物质生物学特性研究
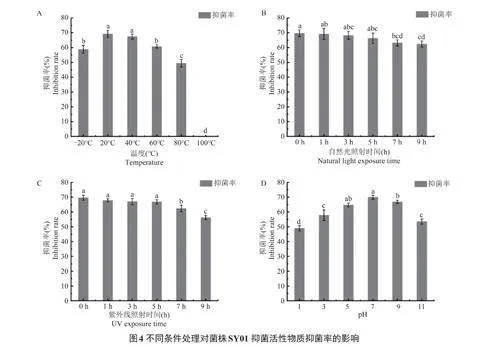
以甲醇为有机溶剂对菌株SY01发酵产物萃取后的抗菌脂肽粗提物进行生物学特性研究(见图4)。由图4A可知,菌株SY01抗菌脂肽粗提物最适温度范围为20~40℃,当温度在20℃时,抑菌活性最大,随后呈下降的趋势,当温度达到100℃时,抑菌率为0%。由图4B和4C可知,在没有自然光和紫外线的照射下,菌株SY01抗菌脂肽粗提物抑菌率最大,且随着自然光和紫外线照射时间的延长,抑菌活性逐渐减小,当照射时间的延长至11h时,其抑菌率最小。由图4D可知,菌株SY01抗菌脂肽粗提物在pH为7时,对苹果树腐烂病菌的抑菌率最高,为70%,其次为pH为5和9,两者之间无显著差异(Plt;0.05)。
2.5 菌株SY01脂肽类抑菌活性物质鉴定
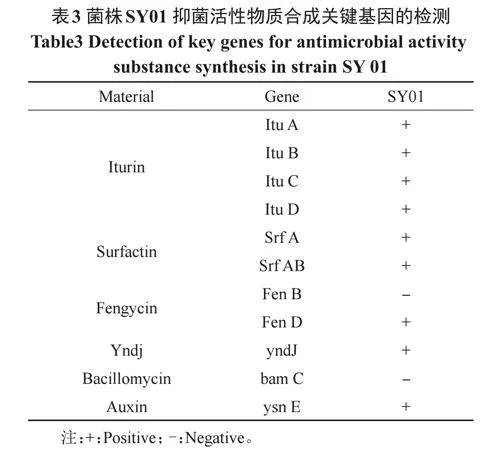
2.5.1 菌株SY01脂肽类抑菌活性物质合成基因的扩增和比对 菌株SY01脂肽类抑菌活性物质合成基因的扩增和比对结果显示(表3),在其基因组中能检测到ItuA、ItuB、ItuC、ItuD、SrfA、SrfAB、FenD、yndJ、ysnE这9种与抑菌活性物质合成相关的基因,由此初步推断出菌株SY01可通过产生Iturin、Surfactin、Fengycin等抗菌次级代谢产物抑制菌株SW5的生长。
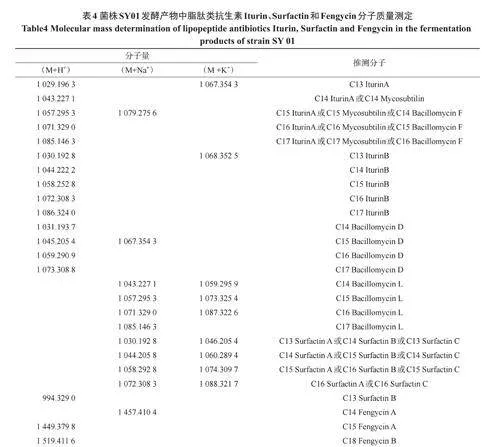
2.5.2 菌株SY01脂肽类抑菌活性物质分析 将菌株SY01发酵产物经甲醇萃取后的有机萃取液进行MALDI-TOF-MS测定[19],对其结果初步分析(表4),发现质谱峰[M+H+]质荷比为1029.1963、1043.2271、1057.2953、1071.3290、1085.1463,分子量相差14Da,即一个亚甲基CH2的同系物系列,推测为IturinA(C13-C17);质谱峰[M+H+]质荷比为1030.1928、1044.2222、1058.2528、1072.3083、1086.3240,推测为IturinB(C13-C17);质谱峰[M+H+]质荷比为1043.2271、1057.2953、1071.3290、1085.1463,推测为Mycosubtilin(C14-C17);质谱峰[M+H+]质荷比为1031.1937、1045.2054、1059.2909、1073.3088,推测为BacillomycinD(C14-C17);质谱峰[M+H+]质荷比为1057.2953、1071.3290、1085.1463,推测为BacillomycinF(C14-C17);质谱峰[M+Na+]质荷比为1043.2271、1057.2953、1071.3290、1085.1463,推测为BacillomycinL(C14-C17);质谱峰[M+Na+]质荷比为1030.1928、1044.2058、1058.2928、1072.3083,推测为SurfactinA(C13-C16)或SurfactinB(C14-C16)或SurfactinC(C13-C16);质谱峰[M+Na+]质荷比为1457.4104,推测为C14FengycinA;[M+H+]质荷比为1449.3798,推测为C15FengycinA,[M+H+]质荷比为1519.4116,推测为C18FengycinB。通过离子响应强度发现,抑菌活性物质中的Fengycin含量较少,Iturin和Surfactin含量相对较多。
3 讨论
研究显示芽孢杆菌可以通过提高植物的防御酶活性,诱导病程相关蛋白(PR蛋白)的产生,造成细胞程序性死亡、胼胝质沉积、活性氧爆发等机制来保护植物免受病原菌的侵害[20]。MdPR1参与调控水杨酸(SA)和乙烯(ET)信号通路,MdPR2和MdPR4具有β-1,3-葡聚糖酶和几丁质酶活性;MdPDF1和MdPDF2参与合成植物保卫素,进行自身防御反应;MdNPR1基因参与调控PR蛋白表达,这些基因合成的抗病物质可以阻止病原菌的进一步侵入以及病害的传播[14]。本研究采用荧光定量PCR验证贝莱斯芽孢杆菌SY01和苹果树腐烂病菌SW5对苹果树抗性相关基因诱导的可持续性,结果表明与接种SW5的枝条相比,经菌株SY01处理后,MdPDF1、MdNPR1、MdPR1、MdPR2、MdPR4这5个基因的表达显著上调。苹果树腐烂病菌虽然能够在入侵初期诱导寄主抗性相关基因的表达,但随其持续的侵染,寄主抗性相关基因被抑制表达,而贝莱斯芽孢杆菌SY01可以持续诱导抗性相关基因的表达来抵抗病原微生物的侵袭。陈作[21]等的研究结果显示经贝莱斯芽孢杆菌ZW10-af处理后,OsPR1a、OsLYP6、OsPR5等参与水杨酸通路相关防御基因表达量上调,有助于增强宿主对病原菌的抗性。
生防菌具有良好的稳定性是其开发为生物制剂并被推广使用的必备条件之一[22]。采用生长速率法对菌株SY01抗菌脂肽粗提物进行稳定性测定,结果表明以甲醇为有机溶剂萃取的抗菌脂肽粗提物在-20℃到60℃范围内有较好热稳定性,以及自然光和紫外线稳定性;适宜pH值为5-9,当pH为强酸强碱时,活性物质抑菌率显著下降。娄向弟[23]等通过抑菌试验对贝莱斯芽孢杆菌PJP10的抑菌物质稳定性进行测定,发现菌株在85℃以内具有良好的热稳定性,赵欣[24]等的研究结果表明解淀粉芽孢杆菌HRH317对自然光和紫外线不敏感;赵雅[25]等发现贝莱斯芽孢杆菌HN-Q-8不耐强酸强碱,最适pH为4.0-10.0。
贝莱斯芽孢杆菌主要通过合成次级代谢产物包括细菌素、抑菌蛋白、脂肽类物质和聚酮化合物等实现对病原菌的抑制作用[26]。近年来,随着对芽孢杆菌脂肽合成基因的深入研究,设计出了多对特异引物以通过PCR方法检测菌株是否具有合成脂肽的基因[27]。不同芽孢杆菌产生的抑菌活性物质有所不同,为明确其主要抑菌活性成分,更好的利用菌株SY01发酵液中产生的次级代谢产物,通过UPLC-TripleTOF-MS/MS在甲醇萃取有机相中检测到多种抑菌活性物质,其中丰度最高的是伊枯草菌素和表面活性素。合成基因的扩增和比对与UPLC-TripleTOF-MS/MS推测结果一致,均表明菌株SY01可通过产生伊枯草菌素、表面活性素、丰原素等抗菌次级代谢产物抑制菌株SW5的生长。本实验室前期对菌株SY01基因组进行预测,菌株中含有表面活性素(surfactin)、大环内酯(macrolactin)、杆菌烯(bacillaene)、丰原素(fengycin)、地非西丁(difficidin)、杆菌巴塞素(bacillibactin)、溶杆菌素(bacilysin)、丁苷菌素(butirosin)、萜类(terpenes)和羊毛硫肽类化合物(lantipeptide)等次级代谢产物[17]。申云鑫[28]等发现贝莱斯芽孢杆菌SH-1471具有srfA、fenB、ituA、ituD、bymA等抗生素合成基因;张晓云[29]通过UPLC-TripleTOF-MS/MS证明贝莱斯芽孢杆菌HMB28521菌株可以产生伊枯草菌素(iturin)、丰产素(fengycin)和表面活性素(surfactin),抑菌试验证明iturin和fengycin是该菌株产生的主要抑菌活性物质,二者能够显著抑制多主棒孢霉的生长,并且造成菌丝畸形。
4 结论
本研究对贝莱斯芽孢杆菌SY01诱导寄主抗性机理和抑菌活性物质进行初步分析,结果表明苹果树腐烂病菌SW5虽然能够在入侵初期诱导寄主抗性基因的表达,但随着其持续的侵染,寄主抗性基因被抑制表达,而贝莱斯芽孢杆菌SY01可以持续诱导苹果树抗性相关基因的表达;抑菌活性物质的最佳萃取溶剂为甲醇;以甲醇为有机溶剂萃取的抗菌脂肽粗提物在-20℃到60℃范围内有较好热稳定性,以及自然光和紫外线稳定性;适宜pH值为5-9,不耐强酸和强碱;脂肽类抑菌物质合成基因的扩增和比对与UPLC-TripleTOF-MS/MS的推测结果一致,均表明菌株SY01可通过产生Iturin、Surfactin、Fengycin等抗菌次级代谢产物抑制苹果树腐烂病菌SW5的生长,为揭示其诱导苹果树抗性基因表达、明确该菌株脂肽类抑菌物质成分提供了理论依据。
