建模思维在电化学类题目中的应用剖析
2024-10-29宋景红

近年来,以新型电化学装置为背景的试题已成为命题趋势.这类题目要求学生不仅要掌握基础知识,还要具备整合信息和解决实际问题的能力.该类题目的核心内容是基础的电化学原理,如电极判断、电极反应式的书写等.为了更好地帮助学生解决这类题型,本文总结了相关解题模型.
1 电化学类问题的解题模型
1.1 理解题意,明确研究对象
在解答电化学试题时,首先需要借助题干中的文字信息,明确题目中描述或展示的装置类型.电化学试题除了涉及原电池和电解池外,还会出现二次电池.二次电池放电时,装置遵循原电池工作原理;充电时,装置遵循电解池工作原理.如果题干含有“电解法”“电解”等字词,则多表明研究对象为电解池;如果题干含有“电池”相关字词,则多表明研究对象为原电池.除了文字描述外,也可以通过装置图进行判断,看装置是否含有外加电源:如果有外加电源,则为电解池;如果不含外加电源,则为原电池.可充电二次电池题目一般会直接用文字进行阐释.
1.2 确定两极
原电池分为正、负极,电解池分为阳极和阴极.确定电极的方法较多,但其遵循的本质是相同的.原电池的工作原理为“负失正得”:失去电子的一端为负极,得到电子的一端为正极.电解池遵循的原理为“阳失阴得”:失去电子的电极为阳极,得到电子的电极为阴极.该步骤通常还会涉及电极方程式的书写,需要遵循如图1所示步骤.
1.3 确定电路
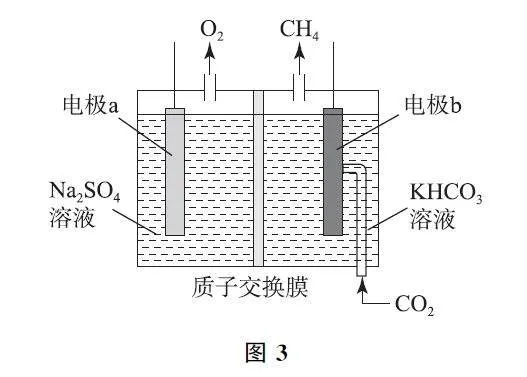
在电化学装置中,微粒移动的考查有两大方面.内电路离子的移动方向和外电路电子的移动方向.在前两步的基础上,根据问题所涉及的是“外电路中的电子”还是“内电路中的离子”,利用表1口诀进行判断.若遇到相关计算,要谨遵“守恒思想”,外电路两极上得失电子总数相等,内电路移动离子的电荷总数与外电路电子的电荷总数相等.
2 建模思维在解题中的应用
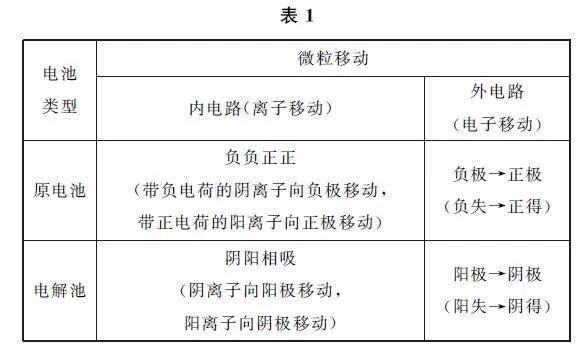
例1 某团队发明的制取H2O2 的绿色方法原理如图2所示(已知:H2O2 ⇌H+ +HO- 2 ,Ka=2.4×10-12).下列说法不正确的是( ).
A.b极的电极反应为O2+H2O+2e- =HO- 2 +OH-
B.X 膜为选择性阳离子交换膜
C.a极为正极
D.每生成1molH2O2,电路中转移4mole-
解析 第1步:确定研究对象.题干中不能直接分析出研究对象,要结合装置图进行分析,装置图无电源,且有电路“负载”,说明研究对象为原电池.
第2步:确定两极.结合装置示意图可知,电极b的反应物为O2,电极a的反应物为H2.根据电极反应式书写流程,a极发生反应H2-2e- =2H+ ,b极上的电极反应为O2+H2O+2e- =HO- 2 +OH- ,选项A说法正确.O 元素由0价变成-1价,每生成1 molH2O2,电路中转移2mol电子,选项D说法错误.根据“负失正得”的原理,a极为负极,选项C说法正确.
第3步:确定内外电路.根据原电池内电路的“负负正正”原理,阳离子会移向正极,因此a极附近生成的氢离子会透过X膜向b极(正极)移动,故X膜为选择性阳离子交换膜,允许H+ 通过,选项B说法正确.答案为D.
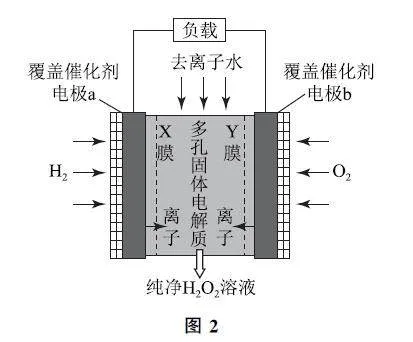
例2 利用电解法将CO2 转化为CH4 的原理如图3所示.下列说法正确的是( ).
A.电解过程中,H+ 由a极区向b极区迁移
B.电极b上反应为CO2+8HCO3--8e-=CH4+8CO23-+2H2O
C.电解过程中化学能转化为电能
D.电解时,Na2SO4 溶液浓度保持不变
解析 该题的装置图未标出电源,但不能依据没有电源直接推断为“原电池”,需要结合文字描述进行综合分析.
第1步:确定研究对象.题干中“电解法”说明该装置是电解池,电解过程中电能转化为化学能,选项C错误.
第2步:确定两极.结合装置示意图可知,电极a生成O2,失去电子,为阳极,则电极b为阴极,化学反应为CO2+8HCO3- +8e- =CH4+8CO23- +2H2O,选项B错误,由a极反应式可知,电解Na2SO4 溶液实质是电解水,选项D错误.
第3步:确定内外电路.根据电解池内电路的“阴阳相吸”原理,阴离子会移向阳极,阳离子会移向阴极.因此H+ 由a极区向b极区迁移,选项A 正确.答案为A.
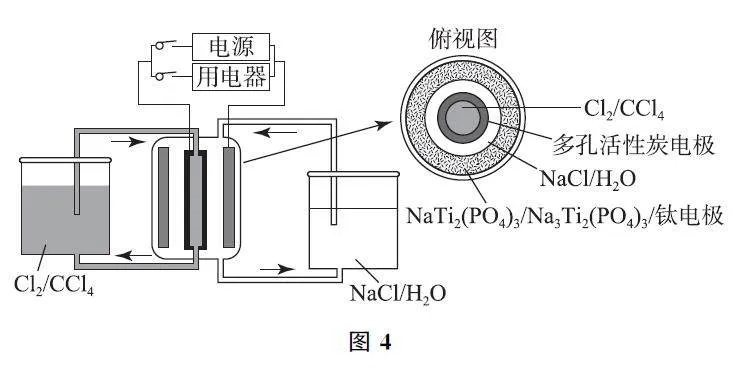
例3 某储能电池原理如图4所示.下列说法正确的是( ).
A.放电时负极反应:Na3Ti2 (PO4)3 -2e- =2Na+ +NaTi2(PO4)3
B.放电时Cl- 透过多孔活性炭电极向CCl4 中迁移
C.放电时每转移1mol电子,理论上CCl4 吸收0.5molCl2
D.充电过程中,NaCl溶液浓度增大
解析 第1步:确定研究对象.题干中“储能电池”说明该装置是一个可充电的二次电池.
第2步:确定两极.结合装置示意图可知,放电时负极失电子,发生氧化反应,负极反应为Na3Ti2(PO4)3-2e- =2Na+ +NaTi2(PO4)3,选项A 正确.正极反应为Cl2+2e- =2Cl- ,需要CCl4 释放Cl2 进行反应,因此每转移1mol电子,理论上CCl4 释放0.5molCl2,选项C错误.充电是放电的逆过程,因此在充电过程中,阳极反应为2Cl- -2e- =Cl2,消耗Cl- ,NaCl的浓度降低,选项D错误.
第3步:确定内外电路.放电时,阴离子会移向负极,故Cl- 透过多孔活性炭电极向NaCl中迁移,选项B错误.答案为A.
通过建立恰当的模型,学生能更系统地分析问题,从宏观和微观层面深入理解电化学过程,不仅提高了解题的准确性,也加深了其对化学反应本质的认识.在今后的教学中,教师应设计更多引导学生主动建模的教学活动,鼓励他们在解决问题时积极应用和调整模型,让“建模”在学生的思维中扎根.
(完)
