高考中化学反应机理的命题趋势分析
2024-10-29周继楠
随着教育改革的不断推进和高考命题思路的不断更新,高考化学试题在化学反应机理方面的命题趋势愈发明显.这一趋势不仅要求学生掌握化学反应的基本原理和核心概念,还要求学生能够深入理解反应机理,注重实际应用,追求创新思维.本文将探讨这一命题趋势的特点,以期帮助学生更好地进行备考.
1 强调基础知识和核心概念
高考化学作为一门考查学生化学知识综合运用能力的考试,始终将基础知识和核心概念作为命题的核心.特别是在化学反应机理的考查中,这种趋势尤为明显.这不仅体现在对基础反应机理的深入探究,还体现在将反应机理与实际应用相结合,考查学生的综合分析能力.
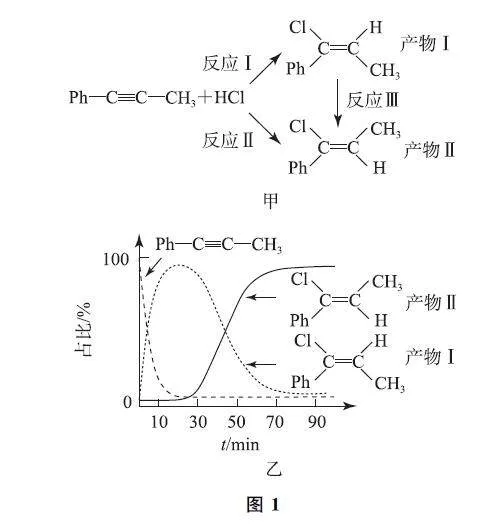
例1 (2023年6月浙江卷)一定条件下,1G苯基丙炔(Ph—C≡C—CH3)可与HCl发生催化加成,反应如图1G甲所示:
反应过程中该炔烃及反应产物的占比随时间的变化如图1G乙所示(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是( ).
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
解析 由图1G甲可知,反应Ⅱ=反应Ⅰ+反应Ⅲ,反应Ⅰ、反应Ⅲ都是放热反应,所以反应Ⅱ也是放热反应,且反应Ⅱ的反应热比反应Ⅰ小,即存在反应焓变:反应Ⅰ>反应Ⅱ,选项A 说法正确.反应所需的活化能越小,反应速率越快,相同时间内所占比例越大,由图可知,短时间内,产物Ⅰ的占比远远大于产物Ⅱ,说明反应Ⅰ的速率远远大于反应Ⅱ,则所需活化能:反应Ⅰ<反应Ⅱ,选项B说法正确.由于存在产物Ⅰ与产物Ⅱ之间的可逆反应,K 与氯化氢含量无关,因此比值不会随着HCl含量的改变而改变,选项C说法错误.由图可知,相对较短的反应时间内产物Ⅰ的占比较大,所以选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,选项D说法正确.
答案 C.
2 注重实际应用
在近年高考中,实际应用类试题在化学反应机理的考查中愈发受到重视.这一转变不仅体现了化学学科与实际生活的紧密联系,更突显了高考对学生综合应用能力的全面要求.化学反应机理,作为化学学科的核心内容,其实际应用不仅关乎学生对理论知识的理解和掌握,更在于培养学生解决实际问题的能力.
例2 (2023年北京卷,节选)尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步.
(1)19世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成.该反应的化学方程式是________.
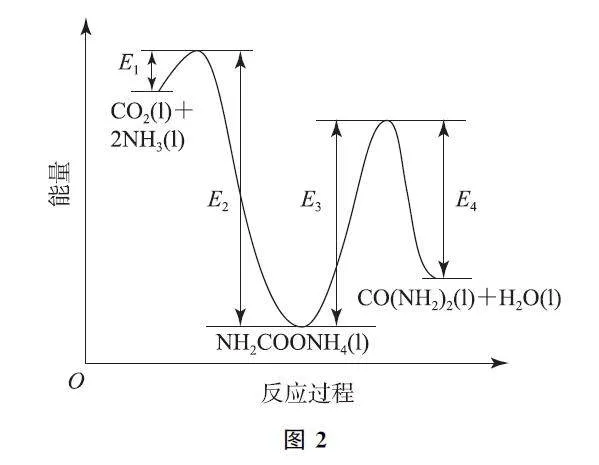
(2)20世纪初,工业上以CO2 和NH3 为原料在一定温度和压强下合成尿素.反应分两步:
ⅰ.CO2 和NH3 生成NH2COONH4;
ⅱ.NH2COONH4 分解生成尿素.
结合反应过程中能量变化示意图(如图2),下列说法正确的是________(填序号).
a.活化能:反应ⅰ<反应ⅱ
b.ⅰ为放热反应,ⅱ为吸热反应
c.CO2(l)+2NH3(l)=CO(NH2)2(l)+H2O(l)ΔH =E1-E4
解析 (1)AgOCN 与NH4Cl在一定条件下反应制得CO(NH2)2 和AgCl,根据原子守恒,该反应化学方程式为AgOCN+NH4Cl=CO(NH2)2+AgCl.
(2)由图可知,反应ⅰ的活化能是E1,反应ⅱ的活化能是E3,E1<E3,故a正确.从图中反应物和生成物能量的相对大小可看出ⅰ为放热反应,ⅱ为吸热反应,故b正确.总反应的ΔH =E1-E2+E3-E4,即CO2(l)+2NH3(l)=CO(NH2)2(l)+H2O(l)的ΔH =E1-E2+E3-E4,故c错误.答案为a、b.
3 强调实验探究
高考试题对于化学反应机理的考查逐渐转向与实验探究相结合,这一转变不仅凸显了化学作为一门实验科学的本质,更强调了实验在理解和分析化学反应机理中的核心地位.考生不仅需要掌握理论知识,更需要通过实验来验证、探究和应用这些理论知识.
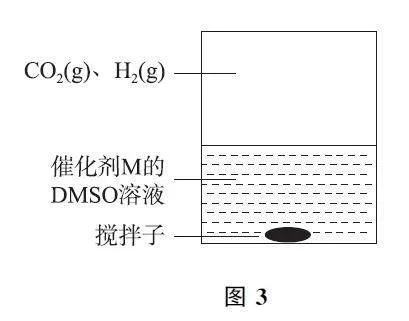
例3 (2024年1月浙江卷,节选)通过电化学、热化学等方法,将CO2 转化为HCOOH 等化学品,是实现“双碳”目标的途径之一.
为提高效率,该研究小组参考文献优化热化学方法,在图3 所示密闭装置中充分搅拌催化剂M 的DMSO(有机溶剂)溶液,CO2 和H2 在溶液中反应制备HCOOH,反应过程中保持CO2(g)和H2(g)的压强不变,总反应CO2+H2⇌HCOOH 的反应速率为v,反应机理如下列3个基元反应,各反应的活化能E2<E1≪E3(不考虑催化剂活性降低或丧失).
Ⅳ:M+CO2⇌Q E1.
Ⅴ:Q+H2⇌L E2.
Ⅵ:L⇌M+HCOOH E3.
(1)催化剂M 足量条件下,下列说法正确的是________(填序号).
A.v 与CO2(g)的压强无关
B.v 与溶液中溶解H2 的浓度无关
C.温度升高,v 不一定增大
D.在溶液中加入N(CH2CH3)3,可提高CO2 转化率
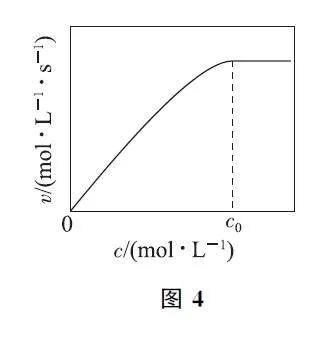
(2)实验测得:298K,p(CO2)=p(H2)=2MPa下,v 随催化剂M 浓度c 变化如图4所示.c≤c0 时,v随c 增大而增大;c>c0 时,v 不再显著增大.请解释原因: ________.
解析 (1)v 与CO2(g)的压强有关,压强越大,溶液中CO2 的浓度越大,v 越大,选项A 错误.v与溶液中溶解H2 的浓度有关,H2 的浓度越大,速率越快,选项B错误.温度升高,v 不一定增大,反应Ⅳ和Ⅴ是快反应,而Ⅵ是慢反应(决速步骤),若Ⅳ和Ⅴ是放热反应且可以快速建立平衡状态,则随着温度升高L的浓度减小,若L的浓度减小对反应速率的影响大于温度升高对总反应速率的影响,则总反应速率减小,总反应的速率不一定增大,选项C正确.在溶液中加入的N(CH2CH3)3 会与HCOOH 反应,使得3个平衡正向移动,可提高CO2 转化率,选项D正确.
(2)因各反应的活化能E2<E1≪E3,反应Ⅵ为决速步骤,但L的浓度取决于反应Ⅴ和Ⅳ,故v 与催化剂M 的浓度、反应物CO2 和H2 的浓度有关.当c≤c0时,催化剂M 活性位点数量不够,v 取决于催化剂M的浓度;当c>c0 时,催化剂M 活性位点数量足够,v取决于反应物CO2 和H2 的浓度.
总之,学生需要全面掌握理论知识,加强实验探究和实践应用,并提高分析和解决问题的能力.
(完)
