以“能量-反应进程图”为情境的高考试题研究
2024-10-29王志庚于红
新高考实施以来,很多省份的试题中出现了一种新的试题类型,这些试题以“能量-反应进程图”为情境,对反应历程、基元反应、活化能、键能、焓变等进行设问,突出考查学生的“理解与辨析”“分析与推测”等关键能力.本文以高考真题为例,研究此类试题的情境特点、考向特点和解题模型,并对试题进行大致的分类,以期对这一题型给出一个大致的“画像”.
1 考查反应机理
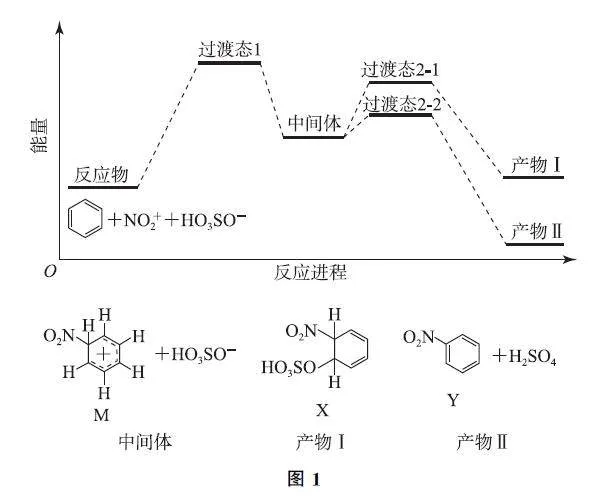
例1 (2024 年北京卷)苯在浓HNO3 和浓H2SO4 作用下,反应过程中能量变化示意图如图1所示.下列说法不正确的是( ).
A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物Ⅱ
B.X为苯的加成产物,Y为苯的取代产物
C.由苯得到M 时,苯中的大π键没有变化
D.对于生成Y的反应,浓H2SO4 作催化剂
解析 从中间体到产物有2条路径,生成产物Ⅱ的过渡态2G2的能量较低,本路径活化能较小,反应速率较快;产物Ⅱ的能量也低于产物Ⅰ,选项A说法正确.由X 的结构简式可以看出,苯环中的大π键被破坏,苯环上引入硝基和磺酸基,故X 是苯的加成产物;Y 是苯环上的H 被硝基取代的产物,选项B说法正确.产物M 的结构中,有1个碳原子除了连接环上的2个碳原子外,还连接了1个硝基和1个H 原子,说明该C 原子原来形成大π键的电子也用于成键,所以苯中的大π键发生了变化,选项C说法错误.生成Y 的反应,终态有H2SO4 生成,因此浓H2SO4作催化剂,选项D说法正确.答案为C.
点评 能量较高的过渡态与初始反应物或中间体之间的能量差,即为该反应的活化能,活化能越小,反应越快.
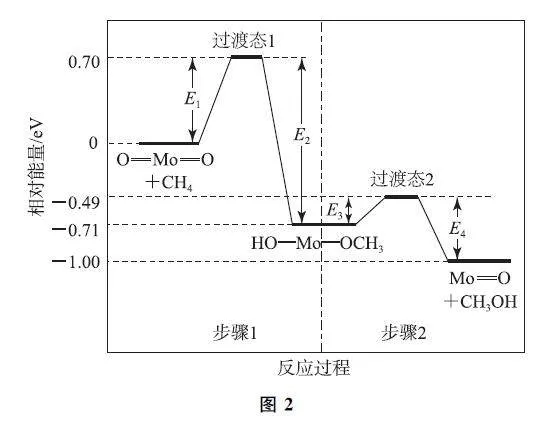
例2 (2024年甘肃卷)甲烷在某含Mo催化剂作用下部分反应的能量变化如图2所示,下列说法错误的是( ).
A.E2=1.41eV
B.步骤2逆向反应的ΔH =+0.29eV
C.步骤1的反应速率比步骤2快
D.该过程实现了甲烷的氧化
解析 由图2可知,E2=0.70eV-(-0.71eV)=1.41eV,选项A 说法正确.步骤2的逆反应为Mo=O+CH3OH→HO—Mo—OCH3,该反应的ΔH =-0.71eV-(-1.00eV)=+0.29eV,选项B说法正确.步骤1的活化能为始态到过渡态1的能垒,即E1=0.70eV;步骤2的活化能为HO—Mo—OCH3到过渡态2的能垒,即E3=-0.49eV-(-0.71eV)=0.22eV.步骤1的活化能大于步骤2的活化能,故步骤1的反应比步骤2慢,选项C说法错误.该过程中CH4转化为CH3OH,属于加氧氧化,实现了甲烷的氧化,选项D说法正确.答案为C.
点评 能量—反应进程图可以给出如下的信息:1)反应包含几个基元反应;2)每个基元反应活化能的大小;3)每个基元反应和总反应的焓变.当然,根据各物质的结构特点,也可以判断出某一步反应或总反应的特点.
2 定量考查反应的活化能和焓变
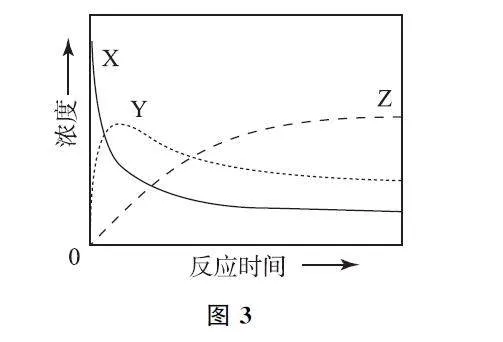
例3 (2024年安徽卷)某温度下,在密闭容器中充入一定量的X(g),发生下列反应:
X(g)⇌Y(g) ΔH1<0,
Y(g)⇌Z(g) ΔH2<0,
测得各气体浓度与反应时间的关系如图3所示.下列反应进程示意图符wnqxYkqexPB7Lc7YqjUiYA==合题意的是( ).
解析 由浓度-时间图像可知,反应初期,由X 生成的Y 不能全部转化为Z,说明X(g)⇌Y(g)比Y(g)⇌Z(g)反应更快,则X(g)⇌Y(g)的活化能小于反应Y(g)⇌Z(g)的活化能,即X到过渡态的能垒小于Y到过渡态的能垒.ΔH1<0,ΔH2<0,说明X、Y、Z的能量X>Y>Z.答案为B.
点评 根据浓度-反应时间图像,可以看出2个反应的快慢,进而确定2个反应活化能的大小,即反应更快的活化能更小;根据反应焓变的正负,可以判断3种物质的能量高低.
3 考查基元反应的数量和判断反应的快慢
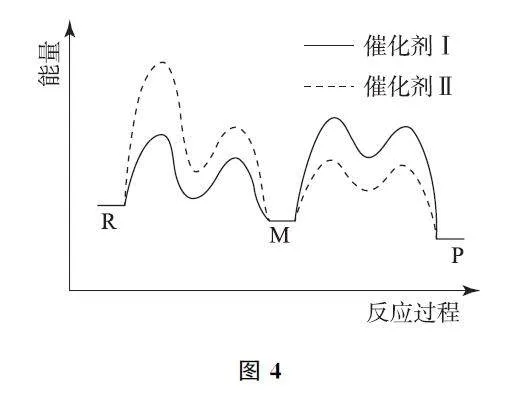
例4 (2023年广东卷)催化剂Ⅰ和Ⅱ均能催化反应R(g)⇌P(g).反应历程如图4所示,M 为中间产物.其他条件相同时,下列说法不正确的是( ).
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M 所能达到的最高浓度更大
解析 由图4可知,按催化剂Ⅰ的实现历程,共有4个峰,每个峰的顶部都是一个相对高能量的过渡态,所以由R转化为P,反应经过4步完成;使用催化剂Ⅱ,反应也经过4步完成,选项A 正确.R的能量高于P的能量,反应R(g)⇌P(g)为放热反应.升高温度,平衡逆向移动,R 的浓度增大,选项B 正确.总反应速率由反应历程中最慢(活化能最高)的一步决定,由图可知使用催化剂Ⅱ时反应历程中第一步活化能最大,速率最小.所以使用催化剂Ⅱ时,反应体系达到平衡用时更长,选项C 错误.使用催化剂Ⅰ时生成M 快,消耗慢,使用催化剂Ⅱ时生成M 慢而消耗快.所以,使用Ⅰ时,反应过程中M 所能达到的最高浓度更大,选项D正确.答案为C.
点评 本题为学术探索情境,对使用不同催化剂造成的速率差别和相同过渡态物质浓度大小的差别进行了考查,此外还考查了能垒大小对速率大小的影响.要求考生具有较强的信息获取能力,是一道较高水平的试题.
4 考查如何根据能垒大小优选催化剂
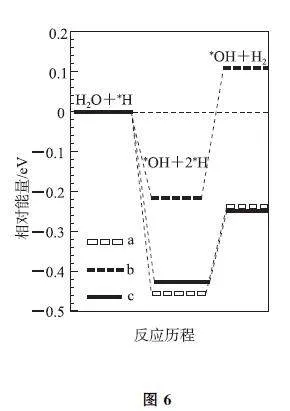
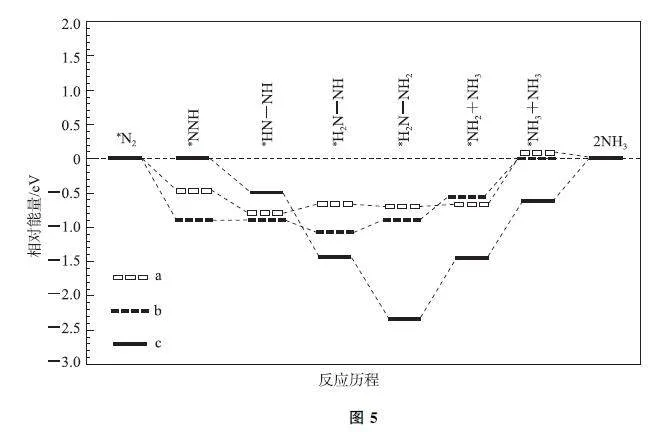
例5 (2023年河北卷,节选)我国科学家研究了水溶液中3种催化剂(a、b、c)上N2 电还原为NH3(如图5)和H2O 电还原为H2(如图6)反应历程中的能量变化,则3种催化剂对N2 电还原为NH3 的催化活性由强到弱的顺序为_______(用字母a、b、c排序).
解析 从图5可以看出,N2 电还原为NH3 无论采用哪种催化剂,都经历了多个过程,有的过程能量变低释放能量,有的过程能量升高吸收能量.3种催化剂对N2 电还原为NH3 的催化活性的强弱,取决于使用该催化剂中,所有过程中吸收能量最多的一步,即能垒最大的一步决定了电催化反应的难易.
读图5,使用a、b、c3种催化剂时,能垒最大步骤的能垒分别为0.7eV、0.5eV、0.9eV,故3种催化剂对N2 电还原为NH3 的催化活性由强到弱的顺序为b、a、c.读图6,H2O 电还原为H2 时,使用a、b、c3种催化剂时,能垒最大步骤的能垒分别为0.22eV、0.34eV、0.18eV,催化活性由强到弱的顺序为c、a、b.由于体系中存在2个电还原的竞争,因此需要综合考虑.所幸,电还原N2 最易的催化剂b,恰恰是电还原H2O 最难的;催化剂c电还原N2 最难,又恰恰是电还原H2O 最易的,所以c是电还原N2 活性最差的.故本题正确答案为b、a、c.
点评 本题中N2 电还原为NH3 过程的难易,需要与H2O 电还原为H2 的难易综合考虑.图中加∗的物质,是吸附态或中间体,不是过渡态,此处的“能垒”虽非活化能,但与活化能的本义一致.
这种考查方式,在新高考河北卷中出现过两次,以下我们再研究一个例子,据此可以看到河北高考命题专家团队的命题思路.
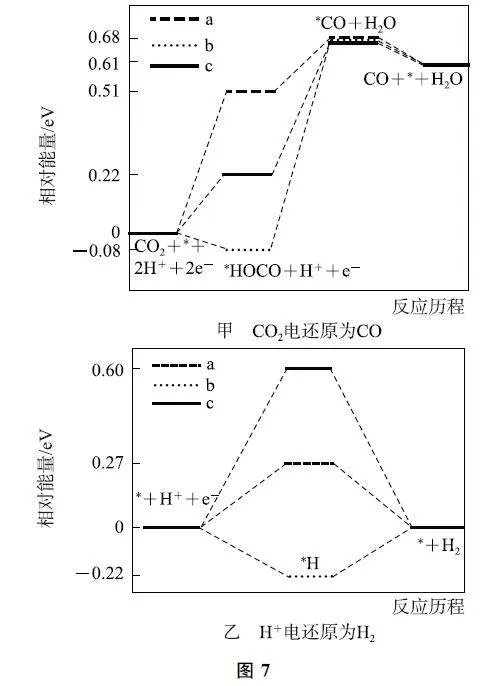
例6 (2021年河北卷,节选)在电解质溶液中,3种不同的催化剂(a、b、c)上CO2 电还原为CO 的反应历程中(H+ 电还原为H2 的反应可同时发生),相对能量变化如图7所示.由此判断CO2 电还原为CO 从易到难的顺序为________(用a、b、c字母排序).
解析 电还原时,同时发生2个竞争反应:主反应CO2+2e- +2H+ =CO+H2O(如图7G甲)和副反应2e- +2H+ =H2(如图7G乙).
对于主反应,催化剂a,两步能垒分别为0.51eV,0.17eV(0.68eV-0.51eV=0.17eV),决速步能垒为0.51eV;催化剂b,两步能垒分别为-0.08eV,0.76eV[(0.68eV-(-0.08eV)=0.76eV],决速步能垒为0.76eV;催化剂c,两步能垒分别为0.22eV、0.46eV(0.68eV-0.22eV=0.46eV),决速步能垒为0.46eV.所以,对于CO2 电还原为CO,所用催化剂由易到难的顺序为c、a、b.
对于副反应,催化剂a的能垒为0.27eV.催化剂b的两步能垒分别为-0.22eV、0.22eV,决速步活化能为0.22eV.催化剂c的能垒为0.60eV.因此,H+电还原为H2,所用催化剂由易到难的顺序为b、a、c.
综上,主反应最易的催化剂c,恰恰是副反应最难的催化剂,而主反应最难的催化剂b又恰恰是副反应最容易的催化剂,催化剂a均介于2个反应的难易之间.所以,我们可以得出结论,CO2 电还原为CO 从易到难的顺序为c、a、b.
点评 对于2个竞争反应,我们总是希望所选择的催化剂对于主反应来说最容易,并且对于副反应来说最困难,这样的催化剂对于生产才最有利,因此优选催化剂时,需要综合考虑.
5 综合考查活化能、键能、焓变
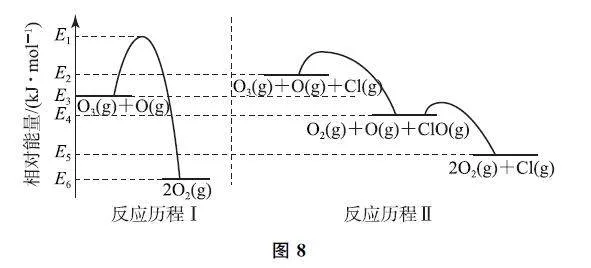
例7 (2023年1月浙江卷)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如图8所示[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( ).
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3)kJ·mol-1
C.相同条件下,O3 的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为ClO(g)+O(g)=O2(g)+Cl(g) ΔH =(E5-E4)kJ·mol-1
解析 E6-E3 代表反应“O3(g)+O(g)=2O2(g)”的焓变;E5-E2 代表反应“O3(g)+O(g)+Cl(g)=2O2(g)+Cl(g)”的焓变,反应“O3(g)+O(g)+Cl(g)→ 2O2 (g)+Cl(g)”也即“O3 (g)+O(g)=2O2(g)”,所以E6-E3=E5-E2.选项A 说法正确.观察图8,“O3(g)+O(g)”的相对能量为E3,“O3(g)+O(g)+Cl(g)”的相对能量为E2,两者的区别在于后者多了“Cl(g)”,考虑到Cl2(g)的相对能量为0,则由“2O3(g)+2O(g)+Cl2(g)”到“2O3(g)+2O(g)+2Cl(g)”的能量变化为Cl—Cl键的键能,即2(E2-E3)kJ·mol-1,选项B说法正确.相同条件下,O3 的平衡转化率与历程无关,故选项C 说法不正确.历程Ⅰ的能垒为E1-E3,历程Ⅱ中,2个能垒均小于E1-E3,且最小的能垒对应的反应速率最快,该反应为ClO(g)+O(g)=O2(g)+Cl(g)ΔH =(E5-E4)kJ·mol-1,选项D说法正确.答案为C.
点评 本题给出了历程-能量图,历程Ⅱ比历程Ⅰ的始态和终态均多了Cl(g),Cl(g)相对能量较高,是由于Cl2 的相对能量为0,破坏Cl—Cl键要吸收能量才变成Cl(g).所以,可以根据由“2O3(g)+2O(g)+Cl2(g)”到“2O3(g)+2O(g)+2Cl(g)”的能量变化求得Cl—Cl的键能.
6 研究结论
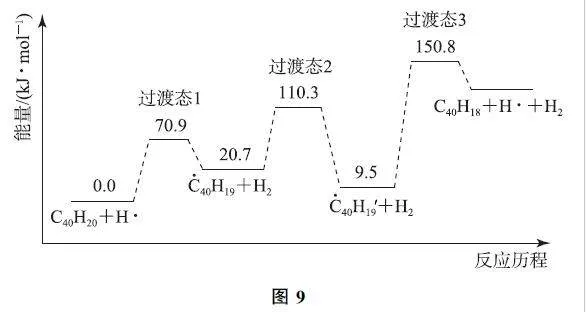
在给出的图像中,因变量为“能量”或“相对能量”,自变量往往表述为“反应历程”“反应进程”或“反应过程”.图像中所给的物质,除了初始的反应物和终态的生成物外,既有中间体,又有过渡态.图9可以帮助我们认识相关的概念.
1)过渡态:初始反应物或某中间体吸收能量后得到的高能量状态,它是一种旧键即将断裂,新键即将生成的状态.过渡态能量较高,非常不稳定,是瞬间存在的一种状态,会自发变成下一物质(中间体或产物).“能量-反应历程”图中,有多少个过渡态,就有多少个基元反应.
2)中间体:2个过渡态之间的物种是中间体.相对于过渡态来说,中间体的能量较低,在反应过程中存在时间相对较长,其吸收能量后,会变成下一高能量的过渡态.
3)活化能与能垒:由初始反应物或中间体达到高能量过渡态所吸收的能量,是该基元反应发生所必须克服的能量壁垒,也称该基元反应的活化能.
4)焓变:生成物的能量与反应物的能量之差,即为该反应的焓变.若生成物能量低于反应物能量,则焓变为负值,该反应放热;反之,焓变为正值,该反应吸热.
5)催化剂的优选:总是希望使用该催化剂时,主反应对应的多步反应中决速步骤的能垒较低,而同时副反应决速步骤的能垒较高,这样才能更利于主反应.备选催化剂3种,对应2个反应时,能优选出最好的催化剂是偶然的,大多会难以选出.河北的两道试题,恰恰能够选出合适的催化剂,是一种数据上的巧合.
近 年来,此类题目在高考试题中较为常见,对学生学习能力的考查与评价具有重要的价值功能.
本文系河北省教育规划“十四五”重点资助课题(2302027)“教育数字化背景下高中化学学生学习水平评价研究”的阶段性研究成果.
(完)
