为什么这样算
2024-10-29刘达琛袁佳蔚

反应热的计算是较为基础的知识点,也是高考的热点和必考点.有些学生在解答相关试题时,对于是“反应物减生成物”还是“生成物减反应物”的记忆容易产生混乱.本文将从不同类型的题目着手,分析反应热计算背后的逻辑,以期对大家的理解和计算有帮助.
1 什么是焓
人民教育出版社2019年版普通高中化学教科书(以下简称高中课本)描述:研究表明,在等压条件下进行的化学反应(严格地说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号ΔH 表示,常用单位是kJ·mol-1.
我们要明确,反应体系放热时,焓减小,ΔH 为负值,即ΔH <0;当反应体系吸热时,焓增大,ΔH 为正值,即ΔH >0.
2 盖斯定律
利用盖斯定律计算反应热是高考中常见的反应热计算题型.要理解如何快速运用盖斯定律进行计算,先要厘清什么是盖斯定律.
高中课本描述:一个化学反应,不管是一步完成的还是分几步完成的,其反应热是相同的.即在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关.
北京大学出版社«普通化学原理(第4版)»(以下简称大学课本)描述:化学家们在研究了相当多的化学现象之后,总结提出了热化学定律.用现代术语可表述为以下两个定律:
(1)在相同条件下正向反应和逆向反应的ΔH 数值相等,符号相反.
(2)一个反应若能分解成两步或几步实现,则总反应的ΔH 等于各分步反应ΔH 之和.这个定律是19世纪中叶俄国化学家盖斯综合分析大量实验数据提出来的,所以叫盖斯定律或反应热加和定律.
我们可以这样去理解计算的逻辑:盖斯定律又名“反应热加和定律”,说明化学反应方程式可以用数学代数计算的逻辑去理解,即“等号两侧相同物质相消”和“生成物与反应物位置互换(即广义上的逆反应)后,焓变应取原反应焓变的相反数”.
例1 (2024年安徽卷,节选)乙烯是一种用途广泛的有机化工原料.由乙烷制乙烯的研究备受关注.回答下列问题.
C2H6 氧化脱氢反应:
①2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g)ΔH1=-209.8kJ·mol-1,
②C2H6(g)+CO2(g)=C2H4(g)+H2O(g)+CO(g) ΔH2=+178.1kJ·mol-1.
计算:2CO(g)+O2 (g)=2CO2 (g)的ΔH3 =________kJ·mol-1.
解析 已知各个反应的方程式和焓变,根据盖斯定律目标反应由①-②×2得,则2CO(g)+O2(g)=2CO2 (g)的ΔH3 = -209.8kJ·mol-1 -(+178.1kJ·mol-1×2)=-566kJ·mol-1.
3 键能
利用键能计算反应热也是较为常见的反应热计算题型,通常给出的公式为
ΔH =反应物的键能之和-生成物的键能之和.
为什么是“反应物-生成物”,而非反过来呢? 我们从键能的概念来理解.人教版课本没有给出明确的键能定义,我们参考大学课本定义来理解.
大学课本描述:键焓(也叫键能)是指在温度T与标准压力时,气态分子断开1 mol化学键的焓变……键焓是一种平均近似值,而不是直接的实验结果.
我们可以将键能简单地理解为“破坏气体所有化学键所需能量的总和”.需要注意的是,键能的大小并不能被用于表示物质能量的多少,而只表示物质与达到活泼态时自由能之差.
我们知道,化学反应的本质即为反应物的断键和生成物的成键.其中,断键过程吸热,物质能量升高,故键能均为正值;成键过程放热,物质能量降低.计算时,取反应物键能的正值,取生成物键能的负值,各项相加即可,表现为“反应物-生成物”.
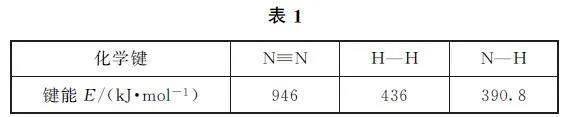
例2 (2021年湖南卷,节选)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气.相关化学键的键能数据如表1所示.
在一定温度下,利用催化剂将NH3 分解为N2 和H2,则2NH3 (g)⇌ N2 (g)+3H2 (g)的ΔH =______kJ·mol-1.
解析 每个NH3 分子含3个N—H 键,每个N2 分子含1 个N≡N 键,每个H2 分子含1 个H—H键.NH3 为反应物,取+390·8kJ·mol-1,N2 和H2 为生成物,分别取- 946 kJ· mol-1 和-436kJ·mol-1,乘上各自对应的键数和计量数,代数相加,即得ΔH =2×3×390.8kJ·mol-1+1×1×(-946kJ·mol-1)+3×1× (-436kJ·mol-1)=+90.8kJ·mol-1.
4 燃烧热
在部分计算反应热的题目中,所给的条件也可能为各物质的燃烧热,而我们常记的公式是这样的:ΔH =反应物的燃烧热之和-生成物的燃烧热之和.这里也是“反应物-生成物”,我们先回顾它的概念.
高中课本描述:在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫作该物质的燃烧热,单位是kJ·mol-1.
可以从两个角度去理解:
1)从定义中可以发现,利用燃烧热计算与盖斯定律是一致的,因为给出某一物质的燃烧热,即给出了该物质热化学反应方程式的焓变.可以写出该物质的热化学反应方程式,标上对应的燃烧热,利用盖斯定律进行计算即可.
