高考热点之配合物试题研究
2024-10-29王高原付士林
«普通高中化学课程标准(2017年版2020年修订)»对配合物模块知识提出的内容要求是:知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用,能够完成简单配合物的制备实验.提出的学业要求是:能运用配位键模型解释配合物的某些典型性质;能从微粒的空间排布及其相互作用的角度对生产、生活、科学研究中的简单案例进行分析;举例说明物质结构研究的应用价值,如配合物在生物、化学等领域的广泛应用.高考各地试卷中与配合物有关的试题每年都超过20道,约占总题量的10%,可见对配合物模块的考查保持持续热度.本文从5个热点考查方向进行举例分析.
1 配合物的结构
考查点主要包括配合物中心离子或原子的价层电子排布、杂化方式,指出配体中的配位原子、配位数,计算配位键数目或共价键总数等.配合物结构考查属于基础知识考查,要求理解配合物的概念、形成条件等.
例1 判断下列说法是否正确.
(1)(2024年山东卷5D)用氨水配制银氨溶液,体现了NH3 的配位性.
(2)(2024年黑、吉、辽卷11D)Cu(NH3)4SO4 是配合物,配位原子是O.
(3)(2024年新课标卷5D)Mg3 [Fe(CN)6]2 中CN- 提供电子对与Fe3+ 形成配位键.
解析 (1)银氨溶液的配制是在硝酸银中逐滴加入氨水,先生成白色沉淀AgOH,再生成易溶于水的Ag(NH3)2OH,Ag(NH3)2OH 中Ag+ 和NH3 之间以配位键结合,体现了NH3 的配位性,正确.
(2)Cu(NH3)4SO4 中铜离子提供空轨道、NH3中N 原子提供孤电子对,两者形成配位键,配位原子为N,错误.
(3)Mg3[Fe(CN)6]2 中CN- 提供电子对与Fe3+形成配位键,正确.
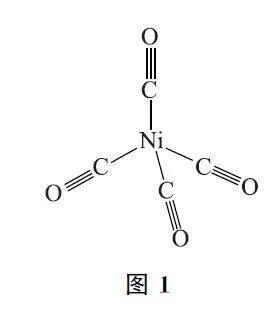
例2 (2024年新课标卷,节选)Ni(CO)4 结构如图1所示,其中含有σ键的数目为____.
解析 单键均为σ键,双键含有1个σ键和1个π键,三键含有1个σ键2个π键,由Ni(CO)4 的结构可知,4个配体CO 与中心原子Ni形成的4个配位键均为σ键,而每个配体CO 中含有1个σ键2个π键,因此1个Ni(CO)4 分子中含有8个σ键.
例3 (2024年湖北卷,节选)Be(OH)2 与醋酸反应得到某含4个Be的配合物,4个Be位于以1个O 原子为中心的四面体的4个顶点,且每个Be的配位环境相同,Be与Be间通过CH3COO- 相连,其化学式为____.
解析 由题意可知,该配合物中有4个铍位于四面体的4个顶点上,四面体中心只有1个O,类比甲烷的结构,Be与Be之间总共有6个CH3COO- ,则其化学式为Be4O(CH3COO)6.
2 配位平衡
这类考题涉及竞争反应、氧化还原反应中配合物的转化,由溶液酸碱性和配体浓度导致的配位平衡移动等,利用配合物性质进行萃取、反萃取分离提纯,考查学生“变化观念与平衡思想”学科核心素养.
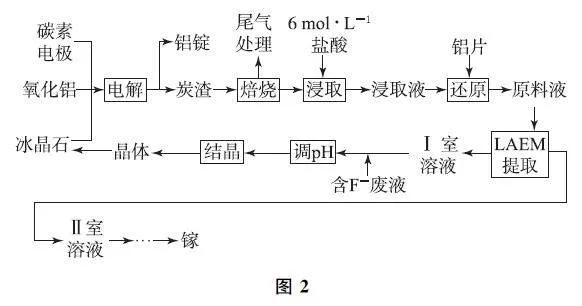
例4 (2024年广东卷,节选)镓(Ga)在半导体、记忆合金等高精尖材料领域有重要应用.一种从电解铝的副产品炭渣(含C、Na、Al、F和少量的Ga、Fe、K、Ca等元素)中提取镓及循环利用铝的工艺如图2所示.
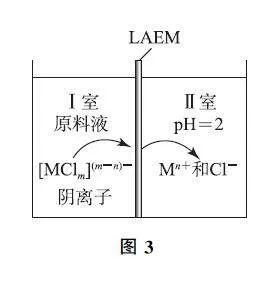
工 艺中,LAEM 是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区.用LAEM 提取金属离子Mn+ 的原理如图3所示.
已知:浸取液中,Ga(Ⅲ ) 和Fe (Ⅲ ) 以[MClm ](m -3)- (m =0~4)微粒形式存在,Fe2+ 最多可与2个Cl- 配位,其他金属离子与Cl- 的配位可忽略.
(1)“浸取”中,由Ga3+形成[GaCl4]- 的离子方程式为________.
(2)“还原”的目的:避免________元素以________(填化学式)微粒的形式通过LAEM,从而有利于Ga的分离.
(3)“LAEM 提取”中,原料液的Cl- 浓度越,越有利于Ga的提取;研究表明,原料液酸度过高,会降低Ga的提取率.因此,在不提高原料液酸度的前提下,可向Ⅰ 室中加入________(填化学式),以进一步提高Ga的提取率.
解析
(1)“浸取”中,由Ga3+ 形成[GaCl4]- 的离子方程式为Ga3+ +4Cl- =[GaCl4]- .
(2)浸取液中,Ga(Ⅲ)和Fe(Ⅲ)以[MClm ](m -3)-(m =0~4)微粒形式存在,LAEM 是一种新型阴离子交换膜,允许带负电荷的配离子从高浓度区扩散至低浓度区,为了避免铁元素以[FeCl4]- 的微粒形式通过LAEM,故加入铝片还原Fe3+ ,从而有利于Ga 的分离.
(3)“LAEM 提取”中,原料液的Cl- 浓度越高,更有利于向生成[GaCl4]- 的反应方向移动,更有利于Ga的提取,在不提高原料液酸度的前提下,同时不引入新杂质,可向Ⅰ室中加入NaCl,提高Cl- 浓度,进一步提高Ga的提取率.
3 配位检验
配合物通常有颜色,可以用于定性与定量检验,如Fe3+ 、Fe2+ 的检验,化学分析(如配位滴定),仪器分析(如光谱法)等.
3.1 定性检验
例5 判断下列说法是否正确.
(1)(2024年黑、吉、辽卷8A)用K3[Fe(CN)6]溶液检验NaBr溶液中是否含有Fe2+ .
(2)(2024年北京卷19改编)用K3[Fe(CN)6]溶液证明某溶液中有Fe2+ 存在,依据的现象是:滴加K3[Fe(CN)6]溶液后产生蓝色沉淀.
(3)(2023 年辽宁卷4B)用KSCN 溶液检验FeSO4 是否变质.
(4)(2023年湖南卷5C)K3[Fe(CN)6]溶液滴入FeCl2 溶液中的离子方程式为K+ +Fe2+ +[Fe(CN)6]3- =KFe[Fe(CN)6]↓.
答案 以上说法全部正确.
3.2 定量检验
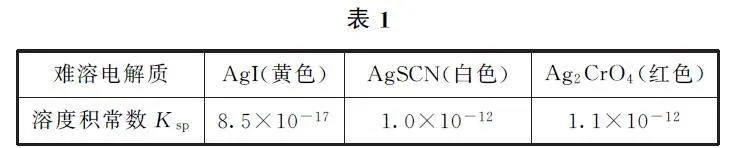
例6 (2024年6月浙江卷,节选)某小组制备AlI3,对粗产品纯化处理后得到产品,再采用银量法测定产品中I- 含量以确定纯度.滴定原理为:先用过量AgNO3 标准溶液沉淀I- ,再以NH4SCN 标准溶液回滴剩余的Ag+ .部分难溶电解质的溶度积常数如表1所示.
(1)从下列选项中选择合适的操作补全测定步骤.
称取产品1.0200g,用少量稀酸A 溶解后转移至250mL容量瓶,加水定容得待测溶液.取滴定管检漏、水洗→ ________→装液、赶气泡、调液面、读数→用移液管准确移取25.00mL待测溶液加入锥形瓶→→________ → 加入稀酸B→ 用1.000×10-2 mol·L-1NH4SCN 标准溶液滴定→ ________→读数.
a.润洗,从滴定管尖嘴放出液体
b.润洗,从滴定管上口倒出液体
c.滴加指示剂K2CrO4 溶液
d.滴加指示剂硫酸铁铵[NH4Fe(SO4)2]溶液
e.准确移取25.00 mL4.000×10-2 mol·L-1AgNO3 标准溶液加入锥形瓶
f.滴定至溶液呈浅红色
g.滴定至沉淀变白色
解析 润洗时,滴定管尖嘴部分也需要润洗;先加25.00 mL 待测溶液,后加25.00 mL4.000×10-2 molL-1 AgNO3 标准溶液,两者充分反应后,剩余的Ag+ 浓度较小,然后滴加硫酸铁铵[NH4Fe(SO4)2]溶液作指示剂,可以防止生成Ag2SO4 沉淀(Ag2CrO4 的溶度积常数与AgSCN 非常接近,因此,K2CrO4 溶液不能用作指示剂),其中的Fe3+ 可以与过量的半滴NH4SCN 溶液中的SCN- 反应生成溶液呈红色的配合物,故需要滴定至溶液呈浅红色;综上所述,需要补全的操作步骤依次是:a、e、d、f.
4 配合物制备
有关配合物制备的题目,常考查配合物的制备实验中所用药品和操作步骤或从配位平衡的角度设置问题,如从平衡移动的角度去分析解决如何提高产品产率.
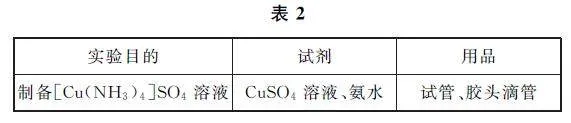
例7 (2024年安徽卷9C)仅用表2提供的试剂和用品,能否实现相应实验目的.解析 向盛有CuSO4 溶液的试管中滴加氨水,首先产生蓝色Cu(OH)2 沉淀,继续滴加氨水,沉淀溶解得到深蓝色的[Cu(NH3)4]SO4 溶液,发生反应的化学方程式为CuSO4+4NH3·H2O=[Cu(NH3)4]SO4+4H2O,能实现实验目的.
例8 (2023 年全国甲卷,节选)钴配合物[Co(NH3)6]Cl3可通过如下反应制备:2CoCl2+2NH4Cl+10NH3+H2O2活性炭→2[Co(NH3)6]Cl3+2H2O.
步骤Ⅴ:滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体.
步骤Ⅴ中加入浓盐酸的目的是_GG3Ev8nyPlwAsINGLqUMfg==_______.
解析 利用同离子效应,促进钴配合物[Co(NH3)6]Cl3尽可能完全析出,提高产率.
5 配合物应用
配合物应用广泛,生物体中血红蛋白中的血红素为铁配合物、叶绿素中含有镁配合物,在催化剂、超分子、电化学、冶金、新材料等领域有着前景无限的应用.
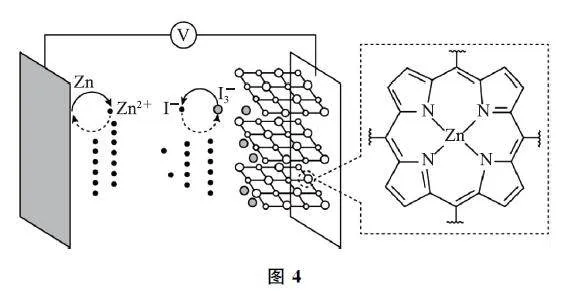
例9 (2024年安徽卷)我国学者研发出一种新型水系锌电池,其示意图如图4所示.该电池分别以ZnGTCPP(局部结构如标注框内所示)形成的稳定超分子材料和Zn为电极,以ZnSO4 和KI混合液为电解质溶液.下列说法错误的是( ).
A.标注框内所示结构中存在共价键和配位键
B.电池总反应为I3-+Zn←放电充电←Zn2+ +3IC.充电时,阴极被还原的Zn2+ 主要来自ZnGTCPP
D.放电时,消耗0.65gZn,理论上转移0.02mol电子
解析 标注框内所示结构属于配合物,配体中存在碳碳单键、碳氮单键和碳氢键等多种共价键,还有由N 提供孤电子对、Zn2+ 提供空轨道形成的配位键,选项A 正确.由图中信息可知,该新型水系锌电池的负极是锌,正极是超分子材料;放电时,负极的电极反应式为 Zn-2e- =Zn2+,正极上发生I3- +2e-=3I-,该电池总反应为I3-+Zn ←放电充电→Zn2+ +3I- ,选项B正确.充电时,阴极电极反应式为Zn2+ +2e- =Zn,被还原的Zn2+ 主要来自电解质溶液,选项C 错误.负极的电极反应式为Zn-2e- =Zn2+ ,因此消耗0.65gZn(物质的量为0.01 mol),理论上转移0.02mol电子,选项D正确.答案为C.
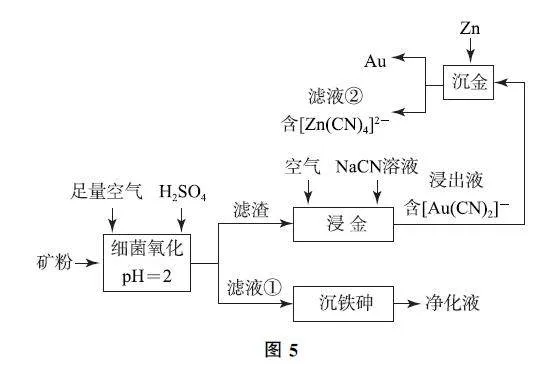
例10 (2024年黑、吉、辽卷,节选)中国是世界上最早利用细菌冶金的国家.已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的Au颗粒被FeS2、FeAsS包裹),以提高金的浸出率并冶炼金,工艺流程如图5所示.
回答下列问题:
(1)“真金不怕火炼”,表明Au难被O2 氧化,“浸金”中NaCN 的作用为________.
(2)“沉金”中Zn的作用为________.
(3)滤液②经H2SO4 酸化,[Zn(CN)4]2- 转化为ZnSO4 和HCN 的化学方程式为________.用碱中和HCN 可生成________(填溶质化学式)溶液,从而实现循环利用.
解析 矿粉中加入足量空气和H2SO4,在pH=2时进行细菌氧化,金属硫化物中的S元素转化为硫酸盐,过滤,滤液中主要含有 Fe3+、SO24-、As(Ⅵ),加碱调节pH,Fe3+ 转化为Fe(OH)3 胶体,可起到絮凝作用,促进含As微粒的沉降,过滤可得到净化液;滤渣主要为Au,Au 与空气中的O2 和NaCN 溶液反应,得到含[Au(CN)2]- 的浸出液,加入Zn进行“沉金”得到Au和含[Zn(CN)4]2- 的滤液②.滤液②经过H2SO4 的酸化,[Zn(CN)4]2- 转化为ZnSO4 和HCN 的化学方程式为Na2[Zn(CN)4]+2H2SO4 =ZnSO4 +4HCN + Na2SO4;用碱中和HCN 得到的产物,可实现循环利用,即用NaOH 中和HCN 生成NaCN,NaCN 可用于“浸金”步骤,从而循环利用.由以上分析可得答案:
(1)NaCN 作络合剂,将Au转化为[Au(CN)2]-从而浸出.
(2)Zn作还原剂,将[Au(CN)2]- 还原为Au.
(3)化学方程式为Na2[Zn(CN)4]+2H2SO4=ZnSO4+4HCN+Na2SO4;用碱中和HCN- 可生成NaCN.
通过以上分析可以看出,与配合物有关的试题有些比较基础,如配合物结构,利用配合物性质进行定性检验等.有些比较综合,如融合实验进行配位滴定、吸收光谱法定量分析等;融合工艺流程进行分离提纯、冶金等;融合电化学作电镀液成分、电极材料;融合反应机理作催化剂等.
(完)
