基于学科理解认知化学工艺流程试题中的除杂问题
2024-10-29夏昌伟
随着选择性必修2«物质结构与性质»的不断修订,高中化学教材体系进一步完善,物质结构与性质相关知识逐渐成为支撑高中化学深度学习的重要基础.为了加强本模块的理论性和系统性,教材中选编了一些较系统介绍物质结构的理论,这些理论有利于学生从学科的角度更加系统地理解物质的结构,也有利于与大学教材内容的衔接.因此,在课堂教学过程中,教师应更加注重从结构视角理解化学学科,建构科学合理的认知模型.对于学科理解教师并不是将教材与新课标之外的大学知识下放给学生,而是基于学情引领学生优化已有认知结构.化工流程试题主要考查金属阳离子在水溶液中的行为,现阶段学生对离子在水溶液中行为的认识处于散点状态,停留在记忆水平,缺乏综合应用知识对事实的解释能力.比如,杂质元素Fe、Al总是以Fe3+ 、Al3+ 水解的方式去除,原因是水解能力强,生成产物Fe(OH)3、Al(OH)3 的Ksp小,可是少有学生能回答:Fe3+ 、Al3+ 为什么水解能力强? 其他三价金属阳离子是否也有较强的水解能力?是否也能生成溶度积小的氢氧化物沉淀? 更高价的金属离子是否水解能力更强呢? 这些能够引发深度学习的问题正在被机械刷题不断地侵蚀,影响着复习备考的深度与精准度.笔者基于对离子势、极化作用、溶度积等概念的学科理解,在学生对溶解、水合、水解等概念的已有认知基础之上,用结构化的视角认识化工流程试题,将有关离子在水溶液中行为的相关知识系统化,在物质结构与性质的基础上建构科学合理的除杂模型.
1 化工流程题的三要素
化工流程题由测量目标、情境和设问三要素组成.立德树人毋庸置疑是测量的最终目标,化工流程题主要取材于矿石原始材料、炉渣废弃物等,利用化学手段提取或纯化物质,凸显变废为宝的学科魅力.基于新教材和«普通高中化学课程标准(2017 年版2020年修订)»划分的学业质量水平,该题型主要聚焦元素及其化合物相关知识的考查.以合适的生活、生产实际等真实情境素材为载体,关联学生已有知识体系,通过问题设置评价学生所达到的素养等级.建构科学合理的认知模型,是在真实情境中迁移知识解决问题的关键步骤,是提升核心素养的有效路径.
2 化工流程题除杂设计的基本逻辑
2.1 为什么总是这几种杂质
化工流程类试题均以陌生元素为目标元素,考查方向是如何利用杂质元素的性质将其除去从而达到纯化目标产物的目的,所以分析杂质元素的性质比分析目标元素对教学更有价值.杂质元素的种类在不同试卷中重复率极高,如Fe、Al、Si等,这与元素在地壳中的含量密切相关.地壳中含量越高的元素,出现在矿石中的概率必然越高.试题命制的核心思路是通过常见杂质元素及其性质考查学生结合应用已有知识解决问题的能力,所以备考复习时,针对地壳中高含量的元素进行重点拓展很有必要.
2.2 为什么要预处理、浸取之后去除杂质
预处理并非浸取的必要过程,预处理的目的是更好地浸取形成溶液.为什么杂质元素一定要在溶液中除去呢? 借助结构决定性质、性质反映结构这一独特的学科思维,不难想象,组成矿石的微粒间必然存在很强烈的作用力,很难将多种金属元素一一分离.预处理的目的便是将有着强烈相互作用的粒子,通过溶剂化作用形成自由离子.熔融和溶解是将微粒自由化的两种常见手段,这是电解质概念学习的已有认知.从工艺生产、操作、设备、成本等角度考虑,溶解的性价比显然远高于熔融.矿石能在地壳中长期稳定存在,其结构必然有很强的稳定性,基本都很难在水中直接溶解,一般还需要配合加强热、酸、碱、氧化剂、还原剂等手段,宏观上利用耦合反应增大反应的限度,微观上改变矿石的稳定结构,进而促进金属离子在溶剂中自由化.
预 处理之后的浸取过程,除了学生较容易理解的酸、碱、水浸之外,盐浸也是一种非常重要的溶解方式.浸取的微观过程即阴阳离子与溶剂分子相互作用的过程.以常见极性溶剂水为例,水分子作为配体与阴阳离子之间形成新的作用力,破坏原有阴阳离子间的相互作用.基于水溶解过程的微观模型M+ A- +(x+y)H2O→M(H2O)x+ +A(H2O)- y ,就不难理解用盐类物质提供的阴离子作配体来辅助溶解某种金属或矿石了.学生已有知识中的王水溶金就是这个道理,用饱和食盐水配合强酸处理含铅矿石、铝制器皿不能腌制咸菜的原因均是氯离子与部分金属阳离子有较强的配位功能,从而表现出对金属的腐蚀能力.
2.3 不同金属离子的除杂逻辑
不同金属离子的除杂逻辑金属元素和非金属元素在性质上存在着差异,去除方式也不相同.非金属元素(S、Si等)常通过加热生成对应氧化物的形式去除;金属元素去除的方式更为复杂一些,是化工流程重点考查的内容.探究金属离子在水溶液中存在的形式,有利于厘清金属离子不同去除方法的知识逻辑.Fe3+ 因其水解能力强,去除方式一般为调节pH 形成Fe(OH)3 沉淀.若杂质为Fe2+ 则先氧化为Fe3+ 再调节pH.通过反复训练,绝大部分学生都已经形成了条件反射,这样的试题已经没有区分度.笔者在教学、听课、学生访谈的过程中发现,少有学生思考:Fe3+ 为什么水解能力强? 为什么大部分二价金属和一价金属难以水解的方式完全去除? 水解能力由什么决定,与离子所带电荷是否有关? 水解强弱是否还存在其他影响因素? 对这些问题的深入思考,代表着复习备考不再是对知识的机械重复和浅层记忆,而是对化学学科知识和思维方式的一种本原性、结构化的认知.
金属阳离子的结构通常用离子半径r 和离子所带电荷Z 来表征.«无机化学»第5版(高等教育出版社)用φ(离子势)=Z2/r 综合衡量离子的性质,离子势大,说明半径小、电荷高,对电子的束缚能力强,使周围微粒电子云变形的能力强.这种使微粒电子云变形的性质称之为极化.离子势越大的金属离子极化能力越强,水溶液中极化水分子能力强,使O-H 键极性增强,容易断裂,表现出较强的水解能力.一般同一元素离子所带电荷越高,其半径越小,Fe3+ 相对于Fe2+ 电荷高、半径小,这样就容易理解Fe3+ 的水解能力要强于Fe2+ ;Ksp [Fe(OH)3 ]=2.64×10-39、Ksp[Fe(OH)2]=4.87×10-17,溶解能力上的明显差异也证明Fe3+ 结合OH- 的能力远强于Fe2+ .由于大部分高中生对离子势的认知局限,笔者将离子势与离子所带电荷的高低进行关联,分类讨论水溶液中不同价态离子的去除方式.
1)部分常考一价金属离子(Na+ 、K+ 、Ag+ 、Li+ )
Li+ 、Na+ 、K+ 均为一价同族离子,随着离子半径的逐渐增大,离子势(极化能力)Li+ >Na+ >K+ .离子的极化能力影响着离子的水解能力、对应化合物的溶解度等性质.阳离子极化能力越强与阴离子之间的共价键属性越突出,对应化合物在水溶液中的溶解度越低.由于Li+ 的离子势相对较大,极化能力强,更容易形成共价性成分较大的化合物,难溶于极性溶剂水.Na+ 、K+ 的离子势较小,极化能力弱,基本不水解,形成化合物离子键属性强,易溶于水,在水的极性作用下电离为水合离子,很难从溶液中去除,常用结晶等方法与目标元素分离.Ag+ 有其特殊性,价电子排布为4d105s0,属18e- 构型,而Na+ 和K+ 属8e- 构型,18e-构型的内层电子排满的状态,会使得排斥作用减小(屏蔽效应减弱),因此Ag+ 的有效电荷Z 更大,导致Ag+ 的离子势φ 相对较大.极化能力较强,容易与阴离子形成沉淀脱离溶液,比如AgCl、Ag2S等.极化作用是相互的,阴离子的结构也对阳离子的极化有一定的影响.以卤化银为例,2024年6月浙江卷化学工艺流程试题中有“AgF易溶于水”的信息,与学生对卤化银难溶于水的认知习惯形成了冲突.AgF与其他卤化银相比有较好的溶解性的原因主要是:在卤化物结构相似的基础上,阴离子(F- )半径过小,变形性较弱,难被Ag+ 极化,微粒间作用力呈现较强的离子键属性,更容易溶解于极性溶剂水.其他卤离子半径较大,容易被极化形成共价键属性较强的化合物,难溶于极性溶剂水.
2)部分常考二价金属离子(Fe2+ 、Mg2+ 、Zn2+ 、Ca2+ 、Ni2+ )
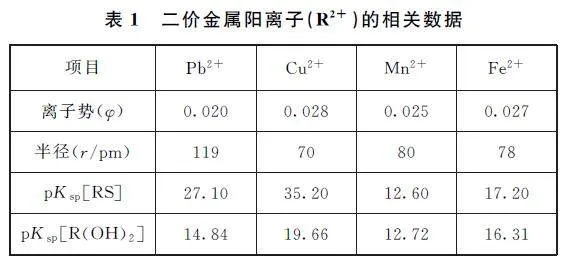
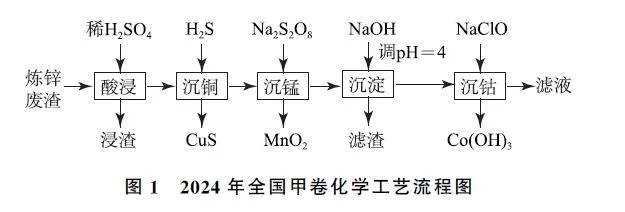
常见二价金属离子随着电荷增加,极化和水解能力略有增强,但并不能像Al3+ 、Fe3+ 等高价离子彻底水解达到很好的除杂效果.试题中二价金属离子(R2+ )一般会选择沉淀剂沉淀、活泼金属置换、电解、电渗析或离子交换等方式来除杂.至于哪种方式最为合适,这与杂质离子的浓度、除杂成本等因素有关.以2024年全国甲卷为例:钴在新能源、新材料领域具有重要用途.某炼锌废渣含有锌、铅、铜、铁、钴、锰的+2价氧化物及锌和铜的单质,从该废渣中提取钴.流程如图1所示.
查阅资料,题中杂质离子的离子势、半径、硫化物和氢氧化物Ksp数据,如表1所示.
杂质离子中铜离子极化阴离子能力最强,不管是S2- ,还是OH- ,形成的化合物有较强的共价属性,在极性溶剂中溶解度较低.根据pKsp数据可知,S2- 沉淀Cu2+ 的效果远好于OH- ,能与其他金属有效分离.以上金属阳离子的硫酸盐普遍为可溶性较强的盐类物质(PbSO4 除外),阴阳离子间表现为较强的离子键属性,易溶于极性溶剂,与金属硫化物溶解性形成了鲜明的对比.S2- 和SO24- 均为-2价阴离子,与卤化银溶解性的模型(半径越大电荷分布越弥散,易被极化)形成了认识冲突.虽然SO24- 作为原子团,半径远大于S2-,但SO24- 有极其稳定的四面体结构,难被极化.PbSO4 难溶于水的主要原因是其晶体内部结构紧密,其密度为6.2g·cm-3,远高于以上其他金属硫酸盐,这便是有力的证据.
3)常考三价及三价以上金属离子[Al(Ⅲ)、Fe(Ⅲ)、Cr(Ⅲ)、V(Ⅴ)、Cr(Ⅵ)、Ti(Ⅳ)]
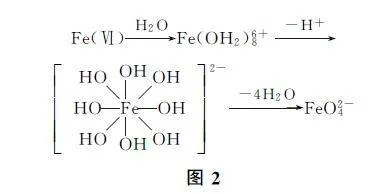
随着金属阳离子电荷的不断增加,金属阳离子吸引水溶液中负电荷的能力增强,水解形成氢氧化物的能力增强.Al3+ 和Fe3+ 常通过调节溶液的pH,利用其水解能力沉淀脱离溶液,达到除杂目的.更高价态的金属元素水解能力更强,在溶液中并不能以简单离子的形式存在,会发生强烈的水合作用,常以含氧酸根或金属氧化物的形式存在.比如2024年全国甲卷中Mn(Ⅱ)被Na2S2O8 氧化为Mn(Ⅳ),在水溶液中水解产生MnO2 固体;又如日常教学中经常出现Fe(Ⅵ)的高铁酸根,在水溶液中形成含氧酸根的简化过程如图2所示.
高价金属含氧酸根的形式与周围氢氧根的数量相关,因此有些高价金属含氧酸根的含氧酸盐在水溶液中的存在形式、稳定性等性质会随着溶液酸碱性强弱而变化.从结构视角,学生更容易理解FeO24- 在碱性条件下的稳定性强于酸性环境.
3 结语
水溶液中的除杂问题主要还是依据物质的溶解度.有关溶解度的问题最科学的思维模型应该是从吉布斯自由能的角度进行建构.但是基于学生现有认知局限,继续深入拓展吉布斯-亥姆霍兹方程,无疑增加了学生的备考负担,也不可能面向全体学生.新课标强调的学科理解的对象主要是教师,强调教师将自己提炼的内容与学生的认知水平相结合,帮助学生建构科学合理的认知模型.也许现阶段这样的模型并不完美,但是能打开学生的认知空间,对已有知识有结构化和系统化的作用.所以笔者尝试用学生已有水合离子的知识,初步引入离子势、极化等概念,帮助学生更好地理解不同价态金属离子在水溶液中的行为,建构相对合理的价态模型去解决化学工艺流程题中陌生元素的相关问题.虽然元素是陌生的,但是求解元素价态是绝大部分学生拥有的基本技能.抛开陌生因素,将价态与性质进行有效关联并建模,能帮助学生基于本质理解此类试题的命制逻辑,从而提升思维水平.
鉴于此,也给元素及其化合物的日常教学备考提供了一些新的思路.比如2023年6月浙江高考出现了FeCl3(s)和FeCl2(s)熔、沸点的比较.FeCl3(s)的熔、沸点为307.6 ℃、316 ℃,FeCl2(s)的熔、沸点为677℃、1023℃,熔沸点数据与日常离子晶体教学中电荷越高熔沸点一般越高的判定方式产生了冲突.其微观结构原因是Fe3+ 极化Cl- 的能力强于Fe2+ ,使Fe3+ 与Cl- 间的作用力有更强的共价键属性,熔化过程中主要破坏分子间作用力,导致熔沸点反而更低.如果学生能将Fe3+ 的水解过程中水分子替换为Cl- ,难题便能迎刃而解.
(完)
