例谈滴定实验在高考中的考查及应用
2024-10-29马泉

滴定分析法是用已知准确浓度的标准溶液,通过滴定测定未知溶液浓度待测液的重要定量检测方法.高考化学中常考的滴定法有酸碱中和滴定、氧化还原滴定、沉淀滴定、配位滴定等.本文例析相关试题,以期提高解答此类试题的准确率.
1 酸碱中和滴定
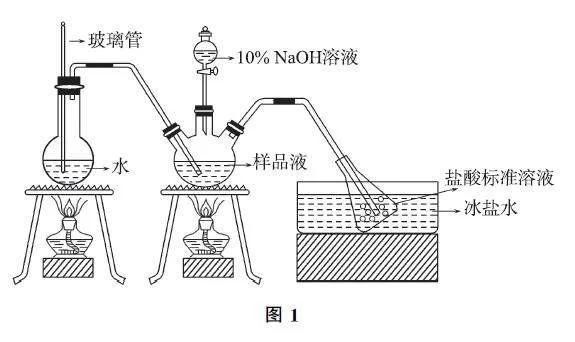
例1 硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}中氨含量的测定方法如下.
精确称取w g硫酸四氨合铜晶体,加适量水溶解,注入如图1所示的三颈瓶中,然后逐滴加入足量质量分数为10%的NaOH 溶液,通入水蒸气,将样品溶液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL0.5mol·L-1的盐酸标准溶液完全吸收.取下接收瓶,用0.5mol·L-1 NaOH 标准溶液滴定过剩的HCl,到终点时消耗V2 mLNaOH 溶液.
(1)为了减少误差,用NaOH 标准溶液滴定过剩的HCl溶液时最好使用______(填“酚酞”或“甲基橙”)作指示剂.
(2)样品中氨的质量分数为______(用含w 、V1、V2 的代数式表示).
(3)下列实验操作可能使氨含量的测定结果偏高的是______(填标号).
A.滴定时未用NaOH 标准溶液润洗滴定管
B.读数时,滴定前平视,滴定后俯视
C.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
解析 (1)甲基橙的变色范围为3.1~4.4,酚酞为8.2~10.0,用NaOH 标准溶液滴定的是NH4Cl和HCl的混合溶液,即滴定终点溶液呈酸性,故应选择酚酞作指示剂.
(2)由题意可得n(HCl)=n(NH3)+n(NaOH),故n(NH3)=n(HCl)-n(NaOH)=0.5mol·L-1×V1×10-3 L-0.5mol·L-1×V2×10-3 L=0.5(V1-V2)×10-3mol,样品中氨的质量分数的表达式为0.5(V1-V2)×10-3×17/ w ×100%.
(3)滴定时未用NaOH 标准溶液润洗滴定管,则相当于稀释了NaOH 溶液,V2 偏大,氨含量偏低,选项A 错误.读数时,滴定前平视,滴定后俯视,则V2 偏小,氨含量偏高,选项B正确.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁,则部分氨损失,滴定时消耗NaOH 溶液的体积偏大,即V2 偏大,氨含量偏低,选项C错误.未用蒸馏水冲洗插入接收瓶中的导管外壁,则盐酸有损失,导致消耗的NaOH 溶液体积V2 偏小,氨含量偏高,选项D正确.答案为B、D.
考点点击 教材以酸碱中和滴定为载体,系统分析滴定法.高考常见的考查角度有滴定管的使用与操作、终点的判定与描述、误差分析以及计算等.其中,计算是高频考点.计算时要对数据进行处理,一般平行测定3次及以上,当数据误差较大时要删去,其他取平均值进行计算.
2 氧化还原滴定
例2 硫代硫酸钠被广泛用于纺织、造纸、化学合成等领域.精确称取0.5000gNa2S2O3·5H2O 晶体样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液.以淀粉为指示剂,用0.1000mol·L-1的碘标准溶液滴定至终点,消耗标准溶液的体积为V mL.已知:2S2O23-+I2=S4O26-+2I-.
(1)滴定时,应使用______(填“酸式”或“碱式”)滴定管.
(2)滴定达到终点的标志是______.
(3)Na2S2O3·5H2O 的质量分数为(用含有V 的代数式表示).
(4)下列说法错误的是______.
A.滴定读数时,应单手持滴定管上端并保持其自然垂直
B.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
C.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
D.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
解析 (1)滴定时,由于碘溶液呈弱酸性,且碘会腐蚀橡胶,所以应使用酸式滴定管.
(2)在Na2S2O3 被消耗完全之前,碘不会有剩余,溶液呈无色,当两者恰好完全反应,达到滴定终点,标志是当滴入最后半滴标准液,溶液由无色变成蓝色,且半分钟内不褪色.
(3)滴定过程发生反应的离子方程式为2S2O23-+I2=S4O26- +2I-,即n(Na2S2O3·5H2O)=2n(I2),则Na2S2O3 · 5H2O 晶体的质量分数为2×0.1000mol·L-1×(V×10-3)L×248g.mol-1/0.5000g ×100%=9.92V%.
(4)滴定读数时,应单手持滴定管上端并保持其自然垂直,选项A 正确.滴定实验中需要用到的仪器是烧杯、锥形瓶、滴定管、滴定管夹、铁架台,其中的玻璃仪器是烧杯、锥形瓶、滴定管,选项B正确.滴定前滴定管尖嘴处有气泡,会导致一部分标准液占据读数,但未参与反应,即标准液体积偏大,导致实验结果偏高,选项C错误.用标准液润洗滴定管后,应将润洗液从滴定管下口放出,选项D错误.故答案为C、D.
考点点击 高考中常涉及KMnO4、I2、K2Cr2O4、铁盐等氧化剂与某些还原剂的相互滴定,由于KMnO4 有颜色,故可以通过自身颜色变化判断终点.滴定过程中颜色变化不明显的,则需要加入指示剂,如I2 与Na2S2O3 溶液滴定加淀粉溶液、铁盐与还原剂加KSCN 等.解题时一定要分清终点前后的颜色变化,并规范准确地描述:当加入最后半滴标准溶液时,溶液由一种颜色变为另一种颜色,且30秒内颜色不恢复(或不褪色).
3 配位滴定
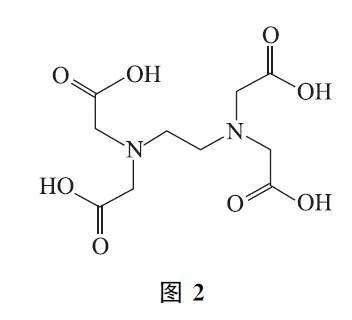
例3 实验室可以用配位滴定法测定锆含量.已知:ZrO2+ 与二甲酚橙生成红色配合物,ZrO2+ 能与EDTA(乙二胺四乙酸,结构如图2所示)发生配位反应(1∶1)生成无色配合物,且配位能力更强,滴定过程如图3所示.
产品中锆的含量是______(用含c、V、m 的代数式表达).
解析 根据题干信息得n(ZrO2+ )=n(EDTA)=c mol·L-1×V ×10-3 L=cV ×10-3 mol,250mL溶液中n(ZrO2+ )=cV ×10-3 mol×0.25L/0.01L=0.025cV mol,则产品中锆的含量为0.025cV mol×91g·mol-1/m g ×100%=227.5cV/m %.
考点点击 配位滴定是以金属离子和配位剂反应生成配位化合物为基础的定量分析法,由于多数金属离子配位数是6以下,而EDTA 结构中2个胺基氮,4个羧基氧可与金属离子形成配位键,它完全能满足一个金属离子所需的配位数,所以不论金属离子是几价,它们都是按1∶1关系配位.EDTA 与金属离子形成配合物的物质的量之比为1∶1.可以根据关系式确定金属离子的含量.
从近几年的高考来看,滴定实验一直是各地高考命题的热点,因此在备考时要夯实基础,进行有针对性的训练.
本文系2022年度山东省淄博市教育规划课题“高中化学大概念教学方案设计与实施研究”(课题编号:2022ZJY065)的阶段性研究成果.
(完)
